Растворы. Растворители. 9-й класс
Цели:
- Организовать деятельность учащихся по восприятию, осмыслению таких понятий как: раствор, растворитель, полярный растворитель, неполярный растворитель. Усвоение закономерностей, которым подчиняются растворы.
- Развивать умения выделить главное, существенное в изучаемом материале.
- Обеспечить закрепление знаний и способов деятельности учащихся.
Ход урока
I. Организационный момент.
II. Подготовка учащихся к работе на основном этапе.
Четвёртый лишний. (Приложение. Слайд 1.)
- Морская вода.
- Клеточный сок.
- Минеральная вода “Аршан”.
- Дистиллированная вода.
Лишняя дистиллированная вода (т.к. всё остальное растворы).
Эпиграфом урока предлагаю взять слова академика Карпинского А.П (Cлайд 3):
“
“Растворы – это живая кровь, которая создает жизнь там, где ее не было”. 
Рассмотрим биологическую роль растворов для живых организмов. (Cлайд 4 “видеофрагмент”.)
“Значение растворов в природе в возникновении и развитии жизни на земле трудно переоценить. Именно в первичном океане впервые развились живые организмы и из этого раствора они получили молекулы и ионы необходимые для их роста и жизни. С течением времени живые организмы развивались и изменялись, что позволило им покинуть водную среду, перейти на сушу и затем подняться в воздух. Они приобрели эту способность сохранив в своих организмах водный раствор в виде жидкости содержащих необходимый запас ионов и молекул. Внутри нас в каждой нашей клеточке воспоминание о первичном растворе в котором зародилась жизнь. Водные растворы обеспечивающие саму жизнь.” [1]
Вспоминаем понятие раствор (Слайд 5):
В трёх стаканах находятся (немаловажным, для детей видеть эти три стакана):
– песок и вода
– вода и медный купорос
– масло и вода
Где по вашему мнению находится раствор? Что такое раствор?
Растворы – однородная система, состоящая из двух и более компонентов (растворителя
и растворённого вещества).
III. Усвоение новых знаний и способов действия.
Лабораторные опыты:
- В пробирку насыпать немного перманганата калия и добавить воды. Разделить пробирку на две пробирки. Во вторую пробирку добавить ещё воды. Одинаковы ли количества перманганата калия, содержащиеся в обоих растворах? А растворителя?
- Попытайтесь растворить очень небольшие количества серы, кристаллического
йода, поваренной соли и карбоната натрия в воде (полярный растворитель)
и в бензине (неполярный растворитель). Представьте результаты опыта в
виде таблицы.
| Вещество | Растворимость | |
| В воде | В бензине | |
| NaCl | ||
| Na2CO3 | ||
| S | ||
| I2 | ||
Можно ли найти универсальный растворитель – жидкость, в которой можно
растворить любое вещество? (Слайд
8. )
)
Проанализируем результаты опыта и сделаем вывод:
Такого растворителя быть не может. Вещества с ионной связью, как и вещества с
ковалентной полярной связью, хорошо растворяются в полярных растворителях (например,
в воде), а вещества с неполярной связью – в неполярных растворителях (например,
в бензине).
Это правило было установлено ещё в средневековье, после длительных
поисков универсального растворителя, “алькагеста”, сформулировали правило
“Подобное растворяется в подобном”.
Растворимость зависит от температуры. При увеличении температуры растворимость веществ увеличивается. Но есть вещества, растворимость которых при нагревании раствора уменьшается. Вы обращали когда-нибудь внимание на то, как ведет себя вода в чайнике незадолго до того, как закипеть? Перед кипением, а иногда и раньше, с самого начала нагревания, на внутренних стенках чайника или кастрюли появляются пузырьки воздуха.

Проанализируйте рисунок со слайда 11 и сформулируйте вывод о физиологической потребности в кислороде у рыб.
IV. Закрепление.
Пополнилась ли ваша “копилка знаний” сегодня? Если да, то что вы узнали?
Какой растворитель можно использовать для растворения P, HCl, NaI, почему? (Слайд
12.)
Совместите части:
Вариант 1.
| 1. Полярный растворитель | А. Вода |
| 2.Неполярный растворитель | Б. Сера |
| 3. Диполь | В. Соляная кислота |
Вариант 2.
| 1. Полярный растворитель | А. Йод |
| 2. Неполярный растворитель | Б. Вода |
| 3. Диполь | В. Поваренная соль |
VI. Рефлексия. (Слайд 14.)
– Выберите из ниже предложенных утверждений, соответствующее вашему мнению и настроению, и закончите фразу согласно вашему выбору.
Очередные 45 драгоценных минут моей не менее драгоценной жизни:
- потеряны безвозвратно, т.к…
- прошли с пользой, т.к…
VII . Домашнее задание. (Слайд 15.)
§6 Немного о растворителях.
“4” – с. 21 вопросы 1.
Задание для учеников интересующихся химией: подготовить сообщение по теме: “Виды растворителей”
Творческий проект: “Какие растворы встречаются в организме человека и какова их роль?”
Литература.
- Диск Кирилла и Мефодия . Биология 10–11 класс.
- Кузнецова Н.Е. и др. Химия: Учебник для учащихся 9 класса общеобразовательных учреждений.– М.: Вентана-Граф, 2003. – 320 с.: ил.
- Кузнецова Н.Е., Шаталов М.А. Обучение химии на основе межпредметной интеграции: 8–9 классы: Учебно-методическое пособие.– М.: Вентана-Граф, 2004. – 352с.
- Зуева М.В., Гара Н.Н. Школьный практикум. Химия 8–9 кл. – М.: Дрофа, 1999.– 128 с.: ил.
Конспект урока по химии на тему «Понятие о растворах»
Урок 6. Понятие о растворах
Цель урока. Закрепление понятий: “растворы”, “растворитель”, “растворенное вещество”, “массовая доля растворенного вещества”.
Задачи.
Обучающие. Закрепить понятия: “растворы”, “растворитель”, “растворенное вещество”, “массовая доля растворенного вещества”.
 Обобщить имеющиеся знания.
Обобщить имеющиеся знания.Воспитательные. Воспитывать внимание и самостоятельность при повторении и закреплении материала, способность рассуждать объективно и логично, с учетом своей точки зрения.
УУД:
регулятивные – преобразовывать совместными усилиями практическую задачу в познавательную;
познавательные – определять способы решения проблем под руководством учителя, выдвигать гипотезы и выстраивать стратегию поиска под руководством учителя, формулировать новые знания совместными групповыми усилиями;
коммуникативные – участвовать в коллективном обсуждении проблемы.
Оборудование.
На столах обучающихся: 8 пробирок, штатив, вода, спирт, хлорид натрия, сода, йод, сера
На столе учителя: стаканы с водой марганцовка, два стакана с разноцветными шариками.
Ход урока
Организационный момент
Письменный опрос (5 минут)
Подготовка учащихся к работе на основном этапе.
На столе перед вами три стакана. Посмотрите на их содержимое и определите, какой стакан лишний:
— медный купорос (раствор)
— марганцовка (раствор)
— керамзит с водой
Лишний – керамзит с водой. Почему?
Сегодня мы с вами будем говорить о растворах. Они играют важную роль в нашей жизни, с ними каждый из нас постоянно сталкивается как в быту, так и на производстве. Да и сам организм человека содержит растворы самых разных веществ.
Да и сам организм человека содержит растворы самых разных веществ.
Дважды Нобелевский лауреат в области химии и биологии американский ученый Лайнус Полинг писал, что “Значение растворов в природе в возникновении и развитии жизни на земле трудно переоценить. Именно в первичном океане впервые развились живые организмы и из этого раствора они получили молекулы и ионы необходимые для их роста и жизни. С течением времени живые организмы развивались и изменялись, что позволило им покинуть водную среду, перейти на сушу и затем подняться в воздух. Они приобрели эту способность, сохранив в своих организмах водный раствор в виде жидкости содержащих необходимый запас ионов и молекул. Внутри нас в каждой нашей клеточке воспоминание о первичном растворе, в котором зародилась жизнь. Водные растворы обеспечивающие саму жизнь.”
Эпиграфом урока предлагаю взять слова академика Карпинского А.П.
“Растворы – это живая кровь, которая создает жизнь там, где ее не было”.
Особенностями образования, свойствами и характеристиками растворов занималась целая плеяда отечественных и зарубежных ученых, таких как Менделеев, Кистяковский, Оствальд и многие другие.
Давайте вспомним, что представляет раствор и дадим его определение.
Стаканы с раствором медного купороса и марганцовки – это гомогенные вещества.
Создадим модель раствора. Из каких компонентов состоит раствор?
Смешаем растворитель и растворенное вещество, перемешаем их и установим какие процессы происходят при этом.
Таким образом, растворы – это гомогенные системы, состоящие из растворенного вещества, растворителя и продуктов их взаимодействия.
Усвоение новых знаний и способов действия.
Рассмотрим характеристики компонентов раствора по отдельности.
А) растворенное вещество
Растворенные вещества могут отличаться по своей природе – Р, М и Н. Как вы думаете из каких вышеперечисленных веществ можно приготовить растворы? (Р, М)
Как вы думаете из каких вышеперечисленных веществ можно приготовить растворы? (Р, М)
В зависимости от массовой доли растворенного вещества различают два вида растворов: разбавленные и концентрированные.
Как их различить? (пример двух растворов марганцовки)
Хорошо когда раствор имеет цвет, а как быть когда он бесцветный? На помощь нам придет математика. По формуле можно рассчитать массовую долю растворенного вещества, если она меньше 30%, то это разбавленный раствор, если больше, то концентрированный.
Осенью люди чаще всего подвержены простудным заболеваниям, в частности ангине. Предлагаю решить задачу и рассчитать сколько понадобится лекарственных средств для борьбы с этим недугом.
При лечении ангины для полоскания горла используют 3%-ный раствор перманганата калия. Рассчитайте, какую массу марганцовки надо взять для приготовления 100 г такого раствора.
Масса марганцовки – 3 г.
В зависимости от массы растворенного вещества различают три вида растворов: ненасыщенные, насыщенные и пересыщенные. Для того чтобы определить и готовить такие растворы на помощь приходят графики растворимости веществ в зависимости от температуры растворителя. Например, если готовить раствор дихромата калия при 90 градусах и растворить в воде 70 г соли, то это будет насыщенный раствор, 50 г – ненасыщенный, 90 г – пересыщенный.
Определите, как приготовить три вида растворов нитрата натрия при 10 градусах.
Иногда для того, чтобы приготовить раствор с необходимой концентрацией используют рабочие растворы с известной концентрацией.
Предлагаю вспомнить решение задач с помощью стаканчиков.
Смешали 300 г раствора с массовой долей соли 20% и 500 г раствора с массовой долей 40%. Массовая доля соли в полученном растворе равна __________ %.
Б) Второй компонент растворов – растворитель.
Различают два вида растворителей: полярные (вода) и неполярные (органические вещества).
Попытайтесь растворить очень небольшие количества серы, кристаллического йода, поваренной соли и карбоната натрия в воде (полярный растворитель) и в спирте (неполярный растворитель). Представьте результаты опыта в виде таблицы.
Можно ли найти универсальный растворитель – жидкость, в которой можно растворить любое вещество?Проанализируем результаты опыта и сделаем вывод: Такого растворителя быть не может.
Вывод: Вещества с ионной связью, как и вещества с ковалентной полярной связью, хорошо растворяются в полярных растворителях (например, в воде), а вещества с неполярной связью – в неполярных растворителях (например, в бензине).
Это правило было установлено ещё в средневековье, после длительных поисков универсального растворителя, “алькагеста”, сформулировали правило “Подобное растворяется в подобном”.
Проделанный нами эксперимент ещё раз показывает, что растворимость веществ зависит от природы растворителя. От чего ещё зависит растворимость? Растворимость зависит от температуры. При увеличении температуры растворимость веществ увеличивается. Но есть вещества, растворимость которых при нагревании раствора уменьшается. Вы обращали когда-нибудь внимание на то, как ведет себя вода в чайнике незадолго до того, как закипеть? Перед кипением, а иногда и раньше, с самого начала нагревания, на внутренних стенках чайника или кастрюли появляются пузырьки воздуха. Почему? Действительно при нагревании растворимость газов уменьшается, что приводит к улетучиванию кислорода.
5. Закрепление.
Пополнилась ли ваша “копилка знаний” сегодня? Если да, то что вы узнали?
Какой растворитель можно использовать для растворения P, HCl, NaI, почему?
6. Рефлексия.
– Выберите из ниже предложенных утверждений, соответствующее вашему мнению и настроению, и закончите фразу согласно вашему выбору.
Очередные 45 драгоценных минут моей не менее драгоценной жизни:
потеряны безвозвратно, т.к…
прошли с пользой, т.к…
V . Домашнее задание.
§3 Немного о растворителях.
4”– с. 21 вопросы 1.
“5” – с. 21 вопрос 3.
Задание для учеников интересующихся химией: подготовить сообщение по теме: “Виды растворителей”
Творческий проект: “Какие растворы встречаются в организме человека и какова их роль?”
Литература.
Диск Кирилла и Мефодия . Биология 10–11 класс.
Кузнецова Н.Е. и др. Химия: Учебник для учащихся 9 класса общеобразовательных учреждений.– М.: Вентана-Граф, 2003. – 320 с.: ил.
Кузнецова Н.Е., Шаталов М.
 А. Обучение химии на основе межпредметной интеграции: 8–9 классы: Учебно-методическое пособие.– М.: Вентана-Граф, 2004. – 352с.
А. Обучение химии на основе межпредметной интеграции: 8–9 классы: Учебно-методическое пособие.– М.: Вентана-Граф, 2004. – 352с.Зуева М.В., Гара Н.Н. Школьный практикум. Химия 8–9 кл. – М.: Дрофа, 1999.– 128 с.: ил.
Растворы и растворители — презентация онлайн
Морская водаКлеточный сок
Минеральная
вода «Аршан»
Дистиллированная
вода
растворы
3. «Растворы – это живая кровь, которая создает жизнь там, где ее не было» Академик Карпинский А.П.
Растворы — однородная система,состоящая из двух и более компонентов
(растворителя и растворённого
вещества).
В каком стакане находится раствор?
Что такое раствор?
1
2
3
6. Лабораторный опыт №1
1. Приготовьте раствор перманганата калия (марганцовки)Как это сделать?
к перманганату калия прилить воды
2. Перемешайте раствор с помощью стеклянной палочки.
Какое вещество является растворителем?
Растворённым веществом?
3.
 Часть раствора перманганата калия отлить в
Часть раствора перманганата калия отлить впустую пробирку и разбавить водой.
Одинаковы ли количества перманганата калия, содержащиеся
в обоих растворах? А растворителя?
разбавленный
раствор
концентрированный
7. Лабораторный опыт №2
1. Попытайтесь растворить очень небольшие количества серы,кристаллического йода, поваренной соли и карбоната натрия в
воде (полярный растворитель) и в бензине (неполярный
растворитель). Представьте результаты опыта в виде таблицы.
Вещество
NaCl
Na2CO3
S
I2
Растворимость
В воде
В бензине
Можно ли найти универсальный
растворитель – жидкость в
которой можно растворить любое
вещество?
Растворимость
–
веществ
растворяться
растворителе.
способность
в
каком-либо
От чего зависит растворимость?
От природы
растворимого
вещества и
растворителя.
От температуры
10. Но есть вещества, растворимость которых при нагревании раствора уменьшается.
 Вы обращали когда-нибудь внимание на то, как ведет себя вода в чайнике незадолго до того, как
Вы обращали когда-нибудь внимание на то, как ведет себя вода в чайнике незадолго до того, какзакипеть? Перед кипением, а иногда и раньше, с самого начала
нагревания, на внутренних стенках чайника или кастрюли
появляются пузырьки воздуха. Почему?
11. Проанализируйте рисунок 1 и 2. Сделайте вывод.
12
Пополнилась ли ваша
«копилка знаний» сегодня?
Если да, то что вы узнали?
Какой растворитель можно
использовать для
растворения P, HCl, NaI,
почему?
13. Совместите части:
Вариант 11. Полярный
растворитель
Вариант 2
А. вода
1.
2. Неполярный
растворитель
Б. сера
2. Неполярный
растворитель
Б. вода
3. диполь
В. Соляная
кислота
3. диполь
В. Поваренная
соль
Полярный
растворит
ель
А. йод
14. Рефлексия
• Выберите из ниже предложенных утверждений,соответствующее вашему мнению и настроению,
и закончите фразу согласно вашему выбору.

Очередные 45 драгоценных минут моей не
менее драгоценной жизни:
1. потеряны безвозвратно, т.к…
2. прошли с пользой, т.к…
15. Домашнее задание
§6 Немного о растворителях«4» — с. 21 вопросы 1
«5» — с. 21 вопрос 3
Задание для учеников интересующихся химией:
Подготовить
сообщение
по
теме:
«Виды
растворителей»
Творческий проект:
«Какие растворы встречаются в организме человека
и какова их роль?»
16. Спасибо за внимание!
Растворимости некоторых неорганических соединений в органических растворителях при
Ароматические полимеры, пригодные для получения термостойких волокон, практически не растворяются в известных органических растворителях. Это обстоятельство в сочетании с неплавкостью указанных полимеров длительное время оказывалось препятствием для синтеза исходных полимеров, так как для большинства термостойких полимеров поликонденсация в растворе является практически единственным способом их получения. И в настоящее время, несмотря на то, что имеется ряд технологически пригодных растворителей и разработаны основы теории растворов жесткоцепных высокомолекулярных соединений, подбор новых растворителей осуществляется эмпирически. Характерно при этом, что термостойкие полимеры растворяются лишь в системах, обладающих высокой полярностью. К такого рода веществам относятся органические апротонные растворители, такие, как Ы,Ы-диметилацетамид, Ы-метилпирролидон, гексаметилфосфортриамид, 1 ,Ы-диметилформ-амид, диметилсульфоксид и т. д. Некоторые полимеры, например ароматические полиамиды, растворимы в Ы-метилкапролактаме, адипонит-риле, сульфолане. Практически универсальным растворителем для большинства термостойких волокнообразующих полимеров являются концентрированные кислоты, такие, как серная, олеум, полифосфорная, хлор- или метансульфоновая. Ниже приведены характеристики некоторых органических и неорганических растворителей, применяемых в производстве термостойких волокнообразующих полимеров и волокон на их основе.
И в настоящее время, несмотря на то, что имеется ряд технологически пригодных растворителей и разработаны основы теории растворов жесткоцепных высокомолекулярных соединений, подбор новых растворителей осуществляется эмпирически. Характерно при этом, что термостойкие полимеры растворяются лишь в системах, обладающих высокой полярностью. К такого рода веществам относятся органические апротонные растворители, такие, как Ы,Ы-диметилацетамид, Ы-метилпирролидон, гексаметилфосфортриамид, 1 ,Ы-диметилформ-амид, диметилсульфоксид и т. д. Некоторые полимеры, например ароматические полиамиды, растворимы в Ы-метилкапролактаме, адипонит-риле, сульфолане. Практически универсальным растворителем для большинства термостойких волокнообразующих полимеров являются концентрированные кислоты, такие, как серная, олеум, полифосфорная, хлор- или метансульфоновая. Ниже приведены характеристики некоторых органических и неорганических растворителей, применяемых в производстве термостойких волокнообразующих полимеров и волокон на их основе. [c.15]
[c.15]
Приводятся значения растворимости (в г на 100 г растворителя) некоторых неорганических соединений в органических растворителях при температуре 18—20°С (или при температуре, указанной в скобках). [c.123] Таблица 8. Растворимости некоторых неорганических соединений в органических растворителях при 18—25 °С [c.88]
При растворении компонентов- нефтяного сырья в растворителях могут в той или иной степени проявляться все составляющие сил межмолекулярного взаимодействия. Очевидно, с повыщением температуры роль ориентационного взаимодействия и водородных связей снижается, роль дисперсионных сил возрастает. По способности растворять углеводороды органические и некоторые неорганические растворители можно разделить на две группы. К первой группе относятся растворители, при обычной температуре смешивающиеся с жидкими компонентами сырья практически во всех отношениях растворимость твердых компонентов в них подчиняется общей теории растворимости твердых веществ в жидких. Такими растворителями являются, например, неполярные соединения — низкомолекуляряые жидкие и сжиженные углеводороды парафинового ряда, а также соединения с очень небольшим дипольным моментом — четыреххлористый углерод, этиловый 5фир, хлороформ и т. д. [c.72]
Такими растворителями являются, например, неполярные соединения — низкомолекуляряые жидкие и сжиженные углеводороды парафинового ряда, а также соединения с очень небольшим дипольным моментом — четыреххлористый углерод, этиловый 5фир, хлороформ и т. д. [c.72]
Влияние свойств экстрагента может быть не только прямым (взаимодействие с извлекаемым веществом), но и косвенным (взаимодействие молекул экстрагента друг с другом и с разбавителем). В настоя-п ее время предложены различные способы классификации экстракционных систем [173—175]. Согласно работе [173], процессы экстракции металлов можно подразделить на экстракцию с образованием различного рода сольватов, например комплексов солей с трибутилфосфатом экстракцию с помощью органических кислот и их солей (экстракцию хелатов) экстракцию ониевых соединений (оксониевых, аммониевых), растворимость которых в неполярном органическом растворителе связана с образованием солей, состояш,их из комплексных анионов и крупных органических или сольватированных катионов. Подобное подразделение охватывает основные варианты химизма экстракций металлов, хотя и носит в некоторой степени условный характер, так как одни и те же органические экстрагенты могут входить в соединения различного типа. При сравнительно высоких значениях pH образуются комплексные катионы экстрагируемого металла, во внутреннюю координационную сферу которых включены молекулы органического основания. При экстракции же из более кислых растворов экстрагируются соединения органических катионов с комплексными металлсодержащими неорганическими анионами. Таким образом, в реальных процессах трудно провести четкую границу между различными видами химизма экстракции. Можно считать, однако, что все виды экстракционного извлечения в той или иной степени предполагают потерю металлсодержащей молекулой или ионом сродства к воде. [c.89]
Растворимость некоторых неорганических соединений в таких растворителях, как спирты, ацетон и др., часто используют для проведения многих реакций в отсутствие воды. Общепринято, например, применение спиртовых растворов едких щелочей для окисления в безводной среде часто применяют раствор хромового ангидрида в ледяной уксусной кислоте или раствор марганцовокислого калия в ацетоне (2,6% при 13° С). Атом хлора в хлористых алкилах гладко замещается атомом иода при действии раствора иодистого натрия в спирте или ацетоне (табл. 20). Для получения органических комплексных соединений с хлорной ртутью можно пользоваться раствором ее в эфире (6,45% при 20° С), в котором она растворима примерно так же, как и в воде (6,8% при 25 ° С), или же растворами в спирте или ацетоне (табл. 20). [c.52]
Приводятся значения растворимости (в г на 100 г растворителя) некоторых неорганических соединений в органических растворителях при температуре 18—20° С. [c.389]
Многие осадки, содержащие анионы органических кислот, например диметилглиоксимат никеля, оксихинолинат алюминия, растворяются в спирте, ацетоне и других растворителях значительно лучше, чем в воде. То же наблюдается для некоторых неорганических соединений комплексного характера так, например, йодная ртуть, роданидные комплексы железа,, кобальта хорошо растворяются во многих органических растворителях. В некоторых случаях растворимость веществ в органических растворителях настолько велика, что оказывается возможным извлекать вещество из водного раствора путем встряхивания с органическим растворителем. На этих свойствах некоторых соединений основаны методы экстрагирования (см. 27) [c.57]
Качественный анализ неорганических и органических веществ существенно различается из-за специфики свойств этих веществ. Хотя между двумя классами соединений нет резкой границы, все же имеются значительные различия в некоторых их основных свойствах, очень важных для выбора способа, по которому будет проводиться анализ — устойчивость при нагревании, летучесть, растворимость в различных растворителях, отношение к таким химическим агентам, как кислоты, окислители и др. Эти различия, а также многообразие комбинаций одних и тех же атомов в орга- [c.172]
Высоко селективной является экстракция неорганических соединений с полностью насыщенными ковалентными связями нейтральными растворителями. Например, в присутствии окислителей четыреххлористый углерод извлекает из солянокислых растворов только Ое и Оз [545]. Однако число экстракционных систем такого рода ограничено. Хорошо известна растворимость в инертных органических растворителях иода, серы, селена. Хлороформ экстрагирует некоторые галогениды и оксигалогениды хорошо экстрагируется хлороформом основной ацетат бериллия [327]. [c.282]
Большой интерес, проявляемый к ДМСО, объясняется многими причинами. Диметилсульфоксид является одним из наиболее интересных представителей среди диполярных апротонных растворителей, к которым он относится (имеются некоторые сомнения относительно его апротонного характера [468]), и характеризуется специфическими свойствами. Он является лучшим растворителем среди ДАР, смешивается с водой, спиртом, эфиром и многими другими растворителями в его среде и в смесях его с другими растворителями растворяются многие неорганические и органические соединения он превосходно растворяет вещества, содержащие гидроксильные или другие протонодонорные группы, даже в тех случаях, когда молекулярная масса растворяемого вещества относительно высока. ДМСО растворяет углеводы (сахар, крахмал, производные целлюлозы), протеины, полиамиды, полиуретаны, полициклические ароматические и гетероциклические соединения и т. д. В табл. 7 представлены сведения о растворимости в ДМСО некоторых соединений — доноров водородной связи. Для подобных соединений ДМСО является лучшим растворителем, чем вода. [c.119]
Экспериментальное изучение термохимии неорганических и органических соединений существенно различно. Если для органических соединений основной изучаемой в термохимии реакцией является сжигание веществ в кислороде, то для неорганических веществ такой преобладающей реакции или хотя бы группы реакций нет. Это вполне понятно, если учесть, что исследования по термохимии неорганических веществ охватывают вещества, очень резко различающиеся по своим химическим и физическим свойствам. Так, исследователям, работающим в этой области, приходится экспериментировать с веществами, которые имеют очень низкую температуру кипения ( постоянные газы) и очень высокую температуру плавления (например, окислы некоторых переходных металлов IV—VI групп), веществами, чрезвычайно агрессивными (фтор, щелочные металлы) и крайне инертными (благородные металлы и газы, кварц, четырехфтористый углерод), веществами, легко растворимыми во многих растворителях и практически не растворяющимися ни в одном из них, веществами неустойчивыми, легко разлагающимися, взрывчатыми, пирофорными, гигроскопичными и т. д. [c.131]
Белое кристаллическое вещество, т. пл. 1340 °С, возгоняется при 1150°С. Растворимость в воде около 2,5%, практически не растворим в гидрофобных органических растворителях. Технический продукт содержит 55—65% основного вещества (или 19—23% азота). В качестве примеси присутствуют углерод, оксид кальция, до 0,2% карбида кальция и некоторые другие неорганические соединения. Технический продукт из-за присутствия углерода окрашен в темно-серый цвет. Для уменьшения пыления к нему прибавляют до 2,5% минерального масла. [c.59]
Ниридин — единственный ароматический растворитель, пригодный для электрохимических целей. Он, безусловно, представляет собой достаточно сильное основание, которое способно образовывать с ионами металлов льюисовские кислоты — основные аддитивные соединения. Хотя пиридин имеет довольно низкую диэлектрическую постоянную (12), он весьма универсальный растворитель. В нем растворимы многие соли, причем их растворы обладают низким сопротивлением. Ниридин находится в жидком состоянии в области температур от -41 до +115°С и характеризуется умеренно низким давлением паров при комнатной температуре. Но вязкости он подобен воде и растворяется в ней в любых пропорциях. Ниридин использовался в качестве среды для электролитического окисления и восстановления неорганических и органических соединений на ртутном, платиновом и графитовом электродах. Из пиридиновых растворов были электроосаждены следующие элементы Ы, Ка, К, Си, Ag, Mg, Са, Ва, 2п, РЬ и Ге [1]. Имеются некоторые указания на образование растворов электронов в пиридине [2. [c.27]
Имеется некоторое число неорганических веществ, растворимых в органических растворителях. К ним относятся такие элементы, как иод, бром, многие комплексные соединения, даже малоустойчивые в водных растворах, например комплексные хлориды, бромиды, иодиды, ро - [c.117]
Тетраметилмочевина [97] (т. кип. 176,5° С т. замерз. —1,2° С е 23,06) смешивается во всех отношениях с водой и со всеми обычными органическими реагентами, включая петролейный эфир. Является сильным акцептором водородной связи. Токсичность низкая. Прекрасно растворяет неорганические вещества, за исключением некоторых ионных соединений (табл. 12). Она является прекрасным растворителем многих циклоалифатических, ароматических и гетероциклических органических веществ, за исключением свободных аминокислот, которые ограниченно растворимы в тетра-метилмочевине вследствие их цвиттерионного характера. Некоторые полимеры, например полиэтилен, полипропилен и высокомолекулярный найлон-6, 6 при комнатной температуре практически нерастворимы, но ацетаты целлюлозы, полиметилакрилат, поликарбонат, полиуретан, полистирол и новолак слегка растворимы. Отмечают, что тетраметилмочевина способствует значительному увеличению степени кристалличности таких полимеров, как поликарбонаты. Этот растворитель с р/Св равным 13,8 является сильно [c.133]
При выборе метода выделения фенола, встречающегося в природе, необходимо учитывать не только свойства соединения, как упоминалось выше, но также и химический состав биологического источника. Растительный материал состоит в основном из нерастворимой целлюлозы и лигнина, а в свежем виде может содержать также большое количество (70—80%) воды. Кроме того, могут присутствовать хлорофилл, воски, жиры, терпены, сложные эфиры, растворимые в воде соли, гемицеллюлозы, сахара и аминокислоты. Из свежего или сухого материала, как правило, сначала выделяют с помощью неполярного органического растворителя (например, петролейного эфира, гексана, бензола, хлороформа или эфира) нефенольные, неполярные вещества. Фенольные соединения можно затем выделить путем экстракции ацетоном, этанолом, метанолом или водой, причем выбор растворителя определяется числом гидроксильных групп и остатков сахара в молекуле. В некоторых случаях растительные материалы подвергаются непосредственной экстракции щелочью, но это не всегда приводит к хорошим результатам. Фенолы из растительного материала затем очищаются путем ряда экстракций и осаждений. С этой целью сырой материал переносят в несмешивающийся растворитель, такой, как эфир, бутанол или этилацетат, и смесь последовательно экстрагируют разбавленными растворами оснований в порядке возрастания активности сначала ацетатом натрия (для удаления сильных кислот), а затем бикарбонатом натрия, карбонатом натрия и едким натром. Водные экстракты, содержащие искомые продукты, подкисляют и вновь экстрагируют бутанолом, эфиром или этилаце-татом. Процедуру повторяют до получения кристаллического продукта. Подобное фракционирование в настоящее время осуществляется путем автоматической подачи несмешивающихся растворителей по принципу противотока (Хёрхаммер и Вагнер [9]). Фенолы можно отделять от других продуктов, содержащихся в растениях, путем осаждения с помощью нейтрального или основного ацетата свинца. Этим методом до некоторой степени отделяются о-диоксисоединения (дают осадок) от монозамещенных соединений (не дают осадка). Соли свинца разлагают серной кислотой, сероводородом или катионообменными смолами и свободные с )енолы элюируют из неорганических солей спиртом. [c.36]
Жидкостная экстракция. Экстракция несмешивающимися растворителями широко применяется на практике. Органические соединения часто-более растворимы в углеводородах, чем в воде, и могут быть извлечены из воды углеводородами. Присутствие других растворенных веществ может сильно влиять на распределение экстрагируемого вещества либо за счет образования комплексного соединения с веществом, либо путем изменения свойств растворителя. Обычным примером этого является процесс высаливания из растворителя при экстракции. Часто экстракцию органическими растворителями из воды ускоряют, насыщая воду хлористым натрием или другой солью, которая не растворяется в органическом растворителе. Некоторые неорганические соли, например хлорное железо и уранилнитрат, растворяются в органических растворителях [c.284]
Имеется некоторое число неорганических веществ, растворимых в органических растворителях. К ним относятся такие элементы, как иод, бром, многие комплексные соединения, даже малоустойчивые в водных растворах, например комплексные хлориды, бромиды, иодиды, роданиды и т. п., гетерополикислоты, фосфорована-даты, фосфоромолибдаты и т. п. Растворимость этих веществ в органических растворителях иногда очень велика, что дает возможность извлекать их таким способом в большом количестве из водных растворов. Иногда после экстракции возможно и количественное колориметрическое их определение в органическом растворителе. [c.136]
При выборе органического растворителя можно руководствоваться некоторыми общими указаниями. Для экстракции неорганических солей из воды пригодны соединения с умеренной растворимостью в воде и небольшой молекулярной массой. Для некоторых солей и слабо растворяющихся в воде органических растворителей можно составить ряд в направлении уменьшающейся экстракционной способности хлороформ, о-дихлорбензол, бензол, толуол, че-тыреххлористый углерод, циклогексан, н-гексан. Для солей, образующих комплексы, и растворителей типа доноров (кетоны, эфиры) составить такой ряд для всех металлов невозможно. Известно, например, что для Ре , Аи и Оа существует следующая последовательность (начиная с высшей) метилизопропилкетон, метилизобутилкетон, фурфурол, этилацетат, этиловый эфир, изопентиловый спирт, изоамилацетат, р-хлорэтиловый эфир, изопропиловый эфир, углеводороды. Для других металлов будет совсем иная последовательность. Некоторые задачи были рассмотрены в 3 и 4. [c.425]
Успехи органической химии привели к синтезу многих но-еых органических растворителей с большим диапазоном разнообразных свойств, а с развитием лабораторной техники появилась возможность работать с новыми неорганическими растворителями при повышенных и пониженных температурах и без-Доступа влаги. Все это позволило в некоторых случаях замедлить воду, являющуюся до сих пор универсальным растворителем. Особенно часто воду заменяют другими растворителями при кислотно-основноМ титровании. Причинами служат плохая растворимость некоторых веществ в воде, что особенно характерно для многих органических соединений мешающее влияние гидролиза, например, при титровании кислот в присутствии хлоридов или соответственно ангидридов кислот нивелирующий эффект растворителя, из-за которого невозможно Проводить дифференцированное титрование сильных кислот или оснований в их смеся х высокая полярность воды, что-исключает возможность диффренцированного титрования карбоновых кислот в их смесях. Применению неводных растворителей способствовало также создание чувствительных и надежных инструментальных методов индикации точки эквивалентности. [c.337]
В подобных случаях, т. е. когда вместо ожидаемого целевого продукта из реакционной смеси выделяют в небольшом количестве некую неожиданную примесь, все это выбрасывают, а синтез повторяют при более тщательной очистке исходных веществ и более строгом соблюдении необходимых для основной реакции условиях, не тратя время на изучение побочного продукта. Если бы Педерсен поступил традиционно (для чего бьни некоторые основания, так как вьщеленный побочный продукт не обладал способностью комплексовать ион VO3), то он, вероятно, больше никогда не получил бы шанса отправиться в Стокгольм за Нобелевской премией, которая была присуждена ему (совместно с Дональдом Крамом и Жаном-Мари Леном) в 1987 г. за открьггие макроциклических полиэфиров типа 214 и другкх комплексонов. К счастью для Педерсена (и для мировой науки ) от его внимания не ускользнули необычные особенности поведения этого соединения. Так, сам 214 очень мало растворим в метаноле, но его растворимость резко возрастает в присутствии едкого натра. Дальнейшие эксперименты показали, что такой эффект независим от основности неорганического реагента и наблюдается для многих натриевых солей, так же как и для солей ряда других неорганических катионов [32Ь,с], Еще более интригующим был тот факт, что неорганические соли, практически не растворимые в неполярных органических растворителях, становятся заметно растворимыми в них в присутствии макроциклического полиэфира 214. Эти наблюдения побудили Педерсона выдвинуть блестящую гипотезу, объясняющую природу этих явлений. Он предположил, что наличие полости в центре макроциклической полиэфирной системы обусловливает способность таких соединений, и, в частности, 214, поглощать неорганический катион, размер которого соответствует размеру [c.466]
Некоторые неионизованные неорганические соединения, например галогениды или оксигалогениды металлов, могут экстрагироваться органическими растворителями. В этом случае отсутствует отчетливо проявленное химическое взаимодействие между растворителем и экстрагируемым соединением. Поэтому экстрагентами могут быть углеводороды и их галоидозамещенные и может быть пригоден даже керосин. Подобно растворимым неионизованным соединениям могут экстрагироваться и нерастворимые соединения, особенно если их кристаллическая решетка неионная и преобладают ковалентные связи (SnJ4, HgJ2). [c.16]
Задачей так называгмых пргдварительных, или ориентировочных, исследований является выбор отправных точек и направления исследования. Это имеет существенное значение для открытия индивидуальных соединений при помощи характерных реакций и для химического анализа смесей. Такой способ исследования особенно полезен при аналитическом изучении огромного числа разнообразных органических веществ, для которых (не существует систематических схем анализа, подобных схеме анализа неорганических веществ. При анализе смеси органических соединений в лучшем случае можно достигнуть выделения некоторых индивидуальных соединений или представителей некоторых классов соединений. Для этой цели изучают растворимость исследуемого вещества в кислотах, основаниях и в органических растворителях, возможность перегонки при атмосферном давлении и с паром, возможность возгонки или разделения при помощи адсорбции (хроматография). На проведение предварительных исследований часто расходуют большое количество вещества и затрачивают много времени этн исследования не всегда применимы, часто не совсем надежны и неизбежно связаны с потерей вещества. Кроме того, число химических реакций органических соединений, имеющих аналитическое значение, пока все еще ограничено и, таким образом, в распоряжении исследователя имеется очень мало специфических и избирательных реакций, пригодных для обнаружения таких соединений. Любые ориентировочные данные или указания, которые можно извлечь из предварительных исследований, проведенных методом капельного анализа с малой затратой времени и вещества, имеют большое значение при анализе органических соединений. [c.86]
Из водной в органическую фазу могут переходить различные формы экстрагируемых элементов. Соединения неорганических ионов в подавляющем большинстпе плохо растворимы в органических растворителях и поэтому не извлекаются ими. Исключение составляют некоторые галиды, цианиды и роданиды. Например, хлорид железа (И1) можно извлечь эфиром в виде анионного комплекса метилизобутилкетоном можно экстрагировать роданид цинка, отделяя его от роданидов кобальта, кадмия, меди и др. В подавляющем большинстве экстрагируются различного типа комплексные соединения, особенно с органическими лигандами, например дитизонаты, купферонаты и др. В некоторых случаях экстрагируются сложные многоядерные комплексные соединения, гетерополикислоты и др. [c.259]
Очистка растворителями. Реагентами, используемыми для очистки подложек, служат водные растворы кислот и щелочей, а также такие органические растворители, как спирты, кетоны и хлористые углеводороды. Эффект очистки кислотами обусловлен превращением некоторых окислов и жиров в растворимые в воде соединения. Щелочные агенты растворяют жиры омыливанием, что делает их смачиваемыми в воде. Однако использование кислот и щелочей имеет свои ограничения. Их способность реагировать со стеклами была обсуждена в разд. 4В. Для химически инертных и слабо травящихся подложек нужно принимать меры против образования осадков и адсорбции молекул растворителя. Неорганические соединения часто бывают нелетучими и, следовательно, последующим нагревом в вакууме не могут быть удалены. Примером может служить удержание адсорбированного хрома на поверхностях стекла, очищенного «в горячих смесях серной и хромовой кислот. В растворах плавиковой кислоты, часто используемых для удаления нерастворимых осадков путем растворения тонкого слоя нижележащего стекла, образуются загрязнения в виде сильно адсорбированного фтора [97]. Индикатором этого является фтор, наблюдаемый в масс-спектрометре даже после того, как обработанное стекло было прогрето в вакууме при 325° С в течение 36 ч [98]. Проблема выпадения осадка может возникнуть и при использовании органических растворителей. Патнер [99] наблюдал слабую адгезию пленки на стеклянных подложках, очищенных четыреххлористым углеродом и трихлорэти-леном. После очистки поверхность покрывалась беловатым осадком, который не мог быть удален нагревом. Именно поэтому установлено, что хлоридные пленки образуются реакцией стекла с растворителями. [c.538]
В большинстве случаев аминами экстрагируют вещества из относительно кислых растворов, причем в таких системах амины присутствуют в виде соответствующих ионов аммония. Предложены и изучены некоторые способы экстракции аминами минеральных кислот [1, 2] и неорганических соединений [3]. Для изучения процесса экстракции аминами необходимо знать основность экстрагентов. На основании предварительных экспериментов и уже опубликованных работ [4—7] можно показать следующий ряд основности аминов первич-ные>вторичные>третичиые. Основность аминов, растворимых в воде, увеличивается в ряду аммиакСпер-вичный вторичный [8]. Последняя закономерность соблюдается и во многих органических растворителях [9—12]. [c.249]
Получение двубромистого п-бромфенилталлия [33]. К кипящему раствору п-бромфе-нилборной кислоты (0,01 моля в 30 мл воды) прибавлен трехбромистый таллий (0,03 моля). После кипячения в течение 25—35 мин. и последующем охлаждении получено около 1,2 г кристаллов желтого цвета, которые после промывания эфиром окрашиваются в оранжевожелтый цвет. Они растворимы в горячей воде, хуже — в холодной, немного растворимы в эфире, нерастворимы в большинстве органических растворителей. При хранении на свету вещество заметно разлагается оно буреет при 190—200° С, разлагаясь. Повышенное содержание таллия при анализе объясняется некоторой примесью неорганических соединений этого металла, от которой освободиться не удается. [c.431]
Качественные предсказания растворимости с большей вероятностью могут быть сделаны на основании представлений о химическом подобии компонентов, нежели по величинам в pa TBopnie-лей. Соли, как правило, плохо растворимы в углеводородах и их галогенпроизводных (одно из исключений — перхлорат серебра в бензоле и толуоле), лучше — в спиртах, амидах, сульфоКсидах, кетонах, нитропроизводных и пр. Соли щелочных и щелочноземельных металлов обычно растворимы хуже в органических растворителях, нежели аналогичные соли элементов, склонных к образованию координационных соединений с растворителем. В последнее время нашли применение некоторые апротонные растворители, обеспечивающие довольно высокую растворимость многих неорганических солей пропиленкарбонат, N-метилацетамид, N-метилпир-ролидон, гексаметилфосфортриамид и др. [c.82]
Растворимость газов в жидкостях. Неорганические газообразные веш ества (газообразные элементы, диоксид углерода, оксиды серы и т. д.) обычно лучше растворяются в воде, чем в органических растворителях. Однако газообразные органические соединения лучше растворимы в органических растворителях, чем в воде, за некоторыми исклточе-ниями. [c.109]
О простых вещах-сложно. Письмо химика 3D-печатнику. Растворители для пластмасс и защита от них
DIY посвящается…Одним из наиболее часто задаваемых вопросов в моей консультационной практике являются вопросы связанные с растворением/склейкой пластмасс с помощью всевозможных органических растворителей. В последнее время произошел настоящий всплеск интереса к химии высокомолекулярных соединений, связанный с появлением доступных 3D принтеров и необходимостью ориентироваться в «чернилах» для них (т.е. полимерных нитях-филаментах). Лишний раз убеждаюсь в том, что ни один, даже самый продвинутый «музей науки» с эффектным шоу не может так заставить IT-шника интересоваться пластмассами, как собственный 3D-принтер. Так что, читатель, если тебе хоть раз приходилось думать чем склеить пластмассу, которую не клеил default-ный суперклей, если мучали сомнения по поводу растворения поддержек свежеотпечатанной детали, да и просто интересно, чем можно отмыть клей от магазинного ценника на подарке — прошу под кат. Также настоятельно рекомендую страницу отправить в закладки не только тем, кто часто занимается склеиванием пластмасс, но и всем тем, кому часто приходится работать с различными растворителями/разбавителями. Делалось для себя — подарено Хабру!
Как я уже писал пару раз в комментариях к своим статьям, в последнее время периодически у меня возникает мысль сделать себе «выставочный» стенд, на котором были бы представлены образцы пластмасс. Просто потому что практически каждый второй вопрос химического толка звучит «а что это за пластик». О чем это говорит, говорит о том, что возможности 3D печати привлекли такое внимание общества к пластикам, полимерам и т.п. какое не смогли бы сделать и сотни онлайн-популяризаторов науки. Ну и в целом, посматривая на эти тенденции можно смело констатировать, что будущее, будущее не столько за металлами, сколько за композитами и новыми видами полимеров. Так что, тот кто сегодня задумывается над выбором химической специальности — рассмотрите этот вариант. Поэтому в очередной раз и ваш покорный слуга решил внести свою скромную лепту и рассказать о том, с чем мне постоянно приходится сталкиваться. Сегодня читаем про растворители для пластмасс и особенности работы с ними. Для начала — небольшое теоретическое введение.
«Матчасть — та часть, что с матерком…»
Рассказать в двух словах о растворении полимеров не получится при всем желании, потому что тема это объемная и неоднозначная (можно даже сказать «потянет на университетский курс», привет вам,
Леонид Петрович Круль, отдаю долг за 8-ку по ВМС). Неплохой (читай учебный) обзор для людей с достаточно высоким уровнем технической (химики и инженеры) грамотности можно почитать
здесь. О процессе растворения будет сказано ниже, пока же пару слов о выборе растворителя (или почему что-то растворяет пластик, а что-то — нет).
В целом, подбор подходящего растворителя производится двумя методами:
1. Используя параметры растворимости Гильдебранда. Такой расчет применяется, если полимер (p) и растворитель (s) имеют одинаковый параметр полярной и водородной связи, тогда работает следующее простое правило:
|δs — δp| ≤ 3.6 MPa1/2
В качестве примера приведу параметры Гильдебранда для некоторых полимеров:
Кто хочет проверить себя — может на досуге посчитать растворимость :). Искать константы можно и нужно вот в
этойкниге. Важно отметить, что параметры Гильдебранда полезны только для неполярных и слабополярных смесей в отсутствие водородных связей (дипольный момент
Примечание: для тех, кто традиционно «знал, да забыл», напоминаю, что по нормам IUPAC (что за они — смотреть в статье про таблицу Менделеева) растворители качественно сгруппированы в неполярные, полярные апротонные и полярные протонные растворители, для разделения на группы которых, часто используется их диэлектрическая постоянная. Чаще всего протонный растворитель представляет собой растворитель, который имеет атом водорода, связанный с кислородом (как в гидроксильной группе), азотом (как в аминогруппе ) или фтором (как во фтористом водороде). В целом, любой растворитель, который содержит подвижный Н+, называется протонным растворителем. Молекулы таких растворителей легко отдают протоны (H+) другим реагентам. И наоборот, апротонные растворители протоны отдавать не могут, так как H+ не содержат. Они обычно имеют большие диэлектрическую проницаемость и высокую полярность. На картинке ниже приведены примеры распространенных растворителей, разбитых на классы.
Возвращаемся к подбору растворителя. Как я уже писал, если Гильдербрант не подошел — используем Хансена.
2. Используя параметры растворимости Хансена, для каждого растворенного вещества можно составить приблизительный сферический «объем» растворимости с радиусом R. Только растворители, которые имеют параметры растворимости Хансена в этом объеме, могут растворять данный полимер:
[4(δd2 — δd1)2 + (δp2 — δp1)2 + (δh3 — δh2)2]1/2 ≤ R
Радиус взаимодействия R зависит от типа полимера. Значения R обычно находятся в диапазоне от 4 до 15 MPa1/2. Параметры Хансена, необходимые для расчета растворимости своей системы можно найти в этой книге. Для наглядности на картинке ниже приведены параметры Хансена (по аналогии с Гильдербрантом) для некоторых широко используемых полимеров.
Если вдруг кому-то действительно будет нужно проводить целенаправленный скрининг растворителя для своего полимера по методу Хансена, я рекомендую обратить внимание на программу
HSPiP, которая отлично с этой задачей справляется. По
ссылке— обзор и описание работы.
В целом можно сказать следующее. Во-первых, «золотое правило растворения» — подобное растворятся в подобном — работает и для полимеров. Т.е. соединения со сходной химической структурой более склонны к растворению, чем соединения с разной структурой. Во-вторых, чем выше молекулярная масса полимера, тем ближе должен быть параметр растворимости растворителя и полимера для растворения полимера в растворителе. Для линейных и разветвленных полимеров график зависимости растворимости от параметра растворимости для ряда растворителей достигнет максимума, когда параметры растворимости (Хансен/Гильдербрандт) растворенного вещества и растворителя совпадают. В случае сшитого полимера объем набухания, то есть поглощение растворителя, достигнет максимума, когда параметры растворимости растворителя совпадают с параметрами полимера. В третьих, параметры растворимости полимеров не сильно изменяются с температурой, тогда как параметры низкомолекулярных соединений часто заметно уменьшаются с повышением температуры, поэтому чем выше молекулярная масса полимера, тем ближе должен быть параметр растворимости растворителя для растворения полимера в растворителе.
Ладно, надеюсь утомил читателя не сильно. Спешу перейти от теории к практике.
Химическая сварка пластмасс
Традционно, в случае если вдруг понадобилось срастить несколько кусков пластика используют различные методы. Некоторые из них показаны на картинке:
В промышленности часто используется либо сварка основанная на физических методах (вроде ультразвуковой или лазерной), либо механическое соединение. Гораздо реже применяют адгезионные методы соединения (клеи, расплавы или растворы полимеров). Такие методы применяются при сборке пластиковых витрин в магазинах, склейке различных аквариумов, кофров и чехлов. Но самыми наверное популярным пользователем данного метода является DIY-ер, или по-нашему, самодельщик. Еще со времен СССР изобретатели и просто рукастые граждане всех мастей клеили корпуса своих поделок из оргстекла и дихлорэтана. С приходом в нашу жизнь доступных 3D принтеров растворы полимеров получили вторую жизнь в виде подпорок, которые создаются при печати и которые в готовом изделии нужно как-то удалять. Не всегда это возможно (и целесообразно) делать механически, поэтому часто в дело вступает его величество «Растворитель пластмасс».
Примечание: если говорить за себя, то несмотря на возможность напечатать модель на 3D принтере, я до сих пор по-старинке клею оргстекло, когда нужно сделать коробочку или что-то подобное (без кривых Безье). На КДПВ, кстати, как раз и показан пример такой «сиюминутной! вещи», которая на скорую руку клеилась красным раствором оргстекла (PMMA) из колбочки.
Итак, химическая сварка пластика — это процесс объединения размягченных с помощью растворителя поверхностей пластмассы. Растворитель временно переводит полимер в «разреженное» при комнатной температуре состояние. Когда это происходит, полимерные цепи могут свободно перемещаться в жидкости и могут смешиваться с другими такими же растворенными цепями. По прошествии некоторого времени растворитель за счет диффузии и испарения будет проникать через полимер и мигрировать в окружающую среду, а полимерные цепи — будут уплотняться (~упаковываться) и терять свою подвижность. Застывший клубок спутанных цепей полимеров — это и есть сварной шов при таком типе сварки. Графически механизм процесса растворения пластика показан на картинке ниже:
Обычно нормальное растворение включает в себя стадию проникновения растворителя, стадию набухания полимера и стадию диффузии полимера в растворитель. Изначально застекловавшийся полимер содержит множество микроканалов и отверстий молекулярных размеров (приходящихся на т.н. инфильтрационный слой).
При контакте с растворителем, последний заполняет эти каналы и отверстия и запускает процесс диффузии (новые каналы при этом не образуются). Схематически такой поверхностный слой растворяющегося полимера выглядит так (грубо говоря, «клей» = гелеобразная масса, то, что находится посредине между твердым полимером и жидким растворителем):
С механизмом, надеюсь, все более или менее понятно, настало время перейти к конкретике «что и чем». В теоретической части я кратенько попытался объяснить, как происходит процесс скрининга растворителя для конкретного типа полимера. Т.е. универсальной и всеобъемлющей таблицы для растворения полимеров пока нет.
А тема эта актуальна. Подтверждением является тот факт, что достаточно часто на страницах различных тематических ресурсов (DIY, 3D, радиолюбительские и т.п.) с заметной периодичностью появляются вопросы вроде «чем обрабатывать»/«чем клеить»/«как растворить» тот или иной вид пластика. Интересно, что в большинстве случаев ответы дают люди с химией полимеров (ВМС) знакомые судя по всему достаточно слабо. В итоге возникает еще больше путаницы и «простора для творчества» всевозможных дилетантов, продавцов и прочих мракобесов. Теряют же деньги и время, традиционно, ни в чем не повинные пользователи. Так что, смотрим таблицу ниже и мотаем на ус.
Темный квадрат в таблице на пересечении линий «полимер»-«растворитель», говорит о том, что химическую сварку с использованием данных компонентов провести представляется возможным.
Примечание: квадратик на пересечении «ABS»-«ацетон» — с буквой
H, потому что именно хабра-сообщество убедило меня в том, что ABS клеит в основном ацетоном (у меня ацетон растворял ABS, но потом склеить этим раствором ничего не получалось, ибо крошился).
Если с вопросом наличия пластика проблем, как правило, не возникает, то достаточно часто возникает проблема с наличием нужного растворителя. Каждый выкручивается в меру своих возможностей — кто-то просто заказывает необходимые растворители, кто-то ищет их на блошином рынке, ну а кто-то пытается эмпирическим методом подобрать из того, что продается в магазинах. Под спойлером, если что, состав имеющихся в продаже растворителей для лаков и красок (взято с chemister).
Где взять сварочные электроды для пластмассы ?Растворители:Растворитель 645: толуол 50%, бутилацетат 18%, этилацетат 12%, бутанол 10%, этанол 10%.
Растворитель 646: толуол 50%, этанол 15%, бутилацетат (или амилацетат) 10%, бутанол 10%, этилцеллозольв 8%, ацетон 7%.
Растворитель 647: толуол (или пиробензол) 41,3%, бутилацетат (или амилацетат) 29,8%, этилацетат 21,2%, бутанол 7,7%.
Растворитель 648: бутилацетат 50%, толуол 20%, бутанол 20%, этанол 10%.
Растворитель 649: ксилол 50%, этилцеллозольв 30%, изобутанол 20%.
Растворитель 650: ксилол 50%, бутанол 30%, этилцеллозольв 20%.
Растворитель 651: уайт-спирит 90%, бутанол 10%.
Растворитель КР-36: бутанол 80%, бутилацетат 20%.
Растворитель Р-4: толуол 62%, ацетон 26%, бутилацетат 12%.
Растворитель Р-10: ксилол 85%, ацетон 15%.
Растворитель Р-12: толуол 60%, бутилацетат 30%, ксилол 10%.
Растворитель Р-14: циклогексанон 50%, толуол 50%.
Растворитель Р-24: сольвент 50%, ксилол 35%, ацетон 15%.
Растворитель Р-40: толуол 50%, этилцеллозольв 30%, ацетон 20%.
Растворитель Р-219: толуол 34%, циклогексанон 33%, ацетон 33%.
Растворитель Р-3160: бутанол 60%, этанол 40%.
Растворитель РКЧ: ксилол 90%, бутилацетат 10%.
Растворитель РМЛ: этанол 64%, этилцеллозольв 16%, толуол 10%, бутанол 10%.
Растворитель РМЛ-315: толуол 25%, ксилол 25%, бутилацетат 18%, этилцеллозольв 17%, бутанол 15%.
Растворитель РС-1: толуол 60%, бутилацетат 30%, ксилол 10%.
Растворитель РС-2: уайт-спирит 70%, ксилол 30%.
Растворитель РФГ: этанол 75%, бутанол 25%.
Растворитель РЭ-1: ксилол 50%, ацетон 20%, бутанол 15%, этанол 15%.
Растворитель РЭ-2: сольвент 70%, этанол 20%, ацетон 10%.
Растворитель РЭ-3: сольвент 50%, этанол 20%, ацетон 20%, этилцеллозольв 10%.
Растворитель РЭ-4: сольвент 50%, ацетон 30%, этанол 20%.
Растворитель ФК-1 (?): абсолютированный спирт (99,8%) 95%, этилацетат 5%
Разбавители:
Разбавитель для водоразбавленных лаков и красок: бутанол 62%, бутилцеллозольв 38%.
Разбавитель М: этанол 65%, бутилацетат 30%, этилацетат 5%.
Разбавитель Р-7: циклогексанон 50%, этанол 50%.
Разбавитель Р-197: ксилол 60%, бутилацетат 20%, этилцеллозольв 20%.
Разбавитель РДВ: толуол 50%, бутилацетат (или амилацетат) 18%, бутанол 10%, этанол 10%, этилацетат 9%, ацетон 3%.
Разбавитель РКБ-1: ксилол 50%, бутанол 50%.
Разбавитель РКБ-2: бутанол 95%, ксилол 5%.
Разбавитель РКБ-3: ксилол 90%, бутанол 10%.
Разбавители для электрокраски:
Разбавитель РЭ-1В: сольвент 70%, бутанол 20%, диацетоновый спирт 10%.
Разбавитель РЭ-2В: сольвент 60%, бутилацетат 20%, этилцеллозольв 20%.
Разбавитель РЭ-3В: сольвент 50%, бутанол 30%, этилцеллозольв 20%.
Разбавитель РЭ-4В: этилцеллозольв 50%, сольвент 50%.
Разбавитель РЭ-5В: ксилол 40%, циклогексанон 25%, этилцеллозольв 25%, бутанол 10%.
Разбавитель РЭ-6В: сольвент 50%, ксилол 35%, диацетоновый спирт 15%.
Разбавитель РЭ-7В: ксилол 60%, бутилацетат 25%, диацетоновый спирт 10%, циклогексанон 5%.
Разбавитель РЭ-8В: бутанол 75%, ксилол 25%.
Разбавитель РЭ-9В: сольвент 50%, бутилацетат 30%, этилцеллозольв 20%.
Разбавитель РЭ-10В: сольвент 40%, бутанол 40%, этилцеллозольв 20%.
Разбавитель РЭ-11В: ксилол 40%, этилцеллозольв 30%, бутилацетат 20%, циклогексанон 10%.
Разжижители:
Разжижитель ДМЗ-Р: бутилацетат (или амилацетат) 39%, толуол 30%, этилацетат 16%, ацетон 15%.
Разжижитель Р-5: ксилол 40%, бутилацетат 30%, ацетон 30%.
Разжижитель Р-6: пиробензол 40%, этанол 30%, бутанол 15%, бутилацетат 15%.
Разжижитель Р-60: этанол 70%, этилцеллозольв 30%.
Разжижитель РВЛ: хлорбензол 50%, этилцеллозольв 50%.
На заметку:
добавлю от себя пару слов про полимеры, не попавшие в таблицу. Конечно же это любимый «народный» филамент —
PLA, который растворяется лучше всего в полярных апротонных
растворителях: пиридин, N-метилпирролидон, этилацетат, пропиленкарбонат, диоксалан, диоксан, дихлорметан, хлороформ, ацетон (??-зависит от производителя PLA-филамента и содержащихся внутри «присадок», это же актуально и для других полимеров), нитробензол, ацетонитрил, диметилацетамид и т.д. Перспективный 3D полимер
PEEK(он же полиэфиркетон) замечательно
растворяетсяв 4-хлорфеноле (более жесткий вариант — смесь 80% хлороформа и 20% дихлоруксусной кислоты). Хлорфенолами (не только 4-, но и 2-хлорфенолом) можно растворить также и широко распространенный и горяче любимый
PET. По просьбам читателей, упомяну и достаточно новый полимер PET-ряда, так называемый PETG (полиэтилентерефталат-гликоль). Как и старший брат, этот полимер устойчив к ряду доступных широко используемых компонентов, растворяется только в
HFIP(гексафторпропанол). Мягкий и податливый
TPU(термопластичный полиуретан), как и другие полиуретаны можно растворить в N,N-диметилформамиде (ДМФА), тетрагидрофуране, этилацетате, циклогексаноне, диметилацетамиде. Кстати, монтажная пена, это тоже полиуретан. Не смотрел что находится в составе специальных жидкостей для промывки пистолетов для монтажной пены, но подозреваю, что какой-то из упомянутых компонентов там точно есть. Полимер
PCL(поликапролактон) растворяется в
анизоле, 2,2,2-трифторэтаноле, N,N-диметилформамиде, метилпирролидоне, тетрагидрофуране, дихлорметане, ацетоне, хлороформе и ДМСО (диметилсульфоксид, он же продающийся в аптеке «Димексид»).
PDMS(полидиметилсилоксан) широко используемый для прототипирования (особенно в научных учреждениях, имеющих отношение к микро- и нанофлюидике) растворяется с помощью ледяной уксусной кислоты. Кстати, подобными свойствами обладают и многие другие силиконы, начиная от строительного двухкомпонентного, и заканчивая теми, на которые клеят стикеры с ценами (поэтому смыть остатки клея от ценника с ABS пластика, например, продуктивнее всего получится с использованием какой-нибудь уксусной эссенции). Ну и в завершение немного экзотики. EVA (этиленвинилацетат), PP (полипропилен), PE (полиэтилен, LD/HD) растворяются в 1,2,4-трихлорбензоле, а PVP (поливинилпирролидон) — в диметилацетамиде.
Техника безопасности при работе с растворителями
Так как растворители, мягко говоря, это вам не аромат цветущей сакуры, то и вопрос техники безопасности при работе с ними на повестке дня имеется. Печально наблюдать, как молодые ребята без всяких средств защиты иногда работают кто с ацетоном, кто с хлороформом, а кто-то даже с бензолом. А правила ТБ, они, как известно, «писаны кровью»…
Основные пути попадания растворителей в организм человека (и их паров) — через органы дыхания и через кожные покровы. Всякие девиации (вроде приема внутрь) я не рассмартиваю, потому как человек в здравом уме никогда не будет пить бензол. Упомянутые реагенты обладают преимущественно наркотическим действием, оказывают выраженное раздражающее действие на слизистые оболочки верхних дыхательных путей и конъюнктиву глаза, умеренное — на кожу. Лучшая защита от них — работать в условиях приточно-вытяжной вентиляции, в специальных боксах. Если дело происходит в специализированных мастерских или лабораториях, то чаще всего там уже есть вытяжной шкаф.
Если невозможно устроить необходимую вентиляцию, работающих с органическими растворителями снабжают средствами индивидуальной защиты: респираторами, противогазами, кислородно-изолирующими приборами и т.п. (в зависимости от концентрации паров). В целом, пары растворителей замечательно сорбируются активированным углем (и многими другими сорбентами) недаром раньше некоторые растворители активно использовались для оценки сорбционной способности материала (т.н. «эксикаторный метод»). Я лично «имел честь» проверять сорбционную способность углей по поглощению ими тетрахлорметана CCl
4. Большую часть паров сможет задержать противогаз с коробкой класса А или маска-респиратор с аналогичным фильтрующим патроном. Вроде такой:
Важно в описании искать что-то вроде «
защищает от паров органических соединений (бензин, керосин, ацетон, бензол и его гомологи, ксилол, сероуглерод и др.), фосфор- и хлорорганических ядохимикатов, пыли, дыма, тумана«. Но к такой маске желательно еще и герметичные очки, стекла которых
от запотевания натерты раствором, в состав которого входит желатин, сахар и вода в соотношении 2:20:50. Лучше конечно при наличии денег сразу взять какой-нибудь противогаз промышленный фильтрующий или
маску защитную панорамнуюи убить двух зайцев (=сэкономить на очках).
Мой любимый защитный equip (после тяги)Упомянутая уже панорамная маска (отличная обзорность после противогаза из СССР)
Она же, но с другой стороны
И моя гордость, фильтрующая коробка с защитой от паров ртути.
Следующим после органов дыхания слабым местом при работе с растворителями являются открытые участки кожи. Если лицо спрятано под противогаз — остаются руки. Многие растворители отлично впитываются через кожу (толуол, тетрагидрофуран) и способны вызывать сильнейшие дерматиты и экземы (бензол, хлористый метилен, хлороформ и т.д.). Поэтому оптимальным вариантом будет а)использование защитных перчаток (перчатки из поливинилового спирта — для хлорорганики, все остальные, вроде латексных или нитриловых — годятся только для спиртов, кетонов), б)применение специальных защитных мазей и паст.
Дополнение: под спойлером спрятаны таблицы устойчивости материала защитных перчаток к различным растворителям, найденные Kriminalist, за что ему огромное спасибо. Очень рекомендуется к просмотру перед покупкой «защитного снаряжения»
Стойкость перчаток к растворителямВыполняя работы с ароматическими растворителями (толуол, бензол, сольвенты, ксилолы) используют пасты: ИЭР-1, ХИОТ-6, ПМ-1, ЯЛОТ. При работе с нафтеновыми, парафиновыми и смешанными растворителями – ЯЛОТ, ХИОТ-6, ИЭР-1. Составы этих проверенных временем мазей (часто называемых еще «биологические перчатки») приведены на картинке ниже.
Ну и буквально пару слов про одежду. В обычных условиях что-то экстраординарное вроде военного костюма химической защиты применять смысла нет. Для защиты тела вполне достаточно спецодежды (халата) из хлопчатобумажной ткани. В случае особо агрессивной хлорорганики или ароматики к этому добавляют фартук/накидку с ПВХ/ПВА или резиновым/неопреновым покрытием.
Примечание: в Европе даже существует специальная организация ECSA — European Chlorinated Solvents Association (Европейская ассоциация по хлорированным растворителям), которая ежегодно выпускает свои бюллетени, в которых подробно описывает необходимые средства защиты при работе с подобными растворителями, материалы, инструменты и т.п.
Подытоживая можно сказать, что в случае соблюдения описанных правил — работать с растворителями будет не только интересно, но и безопасно. На сим откланиваюсь, с растворами полимеров закончено.
P.S. Под спойлером — таблица с ПДК/описанием физиологического действия распространенных растворителей. Взято из справочника Дринберг С.А. Растворители для лакокрасочных материалов за 1986 год. Так что читайте, но проверяйте на факт соответствия современным реалиям (в плане точности ПДК, наврядли оно могло увеличится, а вот уменьшится — вполне).
Важно! если своего растворителя в таблице вы не нашли, настоятельно рекомендую воспользоваться базой TOXNET (Hazardous Substances Data Bank — База данных опасных веществ под эгидой Национальной медицинской библиотеки США) и посмотреть там.
P.P.S. Обращение к тем, кто просит проверить растворимость конкретного пластика в растворителях — после статьи есть замечательная кнопочка «Поддержать автора». Если скопится достаточная сумма — растворимость станет возможным проверить 😉 Также эти вопросы можно решить через упомянутую в начале статьи
консультационную систему.
Важно! Все обновления и промежуточные заметки из которых потом плавно формируются хабра-статьи теперь можно увидеть в моем телеграм-канале lab66. Подписывайтесь, чтобы не ожидать очередную статью, а сразу быть в курсе всех изысканий 🙂
Дринберг С.А. Растворители для лакокрасочных материалов: Справочное пособие. Л.: Химия, 1986.
Жилов Ю.Д. Справочник по гигиене труда и производственной санитарии. М., Высшая школа, 1989.
И. М. Нейман Средства индивидуальной защиты на производстве. Профиздат, М., 1954.
Yue CY. The structure and strength of solvent welds between dissimilar amorphous thermoplastics. International Journal of Adhesion and Adhesives, 8(1), p. 47, 1988.
Tres P: Assembly techniques for plastics. Designing Plastic Parts for Assembly, Reference book (ISBN 1-569-90199-6), Hanser Gardner Publications, Inc., 1995.
Rosato’s Plastics Encyclopedia and Dictionary, Reference book (ISBN 3-446-16490-1), Carl Hanser Verlag, 1993.
Desai J, Barry CMF, Mead JL, Staceer RG: Solvent welding of ABS and HIPS: a case study in methylene chloride substitution. ANTEC 2001, Conference proceedings, Society of Plastics Engineers, Dallas, May 2001.
Warwick CM Solvent welding. Handbook of Adhesion, 2nd Edition, Reference book (ISBN 0-471-80874-1), John Wiley & Sons, 2005.
Lowery T.H. Mechanism and Theory in Organic Chemistry, Harper Collins Publishers 3rd ed. 1987
Sato, S., Gondo, D., Wada, T., Kanehashi, S., & Nagai, K. (2012). Effects of various liquid organic solvents on solvent-induced crystallization of amorphous poly(lactic acid) film. Journal of Applied Polymer Science, 129(3), 1607–1617.
Grewell, D. Plastic and Composite Welding Handbook, Hanser Publishers, Munich (2003)
Xu, J., Zhang, Z., Xiong, X., & Zeng, H. (1992). A new solvent for poly(ether ether ketone). Polymer, 33(20), 4432–4434.
A.F.M. Barton, CRC Handbook of Polymer-Liquid Interaction Parameters and Solubility Parameters, CRC Press, Boca Raton, 1991.
Charles M. Hansen, Hansen Solubility Parameters: A User’s Handbook, 2nd Edition, 2007
Beth A. Miller-chou, Jack L. Koenig A review of polymer dissolution. Prog. Polym. Sci. 2003
Важно!
Если информация из статьи пригодилась вам в жизни, то:
Стань спонсором и поддержи канал/автора (=«на реактивы»)!
ЯндексДеньги: 410018843026512 (перевод на карту)
WebMoney: 650377296748
BTC: 3QRyF2UwcKECVtk1Ep8scndmCBoRATvZkx
Patreon — steanlab
Вода, универсальный растворитель
• Школа наук о воде ГЛАВНАЯ • Темы о свойствах воды •
Знаете ли вы, что вы можете растворить M в M&M? Все, что вам нужно сделать, p , кроме нескольких M & M в воде стороной M вверх и наблюдайте, что происходит!
Кредит: coffeecupsandcrayons.com
Воду называют «универсальным растворителем», потому что она способна растворять больше веществ, чем любая другая жидкость.Это важно для каждого живого существа на земле. Это означает, что везде, где вода проходит через воздух, землю или через наши тела, она уносит с собой ценные химические вещества, минералы и питательные вещества.
Химический состав и физические свойства воды делают ее таким прекрасным растворителем. Молекулы воды имеют полярное расположение атомов кислорода и водорода: одна сторона (водород) имеет положительный электрический заряд, а другая сторона (кислород) — отрицательный. Это позволяет молекуле воды стать привлеченной ко многим другим различным типам молекул .Вода может настолько сильно притягиваться к другому соединению, как соль (NaCl), что может нарушить силы притяжения, которые удерживают натрий и хлорид в соединении соли вместе и, таким образом, растворяют его.
Наши почки и вода составляют отличную пару
Наши собственные почки и растворяющие свойства воды составляют отличную пару для сохранения жизни и здоровья. Почки отвечают за фильтрацию веществ, которые попадают в наш организм из продуктов и напитков, которые мы потребляем.Но почки должны избавляться от этих веществ после того, как они накапливают их. Вот тут-то и помогает вода; будучи таким прекрасным растворителем, вода, промывающая почки, растворяет эти вещества и выводит их из нашего тела.
На этой диаграмме показаны положительные и отрицательные части молекулы воды. Он также показывает, как заряд, например, на ионе (например, Na или Cl), может взаимодействовать с молекулой воды.
Кредит: Мариана Руис Вильярреал, Фонд CK-12
Почему соль растворяется в воде
На молекулярном уровне соль растворяется в воде из-за электрических зарядов и из-за того, что и вода, и солевые соединения полярны, с положительными и отрицательными зарядами на противоположных сторонах молекулы.Связи в солевых соединениях называются ионными, потому что они оба имеют электрический заряд: ион хлорида заряжен отрицательно, а ион натрия — положительно. Точно так же молекула воды имеет ионную природу, но связь называется ковалентной, когда два атома водорода располагаются с положительным зарядом на одной стороне атома кислорода, который имеет отрицательный заряд. Когда соль смешивается с водой, она растворяется, потому что ковалентные связи воды сильнее, чем ионные связи в молекулах соли.
Положительно заряженная сторона молекул воды притягивается к отрицательно заряженным ионам хлорида, а отрицательно заряженная сторона молекул воды притягивается к положительно заряженным ионам натрия. По сути, происходит перетягивание каната, когда молекулы воды выигрывают матч. Молекулы воды разъединяют ионы натрия и хлора, разрывая ионную связь, удерживающую их вместе. После разделения солевых соединений атомы натрия и хлора окружаются молекулами воды, как показано на этой диаграмме.Как только это происходит, соль растворяется, в результате чего получается гомогенный раствор.
Органические растворители в качестве носителей для осаждения жидких эмболий: сравнительное исследование ангиотоксичности с суперселективными инъекциями свиней Rete Mirabile
Abstract
ИСТОРИЯ И ЦЕЛЬ: Органический растворитель диметилсульфоксид (ДМСО), обычно используемый в качестве неадгезивного носителя. жидкие эмболии, не лишенные местного ангиотоксического действия. Мы сравнили микрососудистую токсичность суперселективных инфузий ДМСО с потенциально более совместимыми растворителями в ретемирабиле свиней.
МЕТОДЫ: Четырнадцати свиньям была проведена ангиография для суперселективной катетеризации 28 артерий сетчатки при непрерывном мониторинге электрокардиографии и внутриартериального давления. Исследуемые растворители: ДМСО, диметилизосорбид (DMI), этиллактат, гликофурол 75, N -метилпирролидон (NMP) и солькеталь. Контрольная инфузия физиологического раствора во всех случаях исключила катетер-индуцированный вазоспазм. В каждую артерию ретейнера вводили только один раз 0,8 мл одного из растворителей в течение 60 секунд.Оценивались острые ангиографические и гемодинамические последствия. Образцы крови оценивали на предмет признаков внутрисосудистого гемолиза. Мозг и ретия были взяты для общего и гистопатологического исследования.
РЕЗУЛЬТАТЫ: На основании ангиографических данных ДМСО вызывал наиболее выраженный вазоспазм с самым длительным периодом восстановления из всех исследованных растворителей. Этилактат, гликофурол 75 и солкетал вызывали менее тяжелые спазмы сосудов и, соответственно, разрешались гораздо быстрее.DMI и NMP вызывали только минимальные спазмы сосудов сравнительно короткой продолжительности. Ни один растворитель не вызвал значительных гемодинамических изменений или гемолиза. Общий осмотр мозга не выявил отклонений, тогда как гистопатологическое исследование выявило в основном неспецифические результаты. Один рет, подвергшийся воздействию солкетала, показал возможные причинные гистотоксические изменения.
ЗАКЛЮЧЕНИЕ: DMI и NMP вызывают гораздо меньший спазм сосудов, чем DMSO. При вливании этих растворителей изменений гемодинамических или гемолитических параметров и гистопатологических данных не наблюдалось.
Осаждение жидких эмболий, используемых для эмболизации церебральных аневризм или артериовенозных мальформаций (АВМ), основано на растворах предварительно сформированных полимеров, растворенных в органических, смешивающихся с водой растворителях. 1–6 После внутрисосудистой инъекции жидкая эмболия выпадает в осадок и образует неадгезивный твердый слепок в результате быстрого обмена растворителя с окружающими физиологическими жидкостями. Растущий клинический опыт лечения церебральных аневризм и АВМ приобретается с помощью Onyx (Micro Therapeutics, Ирвин, Калифорния), который в настоящее время является единственным коммерчески доступным неадгезивным жидким эмболическим агентом и использует диметилсульфоксид (ДМСО) в качестве растворителя-носителя. 7–11 Тем не менее, некоторые системные побочные эффекты были приписаны использованию ДМСО для других терапевтических целей. 12–21 Что касается быстрых внутриартериальных инъекций, сообщалось о фатальных побочных эффектах, связанных с растворителями, таких как тяжелый вазоспазм, ангионекроз, обнажение эндотелия и разрушение внутренней эластической пластинки; субарахноидальное кровоизлияние, инсульт и смерть являются частыми клиническими последствиями. 1,5,22–26 Хотя использование низких скоростей инъекций может избежать структурных повреждений сосудов, даже медленные инъекции ДМСО все же не лишены легкого или умеренного вазоспазма, 27 , который может поставить под угрозу правильное развертывание жидкой эмболии к цели во время эмболизации АВМ.Кроме того, требование низкой скорости инфузии может ограничивать его использование для сосудистых структур большого объема, для которых уровни дозозависимой токсичности еще не оценивались. Более того, ДМСО растворяет многие обычно используемые микрокатетеры, поэтому его применение ограничивается использованием специально разработанных катетеров, устойчивых к ДМСО.
Таким образом, были предложены альтернативные водорастворимые растворители для жидких эмболий, позволяющие обойти эти ограничения. 28,29 Растворители, такие как диметилизосорбид (DMI), этиллактат, гликофурол 75, N -метилпирролидон (NMP) или солкетал, использовались в качестве фармацевтических вспомогательных веществ у людей для внутривенного (этиллактат, солькеталь), внутримышечного ( гликофурол 75, NMP) или местное введение (DMI, NMP) для облегчения растворения плохо растворимых в воде лекарственных средств. 28,30,31 Целью этого исследования было сравнение местной ангиографии (степень вазоспазма), системной гемодинамики (артериальное давление, частота сердечных сокращений и электрокардиография [ЭКГ]), клинической лаборатории (гемолитические параметры) и гистопатологических последствий суперселективные инъекции этих растворителей и ДМСО в ретемирабил сонной артерии свиньи, который ранее использовался для оценки ангиографических эффектов ДМСО. 5,22,27
Материалы и методы
Материалы
Проверенные растворители: DMI (Arlasolve; Uniqema, New Castle, Del), DMSO (KIC Chemicals, Armonk, NY), этиллактат (Fluka, Buchs, Швейцария) ), гликофурол 75 (эфир тетрагидрофурфурилового спирта и полиэтиленгликоля; Hoffman-la-Roche, Базель, Швейцария), NMP (Pharmasolve; ISP, Wayne, NJ) и солькеталь (d, l-α, β-изопропилиден-глицерин; Fluka) .За исключением солкетала, все растворители были фармацевтического качества. Перед использованием растворители стерилизовали нагреванием при 121 ° C в течение 20 минут.
Методы
Все эксперименты с животными и работа с ними проводились в соответствии с национальными законами о защите животных и были одобрены Наблюдательным советом по уходу за животными. В этом исследовании было использовано пятнадцать свиней-самок, 14 из которых прошли ангиографию; 1 животное служило контролем. Возраст животных составлял 4–5 месяцев, масса 40–55 кг, они содержались на стандартном лабораторном рационе.После ночного голодания каждую свинью предварительно вводили кетамином внутримышечно (20 мг / кг). Была проведена эндотрахеальная интубация, и общая анестезия поддерживалась кетамином 20 мг / кг / час и фентанилом 0,025 мг / кг / час. Панкуроний 0,1 мг / кг / ч давали для расслабления мышц.
Цифровая субтракционная ангиография (DSA) выполнялась с помощью ангиографической установки (Integris V; Philips Medical Systems, Best, Нидерланды). Непрерывный гемодинамический мониторинг измерялся через направляющий катетер 6F с использованием стандартного предварительно откалиброванного датчика давления внутриартериальной жидкости (Abbott Critical Care Systems, Слайго, Ирландия).Артериальное давление, а также частота сердечных сокращений и ЭКГ непрерывно контролировались и периодически составлялись в виде графиков (Sirecust 732; Siemens, Эрланген, Германия). Оболочки 5F и 6F помещали в левую и правую бедренные артерии и прикрепляли к инфузиям физиологического раствора под давлением. После этого была введена 5000 МЕ гепарина. Направляющий катетер 6F (Envoy; Cordis, Warren, NJ) был помещен в дугу аорты и соединен с датчиком давления жидкости; начат непрерывный мониторинг артериального давления. Катетер-проводник 4F (Vertebral; Terumo Europe, Leuven, Бельгия) использовался для катетеризации общей сонной артерии (ОСА).Из-за несовместимости органических растворителей с некоторыми обычно используемыми полимерами для создания микрокатетеров, все суперселективные катетеризации выполнялись с помощью Rebar 14 (Micro Therapeutics), который ранее был определен как устойчивый к органическим растворителям, протестированным в этом исследовании. Сверхселективная катетеризация восходящей глоточной артерии (т.е. артерии ретейнера) была выполнена путем коаксиального размещения комбинации микрокатетер / микропроводник через направляющий катетер.Наконечник микрокатетера располагался дистальнее глоточной ветви восходящей глоточной артерии, чтобы гарантировать, что инфузия доставляется только в сетчатку (рис. 1). Преинфузионный DSA использовался для обеспечения правильного позиционирования микрокатетера и изучения анатомической конфигурации и картины кровотока ретемирабила. Для всех растворителей общий объем 0,8 мл вводили в течение 60 секунд. Было показано, что эти параметры вызывают глубокий, но обратимый спазм сосудов восходящей глоточной артерии и повторяются после суперселективных инфузий ДМСО. 27 Последовательная суперселективная микрокатетеризация каждой артерии ретейла (восходящей глотки) была проведена у 14 свиней с использованием стандартных методик. Одна свинья, у которой ранее не проводились ангиографические процедуры, служила в качестве контрольной группы девственниц. Перед каждой инфузией растворителя выполнялась суперселективная инфузия 0,8 мл физиологического раствора в течение 60 секунд. Постинфузионный DSA был получен путем инъекции CCA через 3 минуты, чтобы исключить изменения в реальном кровообращении. Ни в одном случае спазм сосудов не был обнаружен после инфузии физиологического раствора, так что суперселективная микрокатетеризация восходящей глоточной артерии была проведена еще раз с последующей инфузией 0.8 мл одного из органических растворителей в течение 60 секунд. Дважды у одного и того же животного растворитель не использовали. Поскольку исследованные растворители, как известно, проявляют гемолитическую активность и вызывают морфологические изменения эритроцитов, 32 кровь была взята из одной из оболочек до и после инфузии растворителя для оценки гемолитических параметров (гемоглобин [Hb], свободный гемоглобин [fHb] , и лактатдегидрогеназа [LDH]). Гемодинамические (артериальное давление, частота сердечных сокращений и ЭКГ), ангиографические и гистопатологические последствия суперселективных инъекций растворителей оценивали с использованием следующего стандартизированного протокола.Измерения артериального давления, частоты сердечных сокращений и ЭКГ были получены непосредственно перед инфузией (т.е. исходный уровень) и впоследствии были повторены сразу же через 1 минуту, 3 минуты и 5 минут после инфузии. Был получен постинфузионный DSA, при котором оценивались изменения анатомического вида или гемодинамики реального кровообращения в результате вазоспазма. Если был обнаружен вазоспазм, последовательно проводились контрольные DSA каждые 5 минут, пока вазоспазм не разрешился или не прошло в общей сложности 30 минут.Эти гемодинамические и ангиографические протоколы были повторены в контрлатеральной сетке.
Рис. 1.Суперселективная катетеризация артерии ретата.
Микрокатетер располагается в восходящей глоточной артерии ( стрелка ) дистальнее мышечной ветви для инфузии 0,8 мл растворителя в течение 60 секунд.
Чтобы иметь возможность лучше сравнить эти результаты с ранее наблюдаемыми результатами по степени тяжести вазоспазма, использовалась 5-балльная система оценки, как описано ранее. 27 Эта система была получена на основе предыдущих систем субъективной ангиографической оценки, использовавшихся для количественной оценки серьезности изменений кровотока, связанных с вазоспазмом и тромбоэмболической окклюзией коронарных и церебральных артерий, 18–21 , включая систему, разработанную для тромболизиса при инфаркте миокарда. (TIMI) клинические испытания. Для поражения восходящих глоточных и ретальных артерий были определены следующие степени: степень 0, отсутствие вазоспазма; степень 1, минимальное сужение (≤25%) восходящей глоточной артерии с нормальным оттоком и без вовлечения ретальных артерий; степень 2 — легкое сужение (26–50%) восходящей глоточной артерии с нормальным стоком и без вовлечения ретальных артерий; степень 3, умеренное сужение (51–75%) восходящей глоточной артерии с незначительным или отсутствующим значительным уменьшением стока (степень 2 или 3 по шкале TIMI) и минимальным вовлечением ретальных артерий или без него; степень 4 — сильное сужение восходящей глоточной артерии (> 75%) с уменьшенным оттоком (степень 1 по TIMI) и спазмом сосудов ретальных артерий; и степень 5 — глубокий вазоспазм восходящих глоточных и ретальных артерий, приводящий к потере антероградного кровотока (степень 0 по TIMI).После DSA свиней умерщвляли под общей анестезией с использованием стандартных утвержденных процедур с последующим немедленным вскрытием трупа. Каждую сеточку осторожно извлекали из кавернозной пазухи, как описано ранее. 22 Ретии тщательно осмотрели на наличие каких-либо признаков гистотоксичности, таких как тромбоз или кровотечение. Для фиксации образцы помещали в 4% формалин. Для подготовки срезов ретии для световой микроскопии использовали стандартные методы, и срезы окрашивали гематоксилин-эозином, эластиком Ван Гизона (EvG) и фосфорновольфрамовой кислотой.Подготовленные слайды оценивал опытный невропатолог, который не знал об используемых растворителях. Реальные образцы были тщательно изучены на предмет различных возможных гистопатологических изменений, включая ангионекроз, повреждения интимы, фибрин, острый воспалительный инфильтрат, нарушение внутренней эластической пластинки и кровоизлияния в стенках артерий или периваскулярных пространствах.
Результаты
Гемодинамика и лабораторные параметры
Не наблюдалось значительных изменений артериального давления, частоты сердечных сокращений, ЭКГ или гемолитических параметров, которые можно было бы приписать суперселективной инфузии любого из исследованных растворителей.Фактически наблюдались значительные различия в исходных измерениях как артериального давления, так и частоты сердечных сокращений: от 90/60 до 160/110 мм рт. Ст. И от 110 до 160 ударов в минуту, соответственно. Такие вариации могут быть объяснены естественными вариациями у отдельных животных и частой вариабельностью и нестабильностью глубины анестезии, достигаемой у свиней. Несмотря на эти большие индивидуальные различия, измерения артериального давления и частоты сердечных сокращений у отдельных свиней до и после инфузии каждого растворителя находились в диапазоне приблизительно 5%.Принимая во внимание вариации исходной гемодинамики и внутренние ошибки в их измерениях с использованием устройств, использованных в этом исследовании, было предложено, чтобы изменение как минимум 10% было необходимо для отражения потенциально реальной разницы в частоте сердечных сокращений или артериального давления, которая может быть объяснена к воздействию растворителей. 27 Используя этот критерий, мы не обнаружили значительных изменений артериального давления или частоты сердечных сокращений для любого исследованного растворителя.
Исходные ЭКГ показали нормальный синусовый ритм или иногда легкую синусовую тахикардию.Никаких существенных аритмий или эктопии на исходном уровне не наблюдалось, хотя у нескольких субъектов были неспецифические изменения ST и T, которые обычно наблюдаются у свиней, находящихся под общей анестезией. После инфузии физиологического раствора или любого из растворителей не было доказательств усиления эктопии, тахиаритмии, брадиаритмии или ишемии миокарда (например, зубцов Q, подъемов ST, инвертированных зубцов T.).
Не было обнаружено значительного увеличения Hb, fHb или LDH, параметров, которые указывали бы на внутрисосудистый гемолиз, ни у одного из животных, которым вводили растворители.Средние значения Hb составили 9,0 ± 0,9 и 8,9 ± 1,1 г / дл до и после эмболизации соответственно; средние значения для fHb составили 17,2 ± 8,7 и 15,9 ± 10,2 мг / дл до и после эмболизации соответственно; а средние значения ЛДГ составили 521,4 ± 104,7 и 501,4 ± 80,7 Ед / л до и после эмболизации, соответственно ( n = 14). Эти значения не имели статистической значимости (критерий Вилкоксона: P = 0,646 для Hb, P = 0,929 для fHb и P = 0,347 для LDH).
Ангиография
При проведении суперселективной катетеризации и инфузии растворителей восходящей глоточной артерии не возникло значительных технических трудностей.Суперселективная инфузия физиологического раствора не привела к ангиографически документированному вазоспазму при постинфузионном DSA ни в одном из образцов. Напротив, все исследованные растворители демонстрировали разную степень спазма сосудов, который обычно был временным в пределах интервала наблюдения. Только у 1 свиньи, которой вводили ДМСО, наблюдался остаточный вазоспазм (степень 1) в конце 30-минутного периода наблюдения, предписанного протоколом.
Чтобы облегчить различение различных свойств исследуемых растворителей, определяли индивидуальную оценку спазма сосудов, среднюю оценку спазма сосудов и среднюю продолжительность спазма сосудов.Эти результаты суммированы в таблице 1. ДМСО вызывал наиболее тяжелый средний вазоспазм через 3 минуты с самой большой средней продолжительностью среди всех исследованных растворителей. Средняя оценка спазма сосудов через 3 минуты для ДМСО составила 2,9, тогда как средний спазм сосудов, вызванный ДМСО, разрешился не ранее 17,3 минуты (рис. 2). Эти данные хорошо согласуются со значениями, приведенными ранее. 27 Спазм сосудов, связанный с инфузией солкетала, этиллактата и гликофурола 75, был умеренным и менее тяжелым по сравнению с спазмом сосудов, вызванным ДМСО.Средняя оценка спазма сосудов через 3 минуты составляла 2,6 для этиллактата и солкетала и 2,0 для гликофурола 75. В отличие от ДМСО, спазм сосудов, вызванный этими растворителями, разрешался намного быстрее, при средней продолжительности спазма сосудов 8,0 минут для солкетала и гликофурола 75. и 9,3 минуты для этиллактата. Растворителями, вызывающими самые слабые и кратковременные спазмы сосудов, были DMI и NMP. Средняя оценка спазма сосудов через 3 минуты после инфузии растворителя составила 1,0 для DMI и 0,8 для NMP.Средняя продолжительность вазоспазма после инфузии DMI или NMP составила 4,8 или 3,7 минуты соответственно (рис. 3). Кроме того, из всех исследованных растворителей только инфузии DMI и NMP не вызвали вазоспазма вообще в 2 случаях каждый. Временное снижение спазмов сосудов, вызванных растворителем, показано на рис. 4.
Рис. 2.Спазм сосудов сетчатой артерии после инфузии ДМСО.
A , Постинфузионный DSA через 3 минуты после инфузии ДМСО выявляет тяжелый вазоспазм 3 степени восходящей глоточной артерии ( стрелки ).
B , Repeat DSA показывает полное разрешение спазма сосудов через 23 минуты после инфузии ДМСО.
Рис. 3.Спазм сосудов сетчатой артерии после инфузии ДМИ.
A , Постинфузионный DSA через 3 минуты после инъекции DMI демонстрирует легкий вазоспазм 1 степени восходящей глоточной артерии ( стрелка ).
B , Повторите DSA через 8 минут после инфузии DMI, чтобы подтвердить полное разрешение вазоспазма.
Рис 4.Временные курсы растворения, вызванные изменениями диаметра артерии сетчатки свиньи ( n = 28), выраженные в процентах от исходных значений до инъекций растворителя. Среди всех исследованных растворителей ДМСО вызывал наиболее тяжелый начальный спазм сосудов, который разрешался наиболее медленно, тогда как DMI и NMP вызывали только слабые спазмы сосудов, которые разрешались быстро.
Таблица 1:Экспериментальные данные
Таблица 2:Статистический анализ
Общая и гистопатологическая оценка
Вся резецированная сетчатка выглядела нормально, без признаков фокального тромбоза или ангионекроза.Собранный мозг был разрезан и исследован макроскопически на предмет размягчения, энцефаломаляции или субарахноидального кровоизлияния. Ни в одном из исследованных образцов не было обнаружено аномального внешнего вида мозга. Микроскопическая оценка ретии выявила в большинстве случаев нормальные сетчатые микропроцессоры, а гистопатологические изменения в большинстве случаев были неспецифическими. Наиболее частой неспецифической находкой было частичное разделение эндотелия в рассеянных ретальных артериях (рис. 5 A ). Кроме того, на одной стороне сетки, подвергшейся воздействию гликофурола 75, было обнаружено небольшое количество ретальных артерий с гиперплазией артериальной стенки всех слоев сосудов (рис. 5 B ).Это открытие нельзя отнести к острым ангиотоксическим эффектам инфузии растворителей. Несколько микрокартерий показали более выраженное эндотелиальное обнажение, чем эндотелиальное разделение, описанное ранее, но только на единственной ретальной стороне, которая подвергалась воздействию солкетала (Рис. 5 C ). Таким образом, это гистопатологическое открытие могло быть связано с инфузией этого растворителя. Окрашивание EvG исключало разрушение внутренней эластической пластинки или повреждение артериальной стенки (рис. 5 D ). Гистопатологические признаки ангионекроза, отложения фибрина, кровотечения, разрушения внутренней эластической пластинки или острого клеточного воспаления не наблюдались ни в одном из исследованных образцов.
Рис. 5.Гистопатологические изменения ретии после инфузии растворителя.
A , Разделение нескольких эндотелиальных клеток в 1 ретальной артерии ( стрелка ) (гематоксилин-эозин; исходное увеличение, 200 ×). Rete подвергали воздействию 0,8 мл ДМСО за 60 секунд.
B , Правосторонняя ретенция свиньи 8, подвергшаяся воздействию 0,8 мл гликофурола 75 за 60 секунд, демонстрирует гиперплазию артериальной стенки, включая все слои сосудов (гематоксилин-эозин; исходное увеличение, 200 ×).
C , Левосторонняя сетка свиней 12, подвергшаяся воздействию 0,8 мл солкетала, демонстрирует обнажение эндотелия нескольких микропроцессоров ( стрелки ) (гематоксилин-эозин; исходное увеличение, 200 ×).
D , обратите внимание на неповрежденную внутреннюю эластичную пластинку внутри этих сосудов ( стрелки ) (резинка Ван Гизона; исходное увеличение, 200 ×).
Обсуждение
В этом сравнительном исследовании мы оценили потенциальные ангиографические, гемодинамические, клинические лабораторные и гистопатологические последствия инфузий ДМСО и смешивающихся с водой органических растворителей DMI, этиллактата, гликофурола 75, NMP и солькетала для свиней. сонная артерия.Эта экспериментальная модель АВМ ранее использовалась для оценки ангиотоксического действия ДМСО, 5,22,27 , хотя следует отметить, что спазм сосудов как вид физиологического эффекта не обязательно является маркером ангиотоксичности. Мы выбрали объем растворителя 0,8 мл для инфузии в течение 60 секунд (мощность дозы 13,3 мкл / с), поскольку предыдущие исследования показали, что идентичные инъекции ДМСО вызывали в среднем умеренную степень спазма сосудов (от легкой до умеренной). тяжелая), которая всегда была полностью обратимой в интервале наблюдения 30 минут. 27
На основании ангиографических данных исследуемые вещества можно разделить на 3 группы: (1) ДМСО вызывал наиболее тяжелый вазоспазм с наибольшей продолжительностью из всех исследованных растворителей; (2) этиллактат, гликофурол 75 и солкеталь вызывали несколько более низкую начальную степень вазоспазма, который, в отличие от ДМСО, разрешался намного быстрее; и (3) DMI и NMP вызвали лишь минимальные начальные спазмы сосудов, которые разрешились очень быстро.
Кроме того, DMI и NMP также обладают благоприятными общетоксичными свойствами для их использования в жидких эмболиях.DMI имеет низкую системную токсичность, LD 50 более 5,4–6,9 г / кг массы тела. 33 Он известен как усилитель проникновения через кожу 34,35 и используется в фармацевтических и косметических целях. 36 Кроме того, он был предложен для лечения афтозного стоматита. 37 Несмотря на то, что токсикологические данные об этом растворителе немногочисленны, никакие агентства США не сообщают о канцерогенности DMI. 38,39 , мутагенном, согласно анализах Эймса, или кластогенном по отношению к лимфоцитам человека. 33 NMP также имеет низкую системную токсичность для экспериментальных животных, LD 50 составляет 2,6–7,0 г / кг массы тела, 40 , таким образом, постепенно заменяет более токсичные и легколетучие растворители в производственных условиях и окружающей среде. Кроме того, NMP имеет некоторые фармацевтические применения из-за его способности в качестве мощного усилителя проникновения через кожу. 41–43 В исследованиях на людях-добровольцах побочных эффектов не наблюдалось ни после 8-часового ингаляционного воздействия 10–50 мг / м. 3 44 , ни после приема 100 мг NMP. 45 Кроме того, NMP не показал канцерогенной активности в двухлетнем исследовании на крысах 46 или мутагенной активности в анализе Эймса in vivo 47 ни у мышей, ни у хомяков. 48 Хотя некоторые испытания показали, что NMP может вызывать анеуплоидию у дрожжей, 49,50 NMP не считается мутагеном или канцерогеном. Исследования токсичности для развития показали, что NMP может быть тератогенным, 51 , но только в дозах, вызывающих токсичность для матери. 52,53 Совсем недавно FDA одобрило систему доставки лекарств, которая может использоваться как для парентеральной, так и для сайт-специфической доставки лекарств на основе композиции полимерной матрицы, растворенной в NMP (Atrigel Implant Drug Delivery Technology, Atrix Laboratories, Форт-Коллинз, Колорадо).
Сообщается, что уровни острой токсичности альтернативных растворителей, измеренные с помощью внутривенного введения LD 50 , находятся в диапазоне 2,7–6,8 г / кг массы тела; ДМСО имеет ЛД внутривенного введения для крыс 50 5,4 г / кг. 28 Поскольку эти дозы обычно на 2–3 порядка выше, чем дозы, вводимые при цереброваскулярной эмболизации, системных эффектов, связанных с растворителем, таких как гемодинамические изменения, не ожидается. Тем не менее, поскольку ни один из растворителей, кроме ДМСО, ранее не тестировался внутриартериально, кровяное давление, частота сердечных сокращений и ЭКГ контролировались в каждом образце, но не было отмечено никаких значительных изменений этих параметров или свидетельств повышенной эктопии или ишемии миокарда.Аналогичные наблюдения были сделаны для медленного введения ДМСО в сетку. 27
Анемия, гемоглобинурия и билирубинурия, имитирующие гемолитическую трансфузионную реакцию, а также сульфгемоглобинемия наблюдались у людей после кожного и внутривенного применения ДМСО. 13,20 Эта исключительно высокая гемолитическая активность ДМСО была исследована на красных кровяных тельцах in vitro вместе с другими органическими растворителями, испытанными в этом исследовании. ДМСО и этиллактат показали самую высокую гемолитическую активность, гликофурол 75, NMP и солкеталь были оценены как умеренные, а DMI был растворителем с самым низким потенциалом гемолиза. 32 Об этой низкой гемолитической активности DMI сообщалось ранее. 54 Несмотря на введение 2 различных растворителей (по 1 на каждый ретейнер) в каждый образец, не было зарегистрировано значительных изменений гемолитических параметров, которые можно было бы отнести к инфузиям любого из исследованных растворителей. Тем не менее, даже если эта экспериментальная установка не выявила гемолиза, связанного с растворителями, для использования в качестве неотъемлемых компонентов жидких эмболий следует отдавать предпочтение растворителям с низкой или умеренной гемолитической активностью.
Микроскопический гистопатологический анализ подтвердил нормальную сборку микробной стенки или только неспецифические изменения на обеих сторонах наиболее открытой ретии. Эти изменения были аналогичны тем, о которых сообщалось ранее. 22,27 Только на одной стороне сетки, подвергнутой воздействию солкетала, в нескольких микрокартериях обнаружена денудия эндотелия. Инфузия солкетала в эту артерию ретата вызвала начальный вазоспазм 3 степени, который полностью разрешился через 18 минут без ангиографических признаков изменений в открытой ретальной системе.Хотя это гистопатологическое открытие можно рассматривать как возможный гистотоксический эффект инфузии растворителя, аналогичных гистологических результатов не наблюдалось после вливания Солкетала или любого другого растворителя.
Заключение
Судя по данным, полученным с помощью суперселективных инъекций органического растворителя в ретемирабил сонной артерии свиней, DMI и NMP вызвали самый низкий спазм сосудов среди всех исследованных веществ. Кроме того, не было обнаружено никаких гемодинамических изменений, признаков внутрисосудистого гемолиза и каких-либо острых гистопатологических данных, связанных с инфузиями этих растворителей.
Ссылки
- ↵
Yang X, Wu Z, Li Y, et al. Повторная оценка полимера ацетата целлюлозы: ангиографические данные и гистологические исследования. Surg Neurol 2001; 55: 116–22
Mandai S, Kinugasa K, Ohmoto T. Прямой тромбоз аневризм полимером ацетата целлюлозы. Часть I. Результаты тромбоза экспериментальных аневризм. J Neurosurg 1992; 77: 497–500
Taki W, Yonekawa Y, Iwata H, et al. Новый жидкий материал для эмболизации артериовенозных мальформаций. AJNR Am J Neuroradiol 1990; 11: 163–68
Hamada J, Kai Y, Morioka M, et al. Смесь сополимера этилена и винилового спирта и этанола, дающая неадгезивный жидкий эмболический агент для лечения церебральных артериовенозных мальформаций: начальный клинический опыт. J Neurosurg 2002; 97: 881–88
- ↵
Murayama Y, Vinuela F, Ulhoa A, et al. Неадгезивный жидкий эмболический агент для церебральных артериовенозных мальформаций: предварительные гистопатологические исследования у свиней rete mirabile. Neurosurgery 1998; 43: 1164–75
- ↵
Murayama Y, Vinuela F, Tateshima S, et al. Эндоваскулярное лечение экспериментальных аневризм с использованием комбинации жидких эмболических агентов и защитных устройств. AJNR Am J Neuroradiol 2000; 21: 1726–35
- ↵
Jahan R, Murayama Y, Gobin YP, et al. Эмболизация артериовенозных мальформаций ониксом: клинико-патологический опыт у 23 пациентов. Neurosurgery 2001; 48: 984–95
Mawad ME, Cekirge S, Ciceri E, et al. Эндоваскулярное лечение гигантских и больших внутричерепных аневризм с использованием комбинации установки стента и инъекции жидкого полимера. J Neurosurg 2002; 96: 474–82
Molyneux AJ, Cekirge S, Saatci I, et al. Многоцентровое европейское исследование оникса (CAMEO) при церебральной аневризме: результаты проспективного обсервационного исследования в 20 европейских центрах. AJNR Am J Neuroradiol 2004; 25: 39–51
Nishi S, Taki W, Nakahara I, et al. Эмболизация аневризм головного мозга жидким эмболом, смесь EVAL: отчет о трех случаях. Acta Neurochir (Wien) 1996; 138: 294–300
- ↵
Saatci I, Cekirge HS, Ciceri EF, et al. Результаты КТ и МРТ и их значение для последующего наблюдения за пациентами с внутричерепными аневризмами, получавшими эндосаккулярную окклюзию ониксом. AJNR Am J Neuroradiol 2003; 24: 567–78
- ↵
Davis JM, Rowley SD, Braine HG, et al. Клиническая токсичность инфузии криоконсервированного трансплантата костного мозга. Кровь 1990; 75: 781–86
- ↵
Самошук М., Рид М.Э., Toy PT. Внутривенная терапия диметилсульфоксидом вызывает тяжелый гемолиз, имитирующий гемолитическую трансфузионную реакцию. Transfusion 1983; 23: 405
Stroncek DF, Fautsch SK, Lasky LC, et al. Побочные реакции у пациентов, которым перелили криоконсервированный костный мозг. Transfusion 1991; 31: 521–26
Smith DM, Weisenburger DD, Bierman P, et al. Острая почечная недостаточность, связанная с аутотрансплантацией костного мозга. Пересадка костного мозга 1987; 2: 195–201
Hameroff SR, Otto CW, Kanel J, et al. Острые сердечно-сосудистые эффекты диметилсульфоксида. Ann N Y Acad Sci 1983; 411: 94–99
Rapoport AP, Rowe JM, Packman CH, et al. Остановка сердца после инфузии аутологичного костного мозга. Пересадка костного мозга 1991; 7: 401–03
- ↵
Styler MJ, Topolsky DL, Crilley PA, et al. Преходящая блокада сердца высокой степени злокачественности после инфузии аутологичного костного мозга. Пересадка костного мозга 1992; 10: 435–38
Баум С.М., Вайсман И.Л., Цукамото А.С. и др. Выделение потенциальной популяции гемопоэтических стволовых клеток человека. Proc Natl Acad Sci U S A 1992; 89: 2804–08
- ↵
Burgess JL, Hamner AP, Robertson WO. Сульфгемоглобинемия после кожного нанесения ДМСО. Vet Hum Toxicol 1998; 40: 87–89
- ↵
Topacoglu H, Karcioglu O, Ozsarac M, et al. Массивное внутричерепное кровоизлияние, связанное с приемом диметилсульфоксида. Vet Hum Toxicol 2004; 46: 138–40
- ↵
Chaloupka JC, Vinuela F, Vinters HV, et al. Техническая осуществимость и гистопатологические исследования сополимера этилена и винила (EVAL) с использованием модели эндоваскулярной эмболизации свиней. AJNR Am J Neuroradiol 1994; 15: 1107-15
Laurent A, Wassef M, Zhang HQ, et al. Желифические растворы для эмболизации: животный этюд токсического вещества сердечно-сосудистой системы, диметилсульфоксид. J Neuroradiol 1997; 24: 314
Sampei K, Hashimoto N, Kazekawa K, et al. Гистологические изменения мозговой ткани и сосудистой сети после внутрикаротидного введения органических растворителей крысам. Neuroradiology 1996; 38: 291–94
Hamada J, Kai Y, Morioka M, et al. Неадгезивный жидкий эмболический агент, состоящий из смеси сополимера этилена, винилового спирта и этанола, для лечения церебральных артериовенозных мальформаций: экспериментальное исследование. J Neurosurg 2002; 97: 889–95
- ↵
Laurent A, Dufaux J, Honiger J, et al. Инъекционные гелеобразные растворы для эмболизации: гидродинамические исследования и исследования на животных. Proceedings of the Société Française de Neuroradiologie (SFNR) 1997; 25: 46
- ↵
Chaloupka JC, Huddle DC, Alderman J, et al. Повторное исследование ангиотоксичности суперселективной инъекции ДМСО на модели повторной эмболизации свиней. AJNR Am J Neuroradiol 1999; 20: 401–10
- ↵
Mottu F, Laurent A, Rufenacht DA, et al. Органические растворители для фармацевтических парентеральных препаратов и жидкостей для эмболии: обзор данных о токсичности. КПК J Pharm Sci Technol 2000; 54: 456–69
- ↵
Mottu F, Gailloud P, Massuelle D, et al. Оценка in vitro новых эмболических жидкостей, приготовленных из предварительно сформированных полимеров и смешивающихся с водой растворителей для лечения аневризмы. Biomaterials 2000; 21: 803–11
- ↵
Powell MF, Nguyen T, Baloian L. Компендиум вспомогательных веществ для парентеральных составов. PDA J Pharm Sci Technol 1998; 52: 238–311
- ↵
Heintz C., Boymond C. Фармакотоксикологические аспекты и терапевтическое применение растворителей для инъекций, не смешиваемых с водой. STP Pharma 1989; 5: 548–60
- ↵
Mottu F, Stelling MJ, Rufenacht DA, et al. Сравнительная гемолитическая активность неразбавленных органических смешивающихся с водой растворителей для внутривенных и внутриартериальных инъекций. PDA J Pharm Sci Technol 2001; 55: 16–23
- ↵
- ↵
Simonsen L, Petersen MB, Groth L. Проникновение салициловых соединений через кожу безволосых крыс in vivo. Eur J Pharm Sci 2002; 17: 95–104
- ↵
Squillante E, Needham T, Maniar A, et al. Коодиффузия пропиленгликоля и диметилизосорбида в голой коже мыши. Eur J Pharm Biopharm 1998; 46: 265–71
- ↵
Арласольв (диметилизосорбид). Техническая записка ICI, 1995
- ↵
Hodosh M, Hodosh SH, Hodosh AJ. Лечение афтозного стоматита насыщенным нитратом калия / диметилизосорбидом. Quintessence Int 2004; 35: 137–41
- ↵
- ↵
Отчет по канцерогенам , 10-е изд. Triangle Park, NC: Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения, Национальная токсикологическая программа; 2002
- ↵
- ↵
Priborsky J, Muhlbachova E. Оценка чрескожной абсорбции in vitro через кожу человека и в моделях на животных. J Pharm Pharmacol 1990; 42: 468–72
Коидзуми А., Фуджи М., Кондо М. и др. Влияние N -метил-2-пирролидона на проницаемость эстрадиола через кожу. Eur J Pharm Biopharm 2004; 57: 473–78
- ↵
Payan JP, Boudry I., Beydon D, et al. Токсикокинетика и метаболизм N — [ 14 C] N -метил-2-пирролидон у самцов крыс Sprague-Dawley: всасывание через кожу in vivo и in vitro. Drug Metab Dispos 2003; 31: 659–69
- ↵
Акессон Б., Полссон К. Экспериментальное воздействие на добровольцев мужского пола N -метил-2-пирролидон (NMP): острые эффекты и фармакокинетика NMP в плазме и моче. Occup Environ Med 1997; 54: 236–40
- ↵
Акессон Б., Йонссон Б.А. Основной путь метаболизма N -метил-2-пирролидон в организме человека. Drug Metab Dispos 1997; 25: 267–69
- ↵
Pharmasolve ( N -метил-2-пирролидон). Техническая записка ISP, 1990
- ↵
Wells DA, Thomas HF, Digenis GA. Мутагенность и цитотоксичность N -метил-2-пирролидинон и 4- (метиламино) бутановая кислота в анализе сальмонелл / микросом. J Appl Toxicol 1988; 8: 135–39
- ↵
Engelhardt G, Fleig H. 1-Метил-2-пирролидинон (NMP) не вызывает структурных и численных хромосомных аберраций in vivo. Mutat Res 1993; 298: 149–55
- ↵
Zimmermann FK, Holzwarth UL, Scheel I, et al. Апротонные полярные растворители, влияющие на агрегацию тубулина головного мозга свиней in vitro, вызывают анеуплоидию в дрожжевых клетках, растущих при низких температурах. Mutat Res 1988; 201: 431–42
- ↵
Mayer VW, Goin CJ, Taylor-Mayer RE. Индукция анеуплоидии у saccharomyces cerevisiae двумя соединениями-растворителями, 1-метил-2-пирролидиноном и 2-пирролидиноном. Environ Mol Mutagen 1988; 11: 31–40
- ↵
Lee KP, Chromey NC, Culik R, et al. Токсичность N -метил-2-пирролидон (NMP): тератогенные, субхронические и двухлетние исследования при вдыхании. Fundam Appl Toxicol 1987; 9: 222–35
- ↵
Saillenfait AM, Gallissot F, Langonne I, et al. Токсичность для развития N -метил-2-пирролидон, вводимый крысам перорально. Food Chem Toxicol 2002; 40: 1705–12
- ↵
Saillenfait AM, Gallissot F, Morel G. Токсичность N-метил-2-пирролидона для развития у крыс после ингаляционного воздействия. Food Chem Toxicol 2003; 41: 583–88
- ↵
Reed KW, Yalkowsky SH. Лизис эритроцитов человека в присутствии различных сорастворителей. J Parenteral Sci Technol 1985; 39: 64–68
- Поступило 4 октября 2005 г.
- Принято после пересмотра 21 декабря 2005 г.
- Авторское право © Американское общество нейрорадиологов
Новый класс электролита на основе растворителя в соли для высокоэнергетических перезаряжаемых металлических литиевых батарей
Концепция Solvent-in -Солевой электролит
В 1993 году Энджелл и др. . Компания 33 предложила инновационную концепцию «Полимер-в-соли», изменив соотношение твердого полимерного растворителя к соли, при котором стеклование ( T г ) было достаточно низким, чтобы оставаться эластичным при комнатной температуре для сохранения хорошего качества. проводимость и высокая электрохимическая стабильность.Однако на практике температура T g оставалась выше температуры окружающей среды и / или система кристаллизовалась. Для обычных неводных органических электролитов концентрация соли обычно ограничивается диапазоном 1-2 моль / л -1 , что является компромиссом между ионной проводимостью, вязкостью и растворимостью соли. Таким образом, большинство исследований сосредоточено на области C на рис. 1, в которой соли гораздо меньше, чем растворителя. Есть несколько отчетов об исследованиях в областях A (желтый) или D (зеленый) на рис.1, в котором либо массовое, либо объемное отношение соли к растворителю превышает 1,0 (ссылки 34, 35, 36, 37). На самом деле, выбирая подходящую соль и растворитель, мы можем переместить электролит в эти области (A, B и D), а также получить некоторые неожиданные свойства. Чтобы отличаться от традиционных электролитов, этот новый класс электролитов обозначается «Solvent-in-Salt» (SIS). Аналогичная система гидратированной расплавленной соли, состоящей из KNO 3 и Ca (NO 3 ) 2 · 4H 2 O, в которой содержание воды недостаточно для удовлетворения большего, чем первая координационная оболочка для катиона, которая было сообщено в 1965 году Энджеллом 38,39 .Этот вид гидратированных расплавленных солей обычно использовался для аккумулирования тепла, но не назывался SIS.
Рис. 1. Общая концепция электролита на основе растворителя в соли.( a ) Обзор доступных электролитов 58,59,60 . ( b ) Карта распределения неводных жидких электролитов с весовыми и объемными отношениями соли к растворителю. Области A, B и D представляют собой электролит «растворитель в соли», в котором отношение соли к растворителю превышает 1,0 по объему или массе.Область C составляет [растворитель]> [соль] по весу и объему.
Физико-химические свойства «Solvent-in-Salt»
Для следующего обсуждения мы выбираем систему электролита, содержащую Li [CF 3 SO 2 ) 2 N] (LiTFSI), один из самых низких соли энергии решетки и 1,3-диоксолан (DOL): диметоксиэтан (DME) (1: 1 по объему) в качестве растворителя, в результате чего мы представляем один из наиболее многообещающих электролитов для Li – S аккумуляторов. Физико-химические свойства этого электролита с различным соотношением соли к растворителю показаны на рис.2. Когда мольное количество соли достигает 4 моль в 1 л растворителя, электролит входит в область D SIS по весу, а за пределами 5 моль соли в 1 л растворителя соль начинает играть доминирующую роль в любом из весов. или объемное соотношение (рис. 2а). Графики Аррениуса ионной проводимости электролитов с разной концентрацией солей в диапазоне температур от -20 до 60 ° C показаны на рис. 2b и демонстрируют типичную кривизну уравнения Фогеля – Таммана – Фулчера (VTF) (дополнительный рис. S1). Видно, что ионная проводимость уменьшается с увеличением концентрации соли.Проводимость медленно падает в области высоких температур (20–60 ° C), но быстро падает в области низких температур (от –20 до 20 ° C), что является результатом повышения T г . Для данного электролита с фиксированной солью и растворителем ионная проводимость зависит как от вязкости, так и от подвижности литий-ионов. При увеличении концентрации соли из-за неполной сольватационной оболочки образуется все больше и больше сложных пар Li – эфир, и вязкость при комнатной температуре заметно увеличивается в области SIS (рис.2c и дополнительный рис. S2). В то же время литий-ионное число переноса электролита SIS-7 # увеличивается до неожиданно высокого значения (tLi + = 0,73, tLi + = σLi + / (σLi ++ σTFSI-)) (см. Рис. 2c и дополнительный рис. S3. ), что намного выше, чем у традиционных электролитов на основе соли в растворителе (0,2–0,4). Проводимость специфического иона i пропорциональна концентрации подвижного иона ( c i ) и его подвижности ( μ i ) ( σ i = NC i μ i ).Подвижность иона определяется вязкостью ( η ) среды и радиусом подвижного иона ( μ i = 1 / 6πηr i ) (ссылка 23). В электролитах с низкой концентрацией солей ионы лития координируются с кислородом эфира и образуют большую сольватную оболочку по сравнению с анионами, что приводит к относительно более низкой подвижности сольватированных катионов Li + . В системе SIS вполне вероятно, что количество сольватированных катионов Li + уменьшено, и большой анион (TFSI — ) может быть увлечен более серьезно, чем небольшой несольватированный катион (Li + ) в этой системе с высокой вязкостью. .Тем не менее, SIS-7 # даже с высокой вязкостью 72 сП сохраняет проводимость 0,814 мСм · см -1 при комнатной температуре, что остается выше, чем у твердотельного сухого полимера или большинства неорганических электролитов, и особенно, может формировать лучшие межфазные контакты.
Рис. 2: Физико-химические свойства электролитов на основе растворителя в соли.( a ) Весовое и объемное отношение соли к растворителю при различных соотношениях LiTFSI к DOL: DME (1: 1 по объему).( b ) Графики Аррениуса ионной проводимости как функции 1000 / T для электролитов с различным соотношением LiTFSI к растворителю (1 #: 1 моль на л растворителя, 2 #: 2 моль на л растворителя, 3 #: 3 моль на л растворителя, 4 #: 4 моль на литр растворителя, 5 #: 5 моль на литр растворителя, SIS-6 #: 6 моль на литр и SIS-7 #: 7 моль на литр на растворитель). ( c ) Вязкость, ионная проводимость и литий-ионное число переноса при комнатной температуре для вышеупомянутых различных электролитов. ( d ) ДСК-следы вышеупомянутых различных электролитов.
Следы дифференциального сканирующего калориметра (ДСК) показывают отчетливые температуры стеклования (рис. 2d), что показывает, что все электролиты являются стеклообразующими жидкостями, и их температуры стеклования смещаются от низких к высоким с увеличением отношения соли к -растворитель. Для чистой смеси растворителей без соли (дополнительный рисунок S4) температура стеклования составляет -138,6 ° C, что подтверждает превосходные низкотемпературные характеристики электролита на основе DOL – DME. В электролите СИС-7 # значение Т г равно –77.3 ° C, что намного ниже, чем в типичной системе «полимер в соли» ( T г > –10 ° C) (ссылка 33) и близко к традиционным коммерческим системам электролитов (1 моль л — 1 LiPF 6 в EC – DMC, T г = –67 ° C)) (ссылка 40). Гибкий шарнир в связи S – N – S в TFSI –, характерный для этих имидных анионов, объясняет этот «пластифицирующий эффект», который также отражается в низкой вязкости ионных жидкостей на основе этого аниона.
Применение в Li – S батареях
Мощность электролитов SIS продемонстрирована их использованием в перезаряжаемых металлических Li – S батареях.Аккумулятор Li – S, в котором в качестве электролита используется SIS-7 #, демонстрирует лучшие электрохимические характеристики (рис. 3).
Рисунок 3: Электрохимические характеристики литий-серных батарей.( a ) Первые профили разряд-заряд C / S электродов в электролитах с различным соотношением LiTFSI к DOL: DME (1: 1 по объему). ( b ) Циклическое исполнение. ( c ) Кулоновский КПД при величине тока 0,2 C (кулоновский КПД = зарядная емкость / разрядная емкость).( d ) Нормализация с электролитом SIS-7 #.
Он показывает начальную удельную разрядную емкость 1041 мА ч г -1 при скорости тока 0,2 ° C (то есть 335 мА г -1 ) и поддерживает обратимую емкость 770 мА ч -1 g −1 с сохранением емкости 74% после 100 циклов (рис. 3b). Что еще более важно, кулоновский КПД достигает почти 100% после первого цикла (он составляет 93,7% для первого цикла) для электролита SIS-7 # (также см. Дополнительный рис.S5), что выше, чем в предыдущих отчетах аналогичной системы 12,13,14,15,16,17,18,19,20,21,22 , благодаря эффективному предотвращению эффекта полисульфидного челнока в процессе зарядки ( Рис. 3c) (ссылка 41). Напротив, другие менее концентрированные электролиты демонстрируют кажущуюся кулоновскую эффективность более 100% (рис. 3c и дополнительный рис. S6), что является признаком «полисульфидного челночного эффекта». Единственным недостатком использования SIS-7 # является то, что поляризация становится немного больше из-за относительно более высокой вязкости по сравнению с традиционными электролитами с низкой концентрацией соли (рис.3а). Тем не менее, Li – S аккумуляторы, в которых используется электролит SIS-7 #, по-прежнему демонстрируют отличную емкость, как показано на рис. 3d. Они могут достигать емкости 1229, 988, 864, 744 и 551 мА · ч на г -1 серы при скоростях тока 0,2, 0,5, 1, 2 и 3 ° C соответственно. Когда текущая скорость возвращается к 0,2C, остается обратимая емкость 789 мА · ч −1 г −1 . Емкость по-прежнему снижается после измерения скорости, хотя растворение полисульфида ингибируется, что, вероятно, связано с нестабильным C / S-электродом.В процессе заряда-разряда электрод подвергается значительному изменению объема из-за реакции превращения между S 8 (2,07 г см −3 ) и Li 2 S (1,66 г см −3 ), что может привести не только к перераспределению серы, но и к структурному повреждению композита углерод-сера. Таким образом, можно ожидать, что за счет оптимизации материалов катода циклические характеристики будут дополнительно улучшены.
Чтобы еще раз доказать эффективность этого нового электролита SIS, Ketjenblack без мезопористой структуры был использован в качестве носителя для серы вместо высокоупорядоченного мезопористого углерода.Показано, что электрохимические характеристики при использовании электролита SIS-7 # намного лучше, чем у электролита 2 # (дополнительный рисунок S7). Циклические характеристики значительно улучшены, а кулоновский КПД составляет почти 100% даже с непористым углеродом в качестве основы. Это еще раз демонстрирует исключительные свойства этого нового электролита SIS.
В настоящее время электрохимические характеристики Li – S аккумуляторов напрямую определяются содержанием серы в композитах C / S, адсорбирующей способностью серы мезопористым углеродом, растворимостью полисульфида лития в электролите и стабильностью металлического литиевого анода в процессе эксплуатации. кататься на велосипеде.Фактически, до настоящего времени казалось почти невозможным одновременно решить все эти проблемы с помощью единого решения. Чтобы улучшить циклические характеристики, одна из стратегий заключается в уменьшении содержания серы в композите C / S (30–50 мас.%), Что не только увеличивает электронную проводимость композитов C / S, но также усиливает эффект поглощения серы и полисульфида, наконец. повышение обратимой емкости, срока службы и кулоновской эффективности. Однако согласно нашей оценке практической плотности энергии, показанной в дополнительной таблице S1, можно видеть, что содержание серы должно быть выше 50 мас.%; в противном случае трудно достичь более высокой плотности энергии, чем у современных литий-ионных аккумуляторов. Другая стратегия заключается в добавлении прочных абсорбирующих материалов, таких как наноразмерный мезопористый SiO 2 (ссылка 13) или Mg 0,6 Ni 0,4 O (ссылка 42), Al 2 O 3 (ссылка 43 ) в серный электрод, что в некоторой степени увеличивает кулоновский КПД; однако растворение полисульфида лития полностью не ингибируется.
Третья стратегия заключается в использовании LiNO 3 в качестве эффективной добавки для стабилизации металлического литиевого анода посредством формирования in situ защитного слоя на поверхности литиевого анода 44,45 .Однако защитный слой может только предотвратить дальнейшую реакцию между полисульфидом лития и литиевым анодом, он не может препятствовать растворению полисульфида лития в электролите, что приводит к нестабильности с точки зрения длительных циклов 16,46 . Наконец, защита металлического литиевого анода с использованием слоя неорганического твердого электролита предотвращает попадание любого растворимого полисульфида в металлический литий, но хрупкость таких материалов препятствует их использованию в практических системах с большой поверхностью 47,48 .
Наши Li – S батареи, в которых используется электролит SIS-7 #, демонстрируют превосходные электрохимические характеристики по всем трем аспектам: (i) начальная удельная емкость C / S-композита с 60 мас.% Серы: 625 мА · ч г −1 , ( ii) сохранение высокой емкости: 74% после 100 циклов и (iii) высокая кулоновская эффективность: почти 100% (дополнительная таблица S2). Кроме того, он также демонстрирует отличные характеристики и хорошо работает в широком диапазоне температур даже до -20 ° C (дополнительный рисунок S8).
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
раствор | Определение и примеры
раствор , в химии, гомогенная смесь двух или более веществ в относительных количествах, которые могут непрерывно изменяться до так называемого предела растворимости.Термин «раствор» обычно применяется к жидкому состоянию вещества, но возможны и растворы газов и твердых тел. Например, воздух — это раствор, состоящий в основном из кислорода и азота с небольшими количествами нескольких других газов, а латунь — это раствор, состоящий из меди и цинка.
Ниже приводится краткое описание решений. Для полной обработки см. жидкость: Растворы и растворимости.
Подробнее по этой теме
жидкость: Растворы и растворимости
Способность жидкостей растворять твердые тела, другие жидкости или газы давно признана одним из фундаментальных явлений природы…
Жизненные процессы во многом зависят от решений. Кислород из легких переходит в раствор в плазме крови, химически соединяется с гемоглобином в красных кровяных тельцах и попадает в ткани организма. Продукты пищеварения также разносятся в растворе к различным частям тела. Способность жидкостей растворять другие жидкости или твердые вещества имеет множество практических применений. Химики используют разницу в растворимости для разделения и очистки материалов, а также для проведения химического анализа.Большинство химических реакций происходит в растворе и зависит от растворимости реагентов. Материалы для химического производственного оборудования выбираются таким образом, чтобы противостоять действию растворителей, содержащихся в их содержимом.
Жидкость в растворе обычно называется растворителем, а добавляемое вещество называется растворенным веществом. Если оба компонента являются жидкостями, различие теряет значение; тот, который присутствует в меньшей концентрации, вероятно, будет называться растворенным веществом. Концентрация любого компонента в растворе может быть выражена в единицах веса или объема или в молях.Они могут быть смешаны, например, молей на литр и молей на килограмм.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасКристаллы некоторых солей содержат решетки ионов, то есть атомы или группы атомов с чередующимися положительными и отрицательными зарядами. Когда такой кристалл должен быть растворен, притяжение противоположно заряженных ионов, которые в значительной степени ответственны за сцепление в кристалле, должно преодолеваться электрическими зарядами в растворителе. Они могут быть обеспечены ионами конденсированной соли или электрическими диполями в молекулах растворителя.Такие растворители включают воду, метиловый спирт, жидкий аммиак и фтороводород. Ионы растворенного вещества, окруженные диполярными молекулами растворителя, отделяются друг от друга и могут свободно перемещаться к заряженным электродам. Такой раствор может проводить электричество, а растворенное вещество называется электролитом.
Потенциальная энергия притяжения между простыми неполярными молекулами (неэлектролитами) имеет очень малый диапазон; оно уменьшается примерно как седьмая степень расстояния между ними.Для электролитов энергия притяжения и отталкивания заряженных ионов падает только как первая степень расстояния. Соответственно, их растворы имеют свойства, сильно отличающиеся от свойств неэлектролитов.
Обычно предполагается, что все газы полностью смешиваются (взаиморастворимы во всех пропорциях), но это верно только при нормальном давлении. При высоких давлениях пары химически разнородных газов вполне могут проявлять лишь ограниченную смешиваемость. Многие разные металлы смешиваются в жидком состоянии, иногда образуя узнаваемые соединения.Некоторые из них достаточно похожи, чтобы образовывать твердые растворы ( см. Сплав ).
Панорама экологически безопасных растворителей с использованием подхода COSMO-RS
Недавние правила запретили множество распространенных органических растворителей, которые признаны опасными для здоровья человека и окружающей среды. Таким образом, существует острая потребность в альтернативах, часто называемых «зелеными» или «устойчивыми» растворителями, которые имеют хороший профиль HSE (здоровая и безопасная среда) и предпочтительно получаются из сырья биомассы.Ряд таких «зеленых» растворителей уже присутствует на рынке или находится в стадии усовершенствования, и они перечислены в этой работе. Чтобы использовать этот набор растворителей в качестве эффективных альтернатив, необходим инструмент для сравнения их физико-химических свойств с характеристиками растворителей, которые они должны заменить. Подход COnductor-like Screening MOdel для реальных растворителей (COSMO-RS) был использован для моделирования растворителей, которые были расположены в псевдотрехмерном пространстве благодаря процедурам анализа основных компонентов и кластеризации.Этот подход уже был успешно применен к классификации классических органических растворителей на десять семейств, к которым относятся зеленые растворители. Это псевдо-3D-представление зеленых растворителей помогает в поиске потенциальных альтернатив сомнительному растворителю. Это также проливает свет на нехватку или даже полное отсутствие зеленых растворителей в некоторых семьях (, например, сильных донорных оснований электронных пар). Таким образом, существует потребность в разработке новых зеленых растворителей с необходимыми свойствами.Поскольку подход COSMO-RS может быть применен практически к любому потенциальному кандидату, он может стать мощным инструментом для разработки in silico новых экологически безопасных растворителей.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте снова? Проект «Растворитель для шоколада» — Узнайте о растворителях с шоколадом
Нет ничего лучше дымящейся чашки шоколадного раствора в холодный зимний день, верно? Хотя вы можете не думать о горячем какао как о растворе шоколадного растворителя , с научной точки зрения, это именно то, чем он является!
Узнайте, как горячий какао-порошок превращается в горячий шоколад, в экспериментальном эксперименте.Чтобы выполнить этот простой проект решения проблемы шоколадного растворителя, вам понадобится всего пара обычных предметов домашнего обихода и один голодный помощник.
Что вам понадобится:
- 3 одинаковых кусочка шоколада или леденцов — мягкий шоколад, как кусочки молочного шоколада, — это
- Секундомер или часы с секундной стрелкой
- Доброволец, растворивший шоколад во рту
- Можно растворить шоколад у себя во рту, если вы экспериментируете в одиночку
Что вы делаете:
1.Положите первый кусок шоколада в рот добровольцу. Скажите добровольцу НЕ шевелить зубами, языком или активно сосать шоколад. Просто дайте ему посидеть и раствориться в слюне во рту добровольца.
2. Измерьте время, необходимое для растворения шоколада с момента его помещения в рот до его полного растворения.
3. Поместите вторую конфету в рот добровольцу. На этот раз скажите своему добровольцу, чтобы он перемещал шоколад языком, но не жуйте его НЕ .
4. Снова посмотрим, сколько времени нужно, чтобы шоколад исчез.
5. Поместите третий кусок в рот добровольцу, на этот раз попросив его жевать шоколад.
6. Еще раз посмотрим, сколько времени нужно, чтобы шоколад исчез.
Что случилось:
Все три метода помогли растворить шоколад, потому что они подвергали шоколад воздействию слюны рта. По химии
терминов, слюна — это растворитель, который помогает расщеплять пищу (растворенное вещество) во рту перед тем, как ее проглотить.(Растворенное вещество — это все, что растворяет растворитель.) В горячем шоколаде горячая вода или молоко действуют как растворитель для растворения какао-порошка, растворенного вещества. Так почему же для растворения каждого кусочка шоколада требовалось разное время? Во-первых, давайте узнаем, как работают растворители и растворенные вещества.
Чтобы растворитель разрушил растворенное вещество, он должен контактировать с площадью поверхности растворенного вещества. Чем больше площадь поверхности подвергается воздействию растворителя, тем быстрее он может разрушить растворенное вещество. В вашем эксперименте единственной переменной было количество встряхивания (движения) каждого кусочка шоколада во рту.
Первый кусочек шоколада просто остался во рту и медленно растворился. Это как высыпать пакет с какао-порошком (растворенным веществом) в чашку с горячей водой (растворителем). Без какого-либо движения, чтобы открыть больше участков поверхности растворенного вещества для растворения, требуется время, чтобы раствориться.
Второй кусок шоколада, который двигался языком, подобен перемешиванию какао-порошка с горячей водой. Это заняло меньше времени, чем просто дать ему отстояться, но все же потребовалось время, чтобы обнажить всю поверхность.Вы знаете, как иногда остаются сухие комки какао-порошка при приготовлении горячего шоколада? Обычно чем дольше вы перемешиваете, тем больше вероятность, что вы их все растворите.
Третий кусок шоколада растворился очень быстро, потому что его прогрызли зубы. Жевание позволило слюне быстрее контактировать с большей площадью поверхности. Это сравнимо с добавлением горячей воды и какао-порошка в блендер. Лезвия блендера действуют как зубы и могут быстро разбить эти сухие комочки порошка, что значительно ускорит приготовление горячего шоколада.Но серьезно, кто наливает шоколадный раствор растворителя в блендер !? Большинство людей просто размешивают горячий шоколад ложкой.
Растворитель для шоколада: дополнительное примечание
Воду часто называют универсальным растворителем, потому что при достаточном времени она растворяет практически все. Есть два основных фактора, которые увеличивают скорость растворения: перемешивание и температура. Как вы обнаружили в этом эксперименте, чем больше перемешивания и движения испытывает растворенное вещество при погружении в растворитель, тем быстрее оно растворяется.В зависимости от температуры, чем горячее растворитель, тем быстрее движутся молекулы растворителя. Следовательно, молекулы обладают большей энергией и могут быстрее растворять растворенное вещество.


 Обобщить имеющиеся знания.
Обобщить имеющиеся знания.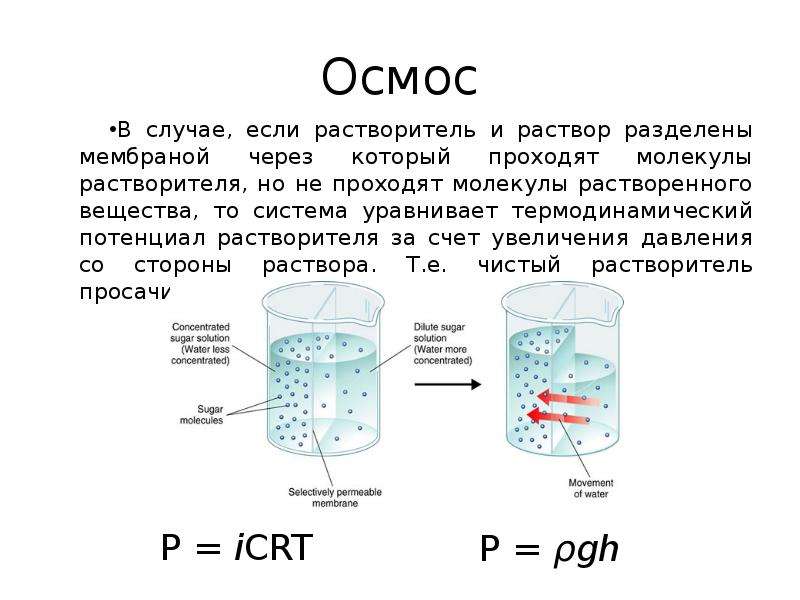 А. Обучение химии на основе межпредметной интеграции: 8–9 классы: Учебно-методическое пособие.– М.: Вентана-Граф, 2004. – 352с.
А. Обучение химии на основе межпредметной интеграции: 8–9 классы: Учебно-методическое пособие.– М.: Вентана-Граф, 2004. – 352с.