Углеводороды — Что такое Углеводороды?
Углеводороды (hydrocarbon) – это органические соединения, состоящие из углерода и водорода.Углеводороды служат фундаментальной основой органической химии: молекулы любых других органических соединений рассматривают как их производные.
Соотношения между углеродом и водородом в углеводородах колеблются в широких пределах (10-90 %).
Соединения углеводородов отличаются друг от друга количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Большинство углеводородов в природе встречаются в сырой нефти.
Кроме того, основными источниками углеводородов являются природный газ, сланцевый газ, попутный нефтяной газ, горючие сланцы, уголь, торф.
Классификация углеводородов
Алканы (парафины) – углеводороды общей формулы CnH2n+2, в молекулах которых атомы углерода связаны между собой σ-связью, а остальные их валентности предельно насыщены атомами водорода.
Отсюда другое название алканов – предельные углеводороды.
Первым представителем данного гомологического ряда является метан СН4.
Алкены (олефины) относятся к непредельным углеводородам общей формулы CnH2n.
В молекуле алкена кроме σ-связей содержится одна π-связь.
Первый представитель гомологического ряда – этилен С2Н4, поэтому алкены называют также «этиленовыми углеводородами».
Диеновые углеводороды содержат в молекуле 2 двойные связи.
Общая формула СnН2n-2.
Первым представителем ряда является бутадиен СН
Алкинами называются углеводороды общей формулы CnH2n-2, молекулы которых содержат тройную связь.
Первый представитель гомологического ряда – ацетилен С2Н2, поэтому алкины называют также «ацетиленовыми углеводородами».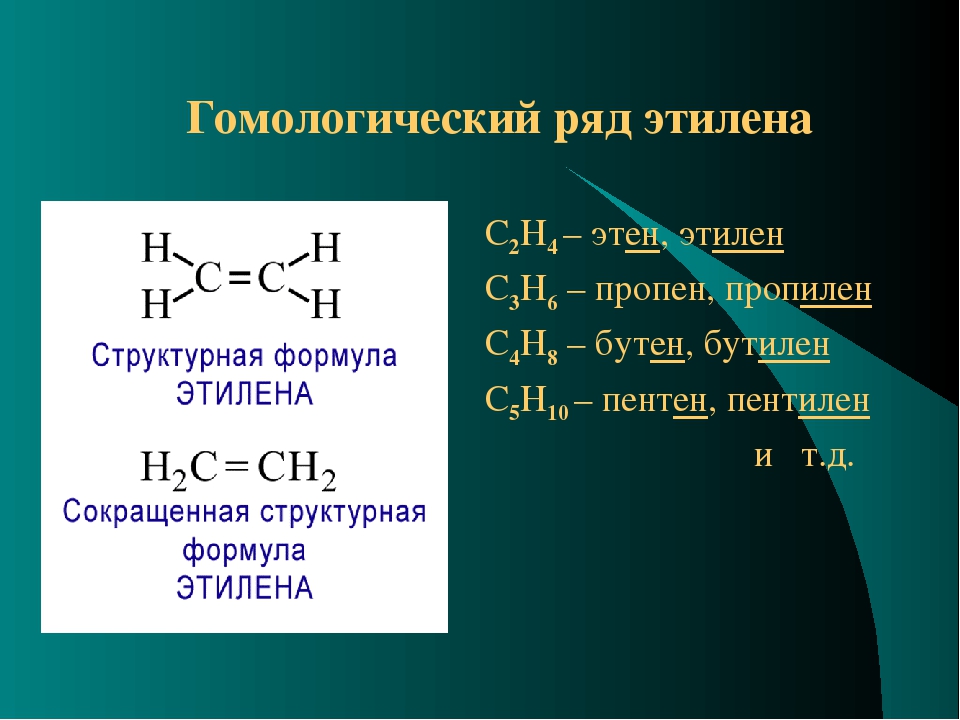
Молекулы циклоалканов содержат циклы разной величины, атомы углерода в которых связаны между собой только σ-связью.
Общая формула СnH2n.
Циклоалкены содержат одну двойную связь и имеют общую формулу СnН2n-2
Углеводороды, имеющие кратные связи, легко вступают в реакции присоединения по месту разрыва π-связей.
Ароматические углеводороды (арены) – углеводороды общей формулы CnH2n-6.
Первые представители ароматических углеводородов были выделены из природных источников и обладали своеобразным запахом, поэтому и получили название «ароматические».
Важнейшим представителем ароматических углеводородов является бензол С6Н6.
В молекуле бензола 6 атомов углерода, соединяясь σ-связями, образуют правильный шестиугольник.
В результате сопряжения 6 свободных р-электронов образуется единое π-электронное облако над и под плоскостью кольца.
Природные источники углеводородов
Каменный уголь – плотная осадочная порода черного, иногда сepo-черного цвета, дающая на фарфоровой пластинке черную черту.
Каменный уголь представляет собой продукт глубокого разложения остатков растений, погибших миллионы лет назад (древовидных папоротников, хвощей и плаунов, а также первых голосеменных растений).
В органическом веществе угля содержится 75-92 % углерода, 2,5-5,7 % водорода, 1,5-15 % кислорода.
Природный газ – полезное ископаемое, основным компонентом которого является метан СН4 (75-98 %).
В природном газе содержатся также его ближайшие гомологи: этан С2Н6, пропан С3Н8, бутан С4Н10 и следовые количества более тяжелых легкокипящих углеводородов.
Существует следующая закономерность: чем выше относительная молекулярная масса углеводорода, тем меньше его количество в природном газе.
Содержание сероводорода и его органических производных (тиолов) в природном газе в сумме может достигать 5-25 %.
Попутные нефтяные газы – газы, которые находятся в природе над нефтью или растворены в ней под давлением.
Их состав может быть выражен примерным соотношением компонентов: метан – 31 %, этан – 7,5 %, пропан – 21,5 %,
бутан – 20 %, пентан и гексан (легкокипящие жидкости) – 20 %.
С каждой тонной добытой нефти выделяется около 50 м3 газов, которые вплоть до середины 20го в. сжигали в факелах, причиняя двойной ущерб – теряли ценное сырье и загрязняли атмосферу.
Первым предприятием в России, на котором стали использовать попутные нефтяные газы, стала Сургутская ГРЭС.
В настоящее время попутные нефтяные газы улавливают и используют как топливо (в том числе и автомобильное) и ценное химическое сырье.

Нефть – смесь углеводородов от светло-бурого до черного цвета с характерным запахом.
Нефть намного легче воды и в ней не растворяется.
В зависимости от происхождения нефть может содержать большое количество алифатических, циклических или ароматических углеводородов.
Значительно больше алканов в грозненской, ферганской, а также нефти штата Пенсильвания (США).
Пермская нефть содержит ароматические углеводороды.
В небольших количествах в состав нефти могут входить также кислородсодержащие соединения, как, например, альдегиды, кетоны, эфиры и карбоновые кислоты.
Алкены. Этилен, его получение — презентация онлайн
Алкены10 класс базовый уровень
Задание: повторить §4, в рабочей тетради по химии
выполнить письменно задания, сразу после урока
отправить фотоотчет о работе в электронный журнал
Программа курса химии для 10-11 классов
общеобразовательных учреждений
(базовый уровень)
А л к е н ы.
 Этилен, его получение (дегидрированием
Этилен, его получение (дегидрированиемэтана и дегидратацией этанола). Химические свойства
этилена: горение, качественные реакции
(обесцвечивание бромной воды и раствора
перманганата калия), гидратация, полимеризация.
Полиэтилен, его свойства и применение. Применение
этилена на основе свойств.
2
ПРАВИЛА РАБОТЫ ЗА КОМПЬЮТЕРОМ
Время непрерывной работы на компьютере -для учащихся X — XI
При работе за компьютером очень важно соблюдать правильную посадку на рабочем месте, поскольку от
нее зависит напряжение глаз, мышц и суставов.
ПРАВИЛЬНАЯ РАБОЧАЯ ПОЗА:
• Следует сидеть прямо (не сутулясь)
• Недопустимо работать, развалившись в кресле.
• Не следует высоко поднимать запястья и выгибать кисти
• Колени — на уровне бедер или немного ниже.
• Нельзя скрещивать ноги, класть ногу на ногу
• Необходимо сохранять прямой угол (900) в области локтевых, тазобедренных и голеностопных суставов.

Так же при работе необходимо:
Держать в расслабленном состоянии плечи и руки — в руках не будет напряжения, если плечи опущены;
Чаще моргать и смотреть вдаль.
При ощущении усталости какой-то части тела сделайте глубокий вдох и сильно напрягите уставшую часть
тела.
• При ощущении усталости глаз следует в течении 2-3 мин окинуть взглядом комнату, устремить взгляд на
разные предметы, смотреть в даль (в окно).
• Если резко возникло общее утомление, появилось дрожание изображение на экране, следует
немедленно прекратить работу
3
Для того, чтобы оградить себя от вредного воздействия компьютера, необходимо делать
регламентированные перерывы. Для снижения утомления зрительного анализатора во время перерывов
УТОМЛЕНИЯ
ЗРИТЕЛЬНОГО
АНАЛИЗАТОРА
Упражнения выполняют сидя или стоя, отвернувшись от экрана,
при ритмичном дыхании, с максимальной амплитудой движения
глаз.
Закрыть глаза, сильно напрягая глазные мышцы, на счет 1-4, затем
открыть глаза, расслабив мышцы глаз, посмотреть вдаль на счет 16. Повторить 4-5 раз.
Посмотреть на переносицу и задержать взор на счет 1-4. До
усталости глаза не доводить. Затем посмотреть вдаль на счет 1-6.
Не поворачивая головы, посмотреть направо и зафиксировать
взгляд на счет 1-4, затем посмотреть вдаль прямо на счет 1-6.
Аналогичным образом проводятся упражнения, но с фиксацией
взгляда влево, вверх и вниз. Повторить 3-4 раза.
4
Перенести взгляд быстро по диагонали: направо вверх — налево
вниз, потом прямо вдаль на счет 1-6; затем налево вверх — направо
вниз и посмотреть вдаль на счет 1-6. Повторить 4-5 раз.
Изучите информацию параграфа 4
учебника «Химия. 10 класс. Базовый
уровень»
О.С.Габриелян.ВНИМАНИЕ! Задания
к каждому слайду помещены под
слайдом, в «заметках».
5
ЗАДАНИЯ
Алкены
Общая формула
алкенов
?
6
Второе
название
алкенов
?
Сnh3n
Предельные
углеводороды
Сnh3n+2
Ароматические
углеводороды
Сnh3n-2
Непредельные
углеводороды
Используя информацию на стр.
 25, заполните схему.
25, заполните схему.Алкан
СН3-СН2-СН3
СН3-СН(СН3)-СН3
СН3-СН2-СН2-СН2-СН3
СН3-СН=СН-СН2-СН3
7
Реакция дегидрирования
— Н2
Алкен
— Н2
— Н2
— Н2
СН2=С(СН3)-СН3
СН2=СН-СН3
Используя информацию стр23 закончите схему.
СН2=СН2
Изомерия алкенов
изомеры
8
Используя информацию на стр.25, найдите изомеры для пентена-2
пентен-1
пентен-2
2-метилпентен-4
9
пентен-3
2-метилбутен-2
4-метилпентен-1
2-метилбутен-1
Используя информацию на стр.25, назовите формулы в соответствии с правилами номенклатуры ИЮПАК
Получение этилена
В промышленности
В лаборатории
C2H5OH
C2H6
10
t, h3SO4 конц
C2h5+ h3O
t, P катализатор..C H +
2 4
h3O
(-Ch3-Ch3-) t, P
C2h5+ Cl2
катализатор..
C2h5
C2h5Cl2
Используя информацию стр.27-29 заполните схему, запишите уравнения реакций на соответствующее место
Химические свойства этилена
C2h5+ Cl2
C2h5+ h3
C2h5+ h3O
nCh3 =Ch3
C2h5+ O2
C2h5+ HCl
11
C2h5Cl2
Реакция полимеризации
C2H6
Реакция горения
C2H5OH
Реакция присоединения
(гидрирования)
(-Ch3-Ch3 -)n
Реакция присоединения
(гидратации)
CO2+h3O
Реакция присоединения
(галогенирования)
C2H5Cl
Реакция присоединения
(гидрогалогенирования)
Используя информацию стр.
 27-29, соотнесите уравнения реакций и названия, переставив фигуры с названиями
27-29, соотнесите уравнения реакций и названия, переставив фигуры с названиямиГенетическая связь
этанол
1
этилен
2
3
этан
1
3
2
4
C2H5OH
t, h3SO4 конц
C2h5+ h3
C2h5+ HCl
12
C2h5+ h3O
C2H6
C2H5Cl
этилен
C2h5+ h3O
C2h5+ Cl2
C2H6
4
C2H5OH
C2h5Cl2
t, P катализатор..C H +
2 4
Используя информацию стр.35 и36, подберите уравнения реакций для схемы
дихлорэтан
h3 O
Качественные реакции на двойную связь
Обесцвечивание раствора
перманганата калия
Обесцвечивание бромной воды
метан
пентан
13
пропан
этан
этилен
бутен
бутан
пропен
пентен
Изучите информацию на стр. 28. Выберите названия веществ, обесцвечивающих растворы бромной воды и
перманганата калия, опишите внешние эффекты реакций, запишите уравнения реакций
Реакция полимеризации
nCh3 =Ch3
мономер
14
полимер
(-Ch3-Ch3 -)n
степень
полимеризации
структурное
звено
число
молекул
Используя информацию на стр.
 29, заполните схему – запишите в прямоугольники соответствующие названия
29, заполните схему – запишите в прямоугольники соответствующие названияПрименение полиэтилена
легкость
химическая
инертность
….
….
….
Предметы
домашнего
обихода
15
Используя информацию стр.39, закончите заполнение схемы –
Решаем задачи
Найдите массовую долю
углерода в молекулах
пропилена, бутена
w%(Э)=
n – количество атомов
элемента
Ar – относительная
аттомная масса
элемента из
Периодической системы
Mr-относительная
молекулярная масса
вещества, равная сумме
атомных масс с учетом
индекса
18
Тесты по теме «Непредельные углероды» (10 класс) – Документ 1 – УчМет
Входной контроль по теме «Непредельные углеводороды».
Вариант №1.
Выбери цифру правильного ответа.
А1. Общая формула непредельных углеводородов ряда этилена:
СпН2п 2) СпН2п+2 3) СпН2п-2 4) СпН2п-6
А2.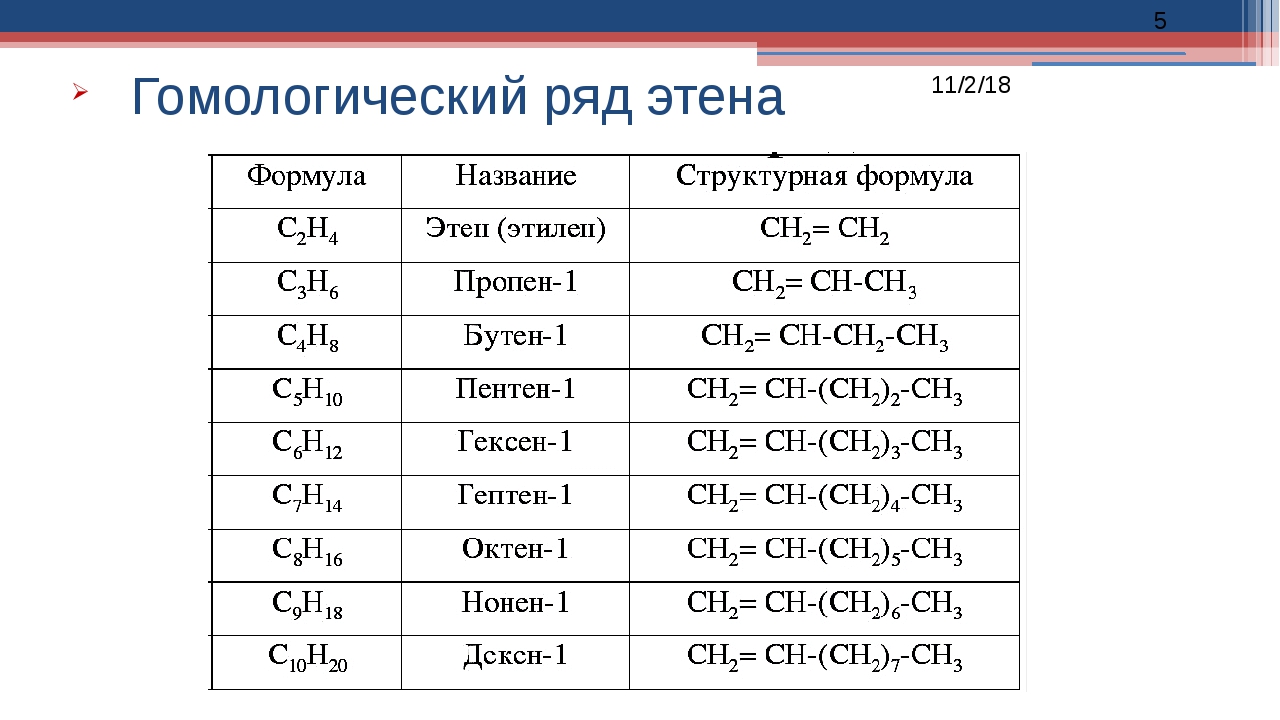 Гомолог этина:
Гомолог этина:
1) С8Н16 2) С5Н8 3) С4Н10 4) С6Н6
А3. Данными формулами представлено веществ:
СН3 – СН(СН3) – СН = СН — СН3
СН3 – СН2 – СН= СН – СН2 – СН2 – СН3
СН3 – СН = СН2 – СН(СН3) – СН3
СН= СН — СН(СН3) – СН(СН3) — СН3
СН3 – СН(СН3) – СН= С(СН3) – СН3
5 2) 3 3) 4 4) 2
А4. Сумма коэффициентов в уравнении горения бутадиена – 1,3 в избытке
кислорода равна:
1) 27 2) 23 3) 20 4) 19
В1. Установите соответствие между формулой
алкена и его
Установите соответствие между формулой
алкена и его
названием.
Формула алкена | Название алкена |
А. СН3 – СН = СН- СН2 — СН3 Б. СН2 = СН(СН3) – СН3 В. СН3 – СН(СН3) – С(СН3) = СН2 Г. СН2 = СН — С(СН3)2 – СН2 – СН3 | 1. 3,3-диметилпентен — 1 2. 2,3-диметилбутен — 3 3. 2,3-диметилбутен — 1 4. пентен — 2 5. 3,3- диметилпентен — 4 6. 2- метилпропен |
С1. Составьте уравнение реакции:
А) гидрирования ацетилена;
Б)
хлорирование пропена.
Входной контроль по теме «Непредельные углеводороды».
Вариант №2.
Выбери цифру правильного ответа.
А1. Общая формула непредельных углеводородов ряда ацетилена:
СпН2п 2) СпН2п+2 3) СпН2п-2 4) СпН2п-6
А2. Гомолог этена:
1) С8Н16 2) С5Н8 3) С4Н10 4) С6Н6
А3. Данными формулами представлено веществ:
СН3 – СН(СН3) – СН = СН — СН3
СН2= СН – СН2 — СН2 – СН2 – СН2 – СН3
СН3 – СН2 — СН2 – СН2 — СН2 – СН2 =СН2
СН3 — СН = СН – СН(СН3) — СН3
СН3 – СН(СН3) – СН2 — СН2 – СН= СН2
5 2) 3 3) 4 4) 2
А4. Сумма коэффициентов в уравнении
горения пропадиена в избытке
Сумма коэффициентов в уравнении
горения пропадиена в избытке
кислорода равна:
1) 10 2) 12 3) 19 4) 8
В1. Установите соответствие между формулой алкена его названием.
Формула алкена | Название алкена |
А. СН3 – СН = СН- СН2 – СН— СН3 Б. СН2 = СН(СН3) – СН2 — СН3 В. СН3 – СН = СН(СН3) – СН3 Г. СН2 = СН — С(СН3) – СН(СН3 ) – СН3 | 1. 3-метилбутен — 2 2. 2,3-диметилпентен — 3 3. 2-метилбутен — 2 4. гексен — 2 5. 3,4- диметилпентен — 1 6. |
С1. Составьте уравнение реакции:
А) полимеризации этена;
Б) бромирования пропена
Промежуточный контроль по теме:
«Непредельные углеводороды. Алкены».
Вариант № 1.
Выбери цифру правильного ответа.
А1. π -связь между атомами углерода образуется в молекуле:
пентана 2) пропанола 3) циклопентана 4) пропена
А2. Гомологом 2 – метилметилпентена -1 является:
СН3 — СН(СН3) – СН2 — СН3 3) СН3 – СН2 – СН2 — СН3
СН3 – СН2 – С(СН3) = СН2 4) СН2 = СН – СН2 – СН2 – СН2 — СН3
А3. В промышленности этилен
получают:
В промышленности этилен
получают:
дегидрированием этана при высокой температуре
разложением полиэтилена
дегидратацией этанола в присутствии соляной кислоты
дегидратацией этанола в присутствии серной кислоты
А4. При взаимодействии пропилена с бромоводородом получают:
1 – бромпропан 3) 2 — бромпропан
1,1 – дибромпропан 4) 2,2 – бромпропан
А5. Вещество, которое обесцвечивает бромную воду:
метан 2) пропилен 3) хлорметан 4) этан
А6. Этилен подвергают реакции гидратации с целью получения:
спирта 3) карбоновой кислоты
альдегида 4) простого эфира
Выберите правильные ответы, и запиши цифры, под которыми
они указаны, в порядке
возрастания.
В1. Для этилена характерны
тетраэдрическая форма молекулы
sp2-гибридизация атомов углерода в молекуле
наличие только π- связи
реакция гидрирования
высокая растворимость в воде
горение на воздухе
Ответ:________________________
В2. Установи соответствие между формулой вещества и его
названием.
Формула алкена | Название алкена |
А.СН2= СН– СН2 — СН3 Б. СН2 = С(СН3) – СН2 — СН3 В. СН3 – СН = СН — СН3 Г. СН2 = СН – С(СН3)2 — СН3 | 1. 2. бутен — 2 3. 3,3 – диметилпентен -1 4. 2 – метилбутен — 1 5. бутен — 1 6. гексен — 1 |
Представьте решение полностью.
С1. Определите массу вещества, полученного при взаимодействии 11,2л (н.у.) этилена и 90г брома.
Промежуточный контроль по теме:
«Непредельные углеводороды. Алкены».
Вариант № 2.
Выбери цифру правильного ответа.
А1. Связь между атомами углерода в молекуле этилена образуется за счет:
двух π – связей 3) двух σ – связей
двух ρ – связей 4) одной π – связи и одной σ — связи
А2. Гомологом пентена -1 является:
пентен — 2 3) гексен — 1
2-метилбутен — 1 4) 2 — метилбутан
А3. В лаборатории этилен получают:
В лаборатории этилен получают:
дегидрированием этана при высокой температуре
разложением полиэтилена
дегидратацией этанола в присутствии соляной кислоты
дегидратацией этанола в присутствии серной кислоты
А4. При гидратации пропилена получают:
пропанол — 1 3) пропанол — 2
бутанол — 1 4) бутанол — 2
А5. Пентен от пентана можно отличить при помощи каждого из реактивов:
раствора перманганата калия и гидроксида меди (II)
оксида серебра и оксида меди(II)
бромной воды и оксида меди(II)
бромной воды и раствора перманганата калия
А6. Этилен подвергают реакции полимеризации с целью получения:
оксида этилена 3) этиленгликоля
полиэтилена 4) простого эфира
Выберите правильные ответы, и запиши цифры, под которыми
они указаны, в порядке
возрастания.
В1. Для пропена характерны
тетраэдрическая форма молекулы
sp2-гибридизация всех атомов углерода в молекуле
наличие π- связи
реакция гидрирования
высокая растворимость в воде
горение на воздухе
Ответ:________________________
В2. Установи соответствие между формулой вещества и его
названием.
Формула алкена | Название алкена |
А.СН2 = С(С2Н5)– СН2 — СН3 Б. СН2= СН – СН2 – СН2 — СН3 В. СН3 – СН = СН — СН2— СН3 Г. СН2 = СН – С(СН3)2 — СН3 | 1. 2. пентен — 2 3. 3,3 – диметилбутен -1 4. 2 – этилбутен — 1 5. 2 – этилбутен — 2 6. гексен — 1 |
Представьте решение полностью.
С1. Определите массу вещества, полученного при реакции гидратации 44,8л (н.у.) этилена 20г воды.
Промежуточный контроль по теме:
«Непредельные углеводороды. Алкины».
Вариант № 1.
Выбери цифру правильного ответа.
А1. Связь между атомами углерода в молекуле этина образуется за счет:
трех π – связей 3) двух π – связей и одной σ — связи
трех σ – связей 4) одной π – связи и двух σ – связей
А2. Изомером вещества, формула которого СН Ξ С – СН2— СН3, является:
СН Ξ С – СН3 3) СН2= СН – СН = СН2
СН3 – СН2— СН2 — СН3 4) СН2 = СН – СН – СН3
А3.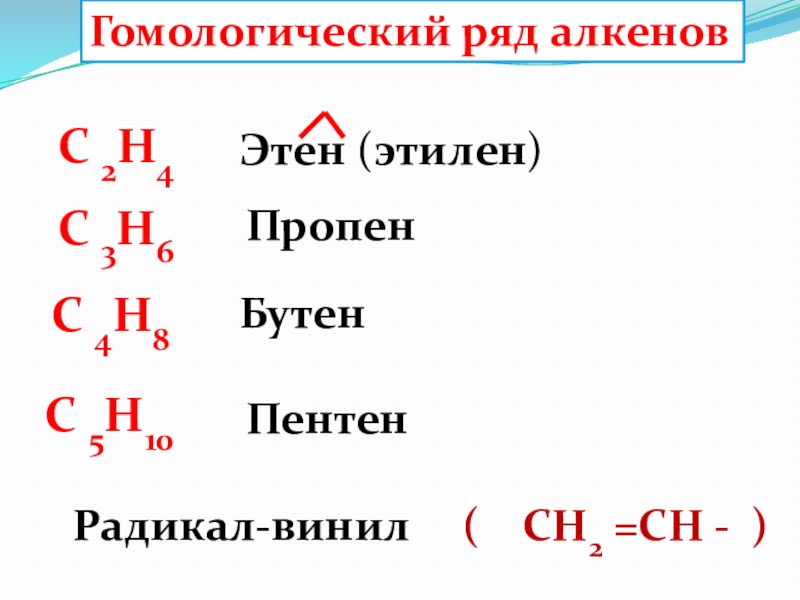 Вещество СН Ξ С – СН(С2Н5)
– СН(СН3) – СН2 – СН2 –
СН(СН3) — СН3,
Вещество СН Ξ С – СН(С2Н5)
– СН(СН3) – СН2 – СН2 –
СН(СН3) — СН3,
называется:
2,5 – диметил, 6- этилоктин -7 3) 4,7 – диметил, 3 – этилоктин — 1
3- этил, 4, 7 – диметилоктин -1 4) 3,4,7 – метилэтилоктин -1
А4. Вещество, с которым не реагирует ацетилен:
бромная вода 2) медь 3) хлор 4) кислород
А5. В схеме превращений
СН4→ Х→ СН3 С(О)Н
веществом «Х» является:
этан 3) этилен
ацетилен 4) пропен
А6. Уравнением реакции замещения
является:
Уравнением реакции замещения
является:
С2Н2 + Н2→ С2Н4 3) С2Н2 + Br2→ С2Н2Br2
С2Н2 + Ag2О → С2Ag 2 + Н2О 4) С2Н2 + НCl→ С2Н3Cl
Выберите правильные ответы, и запишите цифры, под которыми
они указаны, в порядке возрастания.
В1. Для ацетилена характерны
линейная форма молекулы
sp2-гибридизация атомов углерода в молекуле
наличие в молекуле 3-х σ – связей и 2-х π- связей
взаимодействие с раствором йода
образование этиленгликоля при взаимодействии с раствором перманганата калия
образование 1,2 дихлорэтана при взаимодействии с 2 моль хлороводорода
Ответ:________________________
В2.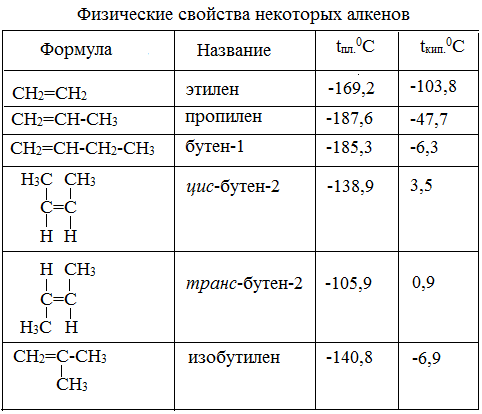 Установи соответствие между формулой
вещества и его
Установи соответствие между формулой
вещества и его
названием.
Формула алкина | Название алкина |
А.СНΞС — СН(С2Н5)– СН2 — СН3 Б. СНΞ С – СН2 – СН2 — СН3 В. СН3 – С ΞС — СН3 Г. СНΞ С – С(СН3)2 — СН3 | 1. пентин -1 2. пентин — 2 3. 3,3 – диметилбутин -1 4. 2 – этилбутин — 1 5. 3 – этилпентин — 1 6. гептин — 1 |
Представьте решение полностью.
С1. Дана схема превращений:
карбонат кальция → карбид кальция → ацетилен → этаналь
Напишите уравнения реакций, с помощью которых можно осуществить
указанные
превращения.
Промежуточный контроль по теме:
«Непредельные углеводороды. Алкины».
Вариант № 2.
Выбери цифру правильного ответа.
А1. Тип гибридизации атомов углерода в соединении СН Ξ С – СН2— СН3:
sp3, sp2 3) sp, sp3
sp, sp2 4) sp2
А2. Гомологом вещества, формула которого СН Ξ С – СН2— СН3, является:
СН Ξ С – СН3 3) СН2= СН – СН = СН2
СН3 – СН2— СН2 — СН3 4) СН2 = СН – СН – СН3
А3.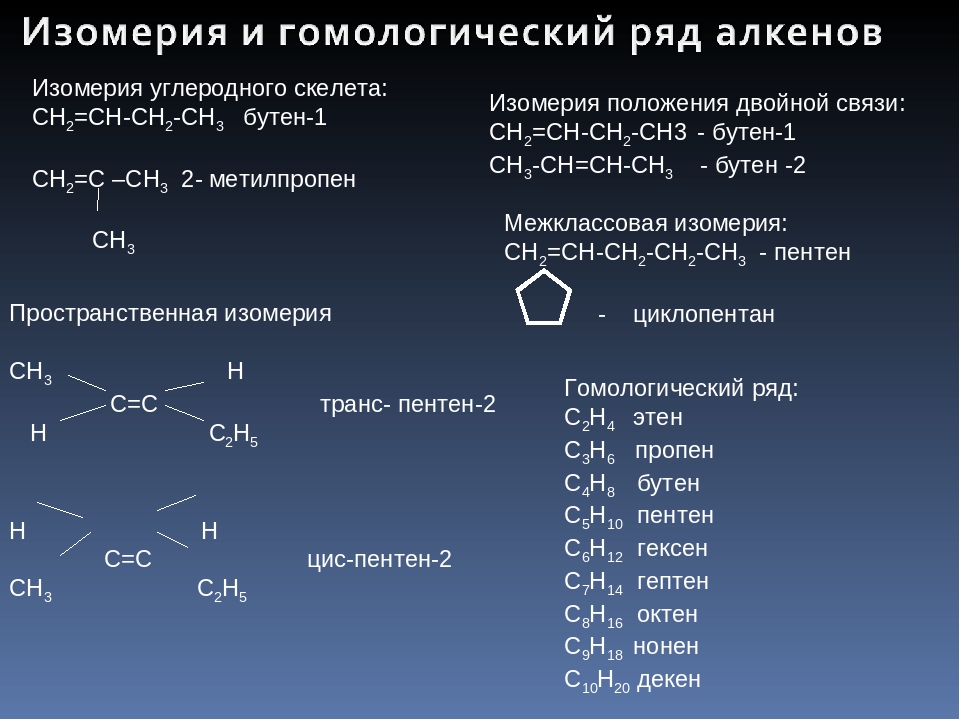 Вещество СН Ξ С – СН(СН3) – СН(СН3)
– СН(СН3) — СН3,
Вещество СН Ξ С – СН(СН3) – СН(СН3)
– СН(СН3) — СН3,
называется:
3 — метил,4 – метил, 5- метилгексин -1
3,4,5 — триметилгексин- 1
нонин-1
2,3,4 – триметилгексинтин -5
А4. Вещество, с которым реагирует пропин:
азот 3) углекислый газ
хлороводород 4) гидроксид натрия
А5. В схеме превращений
СН4→ Х→ С2Н6
веществом «Х» является:
этан 3) этилен
ацетилен 4) пропен
А6. Для алкинов не характерны реакции:
Для алкинов не характерны реакции:
присоединения 3) замещения
полимеризации 4) дегидрирования
Выберите правильные ответы, и запишите цифры, под которыми
они указаны, в порядке возрастания.
В1. Для ацетилена и пропина характерно
тетраэдрическая форма молекулы
sp-гибридизация всех атомов углерода в молекуле
наличие только σ – связей в молекуле
реакция гидратации
взаимодействие с раствором перманганата калия
горение на воздухе
Ответ:________________________
В2. Установи соответствие между формулой вещества и его
названием.
Формула алкина | Название алкина |
А. Б. СНΞ С – СН2— СН3 В. СН3 – С ΞС — СН2— СН3 Г. СНΞ С – С(СН3) — СН3 | 1. пентин -1 2. пентин — 2 3. 3,3 – диэтилпентин -1 4. бутин — 1 5. 3 – метилбутин — 1 6. гептин — 1 |
Представьте решение полностью.
С1. Дана схема превращений:
метан → ацетилен → винилхлорид → поливинилхлорид
Напишите уравнения реакций, с помощью которых можно осуществить
указанные превращения.
Промежуточный контроль по теме:
«Ароматические углеводороды».
Вариант № 1.
Выбери цифру правильного ответа.
А1. Толуол и бензол являются между собой:
гомологами 3) структурными изомерами
геометрическими изомерами 4) одним и тем же веществом
А2. Число σ – связей в молекуле
бензола равно:
Число σ – связей в молекуле
бензола равно:
12 2) 6 3) 3 4) 4
А3. Верны ли следующие суждения?
А. При хлорировании толуола как в присутствии катализатора, так и при облучении образуется м-хлортолуол.
Б. При нитровании толуола образуется смесь о – и п – изомеров.
1) верно только А 3) оба суждения верны
2) верно только Б 4) оба суждения неверны
А4. Бензол не взаимодействует с:
азотной кислотой 3) бромоводородом
бромом 4) кислородом
А5. Верны ли следующие суждения?
А. Бензол вступает в реакции замещения и в реакции присоединения
Б. Бензол легко вступает в
реакции присоединения.
Бензол легко вступает в
реакции присоединения.
1) верно только А 3) оба суждения верны
2) верно только Б 4) оба суждения неверны
А6. В схеме превращений
С6Н6→ Х→ С6Н5ОН
веществом «Х» является:
нитробензол 3) толуол
Пикриновая кислота 4) бензосульфокислота
Выберите правильные ответы, и запиши цифры, под которыми
они указаны, в порядке возрастания.
В1. Для бензола характерны
плоская форма молекулы
sp2-гибридизация всех атомов углерода в молекуле
наличие 12 –ти σ – связей и 6 – ти π – связей в молекуле
реакция полимеризации
взаимодействие с аммиачным раствором оксида серебра (I)
взаимодействие с хлором в присутствии катализатора
Ответ:________________________
В2.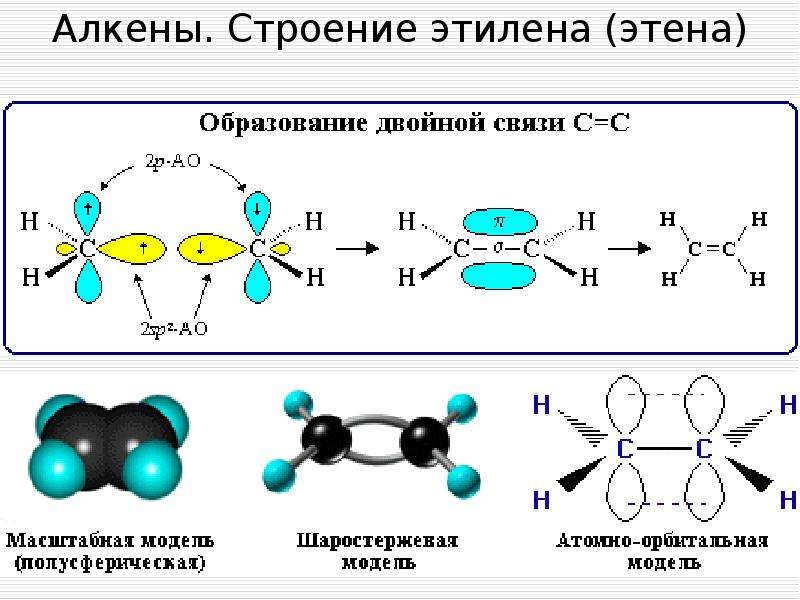 Рассчитайте массу бензола, образующегося
из 13,44л (н.у.) ацетилена . Ответ_________________.
(Запишите число с точностью до целых).
Рассчитайте массу бензола, образующегося
из 13,44л (н.у.) ацетилена . Ответ_________________.
(Запишите число с точностью до целых).
Представьте решение полностью.
С1. Дана схема превращений:
метан → ацетилен → бензол → хлорбензол
Напишите уравнения реакций, с помощью которых можно осуществить
указанные превращения.
Промежуточный контроль по теме:
«Ароматические углеводороды».
Вариант № 2.
Выбери цифру правильного ответа.
А1. Гомологами являются:
бензол и стирол 3) бензол и фенол
толуол и этилбензол 4) толуол и метилбензол
А2. В молекуле толуола гибридизация атомов углерода:
только sp3 2) только sp2 3) sp3 и sp2 4) sp3 и sp
А3. Продуктом алкилирования
бензола толуолом является:
Продуктом алкилирования
бензола толуолом является:
пропилбензол 3) стирол
толуол 4) кумол
А4. Как бензол, как и его гомологи можно получить, осуществляя:
тримеризацию алкенов 3) изомеризацию алканов
димеризацию диенов 4) тримеризацию алкинов
А5. Верны ли следующие суждения?
А. Толуол отличается от бензола числом электронов в π – системе.
Б. Толуол устойчивее, чем бензол, к действию окислителей.
1) верно только А 3) оба суждения верны
2) верно только Б 4) оба суждения неверны
А6. В схеме превращений
С2Н2→ Х→ С6Н5Cl
веществом «Х» является:
этан 3) этен
бензол 4) толуол
Выберите правильные ответы, и запишите цифры, под которыми
они указаны, в порядке
возрастания.
В1. Для бензола характерны
реакция гидрирования
sp2-гибридизация всех атомов углерода в молекуле
наличие только π – связей в молекуле
высокая растворимость в воде
взаимодействие с аммиачным раствором оксида серебра (I)
горение на воздухе
Ответ:________________________
В2 .Рассчитайте массу бензола, которая потребуется для получения 22,24г
нитробензола.
Ответ_________________. (Запишите число с точностью до целых).
Представьте решение полностью.
С1. Дана схема превращений:
циклогексан ← гексан→ бензол → нитробензол
Напишите уравнения реакций, с помощью которых можно осуществить
указанные превращения.
Итоговый контроль по теме«Углеводороды».
Вариант №1.
Выбери
цифру правильного ответа.
А1. Общая формула алкадиенов:
1) СnH2n+2, 2) СnH2n, 3) СnH2n-2, 4) СnH2n-6.
А2. Число ɕ-связей в молекуле этилена равно:
1) 6 2) 2 3) 5 4) 4
А3. sр – гибридный атом углерода присутствует в молекуле:
1) бутадиена – 1,3; 2) пропина; 3) гексена; 4) метана.
А4. Гомологами являются:
1) 3-метилпентан и гексан 3) октен и октадиен
2) бутин и ацетилен 4) гептан и бромгептан
А5. Изомерами являются:
1) гексен и циклогексан 3) бутин и бутилен
2) метилбензол и метилбутан 4) пентан и пентин
А6.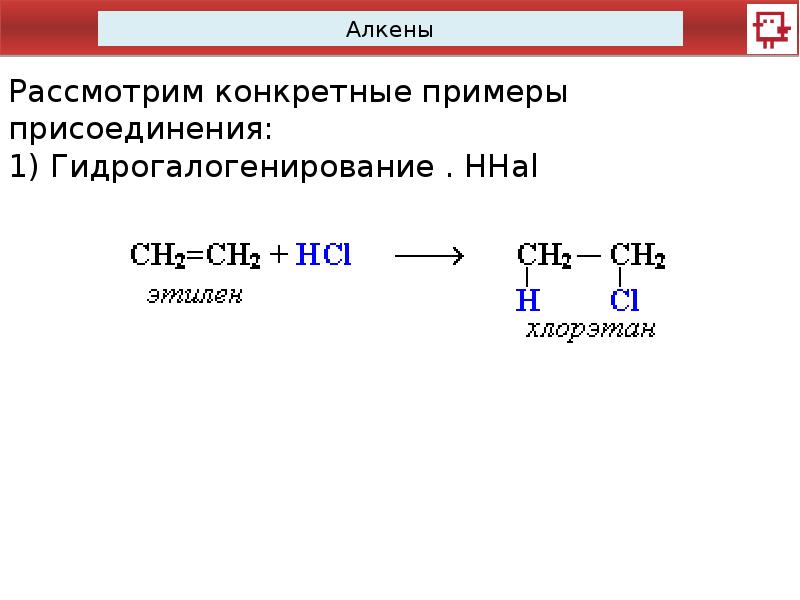 Для
алкинов характерен вид изомерии:
Для
алкинов характерен вид изомерии:
1) геометрическая
2) положения заместителя
3) углеводородной цепочки
4)положения функциональной группы
А7. По реакции Кучерова получают:
1) спирт 3) альдегид
2) галогенопроизводные углеводородов 4) анилин.
А8. Бензол получают из:
1) толуола 3) метана
2) этилового спирта 4) ацетилена
А9. В реакцию дегидрирования может вступать:
1) бензол 2) этин 3) бутан 4)циклогексан
А10. Водный раствор перманганата калия обесцвечивает:
1) метан 2) циклогексан 3) бензол 4) бутин
Выберите правильные ответы, и запишите цифры, под которыми
они указаны, в порядке
возрастания.
В1. Для этилена, и ацетилена характерны:
взаимодействие с оксидом меди (II)
sp2-гибридизация атомов углерода в молекуле
наличие σ – и π- связей в молекуле
реакция гидрирования
горение на воздухе
реакция замещения
Ответ:________________________
Установи соответствие между химической реакцией и ее типом.
В2.
Химическая реакция | Тип химической реакции |
500 С, Ni А. СН3 – СН3————→СН2=СН2 t, AlCl3 Б. СН3-СН2-СН2-СН3————→ СН3-СН(СН3)-СН3 В. Г. n СН3— СН= СН2 → -( СН(СН3)- СН2)-n | 1.реакция полимеризации 2. реакция гидрирования 3. реакция изомеризации 4. реакция дегидрирования 5. реакция дегидратации. |
В3. Рассчитайте объем воздуха (н.у.), необходимый для полного сгорания
50л. ацетилена (н.у.).
Ответ_________________. (Запишите число с точностью до целых)
Представь решение полностью.
С1. Дана схема превращений:
метан → ацетилен →бензол → циклогексан →1-хлоргексан
Напишите уравнения реакций, с помощью которых можно осуществить
указанные превращения.
С2. Найдите формулу углеводорода с массовой долей углерода 80% и
относительной
плотностью вещества по метану 1,875.
Итоговый контроль по теме: «Углеводороды».
Вариант №2.
Выбери цифру правильного ответа.
А1. Общая формула циклоалканов:
1) СnH2n+2 2) СnH2n 3) СnH2n-2 4) СnH2n-6.
А2. Число ɕ-связей в молекуле пентадиена -1,3 равно:
1) 1, 2) 2 3) 12 4) 4
А3. sр3 – гибридный атом углерода присутствует в молекуле:
1) бензола 2) этилена 3) этана 4) ацетилена.
А4. Гомологами являются:
1) 3-метилбутен-1 и 2,2- диметилбутан 3) этин и пропадиен
2) бутан и циклобутан
4) гептен и этилен.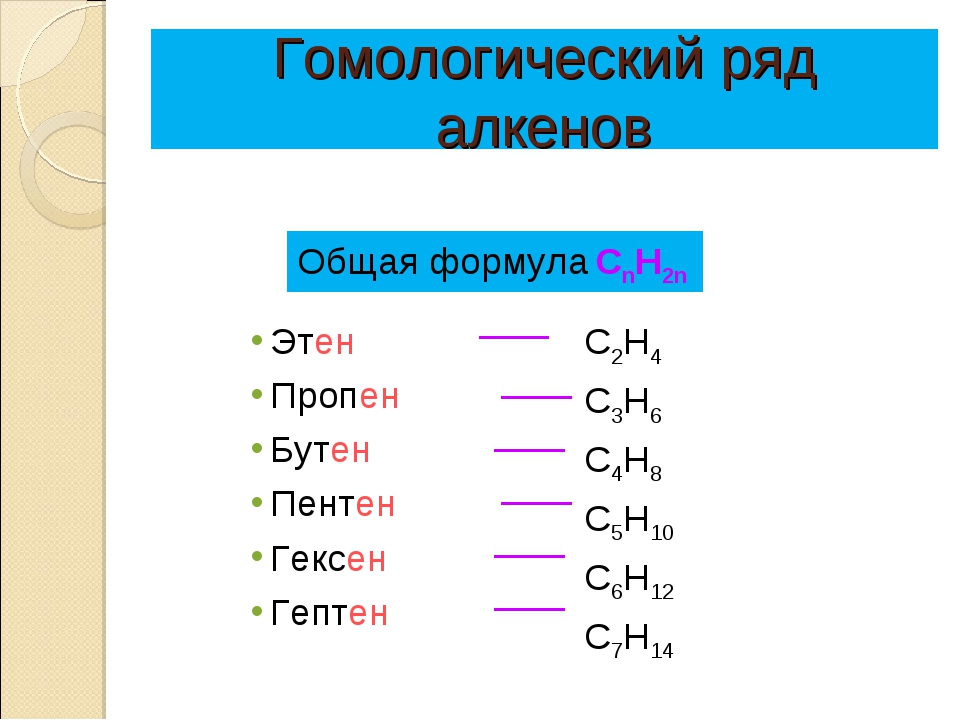
А5. Изомерами являются:
1) орто-бромтолуол и пара-бромтолуол 3) метан и этан
2) циклооктан и этилбензол 4) бутин и бутадиен.
А6. Гексен-2 и гексен-3 являются примером изомерии:
1) геометрической
2) положения заместителя
3) углеводородной цепочки
4)положения функциональной группы.
А7. Ацетилен можно получить из:
1) бензола 2) метана 3) бутина 4) анилина.
А8. Превращение бутана в бутен относится к реакции:
1) полимеризации 3) дегидратации
2) дегидрирования 4) изомеризации.
А9. Этиленовые углеводороды не взаимодействуют с :
1) водородом 3) кислородом
2) азотом
4) хлором.
А10. Продуктом гидратации ацетилена является:
1) кислота, 3) альдегид,
2) спирт, 4) простой эфир.
Выберите правильные ответы, и запишите цифры, под которыми
они указаны, в порядке возрастания.
В1. Для ацетилена, и пропина характерно:
тетраэдрическая форма молекулы
sp-гибридизация всех атомов углерода в молекуле
наличие только σ – связей в молекуле
реакция гидрирования
горение на воздухе
реакция с хлоридом меди
Установи соответствие между формулой вещества и классом углеводородов.
В2.
Химическая реакция | Тип химической реакции |
А. Б. СН3— СН= СН — СН3 В. СН3-СН Ξ СН- СН3 Г. СН3-СН2-СН2-СН3 | 1. алканы 2. алкадиены 3. алкены 4. алкины 5. арены 6. циклоалканы |
В3. В3. Рассчитайте объем воздуха (н.у.), необходимый для полного сгорания
60л. этилена (н.у.).
Ответ_________________. (Запишите число с точностью до целых)
Представь решение полностью.
С1. Дана схема превращений:
этанол → этен →1,2-дихлорэтан → этин→бензол
Напишите уравнения реакций, с помощью которых можно осуществить
указанные превращения.
С2. Найдите формулу углеводорода с массовой долей углерода 85,7% и
относительной плотностью
вещества по водороду 28.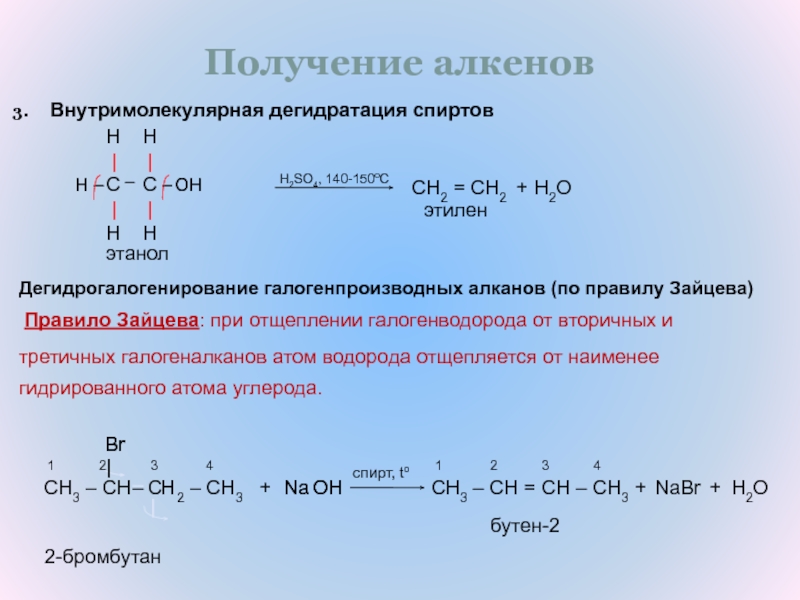
Урок №13. Электронное и пространственное строение алкенов. Гомология и изомерия алкенов
НЕПРЕДЕЛЬНЫЕ, ИЛИ НЕНАСЫЩЕННЫЕ, УГЛЕВОДОРОДЫ РЯДА ЭТИЛЕНА
(АЛКЕНЫ, ИЛИ ОЛЕФИНЫ)
Алкены, или олефины (от лат. olefiant — масло — старое название, но широко используемое в химической литературе. Поводом к такому названию послужил хлористый этилен, полученный в XVIII столетии, — жидкое маслянист вещество.) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь.
Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными.
Алкены образуют гомологический ряд с общей формулой CnH2n
1. Гомологический ряд алкенов
СnH2n алкен | Названия, суффикс ЕН, ИЛЕН |
C2Н4 | этен, этилен |
C3H6 | пропен |
C4H8 | бутен |
C5H10 | пентен |
C6H12 | гексен |
Гомологи:
СH2=CH2 этен
СH2=CH—CH3 пропен
СH2=CH-CH2-CH3 бутен-1
СH2=CH-CH2-CH2—СН3 пентен-1
2. Физические свойства
Физические свойства
Этилен (этен) – бесцветный газ с очень слабым сладковатым запахом, немного легче воздуха, малорастворим в воде.
С2 – С4 (газы)
С5 – С17 (жидкости)
С18 – ( твёрдые)
· Алкены не растворяются в воде, растворимы в органических растворителях (бензин, бензол и др.)
· Легче воды
· С увеличением Mr температуры плавления и кипения увеличиваются
3. Простейшим алкеном является этилен — C2H4
Структурная
и электронная формулы этилена имеют вид:
В молекуле этилена подвергаются
гибридизации одна s— и две p-орбитали атомов C (sp2-гибридизация).
Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p-орбитали. Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C
σ — связь.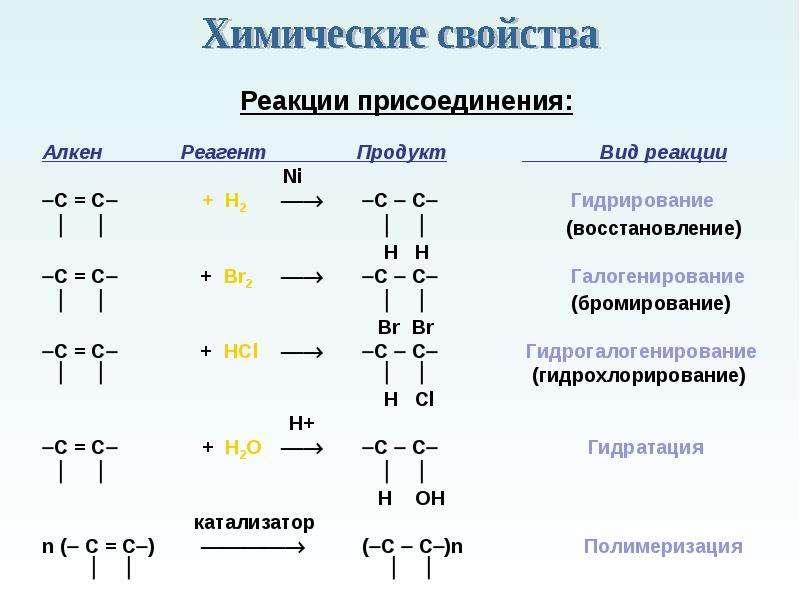 Остальные четыре гибридных
орбитали атомов C перекрываются в той же плоскости с четырьмя s-орбиталями
атомов H и также образуют четыре σ — связь. Две негибридные p-орбитали
атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно
плоскости σ — связь, т.е. образуется одна П — связь.
Остальные четыре гибридных
орбитали атомов C перекрываются в той же плоскости с четырьмя s-орбиталями
атомов H и также образуют четыре σ — связь. Две негибридные p-орбитали
атомов C взаимно перекрываются в плоскости, которая расположена перпендикулярно
плоскости σ — связь, т.е. образуется одна П — связь.
По своей природе П — связь резко отличается от σ — связь; П — связь менее прочная вследствие перекрывания электронных облаков вне плоскости молекулы. Под действием реагентов П — связь легко разрывается.
Молекула этилена симметрична; ядра всех атомов расположены в одной плоскости и валентные углы близки к 120°; расстояние между центрами атомов C равно 0,134 нм.
Запомните! SP2 –гибридизация: 1) Плоское тригональное строение 2) Угол – HCH — 120° 3) Длина (-С=С-) связи – 0,134 нм 4) Связи — σ, П 5) Невозможно вращение относительно (-С=С-) связи |
Если атомы соединены двойной связью, то
их вращение невозможно без того, чтобы электронные облака П — связь не разомкнулись.
4. Изомерия алкенов
Наряду со структурной изомерией углеродного скелета для алкенов характерны, во-первых, другие разновидности структурной изомерии — изомерия положения кратной связи и межклассовая изомерия.
Во-вторых, в ряду алкенов проявляется пространственная изомерия, связанная с различным положением заместителей относительно двойной связи, вокруг которой невозможно внутримолекулярное вращение.
Структурная изомерия алкенов
1. Изомерия углеродного скелета (начиная с С4Н8):
2. Изомерия положения двойной связи (начиная с С4Н8):
3. Межклассовая изомерия с циклоалканами, начиная с С3Н6:
Пространственная изомерия алкенов
Вращение атомов вокруг двойной связи
невозможно без ее разрыва. Это обусловлено особенностями строения p-связи
(p-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие
жесткой закрепленности атомов поворотная изомерия относительно двойной связи не
проявляется. Но становится возможной цис—транс-изомерия.
Вследствие
жесткой закрепленности атомов поворотная изомерия относительно двойной связи не
проявляется. Но становится возможной цис—транс-изомерия.
Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости p-связи. Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис -изомере, либо по разные стороны в транс-изомере.
ВНИМАНИЕ! цис-транс— Изомерия не проявляется, если хотя бы один из атомов С
при двойной связи имеет 2 одинаковых заместителя.
Например,
бутен-1 СН2=СН–СН2–СН3 не имеет цис— и транс-изомеров, т.к. 1-й атом С связан с двумя одинаковыми атомами Н.
Изомеры цис— и транс— отличаются не только физическими
,но и химическими свойствами, т. к.
сближение или удаление частей молекулы друг от друга в пространстве
способствует или препятствует химическому взаимодействию.
к.
сближение или удаление частей молекулы друг от друга в пространстве
способствует или препятствует химическому взаимодействию.
Иногда цис-транс-изомерию не совсем точно называют геометрической изомерией. Неточность состоит в том, что все пространственные изомеры различаются своей геометрией, а не только цис— и транс-.
5. Номенклатура
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен: этан — этилен, пропан — пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:
СH3
|
H3C—CH2—C—CH=CH2
H3C—C=CH—CH—CH2—CH3
|
|
|
CH3 CH3 CH3
3,3-диметилпентен-1
2,4-диметилгексен-2
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
(Н2С=СН— ) винил или этенил
(Н2С=CН—СН2 ) аллил
ЦОР:
Образование молекулы этилена
Образование названий алкенов по номенклатуре ИЮПАК
ТРЕНАЖЁРЫ:
Гомологический ряд этилена
Урок по теме «Алкены» в 10 классе, ФГОС
Введение. Урок разработан и проведен в 10 общеобразовательном классе. Изучение предмета ведётся по одночасовой программе (36 часов в 10 классе и 34 часа в 11 классе) по учебникам для общеобразовательных учреждений авторов Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. Органическая химия, 10 класс», базовый уровень, Москва, Просвещение, 2013; учебник 11 класса «Химия. Основы общей химии, 11 класс» базовый уровень, Москва, Просвещение, 2013, рекомендованных Министерством образования и науки Российской Федерации.
Урок разработан и проведен в 10 общеобразовательном классе. Изучение предмета ведётся по одночасовой программе (36 часов в 10 классе и 34 часа в 11 классе) по учебникам для общеобразовательных учреждений авторов Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. Органическая химия, 10 класс», базовый уровень, Москва, Просвещение, 2013; учебник 11 класса «Химия. Основы общей химии, 11 класс» базовый уровень, Москва, Просвещение, 2013, рекомендованных Министерством образования и науки Российской Федерации.
Данный предмет учащиеся изучают после предмета химии в 8-9 классах, где они познакомились с важнейшими химическими понятиями, неорганическими и органическими веществами, применяемыми в промышленности и в повседневной жизни. На тему алкены в 10 классе отводится один час (урок).
Тема урока: Алкены: строение, изомерия, свойства, применение.
Цель урока: создать условия для формирования знаний об алкенах как классе непредельных углеводородов, об особенностях их электронного строения, изомерии, химических свойствах, способах получения и их применения.
Задачи урока
Обучающие: изучить алкены, развивая знания о кратной двойной связи между атомами углерода; рассмотреть изомерию и номенклатуру алкенов; изучить химические свойства алкенов, качественные реакции на П-связь, правило Марковникова, правило Зайцева познакомить учащихся с основными промышленными и лабораторными способами получения.
Развивающие: способствовать развитию логического мышления и интеллектуальных умений (анализировать, сравнивать, устанавливать причинно-следственные связи).
Воспитательные: продолжить формирование культуры умственного труда; коммуникационных навыков.
Тип урока: изучение нового материала.
Организационная форма: фронтальный опрос, беседа по проблемным вопросам, рефлексия.
Средства обучения: таблицы, химическое оборудование и реактивы, медиапроектор.
Программное обеспечение: компьютерная презентация к уроку.
Оборудование и реактивы:
Для демонстрации: штатив ученический с лапкой, пробирка, пробка с газоотводной трубкой, этиловый спирт, концентрированная серная кислота, спички, спиртовка, пробирка с раствором йода (имитация бромной воды) и пробирка с раствором перманганата калия КМnО4.
коллекции полимерных образцов полиэтилена с разной степенью полимеризации; портрет В.В.Марковникова.
Ход урока:
I. Организационный момент. (1 мин)
II. Постановка темы и учебной цели. (3 мин.)
(Стадия вызова ) СЛАЙД 2.
1) Выберите одно лишнее. Объясните свой выбор
1) пропан 2) пропен 3) циклопропан 4) бутан
2) Выберите одно лишнее. Объясните свой выбор.
1) СН3 — СН2 — СН2 – СН2 — СН3 2) Сh4 — CН — Сh4
Ch4
3) СН2=СН – СН3 4) Сh4 — CН — CН — Сh4
Ch4 Ch4
Учащиеся должны прийти к выводу, что изучать на уроке более подробно будем класс алкены. Так как это не первый класс углеводородов, который мы изучаем, то план изучения учащимся знаком. Исходя из строения, предполагаем, какие виды изомерии характерны для них. Прогнозируем, какими свойствами должны обладать данные углеводороды. Учащиеся работают в группах, изучая материал учебника , каждая группа работает над своей темой.
Так как это не первый класс углеводородов, который мы изучаем, то план изучения учащимся знаком. Исходя из строения, предполагаем, какие виды изомерии характерны для них. Прогнозируем, какими свойствами должны обладать данные углеводороды. Учащиеся работают в группах, изучая материал учебника , каждая группа работает над своей темой.
III. Изучение нового материала (стадия осмысления)
Работа в группах.(5 мин)
1 группа Изучить строение алкенов: выяснить тип гибридизации, геометрию молекулы, угол связи, длину двойной связи, схему образования двойной связи |
2 группа Выяснить возможные виды изомерии алкенов. Изомеры для С4Н8 |
3 группа Изучить химические свойства: реакции присоединения, реакции окисления, качественные реакции на п-связь. |
4 группа Рассмотреть способы получения алкенов: в лаборатории и промышленности. |
5 группа Применение алкенов. |
Выступление в группах корректируется с помощью презентации.
СЛАЙД 3. (5-6 мин)
Комментарии к презентации, запись уравнений реакций в тетрадях. (15мин.)
Строение СЛАЙД 4
Виды изомерии
Изомерия углеродного скелета СЛАЙД 5
С4Н8 СН2 = СН — СН2 – СН3 и Сh3 = C — Ch4
Ch4
Изомерия положения двойной связи СЛАЙД 6
С4Н8 СН2 = СН — СН2 – СН3 и СН3 — СН = СН – СН3
бутен-1 бутен-2
М
h3C
h3C
- ежклассовая изомерия (циклоалканы) СЛАЙД 7
С4Н8 СН2 = СН — СН2 – СН3
h3C
h3C
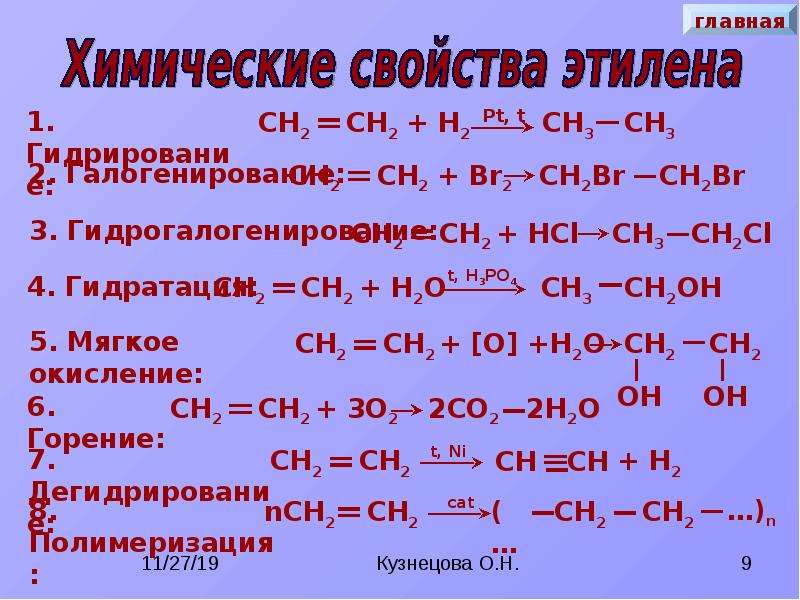
Химические свойства
Реакции присоединения: СЛАЙД 8
А) Гидрирование (присоединение водорода)
СН2=СН2 +Н2 → СН3-СН3
Б) Бромирование (присоединение брома).
Качественная реакция на П-связь.
СН2=СН2 +Br2 → СН2Br — СН2Br
В) Гидратация (присоединение воды) СЛАЙД 9
Правило Марковникова: «При взаимодействии галогеноводородов (воды) с несимметричными алкенами ион водорода присоединяется к наиболее гидрированному атому углерода, а галогенид-ио(гидроксид-ион) к наименее гидрированному атому углерода».
СН2 = СН – СН3 +h3O → СН3 — СН2OH– СН3
Г) Гидрохлорирование (присоединение хлороводорода)
СН2 = СН – СН3 + НСl → СН3 – СНСl – СН3
Д) Реакция полимеризации
(соединение множества одинаковых молекул) СЛАЙД 10
СН2=СН2 + СН2=СН2 + СН2=СН2 +…→ -СН2 — СН2 — СН2 — СН2 — СН2-СН2- … Этилен полиэтилен
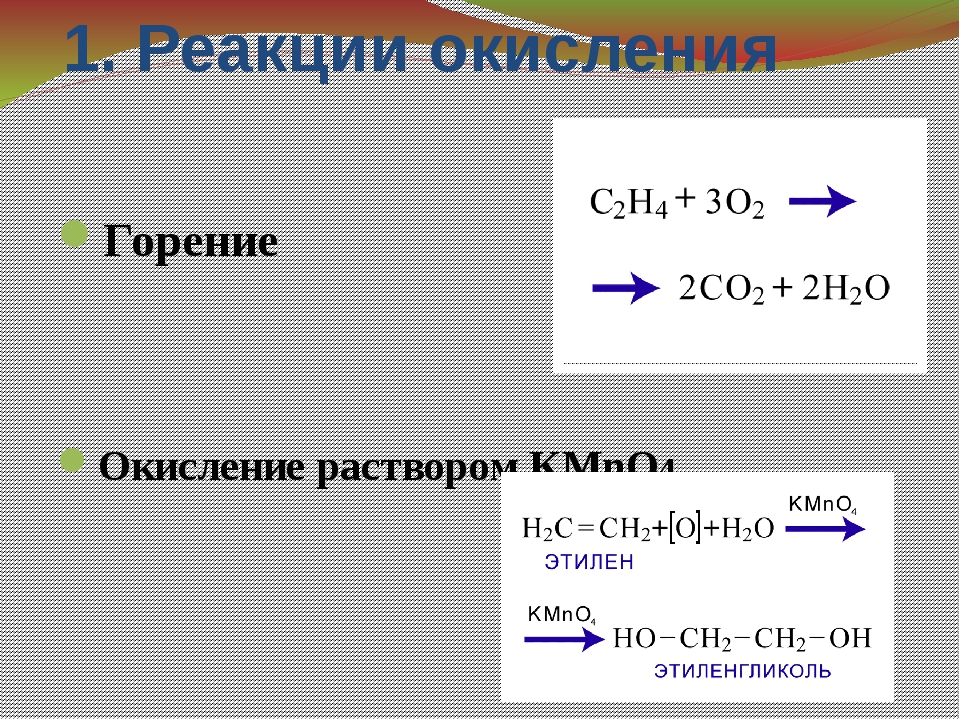
Реакции окисления СЛАЙД 11
А) Горение С2Н4+3О2 → 2СО2 +2Н2О
Б) Окисление перманганатом калия. Качественная реакция на П-связь.
Качественная реакция на П-связь.
СН2=СН2 + Н-ОН+[О] → Ch3 – Ch3
OH OH
Этиленгликоль (двухатомный спирт)
Получение.
В лаборатории. Демонстрационный эксперимент (получение этилена и взаимодействие с иодной водой (имитация бромной воды) и раствором перманганата калия.) Горение этилена.
СЛАЙД 12 Ch4 – Ch3 – OH Н2SO4 Ch3 = Ch3 + h3O
этиловый спирт
Правило Зайцева «При отщеплении галогеноводорода от вторичных и третичных галогеналканов атом водорода отщепляется от наименее гидрированного атома углерода»
СН3 – СН2 – СНBr – Ch4 + NaOH спирт СН3 – СН = СН – Ch4 + NaBr + h3O
В промышленности.
Крекинг алканов СЛАЙД 13
C8h28 → C4h20 + C4H8
алкан алкан алкен
C4h20 → C2H6 + C2h5
алкан алкан алкен
Применение СЛАЙД 14-16
Полиэтилен (демонстрация полиэтиленового пакета с надписями)
Пластмассы
Растворители
Получение этилового спирта (антисептик, получение каучука)
Получение ацетальдегида (органический синтез)
Получение антифризов, тормозных жидкостей
Получение горючего с высоким октановым числом
Для ускорения созревания фруктов (особое свойство этилена).
Закрепление (стадия размышления) . (10 мин)
Вариант 1.
Название вещества, формула которого СН3 – СН – СН = СН – СН3
СН3
А) 2 – метилпентен-3 В) 2 – метилпентен-2
Б) 2 – метилпентен-4 Г) 4 – метилпентен-2
2. Вещества, формулы которых СН2=СН2 и СН2=СН — СН2 –СН3
А) веществами разных классов В) гомологами
Б) одним и тем же веществом Г) изомерами
3. Продуктом реакции пропена с бромоводородом является
А) 1- бромпропан В) 1,2 – дибромпропан
В) 2 – бромпропан Г) 1,2,3 – трибромпропан
4. Реакции гидрирования соответствует схема
А) …+Н2О → С2Н5ОН Б) …+Н2 → С3Н8
В) … → С2Н4 + Н2 Г) … → С2Н4 + Н2О
5. Изомером вещества, формула которого СН2=СН — СН2 –СН3
А) 2- метилбутен – 2 В) бутан
Б) бутен – 2 Г) бутин — 1
6. Вещество, для которого характерна реакция гидрирования:
А) этилен В) бутан
Б) 2- метилпропан Г) пропан
Вариант 2.
Название вещества, формула которого СН3 – СН= С – СН2 – СН3
СН3
А) 2 – метилпентен-3 В) 3 – метилпентен-2
Б) 2 – метилпентен-4 Г) 3 – метилпентен-3
2. Вещества, формулы которых СН2=СН — СН3 и СН2=СН — СН2 –СН3
А) веществами разных классов В) гомологами
Б) одним и тем же веществом Г) изомерами
3. Продуктом реакции бутена-1 с хлороводородом является
А) 2- хлорбутан В) 1,2 – дихлорбутан
В) 1– хлорбутан Г) 1,2,3 – трихлорбутан
4. Реакции гидратации соответствует схема
А) …+Н2О → С2Н5ОН Б) …+Н2 → С3Н8
В) … → С2Н4 + Н2 Г) … → С2Н4 + Н2О
5. Изомером вещества, формула которого СН2=СН — СН2 –СН3
А) 2- метилбутан В) циклобутан
Б) бутан Г) бутин — 1
6. Вещество, для которого характерна реакция гидрирования:
А) 2- метилбутан В) пентан
Б) пропан Г) пропилен
Учащиеся проверяют друг у друга и ставят оценку
1 | 2 | 3 | 4 | 5 | 6 | |
В-1 | Г | В | В | Б | Б | А |
В-2 | В | В | А | А | В | Г |
Количество баллов | оценка |
6 | 5 |
5 | 4 |
3-4 | 3 |
2-1 | 2 |
Составить синквейн СЛАЙД 17
1. Этилен
Этилен
2.Непредельные, ненасыщенные
3.Горят, присоединяют, окисляют
4. Сырье для производства полиэтилена
5.Алкен.
Рефлексия СЛАЙД 18
1 Сегодня я узнал…
2.Было трудно…
3.Было интересно…
4.Я почувствовал, что…
5. Урок мне дал для жизни…
Домашняя работа. СЛАЙД 19
§-9-10.
Найти молекулярную формулу алкена, относительная плотность которого по кислороду равна 2,19. Составить изомеры и назвать.
Осуществить превращения:
С3Н8 → С2Н4 → С2Н5Br → C2h5 → C2H5OH → CO2
Подготовить сообщение — презентацию о применении этилена и его гомологов.
Литература и интернет-ресурсы:
1. Рудзитис Г. Е., Фельдман Ф. Г. Химия. 10 класс. М.:Просвещение,2013
2. Кузнецова Н. Е., Титова И. М., Гара Н. Н. Химия. 10 класс. М.: Издательский центр “Вентана-Граф”, 2005.
3. Картинки
https://yandex.ru/images/search ?source=wiz&img_url=http%3A%2F%2Fmognovse. ru%2Fmogno%2F662%2F661371%2F661371_html_45d6615a.png&p=14&text=%D1%81%D1%82%D1%80%D0%BE%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%B0%D0%BB%D0%BA%D0%B5%D0%BD%D0%BE%D0%B2%20%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD%D0%BA%D0%B8&noreask=1&pos=294&rpt=simage&lr=10942
ru%2Fmogno%2F662%2F661371%2F661371_html_45d6615a.png&p=14&text=%D1%81%D1%82%D1%80%D0%BE%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%B0%D0%BB%D0%BA%D0%B5%D0%BD%D0%BE%D0%B2%20%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD%D0%BA%D0%B8&noreask=1&pos=294&rpt=simage&lr=10942
https://yandex.ru/images/search ?source=wiz&img_url=http%3A%2F%2Fwww.rawpedagogy.ru%2Fimages%2Fbooks%2F389%2Fimage043.png&p=8&text=%D1%81%D1%82%D1%80%D0%BE%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%B0%D0%BB%D0%BA%D0%B5%D0%BD%D0%BE%D0%B2%20%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD%D0%BA%D0%B8&noreask=1&pos=176&rpt=simage&lr=10942
Презентация алкены: строение, свойства, применение
PPT / 1.91 Мб
13.1: Алкены — структуры и названия
Цели обучения
- Называть алкены по данным формулам и писать формулы для алкенов по именам.
Как отмечалось ранее, алкены представляют собой углеводороды с двойными связями углерод-углерод (R 2 C = CR 2 ), а алкины представляют собой углеводороды с тройными связями углерод-углерод (R – C≡C – R).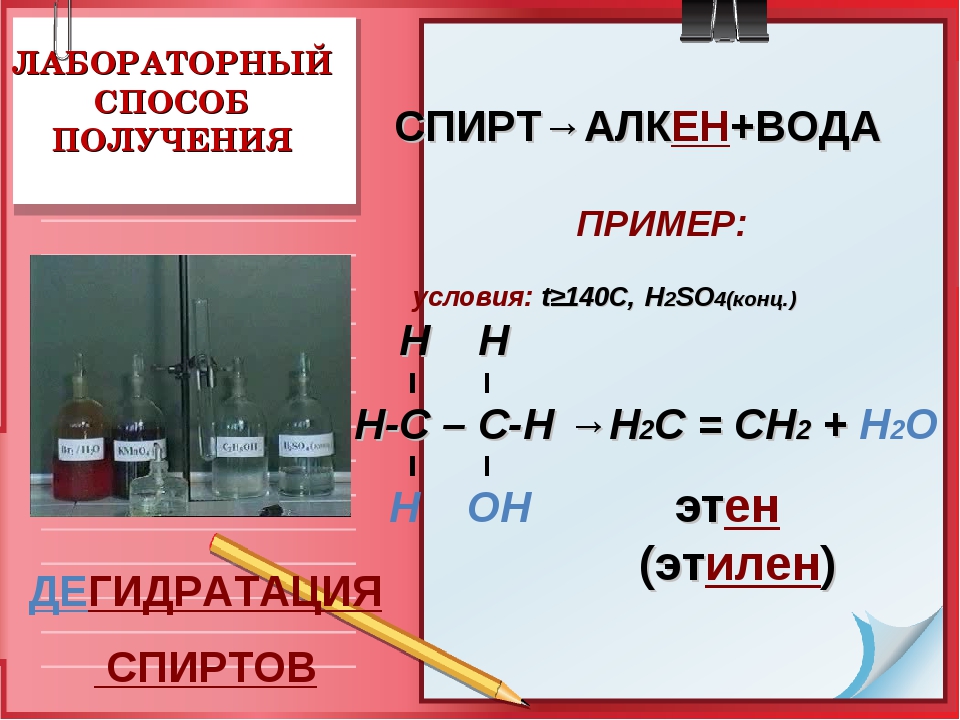 В совокупности они называются ненасыщенными углеводородами, потому что в них меньше атомов водорода, чем в алканах с таким же числом атомов углерода, как указано в следующих общих формулах:
В совокупности они называются ненасыщенными углеводородами, потому что в них меньше атомов водорода, чем в алканах с таким же числом атомов углерода, как указано в следующих общих формулах:
Некоторые типичные алкены — их названия, структуры и физические свойства — приведены в Таблице \ (\ PageIndex {1} \).
| Название ИЮПАК | Молекулярная формула | Концентрированная структурная формула | Температура плавления (° C) | Температура кипения (° C) |
|---|---|---|---|---|
| этен | С 2 В 4 | CH 2 = CH 2 | –169 | –104 |
| пропен | С 3 В 6 | CH 2 = CHCH 3 | –185 | –47 |
| 1-бутен | К 4 В 8 | Канал 2 = Канал 2 Канал 3 | –185 | –6 |
| 1-пентен | С 5 В 10 | CH 2 = CH (CH 2 ) 2 CH 3 | –138 | 30 |
| 1-гексен | С 6 В 12 | CH 2 = CH (CH 2 ) 3 CH 3 | –140 | 63 |
| 1-гептен | К 7 В 14 | CH 2 = CH (CH 2 ) 4 CH 3 | –119 | 94 |
| 1-октен | К 8 В 16 | CH 2 = CH (CH 2 ) 5 CH 3 | –102 | 121 |
Мы использовали только сокращенные структурные формулы в таблице \ (\ PageIndex {1} \). Таким образом, CH 2 = CH 2 означает
Таким образом, CH 2 = CH 2 означает
Двойная связь является общей для двух атомов углерода и не включает атомы водорода, хотя сжатая формула не делает этот момент очевидным. Обратите внимание, что молекулярная формула для этена — C 2 H 4 , а для этана — C 2 H 6 .
Первые два алкена в таблице \ (\ PageIndex {1} \), этен и пропен, чаще всего называют их общими названиями — этилен и пропилен, соответственно (рисунок \ (\ PageIndex {1} \)).Этилен является основным коммерческим химическим веществом. Химическая промышленность США производит около 25 миллиардов килограммов этилена ежегодно, больше, чем любое другое синтетическое органическое химическое вещество. Более половины этого этилена идет на производство полиэтилена, одного из самых известных пластиков. Пропилен также является важным промышленным химическим веществом. Он превращается в пластмассы, изопропиловый спирт и множество других продуктов.
Хотя существует только один алкен с формулой C 2 H 4 (этен) и только один с формулой C 3 H 6 (пропен), существует несколько алкенов с формулой C 4 Н 8 .
Вот несколько основных правил наименования алкенов от Международного союза чистой и прикладной химии (IUPAC):
- Самая длинная цепь из атомов углерода , содержащая двойную связь , считается родительской цепью.Он назван с использованием той же основы, что и алкан, имеющий такое же количество атомов углерода, но оканчивается на — ен , чтобы идентифицировать его как алкен. Таким образом, соединение CH 2 = CHCH 3 представляет собой пропен .
- Если в цепи четыре или более атомов углерода, мы должны указать положение двойной связи.
 Атомы углерода пронумерованы так, что первый из двух, которые связаны двойной связью, получает меньшее из двух возможных номеров. Например, соединение CH 3 CH = CHCH 2 CH 3 имеет двойную связь. между вторым и третьим атомами углерода.Его называют 2-пентеном (а не 3-пентеном).
Атомы углерода пронумерованы так, что первый из двух, которые связаны двойной связью, получает меньшее из двух возможных номеров. Например, соединение CH 3 CH = CHCH 2 CH 3 имеет двойную связь. между вторым и третьим атомами углерода.Его называют 2-пентеном (а не 3-пентеном). - Группы заместителей названы так, как у алканов, и их положение обозначено числом. Таким образом, приведенная ниже структура представляет собой 5-метил-2-гексен. Обратите внимание, что нумерация родительской цепи всегда выполняется таким образом, чтобы дать двойной связи наименьшее число, даже если это приводит к тому, что заместитель имеет более высокий номер. Двойная связь всегда имеет приоритет при нумерации.
Пример \ (\ PageIndex {1} \)
Назовите каждое соединение.
Решение
- Самая длинная цепь, содержащая двойную связь, имеет пять атомов углерода, поэтому соединение представляет собой пентен (правило 1).
 Чтобы дать первому атому углерода двойной связи наименьшее число (правило 2), мы нумеруем слева, так что соединение представляет собой 2-пентен. У четвертого атома углерода есть метильная группа (правило 3), поэтому название соединения — 4-метил-2-пентен.
Чтобы дать первому атому углерода двойной связи наименьшее число (правило 2), мы нумеруем слева, так что соединение представляет собой 2-пентен. У четвертого атома углерода есть метильная группа (правило 3), поэтому название соединения — 4-метил-2-пентен. - Самая длинная цепь, содержащая двойную связь, имеет пять атомов углерода, поэтому исходным соединением является пентен (правило 1).Чтобы дать первому атому углерода двойной связи наименьшее число (правило 2), мы нумеруем слева, так что соединение представляет собой 2-пентен. У третьего атома углерода есть метильная группа (правило 3), поэтому название соединения — 3-метил-2-пентен.
Упражнение \ (\ PageIndex {1} \)
Назовите каждое соединение.
Так же, как есть циклоалканы, существует циклоалкена .Эти соединения названы как алкены, но с префиксом цикло — присоединенным к началу имени исходного алкена.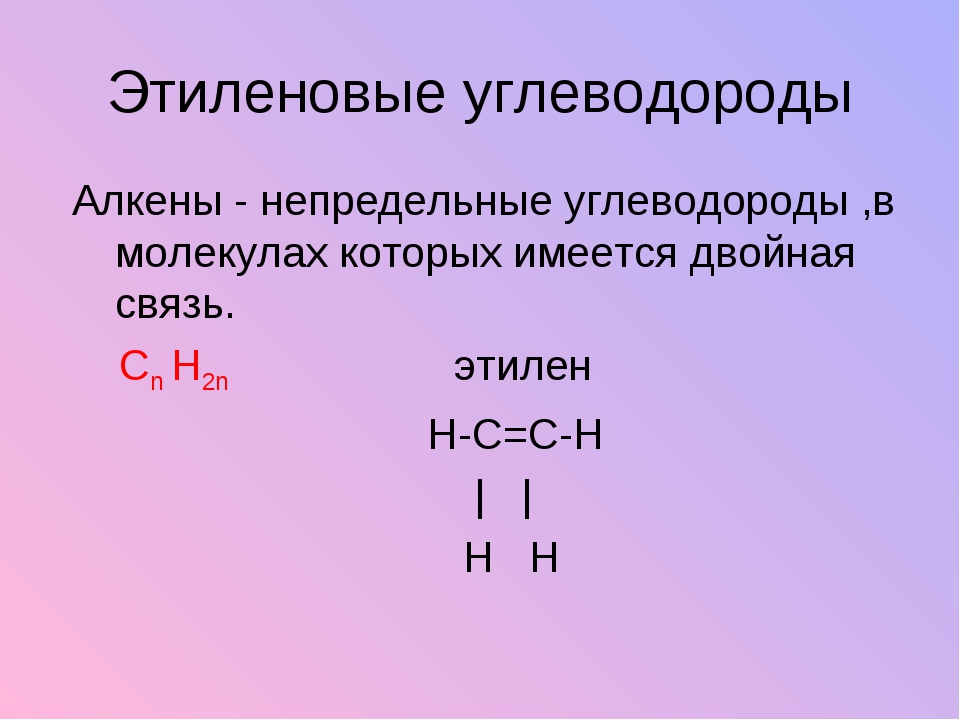
Пример \ (\ PageIndex {2} \)
Изобразите структуру каждого соединения.
- 3-метил-2-пентен
- циклогексен
Решение
- Сначала напишите родительскую цепочку из пяти атомов углерода: C – C – C – C – C. Затем добавьте двойную связь между вторым и третьим атомами углерода:
Теперь поместите метильную группу на третий атом углерода и добавьте достаточно атомов водорода, чтобы у каждого атома углерода было четыре связи.
- Во-первых, подумайте, что означает каждая из трех частей имени. Cyclo означает кольцевое соединение, гекс, означает 6 атомов углерода и — ен означает двойную связь.
Упражнение \ (\ PageIndex {2} \)
Изобразите структуру каждого соединения.
- 2-этил-1-гексен
- циклопентен
Упражнения по обзору концепции
Кратко опишите важные различия между насыщенным углеводородом и ненасыщенным углеводородом.

Кратко опишите важные различия между алкеном и алканом.
Классифицируйте каждое соединение как насыщенное или ненасыщенное. Идентифицируйте каждый как алкан, алкен или алкин.
- Канал 3 Канал 2 Канал 3
Ответы
Ненасыщенные углеводороды имеют двойные или тройные связи и обладают высокой реакционной способностью; насыщенные углеводороды имеют только одинарные связи и довольно инертны.
Алкен имеет двойную связь; алкан имеет только одинарные связи.
- насыщенный; алкан
- ненасыщенный; алкин
- ненасыщенный; алкен
Ключевые вынос
- Алкены — это углеводороды с двойной связью углерод-углерод.

ответы
- 2-метил-1-пентен
- 2-метил-2-пентен
- 2,5-диметил-2-гексен
Что такое алкен в химии?
Что такое алкены и примеры? Какова общая формула алкена?Алкенес
- Алкены образуют еще одно семейство углеводородов.
- Общая формула для семейства алкенов: C n H 2n , , где n = 2, 3, 4,…
- Алкены — это ненасыщенные углеводороды. Каждый алкен имеет двойную связь углерод-углерод .
- Двойная связь углерод-углерод является функциональной группой семейства алкенов.
- Функциональная группа — это группа атомов, которая определяет химические свойства органической молекулы.

- Следовательно, двойная связь определяет химические реакции алкенов.
Обозначение алкенов
- Присвоение названий алкенам следует тем же правилам IUPAC, которые используются для наименования алканов. Однако необходимо указать наличие и расположение двойной связи углерод-углерод.
- Название алкена с прямой цепью состоит из двух составляющих:
- Определение корневого имени:
- Определите самую длинную непрерывную углеродную цепь, содержащую двойную связь.
- Подсчитайте количество атомов углерода в этой цепочке.
- Назовите его соответствующим образом.
- Определение концовки:
- Используйте окончание -ene для обозначения семейства алкенов.
- Пронумеруйте атомы углерода в самой длинной цепи. Начните нумерацию с конца ближе к двойной связи.
- Определите расположение двойной связи, используя номер первого атома углерода в двойной связи.
- Поместите число перед окончанием -ene.
- Для молекул, содержащих более трех атомов углерода, необходимо указать положение двойной связи.
- Пример показывает используемый метод.
Пример наименования алкенов
Назовите молекулу алкена со структурой, приведенной ниже.
Решение:
- Определите самую длинную углеродную цепь, содержащую двойную связь.
- Подсчитайте количество атомов углерода в самой длинной цепочке.
Число атомов углерода = 6 - Укажите имя корня.
Имя корня: hex- - Определите семейство молекулы.
Семейство: алкен
Окончание: -ене - Пронумеруйте атомы углерода от конца, ближайшего к двойной связи. Дайте двойной связи меньшее число.
Положение двойной связи: 1-ен - Завершите название молекулы алкена.
Название алкена: гекс-1-ен
Люди тоже спрашивают
Какова структура алкена?Структурные формулы алкенов
Первым членом семейства алкенов является этен, C 2 H 4 .Модель молекулы этена показана на фотографии.
Второй член, пропен, C 3 H 6 , получают следующим образом.
Используя аналогичные шаги, можно получить структурные формулы других членов семейства алкенов.
В таблице приведены названия и молекулярные формулы первых девяти алкенов с прямой цепью.
В таблице приведены структурные формулы первых четырех алкенов с прямой цепью.
Физические свойства алкенов
По своим физическим свойствам алкены аналогичны свойствам алканов.
В таблице приведены некоторые физические свойства алкенов.
- Точки плавления и кипения
(a) Алкены имеют низкие точки плавления и кипения. Это связано с тем, что для преодоления слабых межмолекулярных сил притяжения между простыми молекулами алкена требуется меньше энергии.
(b) По мере увеличения числа атомов углерода в молекуле размер молекулы увеличивается, а межмолекулярная сила усиливается. Чтобы преодолеть более сильные силы притяжения, требуется больше энергии. Следовательно, точки плавления и кипения алкенов увеличиваются на с увеличением числа атомов углерода в молекуле.
(c) В комнатных условиях первые три алкена, этен, пропен и бутен, являются газами. Те, которые содержат пять или более атомов углерода, являются жидкостями или твердыми телами. - Плотность
(a) Алкены имеют низкие плотности . Жидкие и газообразные алкены менее плотны, чем вода.
(b) Плотность алкенов увеличивается на с увеличением числа атомов углерода в молекуле. - Растворимость в воде
(a) Алкены не растворяются в воде , но растворимы в органических растворителях.
(b) При смешивании с водой жидкие алкены образуют маслянистый слой, плавающий на поверхности воды. - Электропроводность
Алкены не могут проводить электричество. Алкены состоят из нейтральных молекул. У него нет подвижных ионов или электронов, чтобы проводить электричество.
Алкены химически более активны, чем алканы, потому что двойные углерод-углеродные связи более активны, чем одинарные углерод-углеродные связи. Почти все реакции алкенов протекают по двойным связям.
Реакция горения
- Алкены полностью сгорают в избытке кислорода с образованием диоксида углерода, и воды. Полное сгорание этена показано следующим уравнением.
- Однако алкены горят более тёплым пламенем, чем алканы. Это потому, что алкены имеют более высокий процент углерода в своих молекулах, чем алканы. Уравнения неполного сгорания этена показывают, что образуются окись углерода и сажа (углерод).
Реакции присоединения
- Реакция присоединения — это реакция, в которой атомы или группы атомов присоединяются к каждому атому углерода двойной связи углерод-углерод с образованием единого продукта.
- Добавление водорода
(a) Этен реагирует с водородом при 180 ° C в присутствии никеля или платинового катализатора с образованием этана. Этот процесс называется каталитическим гидрированием .
(b) Реакция гидрирования используется для
(i) превращения ненасыщенного соединения в насыщенное соединение.
(ii) получают алкан из алкена. - Добавление галогенов
(a) Галогенирование — добавление галогенов к алкенам. Хлор, бром и йод легко реагируют с алкенами. Никакого катализатора или ультрафиолета не требуется.
(b) Например, когда этен барботируют через раствор брома в воде или тетрахлорметан в темноте, красно-коричневый бром обесцвечивается и образуется бесцветная жидкость, 1,2-дибромэтан.
(c) Следовательно, бромная вода является реагентом, используемым в качестве теста на наличие двойной связи углерод-углерод в органических молекулах.
(d) Пропен реагирует с хлором с образованием 1,2-дихлорпропана. - Добавление галогенидов водорода
(a) Галогениды водорода легко присоединяются по двойной связи в алкенах. Реакция протекает быстро при комнатной температуре и не требует катализатора.
(b) Галогениды водорода, которые реагируют с алкенами, включают хлористый водород, бромистый водород и йодоводород.
(c) Этен реагирует с хлористым водородом с образованием хлорэтана в соответствии с приведенным ниже уравнением.
(d) Добавление галогенидов водорода к пропену может привести к образованию двух возможных продуктов. Например, в реакции бромистого водорода с пропеном можно ожидать двух продуктов, 1-бромпропана или 2-бромпропана, в зависимости от того, присоединен ли атом брома из бромистого водорода к углероду 1 или углероду 2.
(e) В В указанной выше реакции основным продуктом является 2-бромпропан.Также образуется меньшее количество альтернативного 1-бромпропана. - Добавление воды
(a) Алкены не реагируют с холодной водой в обычных условиях. Когда смесь алкена и водяного пара проходит над катализатором, молекула воды добавляется к двойной связи углерод-углерод с образованием спирта .
(b) Добавление воды к алкену называется гидратацией . Примером является добавление воды к этену для получения этанола. - Добавление гидроксильных групп
(a) Когда алкен обрабатывают разбавленным подкисленным раствором манганата калия (VII), к бромпропану по двойной связи добавляются две гидроксильные группы.Продукт представляет собой бесцветное органическое соединение, называемое диолом .
(b) Этен реагирует с разбавленным подкисленным раствором манганата (VII) калия с образованием продукта, называемого этан-1,2-диолом.
(c) Этен обесцвечивает пурпурный раствор подкисленного манганата калия (VII).
(d) Подкисленный раствор манганата (VII) калия можно использовать в качестве реагента для теста на наличие двойной связи углерод-углерод.
Реакция полимеризации
- Небольшие молекулы алкена легко вступают в реакцию присоединения друг с другом.Сотни или тысячи молекул алкена соединяются вместе, образуя длинные цепи, называемые полимерами .
- Этот тип реакции образования полимера из мономеров алкена называется аддитивной полимеризацией .
- Полимеризация этена осуществляется путем нагревания этена при температуре около 200 ° C и давлении 1200 атм в присутствии следов кислорода. Реакция представлена на рисунке.
- Поли (этен), также известный под торговым названием полиэтилен, является наиболее часто используемым синтетическим полимером.Он используется для изготовления пленки и пленки для пакетов и обертки, а также для изготовления формованных изделий, таких как игрушки, бутылки и выдавливаемые бутылки.
Карта реакций для этена
Свойства алканов и алкенов
- И алканы, и алкены имеют почти одинаковые физические свойства, а именно:
(a) Имеют низкие температуры плавления и кипения
(b) Имеют физическое состояние, которое меняется от газа к жидкости, а затем к твердому веществу
(c) Имеют низкую плотность
(d) Нерастворим в воде, но растворим в органических растворителях
(e) Не может проводить электричество ни в каком состоянии - Что касается физических свойств, таких как точка плавления, точка кипения, плотность и физическое состояние, они постепенно увеличиваются из-за увеличения числа атомов углерода в молекуле.
- Однако оба имеют разные химические свойства из-за наличия двойных связей C = C в алкенах.
Таблица: Алканы и алкены имеют разные химические свойства
| Химические свойства | Отличия | |
| Алканы | Алкенес | |
| Реакционная способность |
|
|
| Реакция с кислородом |
|
|
| Реакция с бромом |
| |
| Реакция с подкисленным раствором манганата (VII) калия |
| |
Цель: Сравнить химические свойства алканов и алкенов.
Аппарат: Фарфоровая посуда, капельница, пробирки, горелка Бунзена.
Материалы: Гексан, гексен, бром в 1,1,1-трихлорэтане, 0,1 моль дм -3 Раствор манганата (VII) калия, разбавленная серная кислота, деревянная шина, фильтровальная бумага.
А. Реакция с кислородом.
Процедура:
- Около 1 см 3 гексана и 1 см 3 гексена помещают в две отдельные фарфоровые чашки.
- Деревянная шина с подсветкой используется для воспламенения двух жидкостей.
- Наблюдается и регистрируется сажистость пламени от двух горящих углеводородов.
- Кусок фильтровальной бумаги удерживается над каждым пламенем в обеих чашках, как показано на рисунке.
- Количество сажи, собранной на двух листах фильтровальной бумаги, фиксируется и регистрируется.
Б. Реакция с бромом
Процедура:
- Около 2 см 3 гексана наливают в пробирку.
- К гексану добавляют 2–3 капли брома в 1,1,1-трихлорэтане. Смесь взбалтывают.
- Любые происходящие изменения отмечаются и записываются.
- Шаги с 1 по 3 повторяются с использованием гексена вместо гексана.
C. Реакция с подкисленным раствором манганата (VII) калия
Процедура:
- Около 2 см 3 разбавленного раствора манганата калия (VII) наливают в пробирку.
- Добавляется около 2 см 3 разбавленной серной кислоты.Смесь взбалтывают.
- К подкисленному раствору манганата калия (VII) добавляют около 2 см 3 гексана. Смесь взбалтывают.
- Любые происходящие изменения отмечаются и записываются.
- Шаги с 1 по 4 повторяются с использованием гексена вместо гексана.
Наблюдения:
| Реакция | Наблюдение | |
| Гексан | гексен | |
| Реакция с кислородом | Гексан горит желтым, покрытым сажей пламенем. | Гексен горит желтым и очень закопченным пламенем. |
| Реакция с бромом | Без видимых изменений. | Гексен обесцвечивает красно-коричневый бром. |
| Реакция с подкисленным раствором манганата (VII) калия | Без видимых изменений. | Гексен обесцвечивает пурпурный раствор подкисленного манганата (VII) калия. |
Обсуждение:
- Гексан, C 6 H 14 является членом семейства алканов, тогда как гексен, C 6 H 12 принадлежит к семейству алкенов.
- И гексан, и гексен не полностью горят на воздухе из-за сажистого пламени. Это связано с тем, что оба углеводорода содержат высокий процент углерода по массе. Кроме того, воздух содержит только 21% кислорода.
Гексен горит более сажистым пламенем по сравнению с гексаном, поскольку в нем намного больше углерода. - Гексан — это неактивный углеводород, который не реагирует с бромной водой или подкисленным раствором манганата (VII) калия.
- Гексен — реактивный углеводород. Обесцвечивает красно-коричневый бром в результате реакции присоединения.
Он также обесцвечивает пурпурный подкисленный манганат калия (VI) с образованием диола.
Заключение:
Алканы и алкены имеют разные химические свойства.
Введение алкена гидрида магния и каталитическое гидросилилирование
Димерный гидрид β-дикетиминато магния, [(BDI) MgH] 2 , реагирует при 80 ° C с концевыми алкенами, 1-гексеном, 1-октеном, 3-фенил-1-пропеном и 3,3 -диметилбутен с получением соответствующих металлоорганических соединений n, -гексила, n, -октила, 3-фенилпропила и 3,3-диметилбутилмагния.Простота проведения и региональное различение этих реакций в значительной степени зависят от стерических требований алкенового реагента. Реакции с фенилзамещенными алкенами, стиролом и 1,1-дифенилэтилом требуют более высокой температуры 100 ° C со стиролом, обеспечивающим смесь 2-фенилэтильных и 1-фенилэтильных продуктов в течение 7 дней. Хотя реакция с 1,1-дифенилэтеном дает 1,1-дифенилэтиловое производное магния в качестве единственного продукта реакции, конверсия только 64% была достигнута в течение 21 дня.Реакции с α, ω-диенами, 1,5-гексадиеном и 1,7-октадиеном дали разные результаты. Исходный продукт реакции 5-алкенилмагния диена с более короткой цепью подвергается 5- экзо -запуск циклизации через внутримолекулярное карбомагнирование с образованием циклопентилметильного производного, которое, как показал рентгеноструктурный анализ, существует в виде трехкоординатного мономера. . Напротив, 1,7-октадиен представляет собой смесь двух соединений, производного окт-7-ен-1-ила магния и димагний-октан-1,4-диида в результате однократной или двукратной активации концевые двойные связи CC.Гидрид магния не реагирует с внутренними алкенами, за исключением напряженного бицикла, норборнена, что позволяет охарактеризовать полученное трехкоординированное производное норборнила магния с помощью рентгеноструктурного анализа. Вычислительный анализ реакции между [(BDI) MgH] 2 и 1-гексеном с использованием теории функционала плотности (DFT) показал, что начальный процесс внедрения Mg – H / CC определяет скорость и происходит в неповрежденном гидриде магния. димер. Эта экзотермическая реакция (Δ H = -14.1 ккал моль -1 ) преодолевает барьер в 18,9 ккал моль -1 и приводит к разрыву биядерной структуры на молекулы алкила и гидрида магния. Хотя последнее трехкоординатное гидридное производное может быть склонно к редимеризации, оно также может обеспечивать дополнительный путь к алкильным соединениям магния посредством его прямой реакции с дополнительным эквивалентом 1-гексена, которая происходит через более низкий барьер в 15,1 ккал моль. -1 .Эта реакционная способность внедрения Mg-H / CC обеспечивает основу для каталитического гидросилилирования концевых алкенов с помощью PhSiH 3 , которое протекает с предпочтительным образованием антимарковниковского органосиланового продукта. Дальнейшие расчеты методом DFT показывают, что каталитическая реакция основана на последовательности внедрения Mg – H / CC и классических реакций метатезиса σ-связей Si – H / Mg – C, последняя из которых с высотой барьера 24,9 ккал моль −1 , как оказалось, является определяющим фактором.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Химические свойства алкенов
Алкены — представители семейства углеводородов
В органической химии мы изучаем различные типы соединений, образованных из атома углерода. На основе связывания органические соединения бывают трех типов: алканы (одинарная связь), алкены (двойные связи) и алкины (тройные связи). Когда между атомом углерод-углерод существует одинарная связь, он образует алканы (C-C). Когда между атомом углерод-углерод существует двойная связь, образуются алкены (C = C).Если он имеет тройную связь между углерод-углеродным атомом, то это алкины (C≡C). Большое количество круговых связей присутствует в алканах, которые прочно удерживаются, благодаря чему они проявляют различные химические свойства.
Химические свойства алкенов
Одинарная связь> Двойная связь> Тройная связь
Алкены существуют во всех трех состояниях твердое-жидкое и газообразное.
Алкены менее растворимы в воде из-за слабых сил Ван-Дер-Вааля
Температура кипения алкенов зависит от молекулярной структуры, чем длиннее будет молекулярная цепь, тем выше будет ее точка кипения.
Функциональные группы отвечают за полярность алкенов.
Реакции алканов
Ненасыщенные соединения алкенов обладают высокой реакционной способностью. Они образуют двойную связь между углерод-углеродными атомами, что делает их менее стабильными из-за слабо удерживаемых пи-связей.
Добавление галогенов
Алкеновая группа реагирует с галогенами, такими как бром, хлор, за исключением йода, поскольку это исключение, и он не реагирует в нормальных условиях.Когда алкеновая группа реагирует с бромом, тогда бром уменьшает свой красновато-оранжевый цвет из-за добавления длинной цепи ненасыщенного углерода.
Для проверки наличия ненасыщенности в растворе он реагирует с бромом, если бром теряет свой красновато-коричневый цвет в растворе четыреххлористого углерода, тогда в растворе присутствует участок ненасыщенности.
Эти типы реакций называются электрофильными реакциями. Одна из электрофильных реакций выглядит следующим образом:
[Изображение будет загружено в ближайшее время]
Добавление воды
Эти реакции следуют правилу Марковникова, согласно которому при взаимодействии воды с алкеновой группой происходит образование спиртов i .е (ОН) функциональную группу, и реакция протекает в присутствии серной кислоты.
Реакция алкена с водой выглядит следующим образом:
[Изображение будет загружено в ближайшее время]
Добавление галогенидов водорода к алкенам
Когда галогениды водорода вступают в реакцию с алкильной группой, они образуют алкилгалогениды. Алкилгалогениды образуются с помощью двух правил: одного правила Марковникова и другого правила Антимарковникова.
Порядок реактивности галогенов:
HI> HBr> HCL
Согласно правилу Марковникова:
Когда галогениды водорода добавляются с несимметричной алкильной группой, тогда молекула или отрицательная часть, которая должна быть добавлена к углеродной цепи присоединяется к атому углерода, к которому присоединяется наименьшее количество атомов водорода.
[Изображение будет загружено в ближайшее время]
Согласно Правилу Анти-Раскольникова:
Когда галогениды водорода вступают в реакцию с несимметричной алкильной группой в присутствии пероксида, полученный продукт противоречит правилу Марковникова. Молекулы, которые необходимо добавить к углеродной цепи, присоединяются к атому углерода, который присоединен к большему количеству атомов водорода.
[Изображение будет загружено в ближайшее время]
Добавление дигидрогена
Когда алкеновые группы вступают в реакцию с одной молекулой дигидрогена i.Если одна двухатомная молекула водорода, то эта реакция приводит к образованию алканов в присутствии различных типов катализаторов, таких как палладий, никель, кобальт или платина.
Катализатор, добавленный в реакцию, приводит к увеличению скорости реакции, или мы можем сказать, что они помогают ускорить реакцию, не влияя на термодинамику реакции.
Реакция окисления
[Изображение будет загружено в ближайшее время]
Окисление перманганатом калия: — Еще одна реакция, используемая для проверки наличия ненасыщенности в растворе.В этой реакции алкены реагируют с реагентом Байера, то есть с холодным разбавленным KMnO 4 , и в результате образуются вицинальные гликоли. Кроме того, розовый цвет KMnO 4 также блекнет. Следовательно, эта реакция также может быть предпочтительной для проверки наличия сайта ненасыщенности.
[Изображение будет загружено в ближайшее время]
Озонолиз
Еще одно важное химическое свойство алкеновых соединений, которое при добавлении озона или трех молекул приводит к образованию озона, при восстановлении которого цинковой пылью и водой образуются альдегиды и кетоны соответственно.Эта реакция также рассматривается как способ получения альдегидов и кетонов.
[Изображение будет скоро загружено]
Реакция окисления и озонолиз заметно проявляются в химических свойствах алканов
Органические химические вещества: алканы, алкены и ацетилены
1,1,2,2-Тетраметилциклопропан, 99%
1,13-Тетрадекадиен, 90 +%
1,1,4,4-Тетрафенил-1,3-бутадиен, 99%
1,1′-Бинафтил, 98%
1,1-Дифенилэтилен, 98%
1,1-дифенилгексан, 98%
1,1-дифенилпентан, 97%
1,1-дифенилпропан, 98 +%
1,2,3,4,5-Пентаметилциклопентадиен, 94%
1,2,3,4-Тетрагидронафталин, 97%
1,2,3,4-Тетраметилбензол, 95%
1,2,4,5-Тетраметилбензол, 97 +%
1,2,4-триметилбензол, 98%
1,2-бис (1-нафтил) этан, 97%
1,2-ди (3-инденил) этан, 98%
1,2-диэтилбензол, 97%
1,2-Диметилнафталин, 98%
1,2-дифенилциклопропан, цис + транс, 97%
1,2-дифенилэтан, 98 +%
1,2-ди (п-толил) этан, 98%
1- (2-Фенилэтил) -4- (фенилэтинил) бензол, 97%
1,3,5,5-Тетраметил-1,3-циклогексадиен, 94%
1,3,5,7-Циклооктатетраен, 98%, стаб.с 0,1% гидрохиноном
1,3,5-Триэтилбензол, 95%
1,3,5-Триэтинилбензол, 98%
1,3,5-Триизопропилбензол, 95%
1,3,5-Трифенилбензол, 99 +%
1,3,5-Три-трет-бутилбензол, 97 +%
1,3-Циклогексадиен, 96%, стаб.с 0,1% BHT
1,3-Циклооктадиен, 97%
1,3-диэтилбензол, 97 +%
1,3-Диизопропилбензол, 96%
1,3-Диизопропилциклогексан, цис + транс, 97 +%
1,3-дифенилпропан, 98%
1,3-ди-трет-бутилбензол, 99%
1,4,6,7-Тетраметилнафталин, 98%
1,4-Бис (2-метилстирил) бензол, 99%
1,4-бис (фенилэтинил) бензол, 97%
1,4-Циклогексадиен, 97% стаб.с 0,1% BHT
1,4-Дициклогексилбензол, 99%
1,4-диэтилбензол, 98%
1,4-диизопропилбензол, 98%
1,4-диизопропилциклогексан, цис + транс, 98%
1,4-ди-н-бутилбензол, 97 +%
1,4-дифенилбутадиин, 99%
1,4-ди-трет-бутилбензол, 98%
1,4-гексадиен, цис + транс, 99%
1,5,9,13-Тетрадекатетраен, 95%
1,5,9-декатриен, цис + транс, 97%
1,5-Диметилнафталин, 99%
Алкенов — Энциклопедия Нового Света
Химическая структура этилена, простейшего алкена.В органической химии алкен , олефин , олефин или представляет собой ненасыщенное химическое соединение, содержащее по крайней мере одну двойную связь углерод-углерод. Простейшие алкены с одной двойной связью и без других функциональных групп образуют гомологический ряд углеводородов с общей формулой C n H 2n .
Простейшим алкеном является этилен (C 2 H 4 ), которому Международный союз теоретической и прикладной химии (IUPAC) присвоил название этен. Алкены также называют олефинами, (архаичный синоним, широко используемый в нефтехимической промышленности) или виниловыми соединениями.
Конструкция
Форма
Согласно модели VSEPR отталкивания электронных пар, молекулярная геометрия алкенов включает валентные углы вокруг каждого углерода в двойной связи около 120 градусов. Угол может меняться из-за стерической деформации, вносимой несвязанными взаимодействиями, создаваемыми функциональными группами, присоединенными к атомам углерода двойной связи.Например, валентный угол C-C-C в пропилене составляет 123,9 градуса. Двойная связь алкена сильнее, чем одинарная ковалентная связь, а также короче со средней длиной связи 133 пикометра.
Молекулярная геометрия
Подобно одинарным ковалентным связям, двойные связи могут быть описаны в терминах перекрывающихся атомных орбиталей, за исключением того, что, в отличие от одинарной связи (которая состоит из одинарной сигма-связи), двойная связь углерод-углерод состоит из одной сигма-связи и одной пи-связи.
Каждый углерод двойной связи использует свои три гибридных орбитали sp 2 для образования сигма-связей с тремя атомами.Негибридизованные атомные орбитали 2p , которые лежат перпендикулярно плоскости, созданной осями трех гибридных орбиталей sp 2 , объединяются, образуя пи-связь.
Поскольку для разрыва пи-связи требуется большое количество энергии (264 кДж / моль в этилене), вращение вокруг двойной связи углерод-углерод очень затруднено и поэтому сильно ограничено. Как следствие, замещенные алкены могут существовать в виде одного из двух изомеров, называемых цис--изомерами и транс--изомерами.Например, в цис- -2-бутилене два метильных заместителя обращены к одной и той же стороне двойной связи, а в транс- -2-бутилене они обращены к противоположной стороне.
Совершенно очевидно, что двойную связь невозможно скрутить. Фактически, для поворота на 90 градусов требуется энергия, примерно равная половине прочности пи-связи. Смещение орбиталей p меньше, чем ожидалось, потому что имеет место пиридализация. Транс -Циклооктен представляет собой стабильный деформированный алкен, смещение орбиты которого составляет всего 19 градусов с двугранным углом 137 градусов (обычно 120 градусов) и степенью пирамидализации 18 градусов.Это объясняет дипольный момент 0,8 D для этого соединения (цис-изомер 0,4 D), где ожидается нулевое значение. [1] Изомер транс циклогептена стабилен только при низких температурах.
Физические свойства
По физическим свойствам алкены сравнимы с алканами. Физическое состояние зависит от молекулярной массы (газы от этена до бутана, жидкости, начиная с пентена). Простейшие алкены, этилен, пропилен и бутилен — это газы. Линейные алкены, содержащие приблизительно от 5 до 16 атомов углерода, являются жидкостями, а высшие алкены — воскообразными твердыми веществами.
Химические свойства
Алкены являются относительно стабильными соединениями, но обладают большей реакционной способностью, чем алканы, из-за их двойной углерод-углеродной связи. Хотя алкены сильнее, чем одинарная углерод-углеродная связь, большинство реакций алкенов включает разрыв этой двойной связи с образованием двух новых одинарных связей.
Синтез
- Наиболее распространенным способом промышленного синтеза алкенов является крекинг нефти.
- Алкены можно синтезировать из спиртов путем дегидратации, при которой удаляется вода.Например, при дегидратации этанола образуется этен:
- CH 3 CH 2 OH + H 2 SO 4 (конц. Водн.) → CH 3 CH 2 OSO 3 H + H 2 O → H 2 C = CH 2 + H 2 SO 4 + H 2 O
- Другими элиминациями алкоголя являются элиминация Чугаева и элиминация Грико, при которых сначала алкогольная группа превращается в короткоживущее промежуточное соединение.
- Реакция отщепления от алкиламина происходит в процессе отщепления Хофмана и реакции Коупа с образованием алкенов.
- Каталитический синтез высших α-алкенов может быть осуществлен реакцией этилена с металлоорганическим соединением триэтилалюминий в присутствии никеля, кобальта или платины.
- Алкены участвуют в метатезисе олефинов.
- Алкены могут быть получены из карбонильных соединений, таких как альдегид или кетон, с помощью множества реакций.
- Реакция с алкилгалогенидами в реакции Виттига
- Взаимодействие с фенилсульфоном в олефинировании по Джулиа
- Реакция двух разных кетонов в реакции Бартона-Келлогга
- Сочетание одного кетона в реакции Бэмфорда-Стивенса или реакции Шапиро
- Сочетание двух кетонов или двух альдегидов в реакции Макмерри
- Алкены могут быть получены в результате реакций сочетания винилгалогенидов.
- Алкены могут быть получены путем селективного восстановления алкинов.
- Алкены перегруппируются в реакции Дильса-Альдера и реакции Эне.
- Алкены образуются из α-галогенсульфонов в реакции Рамберга-Беклунда.
- Мультизамещенные алкены могут быть образованы из алкинов при карбометаллировании с использованием различных металлоорганических реагентов.
Для несимметричных продуктов более замещенные атомы углерода (с меньшим количеством атомов водорода) имеют тенденцию образовывать более стабильные участки для двойных связей (см. Правило Сайцефа).
Реакция
Алкены служат сырьем для нефтехимической промышленности, поскольку они могут участвовать в самых разных реакциях.
Реакции присоединения
Алкены реагируют во многих реакциях присоединения, которые происходят путем раскрытия двойной связи.
- Каталитическое добавление водорода: Каталитическое гидрирование алкенов дает соответствующие алканы. Реакцию проводят под давлением в присутствии металлического катализатора. Обычные промышленные катализаторы основаны на платине, никеле или палладии. Для лабораторных синтезов часто используется никель Ренея. Это сплав никеля и алюминия.Примером этой реакции является каталитическое гидрирование этилена с получением этана:
- CH 2 = CH 2 + H 2 → CH 3 -CH 3
- Электрофильное присоединение: Большинство реакций присоединения к алкенам протекает по механизму электрофильного присоединения. Примером является реакция Принса, в которой электрофилом является карбонильная группа.
- Галогенирование: Добавление элементарного брома или хлора к алкенам дает вицинальные дибром- и дихлоралканы соответственно.Обесцвечивание раствора брома в воде является аналитическим тестом на наличие алкенов:
- CH 2 = CH 2 + Br 2 → BrCH 2 -CH 2 Br
- Он также используется в качестве количественного теста ненасыщенности, выражаемого как бромное число отдельного соединения или смеси. Реакция работает, потому что высокая плотность электронов в двойной связи вызывает временный сдвиг электронов в связи Br-Br, вызывая временный индуцированный диполь.Это делает Br, ближайший к двойной связи, слегка положительным и, следовательно, электрофилом.
- Гидрогалогенирование: Добавление галогеноводородных кислот, таких как HCl или HBr, к алкенам дает соответствующие галогеналканы.
- CH 3 -CH = CH 2 + HBr → CH 3 -CH Br -CH 3
- Если два атома углерода в двойной связи связаны с разным числом атомов водорода, галоген находится преимущественно у углерода с меньшим количеством водородных заместителей (правило Марковникова).
- Это механизм реакции гидрогалогенирования:
- Добавление карбена или карбеноида дает соответствующий циклопропан.
Окисление
Алкены окисляются большим количеством окислителей.
- В присутствии кислорода алкены горят ярким пламенем с образованием диоксида углерода и воды.
- Каталитическое окисление кислородом или реакция с перкарбоновыми кислотами дает эпоксиды
- Реакция с озоном при озонолизе приводит к разрыву двойной связи с образованием двух альдегидов или кетонов
- R 1 -CH = CH-R 2 + O 3 → R 1 -CHO + R 2 -CHO + H 2 O
- Эту реакцию можно использовать для определения положения двойной связи в неизвестном алкене.
- Бишидроксилирование по Шарплесу и цис-гидроксилирование Вудворда дают диолы
Полимеризация
Полимеризация алкенов — это экономически важная реакция, которая дает полимеры высокой промышленной ценности, такие как пластмассы, полиэтилен и полипропилен. Полимеризация может протекать по свободнорадикальному или ионному механизму.
Номенклатура
Имена ИЮПАК
Чтобы сформировать корень имен IUPAC для алкенов, просто измените инфикс -an- родительского элемента на -en-.Например, CH 3 -CH 3 — это алкан ethANe. Имя CH 2 = CH 2 , следовательно, ethENe.
В высших алкенах, где существуют изомеры, различающиеся расположением двойной связи, используется следующая система нумерации:
- Пронумеруйте самую длинную углеродную цепь, содержащую двойную связь, в том направлении, которое дает атомам углерода двойной связи наименьшие возможные числа.
- Укажите расположение двойной связи по положению ее первого углерода
- Назовите разветвленные или замещенные алкены аналогично алканам.
- Пронумеруйте атомы углерода, найдите и назовите группы заместителей, найдите двойную связь и назовите основную цепь
Канал 3 Канал 2 Канал 2 Канал 2 Канал == Канал 2 | CH 3 | CH 3 |
Обозначение EZ
Когда алкен имеет более одного заместителя, геометрия двойной связи описывается с использованием меток E и Z .Эти ярлыки происходят от немецких слов «entgegen», что означает «противоположный», и «zusammen», что означает «вместе». Алкены с группами более высокого приоритета на одной стороне двойной связи имеют эти группы вместе и обозначаются « Z ». Алкены с группами более высокого приоритета на противоположных сторонах обозначаются « E ».
См. Также
Банкноты
Список литературы
- Макмерри, Джон. Органическая химия. 6 изд.Бельмонт, Калифорния: Брукс / Коул. 2004. ISBN 0534420052 .
- Моррисон, Роберт Т. и Бойд, Роберт Н. Органическая химия. 6 изд. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. 1992. ISBN 0-13-643669-2 .
- Solomons, T.W. Грэм и Фрайл, Крейг Б. Органическая химия. 8-е изд. Хобокен, Нью-Джерси: Джон Вили. 2004. ISBN 0471417998
Кредиты
Энциклопедия Нового Света писателей и редакторов переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
.
 2- метилбутен -1
2- метилбутен -1 пентен -1
пентен -1 пентен -1
пентен -1 СНΞ СН –
С(С2Н5)2 – СН2 —
СН3
СНΞ СН –
С(С2Н5)2 – СН2 —
СН3 СН2=СН2 + Н2→ СН3 –
СН 3
СН2=СН2 + Н2→ СН3 –
СН 3 СН2= СН– СН= СН2
СН2= СН– СН= СН2
 Атомы углерода пронумерованы так, что первый из двух, которые связаны двойной связью, получает меньшее из двух возможных номеров. Например, соединение CH 3 CH = CHCH 2 CH 3 имеет двойную связь. между вторым и третьим атомами углерода.Его называют 2-пентеном (а не 3-пентеном).
Атомы углерода пронумерованы так, что первый из двух, которые связаны двойной связью, получает меньшее из двух возможных номеров. Например, соединение CH 3 CH = CHCH 2 CH 3 имеет двойную связь. между вторым и третьим атомами углерода.Его называют 2-пентеном (а не 3-пентеном). Чтобы дать первому атому углерода двойной связи наименьшее число (правило 2), мы нумеруем слева, так что соединение представляет собой 2-пентен. У четвертого атома углерода есть метильная группа (правило 3), поэтому название соединения — 4-метил-2-пентен.
Чтобы дать первому атому углерода двойной связи наименьшее число (правило 2), мы нумеруем слева, так что соединение представляет собой 2-пентен. У четвертого атома углерода есть метильная группа (правило 3), поэтому название соединения — 4-метил-2-пентен.

