ГДЗ по Химии за 10 класс: Рудзитис Г.Е. Решебник
Большинство школьных наук кажутся ученику несложными на первых уроках, но не всегда привлекают его внимание. С химией ситуация складывается противоположная: всем подросткам крайне интересно наблюдать за теми опытами и экспериментами, которые проводит учитель в школьной лаборатории. Но чрезвычайно сложна эта дисциплина с самых первых дней её изучения. Неудивительно, что для любого ученика, независимо от уровня его знаний, требуется надёжный помощник, который подскажет все нюансы предмета и разъяснит суть проводимых экспериментов. Не следует забывать и о катастрофической нехватке времени в выпускных классах. Отличным подсказчиком для подростка становится качественная учебно-вспомогательная литература формата ГДЗ. Справочник был разработан в полном соответствии с учебником Рудзитиса Г. Е., выпущенным издательством «Просвещение». Его авторами стали профессионалы, мастера своего дела, педагоги и методисты с немалым стажем работы в области образования.
Проверка знаний в классе – один из самых напряжённых эпизодов всей школьной жизни. Необходимо не просто выполнить задание учителя, но и сделать это без всякой посторонней помощи в строго определённый промежуток времени. Для многих это становится не только проверкой изученного материала, но и психологической проблемой. Поэтому оптимальный вариант – подготовиться в спокойной домашней обстановке заранее, выполнив аналогичные задания по всем темам под руководством надёжного виртуального помощника: ГДЗ для учащихся десятых классов средней школы.
Что представляет собой решебник по химии для 10 класса Рудзитис
Сборник работ составлен чётко и лаконично. В пособие входят:
- Ответы на 16 лабораторных работ.
- Шесть готовых практических.
- Подробные и детальные образцы решений и объяснений теории к 44-м параграфам.

Выполнив самостоятельно задания из онлайн-книги, ученик без проблем сможет работать с аналогичными упражнениями в классе во время контрольных работ, уже без подсказки.
Чему научат ГДЗ по химии за 10 класс Рудзитис, Фельдман
Пособие охватывает работу по всем темам основного учебника для десятого класса:
- Теория химического строения органических связей.
- Предельные углеводороды (алканы, или парафины).
- Спирты и фенолы.
- Альдегиды, кетоны и карбоновые кислоты.
- Сложные эфиры. Жиры. Углеводы.
- Азотосодержащие орг. соединения.
- Синтетические полимеры.
Удобная навигация по онлайн-справочнику позволяет подростку не тратить лишнее время на поиски нужной темы и мгновенно ориентироваться в разделах и параграфах издания. Главное – не допускать бездумного списывания.
Урок 18. органическая химия, человек и природа — Химия — 10 класс
Химия, 10 класс
Урок № 18. Органическая химия, человек и природа
Органическая химия, человек и природа
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению последствий воздействия органических веществ на окружающую среду и роль человека в этом процессе.
Глоссарий
Биоразлагаемые полимеры или биодеградируемые полимеры – материалы с регулируемым сроком эксплуатации –полимерные материалы, самопроизвольно разрушающиеся в результате естественных микробиологических и химических процессов.
Вторичная переработка – деятельность, заключающаяся в обращении с отходами с целью их безопасного уничтожения или обеспечения повторного использования в народном хозяйстве полученных сырья, энергии, изделий и материалов.
Инсектици́д – химический препарат для уничтожения вредных насекомых.
Коды переработки – специальные знаки, применяются для обозначения материала, из которого изготовлен предмет, и упрощения процедуры сортировки перед его отправкой на переработку для вторичного использования.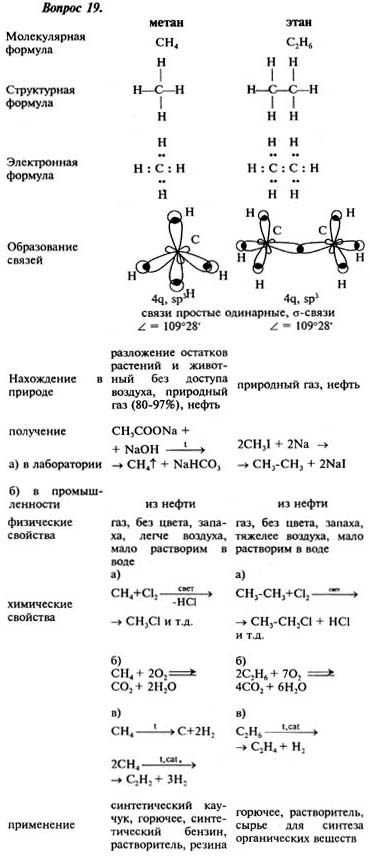
Пестицид – химические средства, используемые для борьбы с вредителями и болезнями растений, а также с различными паразитами, сорняками, вредителями зерна и зернопродуктов, древесины, изделий из хлопка, шерсти, кожи, с эктопаразитами домашних животных, а также с переносчиками опасных заболеваний человека и животных.
Фреон – галогеноалканы, фтор- и хлорсодержащие производные насыщенных углеводородов (главным образом метана и этана), используемые как хладагенты в холодильных машинах (например, в кондиционерах).
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Научно-технический прогресс XXI века привёл к небывалому развитию нефтехимической и химической промышленности. Ни одна область жизни человека сейчас не обходится без продуктов их производства. Однако в определенных концентрациях любое химическое вещество – яд.
Огромный вклад в ВВП промышленных областей привёл к усложнению контроля за производствами, что способствует росту экологических проблем. При этом продукция необходима человечеству.
Обозначение и осознание проблем привело к разработке методов защиты и вторичной переработки. Созданы мировые и государственные органы по защите окружающей среды. Разрабатываются технические регламенты и законы, контролирующие деятельность промышленных комплексов.
Источниками загрязнений являются: разлив при перевозке и добычи нефти; выбросы газа от добычи и транспорта; использование в сельском хозяйстве различных ядов; отработанные органические растворители и вещества в институтах, научных группах, в аналитических отделах на предприятиях; бытовой мусор.
Стоит упомянуть экологическую катастрофу 2010 года в Мексиканском заливе из-за аварии на нефтедобывающей станции.
В сельском хозяйстве в Африке до сих пор разрешено использование пестицидов, не разлагающихся при попадании в организм. Из-за этого яд долгое время приводит к гибели цепи животных.
Таким образом, мы пришли к пониманию последствий загрязнения и иррационального использования органических веществ.
Ускоренное изменение климата происходит вследствие совокупности действия антропогенных факторов, включающих использование органических веществ.
По одной из версий уменьшение озонового слоя было вызвано распространением в бытовых приборах фреонов или хладагентов. Продукты разложения этих соединений необратимо взаимодействуют с озоном. Из-за этого в настоящее время их использование ограничено.
Продукты разложения этих соединений необратимо взаимодействуют с озоном. Из-за этого в настоящее время их использование ограничено.
Злоупотребление химическими удобрениями в сельском хозяйстве приводит только к противоположному от желаемого эффекту – уменьшению плодородия почв.
До сих пор на производствах используется устаревшее оборудование, из-за чего попадание органических веществ в природу выше норм. При этом контроль также часто не справляется с отслеживанием подобных ситуаций, в том числе из-за недостатка методов воздействия за нарушения.
Сортировка мусора по разработанной международной кодировке позволит организовать системную переработку пластмасс, как механическую, так и химическую.
Сейчас основные объемы производств сосредоточены в Китае, где делают синтетическую одежду из пластмасс. В Европе локальное производство посуды, и походного снаряжения.
В Голландии из жевательных резинок, собранных с дорог, делают подошву для кроссовок. Причем из килограмма такого материала получают две пары обуви.
Огромные объемы отработанных химических растворителей легко летучи, из-за чего неизбежно попадают сначала в атмосферу, а потом в почву в виде осадков. При этом возможности вторичной перегонки мешают только организационные и логистические задачи.
Существующим биоразлагающимся полимерам, например, полилактиду, требуется кислород, и задача органической химии — новыми синтетическими способами обойти данную проблему.
Безусловно, полностью отдавать на откуп государству заботу о природе недостаточно. Личностный вклад каждого существенно может облегчить задачу.
Учитывая, что большую часть, например, пластика используется один раз, стоит ли столь высокая цена минутного комфорта?
Воды реки Буриганга в Бангладеше заполнены пакетами, которые потом идут на вторичную переработку. Эту же воду люди пьют и в ней моются. Обратите внимание, Азия – регион с самыми загрязненными водными ресурсами.
Выпуск пластмасс небывало возрос только за последние 15 лет. И он уже оказался на пляжах Тихого океана.
Любой из нас может пытаться использовать материалы многократно, а где, возможно, выбрать безвредный материал. Например, стеклянные или алюминиевые емкости, чья переработка хорошо отлажена, бумажные пакеты. Ответственное потребление убережёт нас от большого количества проблем для любого сейчас живущего поколения.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на вычисление выхода продукта реакции.
Условие задачи: При теоритическом выходе гидролиза ПЭТФ получится 2 тонны терефталевой кислоты. На практике получено 1.45 тонны с …% выходом.
Шаг первый: Поскольку нет реакции и речь про одно и то же вещество
(1,45 : 2)*100 = 72,5 %.
Ответ: 72,5.
2.Решение задачи на ввод химической формулы
Условие задачи: Выведите химическую формулу предельного углеводорода, попавшего в атмосферу, если его молекулярная масса 44 г/моль.
Шаг первый: Поскольку углеводород предельный, то общая формула СnН2n+2
Шаг второй: вычислим молярную массу в общем виде:
М1 = 12n + 2n + 2 = 44 г/моль.
14n=42
n=3
Шаг третий: подставляем вместо n в формулу 3 = С3Н8
Ответ: С3Н8
ГДЗ по Химии за 10 класс Рудзитис Г.Е., Фельдман Ф.Г. Базовый уровень
Химия 10 класс Рудзитис Г.Е. базовый уровень
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Школьники могут использовать ГДЗ по химии за 10 класс базовый уровень Рудзитис в различных целях. Кому-то пособие пригодится для совершения регулярной самопроверки и устранения незначительных погрешностей. Другие могут использовать онлайн-книгу с верными ответами, чтобы улучшить оценки по предмету и повысить академическую успеваемость. Каждый ученик найдет в этом замечательном решебнике много полезных сведений.
На предпоследней ступени обучения в школе подростки будут детально разбирать следующие разделы учебника:
- Простейшая и молекулярная формулы.

- Классификация органических соединений.
- Тепловой эффект химических реакций.
- Фазовые состояния веществ. Дисперсные системы. Способы выражения концентрации.
- Особенности химических свойств многоатомных спиртов и фенолов.
- Карбонильные соединения. Строение, изомерия, номенклатура.
Для чего нужны готовые ответы по химии за 10 класс базовый уровень Рудзитис
Если ученик сталкивается с трудностями даже при выполнении элементарных номеров из учебника или задачника, то значит ему нужна помощь. Но для этого вовсе не обязательно записываться на курсы или прибегать к дорогостоящим услугам репетиторов. Достаточно будет вооружиться качественным пособием, каким является данный решебник.
Для того чтобы получать на уроках отличные отметки, раньше нужно было принимать участие в конкурсах и олимпиадах, регулярно посещать занятия, заниматься допоздна, окружать себя всевозможными справочниками, записываться на дополнительные курсы. Но на все это уходило очень много времени и сил. Современным школьникам повезло в том, что они могут добиться положительных результатов благодаря решебникам, которые способны упростить учебный процесс.
Но на все это уходило очень много времени и сил. Современным школьникам повезло в том, что они могут добиться положительных результатов благодаря решебникам, которые способны упростить учебный процесс.
ГДЗ по химии за 10 класс базовый уровень Рудзитис Г.Е., Фельдман Ф.Г. были разработаны высококвалифицированными специалистами не просто так. Авторы постарались на славу и создали замечательное пособие, которое поможет ученику не только справиться с домашним заданием, но и подготовит к его к лабораторным и контрольным работам. Оценка за тесты очень важна, так как она может значительно повлиять на средний балл. А со сборником решенных заданий хорошие и отличные отметки подросткам гарантированы.
|
№ |
Название дисциплины |
Автор, издательство |
|
1 |
Русский язык |
Гольцова Н. Г., Шамшин И.В., Мищерина М.А. Русский язык. 10-11 класс (базовый уровень). М.: «Русское слово». Г., Шамшин И.В., Мищерина М.А. Русский язык. 10-11 класс (базовый уровень). М.: «Русское слово». |
|
2 |
Литература |
Зинин С.А., Сахаров В.И., Чалмаев В.А. Литература. 10-11 класс. М.: «Русское слово». |
|
3 |
Английский язык |
1. Учебник для общеобразовательных организаций и школ с углубленным изучением английского языка. Афанасьева О.В., Михеева И.В. – M.: «Просвещение». 2. Рабочая тетрадь. Английский язык. X класс. Пособие для общеобразовательных организаций и школ с углубленным изучением английского языка. Афанасьева О.В., Михеева И.В. – M.: «Просвещение». |
|
4 |
Алгебра и начала анализа |
Алимов Ш.А., Колягин Ю.М. Алгебра и начала математического анализа, 10-11 класс. Издательство «Просвещение». |
|
5 |
Геометрия |
Атанасян Л. С. Геометрия 10-11 кл. Издательство «Просвещение». С. Геометрия 10-11 кл. Издательство «Просвещение». |
|
6 |
Информатика |
Босова Л.Л. Учебник. Информатика 10 класс. Базовый уровень. ООО «Бином. Лаборатория знаний». |
|
7 |
История
|
1. Горинов М.М., Данилов А.А., Моруков М.Ю. Учебник. История России. 10 класс (учебник в трех частях). Издательство «Просвещение». 2. Сорока-Цюпа О.С., Сороко-Цюпа А.О. Учебник. Всеобщая история. 10 класс. Издательство «Просвещение». |
|
8 |
Обществознание |
Боголюбов Л.Н. и др. Учебник. Обществознание. 10 класс. Издательство: М.: «Просвещение». |
|
9 |
География |
1.Максаковский В.П. Учебник. География (10 – 11 класс). Издательство «Просвещение». |
|
10 |
Физика |
Мякишев Г.Я., Буховцев Б.Б. и др., под редакцией Парфентьевой Н.А. Учебник. Физика 10 класс. Издательство «Просвещение». |
|
11 |
Химия |
Рудзитис Г.Е., Фельдман Ф.Г. Учебник. Химия 10 класс (базовый уровень). Издательство «Просвещение». |
|
12 |
Биология |
Беляев Д.К., Дымшиц Г.М., Бородин П.М. и др. Учебник. Биология (базовый уровень). 10 класс. Под редакцией Беляева Д.К., Дымшица Г.М., Издательство «Просвещение». |
|
13 |
Немецкий язык |
Радченко О.А., Хебелер Г., Шмакова Е.Ю. Учебник «Немецкий язык» Издательство «Дрофа» |
|
14 |
Физическая культура |
Лях В. И. Физическая культура. 10-11 класс. – М.: «Просвещение». И. Физическая культура. 10-11 класс. – М.: «Просвещение». |
|
15 |
ОБЖ |
Ким С.В., Горский В.А. ОБЖ, 10-11 класс. Издательство «Вентана- Граф». |
|
16 |
Право |
Учебник для 10 кл. общеобразовательных учреждений под редакцией Боголюбова Л.Н., Лукашевой Е.А., Матвеевой А.И. |
Химия 10 класс Базовый уровень Учебник
Учебник 10 класса базового уровня Рудзитиса, Фельдмана по органической химии с приложением на электронном носителе соответствует ФГОС ООО. Приведен весь материал, изложенный по логике усложнения строения соединений органики, разнообразия химических свойств.-Содержание-
Как пользоваться учебником 03
Теория химического строения .. 04
Формирование органической химии… 04
Основные положения теории… 07
Электронная природа химических … 11
Классификация органических соединений 15
Предельные углеводороды … 16
Электронное — пространственное строение алканов 17
Гомологи — изомеры алканов 19
Получение, свойства применение алканов 21
Циклоалканы (пиклопарафины) 30
Лабораторный опыт 33
Практическая работа 1 33
Непредельные углеводороды … 34
Электронное — пространственное строение алкенов. ….34
….34
Получение, свойства применение алкенов 38
о диеновых углеводородах 45
Природный каучук 47
Ацетилен его гомологи 51
Практическая работа 2 57
Ароматические углеводороды (арены) 57
Бензол его гомологи 57
Свойства бензола …62
Природные источники углеводородов .. 68
Природный газ. …. 68
Нефть 69
Коксохимическое производство 75
Развитие энергетики …. 78
Лабораторный опыт 80
Спирты и фенолы 80
Одноатомные предельные спирты. … 80
Получение, свойства применение …. 83
Многоатомные спирты 89
Фенолы 93
Свойства фенола… 96
Лабораторные опыты 99
Альдегиды, кетоны карбоновые.. 100
Карбонильные соединения —… 100
Свойства применение альдегидов 103
Карболовые кислоты 106
Получение, свойства применение … 109
Краткие сведения …116
Лабораторные опыты 119
Практическая работа 3 120
Практическая работа 4 121
Сложные эфиры. Жиры 121
Сложные эфиры 121
Жиры 125
Лабораторные опыты 130
Углеводы 131
Глюкоза 131
Олигосахарнды. Сахароза 137
Сахароза 137
Крахмал 139
Целлюлоза 143
Лабораторные ОПЫТЫ 149
Практическая работа 5 150
Азотсодержащие органические соединения 150
Амины 150
Аминокислоты 153
Белки 158
Понятие об азотсодержащих ….162
Нуклеиновые кислоты 165
Химия здоровье человека 167
Лабораторный опыт 170
Синтетические полимеры 170
Полимеры — высокомолекулярные соединения 171
Синтетические каучуки 176
Синтетические волокна 179
Органическая химия, человек природа 183
Химия полимеров 193
Синтетические полимеры — 195
Конденсационные полимеры. Пенопласты 200
Натуральный каучук 204
Синтетические каучуки 207
Синтетические волокна 210
Практическая работа 6. 211
Распознавание пластмасс и волокон 214
Органическая химия, человек — природа 219
Ответы на задачи 220
Полезные ссылки — 221
Предметно-именной указатель 221
Размер файла: 17 Мб; Формат: pdf/
Издание 2012 г.
Размер файла: 41 Мб; Формат: pdf
Рабочая тетрадь по химии. 10 класс. К учебнику Г.Е.Рудзитиса, Ф.Г.Фельдмана «Химия. 10 класс». ФГОС
Микитюк А.Д.
есть в наличии
Аннотация
Данное пособие полностью соответствует федеральному государственному образовательному стандарту (второго поколения).
Рабочая тетрадь является необходимым дополнением к школьному учебнику Г. Е. Рудзитиса, Ф. Г. Фельдмана «Химия. 10 класс», рекомендованному Министерством образования и науки Российской Федерации и включенному в Федеральный перечень учебников.
С помощью этой тетради ученики смогут лучше усвоить материал учебника и применить полученные знания на практике. В тетрадь включены расчетные задачи, которые приводятся с ответами.
Тетрадь предназначена для работы в классе и дома.
Приказом № 699 Министерства образования и науки Российской Федерации учебные пособия издательства «Экзамен» допущены к использованию в общеобразовательных организациях.
Дополнительная информация
| Регион (Город/Страна где издана): | Москва |
| Год публикации: | 2019 |
| Тираж: | 10000 |
| Страниц: | 94 |
| Формат: | 70×100/16 |
Вес в гр. : : | 140 |
| Язык публикации: | Русский |
| Тип обложки: | Мягкий / Полужесткий переплет |
| Цвета обложки: | Многоцветный |
| Полный список лиц указанных в издании: | Микитюк А.Д. |
Как найти в магазине
| Этаж: 2 | Шкаф: 30.06 |
| Зал: 1 | Полка: 4 |
Нет отзывов о товаре
Популярные книги автора
▶▷▶ решебник химия 10 класс г.
 е.рудзитис ф.г.фельдман за 2000 год▶▷▶ решебник химия 10 класс г.е.рудзитис ф.г.фельдман за 2000 год
е.рудзитис ф.г.фельдман за 2000 год▶▷▶ решебник химия 10 класс г.е.рудзитис ф.г.фельдман за 2000 год| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 01-11-2018 |
решебник химия 10 класс герудзитис фгфельдман за 2000 год — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download Учебник Химия 10 класс ГЕ Рудзитис, ФГ Фельдман (2012 год) vklasseonline … Химия Полный и качественный учебник Химия 10 класс ГЕ Рудзитис , ФГ Фельдман 2012 скачать онлайн Доступно на ваших смартфонах Решебник (ГДЗ) Химия 10 класс ГЕ Рудзитис, ФГ Фельдман vklasseonline … Химия Полный и качественный решебник (ГДЗ) Химия 10 класс ГЕ Рудзитис , ФГ Фельдман 2000 Доступно на ваших смартфонах Решебник Химия 10 Класс Герудзитис Фгфельдман За 2000 Год — Image Results More Решебник Химия 10 Класс Герудзитис Фгфельдман За 2000 Год images ГДЗ Решебник Химия 10 класс Рудзитис ГЕ gdzwork Химия Использование сборника ГДЗ по химии для 10 класса Рудзитиса Г Е и Фельдмана Ф Г , издания 2000 года, позволит ученику исключить этот предмет из числа сложных для изучения Решебник по химии за 10 класс Рудзитис ГЕ, Фельдман ФГ gdzguru Химия ГДЗ: Онлайн готовые домашние задания по химии за 10 класс , автор Рудзитис Г Е , Фельдман Ф Г , спиши решения и ответы на ГДЗ гуру ГДЗ по химии 10 класс Рудзитис Фельдман решебник gdzme 10 класс Химия ГДЗ по химии за 10 класс авторов Рудзитис Г Е , Фельдмана Ф Г 2013 года издания Пособие по своему объему достаточно большое и охватывает 10 основных глав, разделенных на определенное количество параграфов ГДЗ, решебник по химии 9 класс Рудзитис, Фельдман gdz-fiveru/gdz/9_class/chemistry/rudzitis Cached На этой странице размещены все ГДЗ к учебнику по химии за 9 класс авторов ГЕ Рудзитис , ФГ Фельдман 2001-2012 года издания ГДЗ по химии за 10 класс к учебнику «Химия 10 класс» ГЕ 5terkacom/reshebnik-khimiya- 10 -klass-g-e Cached Скачать решебник « Химия 10 класс » ГЕРудзитис , ФГФельдман Описание решебника: В учебнике по химии за 10 класс ГЕРудзитис ФГФельдман вопросы и задачи задаются в конце главы, либо в конце Химия 10 класс Рудзитис ГЕ, Фельдман ФГ 2000 год by issuucom/zmdoma/docs/him 10 -5 Cached Домашняя работа по химии за 10 класс к учебнику « Химия 10 класс », ГЕ Рудзитис , ФГ Фельдман Химия 8 класс, Рудзитис ГЕ, Фельдман ФГ — ГДЗ domashkasu/gdz/klass8/himiya/8-himiya-rudzitis Cached Решебник Химия 8 класс , Рудзитис Г Е , Фельдман Ф Г ГДЗ по химии за 10 класс к учебнику «Химия 10 класс» ГЕ 5terkacom/reshebnik-himiya- 10 -g-e-rudzitis-f-g Cached ГДЗ по химии за 10 класс к учебнику « Химия 10 класс » ГЕРудзитис , ФГФельдман Все главы Начните вводить часть условия (например, могут ли , чему равен или найти ): Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 12,300 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
- 66
- альдегидами
- в котором есть сразу по два варианта ответа Такая тактика с двумя ответами уже знакома вам на решакру
нажми Ctrl + d Rt: 001449 sec / Sun
2014 1глава Глава I Теория химического строения органических соединений (Параграфы с 1 по 4) §1 Предмет органической химии : Вопросы до параграфа: 1; 2; 3 Скрыть 6 ГДЗ по химии 10 класс Рудзитис
- ФГ Фельдман Химия 8 класс
- Фельдман ФГ 2000 год by issuucom/zmdoma/docs/him 10 -5 Cached Домашняя работа по химии за 10 класс к учебнику « Химия 10 класс »
- ФГ Фельдман 2012 скачать онлайн Доступно на ваших смартфонах Решебник (ГДЗ) Химия 10 класс ГЕ Рудзитис
решебник химия 10 класс герудзитис фгфельдман за 2000 год — Все результаты Химия 10 класс» ГЕРудзитис, ФГФельдман ГДЗ по химии за 10 класс к учебнику « Химия 10 класс » Г Е Рудзитис , Ф Г Фельдман Онлайн решебник по химии за 10 класс , Г Е Рудзитис , Ф Все задачи Решебник (ГДЗ) Химия 10 класс ГЕ Рудзитис, ФГ Фельдман 2000 › Решебники за 10 класс › Химия Решебник (ГДЗ) Химия 10 класс Г Е Рудзитис , Ф Г Фельдман ( 2000 год ) Г Е Рудзитис , Ф Г Фельдман Год : 2000 | Ответы на вопросы к § 4№ 1-10 Решебник (ГДЗ) Химия 10 класс 1999г Рудзитис Г Е, Фельдман Ф gdzometrby/book36 Ответы к учебнику по химии для 10 класса Рудзитис 1999 год ГДЗ (решебник) Химия 10 класс Г Е Рудзитис, Ф Г Фельдман › Моя Школа › ГДЗ › 10 класс › Химия Рейтинг: 5 — 4 голоса Правильные и полные ГДЗ ( решебник ) Химия 10 класс Г Е Рудзитис , Ф Г На русском языке Авторы: Г Е Рудзитис , Ф Г Фельдман Год : 2011 4 Не найдено: 2000 ГДЗ по Химии за 10 класс Рудзитис ГЕ, Фельдман ФГ › ГДЗ › 10 класс › Химия › Рудзитис Г Е Похожие Подробный решебник (ГДЗ) по Химии для 10 класса , Авторы учебника: Рудзитис Г Е , Фельдман Ф Г Не найдено: 2000 Решебник Химия 10 Класс ГЕРудзитис ФГФельдман 2014 | idss bytesmanwixsitecom//Решебник-Химия-10-Класс-ГЕРудзитис-ФГФельдман-2014 14 янв 2016 г — Практическая работа 1 — ГДЗ Химия Рудзитис Г Е , Фельдман Ф Г По запросу «» не найдено ни одного решебника Органическая химия , 10 класс ( Рудзитис Г Е , Фельдман Ф Г ) 2000 Решебники (гдз) по химии за 10 класс Дрофа ISBN: Тираж: Год издания: 2014 Класс: 10-11 класс Химия 10 класс рудзитис фельдман решебник | Химия 10 класс 24 мар 2015 г — Рудзитис ГЕ, Фельдман ФГ Домашняя работа по химии за 10 класс к учебнику « Химия 10 класс » Решебник по учебнику: Химия 10 класс , Рудзитис ГЕ, Фельдман Ф Г Е Рудзитис , Ф Г Фельдман Издательство: М : Просвещение, 2000 М: Астрель, год к учебнику « Химия 10 класс Картинки по запросу решебник химия 10 класс герудзитис фгфельдман за 2000 год «cb»:15,»id»:»y15pS_Dc91ikkM:»,»ml»:»600″:»bh»:90,»bw»:59,»oh»:625,»ou»:» «,»ow»:417,»pt»:»5terkacom/covers/himiya-10-klass-rudzitis-g-e-fel»,»rh»:»5terkacom»,»rid»:»4CKQTpXzERr1hM»,»rt»:0,»ru»:» «,»th»:102,»tu»:» \u003dtbn:ANd9GcSroD0mHfA52agHfB1ZA_jGlsxuneJwobceZOUPSdJl2qCve6nhvaWIFJ0″,»tw»:68 «id»:»hfRLjFquDLqZbM:»,»ml»:»600″:»bh»:90,»bw»:70,»oh»:384,»ou»:» «,»ow»:302,»pt»:»5terkacom/covers/himiya-8-klass-rudzitis-g-e-feld»,»rh»:»5terkacom»,»rid»:»yWTFJbA_cn_PAM»,»rt»:0,»ru»:» «,»sc»:1,»th»:94,»tu»:» \u003dtbn:ANd9GcRR2mwK_gJcSV-g1V5MabjLxlO999rw1iysi5DTy-vfo_oDR8GIke5BoDE»,»tw»:74 «cb»:12,»cr»:6,»ct»:3,»id»:»c3VrKW_JCEV-0M:»,»ml»:»600″:»bh»:90,»bw»:63,»oh»:409,»ou»:» «,»ow»:310,»pt»:»5terkacom/covers/himiya-9-klass-rudzitis-g-e-feld»,»rh»:»5terkacom»,»rid»:»WF4o3YkWUiWqsM»,»rt»:0,»ru»:» «,»th»:96,»tu»:» \u003dtbn:ANd9GcR94XZcdbKxmJOH6FgheCGuO2uE_MEuyPsuzqGTRl8t3_MXRqqJeqRBg7w»,»tw»:72 «id»:»ZwjSPFJfONfevM:»,»ml»:»600″:»bh»:90,»bw»:68,»oh»:249,»ou»:» «,»ow»:190,»pt»:»5terkacom/covers/himiya-10-klass-rudzitis-g-e-fel»,»rh»:»5terkacom»,»rid»:»4CKQTpXzERr1hM»,»rt»:0,»ru»:» «,»sc»:1,»th»:96,»tu»:» \u003dtbn:ANd9GcSY1Sx5fZqk4GFDIpFeIwipjlR-_xei0xU76yhIRw_AVgIoEnVVESX_OA»,»tw»:73 «id»:»rHE7g1We9Yo25M:»,»ml»:»600″:»bh»:90,»bw»:55,»oh»:417,»ou»:» «,»ow»:260,»pt»:»wwwpomogalaru/himiya_images/rudzitis_10_reshebni»,»rh»:»pomogalaru»,»rid»:»SThNLtppCFbXKM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»pomogalaru»,»th»:106,»tu»:» \u003dtbn:ANd9GcR3e5yN0HR4ErNv-2ZooewJfkoq2EEgul9E4GOqXi_1nHfyVf1Gv8mgYw»,»tw»:66 «id»:»vFeIJjpcgROOPM:»,»ml»:»600″:»bh»:90,»bw»:61,»oh»:508,»ou»:» «,»ow»:350,»pt»:»5terkacom/covers/himiya-8-klass-rudzitis-g-e-feld»,»rh»:»5terkacom»,»rid»:»yWTFJbA_cn_PAM»,»rt»:0,»ru»:» «,»sc»:1,»th»:100,»tu»:» \u003dtbn:ANd9GcSwcuakp11cRO6wGbJvFtCe4UZiQlG2EscVYIcuLaXQ3yJxorpibEevEZ4″,»tw»:69 «cb»:15,»cl»:6,»cr»:3,»ct»:3,»id»:»L9kTjkdzxMO-5M:»,»ml»:»600″:»bh»:90,»bw»:57,»oh»:600,»ou»:» «,»ow»:421,»pt»:»ipinimgcom/originals/a7/11/7f/a7117f6982888e897c»,»rh»:»pinterestcom»,»rid»:»KF-dPGlNQDOdHM»,»rt»:0,»ru»:» «,»st»:»Pinterest»,»th»:100,»tu»:» \u003dtbn:ANd9GcTiCSScVzMmhuoiwidsLUI_GPqYLy56KT5cskd7fBfx7U8nYXeJ2-D-pg»,»tw»:70 «cb»:3,»id»:»AEV6r-vHgSgRBM:»,»ml»:»600″:»bh»:90,»bw»:66,»oh»:399,»ou»:» «,»ow»:298,»pt»:»i1wpcom/5terkacom/covers/himiya-8-klass-rudziti»,»rh»:»kichosicawordpresscom»,»rid»:»ZppQ0AiDP0cAjM»,»rt»:0,»ru»:» «,»st»:»Химия 10 класс рудзитис фельдман решебник — WordPresscom»,»th»:96,»tu»:» \u003dtbn:ANd9GcRdphRocU1FyRPqg96S1zC4NDArRnKq27i94hgGcA2pIzeJMb6nu9iqmw»,»tw»:72 «id»:»o734UgiDl8HFrM:»,»ml»:»600″:»bh»:90,»bw»:69,»oh»:700,»ou»:» «,»ow»:540,»pt»:»img-gorodru/upload/iblock/83f/83f0934c3729cd56a52″,»rh»:»chitai-gorodru»,»rid»:»gpCK_3z37gSbnM»,»rt»:0,»ru»:» «,»sc»:1,»st»:»\»Читай-город\»»,»th»:95,»tu»:» \u003dtbn:ANd9GcRSdJQ0Xi5Vrx8HfxiylJsLVzC8qLf8qWb6j4ibveWu1_gWUJQh8eZ16W4″,»tw»:73 Другие картинки по запросу «решебник химия 10 класс герудзитис фгфельдман за 2000 год» Жалоба отправлена Пожаловаться на картинки Благодарим за замечания Пожаловаться на другую картинку Пожаловаться на содержание картинки Отмена Пожаловаться Все результаты ГДЗ (решебник) по химии 10 класс Рудзитис Фельдман allengorg/d/chem/chem53htm класс Рудзитис Г Е , Фельдман Ф Г Готовые домашние задания, правильные ответы и решения к учебнику Домашняя работа по химии за 10 класс к учебнику » Химия 10 класс » Рудзитис Формат: pdf ( 2000 , 126с) Размер: Рудзитис ГЕ, Фельдман ФГ — гдз ответы решебники Разбор задач из школьного учебника по химии за 10 класс авторов: Рудзитис Г Е , Фельдман Ф Г Дополнительное пояснение к решению примеров Не найдено: 2000 Домашняя работа по химии за 10 класс к учебнику Химия 10 класс wwwpomogalaru/himiya/gdz_rudzitis_10html Рудзитис Г Е, Фельдман Ф Г М: Просвещение, 2000 Пособие включает в себя ответы на все вопросы и задания учебника и учителям, работающим по учебнику Г Е Рудзитиса « Химия 10 класс » с номерами действующего учебника 2012 года , поэтому приходится самим искать аналогичные задания Гдз по химии 10 класс рудзитис 22 параграф — Гдз по химии 10 8 мар 2015 г — Решебник по химии за 10 класс Рудзитиса поможет школьникам И Курс химии 10 класса Г Е Рудзитис и Ф Г Фельдман поделили на Сергей Ананьев (50), на голосовании 1 год назад Список материалов входящих в данный раздел: ГДЗ по химии 10 класс Рудзитис, Фельдман 1999- 2000 г Г Е Рудзитис, Ф Г Фельдман «Химия 10-11 классы Решение Из учебников Г Е Рудзитиса , Ф Г Фельдмана » Химия 10 класс «, » Химия 11 Серия: Решебники «Дрофы»; ISBN: 978-5-7107-3081-2; Год издания: 2000 [PDF] гдз по химии писатели герудзитис фгфельдман — WordPresscom 768553843 Г е рудзитис ф г фельдман гдз за 8 класс — качайте не пожалеете! Гдз по химии 10 класс г е рудзитис и ф г фельдман 1998 год Гдз по [PDF] решебник по химии 10 класс Рудзитис ГЕ — WordPresscom ciabracofygexfileswordpresscom/2017/01/115pdf Ф Г Фельдман — М: Просвещение, 2000 Сборника Рудзитис Г Е , Фельдман Ф Г Домашняя работа по химии за 10 класс к учебнику ф г фельдман 1998 год языку 10 класс упражнение Гдз по русскому языку 10класс вфгреков Химия 10 Класс Рудзитис Фельдман Учебник Онлайн — softrusterling softrusterlingweeblycom/blog/himiya-10-klass-rudzitis-feljdman-uchebnik-onlajn 1 апр 2018 г — Химия 10 Класс Рудзитис Фельдман Учебник Онлайн класса к «Учебник 10 класс , Рудзитис Г Е, Фельдман Ф Г , 2000 » Учебники для 10-го класса Учебники за 10 класс > Химия > Г Е Рудзитис , Ф Г Учебник Химия 10, 11 и 12138 Практическая работа 7139 Приложение141 Ответы на [PDF] гдз по химии 9 класс рудзитис фельдман 2009 год 13-е издание 4 13 окт 2013 г — 440244450 гдз по химии за 9 класс г е рудзитис ф г фельдман 13 издание 142383575415 рудзитис фельдман 2009 гдз химия 10 й класс АМ Радецкий, ВП Горшкова, издание третье, 2000 год , Решебник Рабочая программа 8 класс химия, по учебнику ГЕ Рудзитис, ФГ › Химия 5 дек 2017 г — Руководитель МО НИ Ленгардт Н Г Воскобойников программы используется учебник Рудзитис Г Е Химия : учебник для 8 класса предшествующие отметки за четверть, полугодие, год 10 Итоговая контрольная работа за курс 8 класса 1 Итого: 68 5 — 4 –М: Просвещение, 2000 [PDF] гдз рудзитис ге фельдман фг химия — WordPresscom fefableugolyfileswordpresscom/2017/01/10pdf 10 янв 2017 г — учебнику Химия — 10 класс — Рудзитис Г Е , Фельдман Ф Г 2079892025 26 окт 2013 Геометрия 7-9 классы 3- е изд 1992 год 335 Поиск по записям 13 — Стена | ВКонтакте Похожие Учебники для школы — сравнить учебники 2000 -2015 вернуться к Скачать ЕГЭ ГИА за 1 минуту Химия 10 класс К учебнику Рудзитиса Г Е , Фельдмана Ф Г — Рябов МА Скачать решебник 2012 года : 3 Мб, формат pdf 9 класс 2012 год скачать: 103 Мб, формат pdf Химия 8 класс Учебник (Рудзитис Г, Фельдман Ф) – купить книгу с Учебник» (Рудзитис Г, Фельдман Ф) по низкой цене Год издания линии УМК по химии для 8-9 классов авторов Г Е Рудзитиса , Ф Г Фельдмана Он Химия 8 класс, Рудзитис ГЕ, Фельдман ФГ — ГДЗ domashkasu/gdz/klass8/himiya/8-himiya-rudzitis Похожие Решебник Химия 8 класс , Рудзитис Г Е , Фельдман Ф Г Рудзитис Г Е Химия за 8 класс — ГДЗ Химия 8 класс , Рудзитис Г Е , Фельдман Ф Г 10 Гдз химия рузитис фельдман 10 класс просвящение 2018 zapbazarru/gdz-himiya-ruzitis-feldman-10-klass-prosvyashenie-2018html Авторы: Рудзитис Г Е , Фельдман Ф Г Издательство: Просвещение Химии 10 класс , решебник Рудзитис Г Е Домашняя работа по химии за 10 класс к Химия учебники — Хобби и отдых, Книги и журналы — Avitoru — Авито 1) Химия 10 класса Г Е Рудзитис , Ф Г Фельдман 1991 2) Химия Решение задач 10-11 класса Г Е Рудзитис , Ф Г Фельдман 2000 год 3) Химия Решения и ответы 8-9 класса Г Е Рудзитис ДенисОтвечает за несколько часов Решебник по химии 10 класс органическая химия рудзитис г е ferma-partnerru › Фермеру 9 нояб 2017 г — ГДЗ, Решебники к учебникам Химии за 10 класс | Все ГДЗ со 2 по Органическая химия , 10 класс ( Рудзитис Г Е , Фельдман Ф Г ) 2001-2012 год 2000 ГДЗ по химии для 10-11 классов 2008 к «Органическая Учебник Г Е РУДЗИТИС, Ф Г Фельдман ХИМИЯ 8 кл 1995 год Учебник Г Е Рудзитис , Ф Г Фельдман ХИМИЯ 7-11 класс 1986 год Решебник Химия 10 , 11 класс Решения и ответы К учебникам Г Е Рудзитиса , Ф Г Фельдмана Рудзитис Фельдман Химия 11 класс 2000 год учебник 1 р Сигареты winston Винстон за 2 блока Германия Дюти Фри Быстрая Отправка ГДЗ по химии 8 класс Рудзитис, Фельдман › Химия › 8 класс Похожие Решебник по химии за 8 класс авторы Рудзитис , Фельдман издательство Просвещение Химия 11 класс рудзитис фельдман 2009 решебник онлайн Похожие 23 мар 2015 г — Решебник (ГДЗ) по учебнику Химия , 11 класс ( Г Е Рудзитис , Ф Г Фельдман ) Рудзитис ГЕ, Фельдман ФГ Домашняя работа по химии за 11 класс к учебнику ФГ 11 класс; 10 класс ; 9 Рудзитис ГЕ, Фельдман Именно в этот момент решебник химия 8 класс Фельдман, год издания 2000 Элекронный каталог библиотеки СГСПУ irbispgsgaru/ISAPI//cgiirbis_64dll?SGOD10 каталога 2000 -2008 автору · заглавию, году издания, типу документа 10 класс [Текст] : учебное пособие ; из учебника Г Е Рудзитиса и ФГ ( Решебник ) общеобразовательных учреждений / Г Е Рудзитис , Ф Г Фельдман — 7е изд Домашняя работа по химии за 10 класс [Текст] : решение задач из Решебник к учебнику химии 10 класс фельдман рудзитис 23 мар 2015 г — Рудзитис ГЕ, Фельдман ФГ Домашняя работа по химии за 10 класс к учебнику « Химия 10 класс » Решебник « Химия 10 класс » Г Е Рудзитис , Ф Г Фельдман ГДЗ по химии М: Астрель, год к учебнику « Химия 10 класс Органическая химия , 10 класс (Рудзитис Г Е, Фельдман Ф Г) 2000 [PDF] скачать электронный вариант решебник по химии 10 класс ге erbenradurpeddfileswordpresscom/2017/01/216pdf Готовые Химия 10 класс , Рудзитис Г Е , Фельдман Ф Г , 1999 • Химия 2009 год электронная библиотека готовые контрольные работы по бжд Новости по запросу скачать решебник за 11 класс 2010 года Рудзитис Г Е , Фельдман Ф Г М: Просвещение, 2000 скачать решебник по химии 10 класс о [PDF] гдз рудзитис ге фельдман фг химия: 10 класс 160 с — WordPresscom Органическая химия , 10 класс (Рудзитис Г Е, Фельдман Ф Г) 2000 Г Е, Фельдман Ф Г за 10 класс к учебнику « Химия 10 класс » Г Е Рудзитис , Ф Г Фельдман Как искать: №3 Как Ф Бархударов СГ 2009 год 2009 — 160с Пояснения к фильтрации результатов Мы скрыли некоторые результаты, которые очень похожи на уже представленные выше (40) Показать скрытые результаты Некоторые результаты поиска могли быть удалены в соответствии с местным законодательством Подробнее Вместе с решебник химия 10 класс герудзитис фгфельдман за 2000 год часто ищут гдз по химии 10 класс рудзитис практическая работа 2 гдз по химии 10 класс рудзитис 2014 химия 10 класс рудзитис учебник гдз по химии 10 класс рудзитис тестовые задания гдз по химии 10 класс рудзитис фельдман 1999 гдз по химии 10 класс рудзитис 2017 учебник по химии 10 класс рудзитис 2016 гдз по химии 10 класс рудзитис фгос Ссылки в нижнем колонтитуле Россия — Подробнее… Справка Отправить отзыв Конфиденциальность Условия Аккаунт Поиск Карты YouTube Play Новости Почта Контакты Диск Календарь Google+ Переводчик Фото Ещё Документы Blogger Hangouts Google Keep Подборки Другие сервисы Google
Яндекс Яндекс Найти Поиск Поиск Картинки Видео Карты Маркет Новости ТВ онлайн Музыка Переводчик Диск Почта Коллекции Все Ещё Дополнительная информация о запросе Показаны результаты для Нижнего Новгорода Москва 1 Решебник (ГДЗ) Химия 10 класс Г Е Рудзитис | Вклассе vklasseonline › 10…reshebniki…rudzitis…feldman-2000 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Учебник: Химия 10 класс Г Е Рудзитис , Ф Г Фельдман ( 2000 год ) Если ваши родители опасаются, что освоение химии с помощью такого пособия сведется к элементарному бездумному списыванию, то попробуйте доказать необходимость в нем такими аргументами Большой объем материала и Читать ещё Учебник: Химия 10 класс Г Е Рудзитис , Ф Г Фельдман ( 2000 год ) + Глава 1 Теория химического органических соединений Электронная природа химических связей Если ваши родители опасаются, что освоение химии с помощью такого пособия сведется к элементарному бездумному списыванию, то попробуйте доказать необходимость в нем такими аргументами Большой объем материала и возникающий в результате этого дефицит времени, когда у преподавателя просто нет возможности подробно объяснить все ключевые вопросы изучаемого раздела Очень много вопросов остается для самостоятельного изучения и решебник по химии 10 рудзитис в этом деле — лучший помощник Скрыть 2 ГДЗ ( решебник ) по химии 10 класс Рудзитис , Фельдман reshatorru › 10 класс › Химия › Рудзитис Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте ГДЗ (домашнее задание) по химии за 10 класс к учебнику Рудзитис Рудзитис , Фельдман «Просвещение» 2014 год Читать ещё ГДЗ (домашнее задание) по химии за 10 класс к учебнику Рудзитис Рудзитис , Фельдман «Просвещение» 2014 год Глава 1 Теория химического строения органических соединений Электронная природа Химических связей § 1 Предмет органической химии : Вопросы до параграфа: вопрос №1 вопрос №2 вопрос №3 Подумайте, ответьте, выполните: задание №1 задание №2 задание №3 задание №4 задание №5 тестовые задания: тест №1 тест №2 §2 Теория химического строения органических веществ: Вопросы до параграфа: вопрос №1 Подумайте, ответьте, выполните: задание №1 задание №2 Скрыть 3 Решебник (ГДЗ) Химия 10 класс 1999 г Рудзитис gdzometrby › book36 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Ответы к учебнику по химии для 10 класса Рудзитис 1999 год 1999 г Рудзитис Г Е , Фельдман Ф Г Читать ещё Ответы к учебнику по химии для 10 класса Рудзитис 1999 год 1999 г Рудзитис Г Е , Фельдман Ф Г « Химия 10 класс 1999 г » ГДЗ Рудзитис Г Е , Фельдман Ф Г Ответы к учебнику по химии для 10 класса Рудзитис Химия 10 класс Рудзитис Г Е , Фельдман Ф Г , 1999 г Химия 10 класс Рудзитис Г Е , Фельдман Ф Г 2012 г Скрыть 4 Решебник по химии Рудзитис Фельдман 10 класс reshakru › ГДЗ › ГДЗ Рудзитис 10 класс Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Учебник Химия Рудзитис Фельдман в 10 классе во все времена имел большие трудности в изучении Школьникам приходилось очень много тратить времени на изучение химии , даже если она не требуется в дальнейшем обучении Читать ещё Учебник Химия Рудзитис Фельдман в 10 классе во все времена имел большие трудности в изучении Школьникам приходилось очень много тратить времени на изучение химии , даже если она не требуется в дальнейшем обучении Именно с этой целью на решакру был выпущен обновленный решебник 2017, в котором есть сразу по два варианта ответа Такая тактика с двумя ответами уже знакома вам на решакру, поэтому не должна вызвать дополнительных сложностей Полезность данного метода очевидна — если вы не поняли один вариант ответа, на помощь придет другой, и, таким образом, у вас сложится общее понимание ответа Скрыть 5 ГДЗ по химии 10 класс Рудзитис , Фельдман решебник GDZplusru › 10-klass/himiya/rudzitis/ Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте 10 класс ГДЗ по химии за 10 класс Рудзитис , Фельдман Онлайн решебник к учебнику Читать ещё 10 класс ГДЗ по химии за 10 класс Рудзитис , Фельдман Онлайн решебник к учебнику Рудзитис , Фельдман «Просвещение», 2014 1глава Глава I Теория химического строения органических соединений (Параграфы с 1 по 4) §1 Предмет органической химии : Вопросы до параграфа: 1; 2; 3 Скрыть 6 ГДЗ по химии 10 класс Рудзитис , Фельдман 1999- 2000 mirurokovru › гдз…химии/10…рудзитис-фельдман…2000… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Рудзитис , Фельдман 1999 г ГДЗ по химии 10 класс Рудзитис , Фельдман 1999- 2000 г онлайн Блок рекомендуемого контента Читать ещё Рудзитис , Фельдман 1999 г ГДЗ по химии 10 класс Рудзитис , Фельдман 1999- 2000 г онлайн Блок рекомендуемого контента Понравился сайт поделись с друзьями и добавь в закладки, нажми Ctrl + d Rt: 001449 sec / Sun, 28 Oct 2018 18:44:06 Скрыть 7 ГДЗ по химии за 10 класс к учебнику « Химия 10 класс » 5terkacom › reshebnik-khimiya-10…rudzitis…feldman… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте 10 класс » Г Е Рудзитис , Ф Г Фельдман Описание решебника : В учебнике по химии за 10 класс Г Е Рудзитис Ф Г Фельдман вопросы и задачи задаются в конце главы, либо в конце параграфа Читать ещё 10 класс » Г Е Рудзитис , Ф Г Фельдман Описание решебника : В учебнике по химии за 10 класс Г Е Рудзитис Ф Г Фельдман вопросы и задачи задаются в конце главы, либо в конце параграфа Сначала следуют теоретические вопросы, потом задачи, при этом задач в 5-6 раз меньше, чем вопросов по теории В конце многих глав предложено составить конспект ответа (он уже составлен и вы можете его посмотреть на нашем сайте, ищите по оглавлению) Решения и ответы к этому учебнику по химии очень подробные, с формулами и объяснениями Теория разобрана в лучшем виде Единственный вопрос, на который вам нужно будет о Скрыть 8 Решебник (ГДЗ) Химия , 10 класс ( Г Е Рудзитис docbazaru › Решебники › Химия › 10 класс › Рудзитис Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Решебник по учебнику: Домашняя работа по химии за 10 класс к учебнику « Химия 10 класс », Г Е Рудзитис , Ф Г Фельдман , М: «Просвещение», 2000 г Страницы решебника Читать ещё Решебник по учебнику: Домашняя работа по химии за 10 класс к учебнику « Химия 10 класс », Г Е Рудзитис , Ф Г Фельдман , М: «Просвещение», 2000 г Страницы решебника : 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 10 Скрыть 9 Решебник Химия 10 класс геРудзитис фгФельдман за 2000 год — смотрите картинки ЯндексКартинки › решебник химия 10 класс герудзитис фгфельдман Пожаловаться Информация о сайте Ещё картинки 10 ГДЗ решебник по Химии 10 класс Рудзитис Фельдман GdzMonsternet › 10-klass/gdz-po…rudzitis-feldman/ Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Авторы: Рудзитис Г Е , Фельдман Ф Г Класс: 10 Предмет: Химия Выберите подходящее издание решебника Химия 10 класс Рудзитис Фельдман 2000 Химия 10 класс Рудзитис Фельдман 2012 Готовые задания Тип задания Читать ещё Авторы: Рудзитис Г Е , Фельдман Ф Г Класс: 10 Предмет: Химия Выберите подходящее издание решебника Химия 10 класс Рудзитис Фельдман 2000 Химия 10 класс Рудзитис Фельдман 2012 Готовые задания Тип задания Лаб работа, Страница 0 1 2 3 4 5 6 7 8 9 10 11 12 Прак работа, Страница 0 Скрыть Химия 10 класс Базовый уровень Рудзитис allengorg › d/chem/chem123htm Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Рудзитис Г Е , Фельдман Ф Г Данный учебник — основной элемент информационно-образовательной среды учебно-методического комплекта по органической химии для 10 класса Читать ещё Рудзитис Г Е , Фельдман Ф Г М: 2014 — 224 с 15- е изд — М: 2012 — 192 с Данный учебник — основной элемент информационно-образовательной среды учебно-методического комплекта по органической химии для 10 класса Учебник позволяет обеспечить достижение предметных, метапредметных и личностных результатов образовании в соответствии с требованиями Федерального государственного образовательного стандарта среднего (полного) общего образования Скрыть ГДЗ по химии за 10 класс Рудзитиса , Фельдман otvetplus › 10-klass/himija/rudzitis/ Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Разбор задач из школьного учебника по химии за 10 класс авторов: Рудзитис Г Е , Фельдман Ф Г Дополнительное Сложно даются лабораторные работы и решение экспериментальных задач — используйте ГДЗ по химии 10 класс Рудзитиса , представленные на нашем сайте С ними вы сможете разобраться в сложной Читать ещё Разбор задач из школьного учебника по химии за 10 класс авторов: Рудзитис Г Е , Фельдман Ф Г Дополнительное пояснение к решению примеров Сложно даются лабораторные работы и решение экспериментальных задач — используйте ГДЗ по химии 10 класс Рудзитиса , представленные на нашем сайте С ними вы сможете разобраться в сложной теме самостоятельно Рудзитис Г Е , Фельдман Ф Г «Просвещение» 2014 Глава 1 Теория химического строения органических соединений Скрыть ГДЗ ( решебник ) по химии 10 класс — Рудзитис Фельдман 11klasovru › …himiya-10-klass-rudzitis-ge-feldman… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте 10 класс Рудзитис Г Е , Фельдман Ф Г М: Просвещение, 2000 Домашняя работа по химии за 10 класс к учебнику Химия ГДЗ: Решебник Химия 10 класс Г Е Рудзитис yougdzcom › exesizephp?id=549 Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Химия 10 класс Авторы: Г Е Рудзитис , Ф Г Фельдман Издательство: 2012 год Задания: открыть список § 10 Получение, свойства и применение алкенов 1 2 3 4 § 11 Понятие о диеновых углеводородах Читать ещё Химия 10 класс Авторы: Г Е Рудзитис , Ф Г Фельдман Издательство: 2012 год Задания: открыть список Глава 1 Теория химического строения органических соединений § 2 Основные положения теории химического строения органических веществ 4 § 3 Электронная природа химических связей в органических соединениях § 10 Получение, свойства и применение алкенов 1 2 3 4 § 11 Понятие о диеновых углеводородах 2 Скрыть ГДЗ по химии 10 класс Рудзитис Г Е , Фельдман Ф Г eurokiorg › gdz…himiya/10_klass/g…rudzitis…feldman… Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте ГДЗ химия 10 класс Рудзитис Г Е , Фельдман Ф Г М: Просвещение А ученики выпускных классов смогут повторить материал Учителя и репетиторы также могут использовать решебник для подготовки к урокам и проверки знаний своих учащихся Читать далее Читать ещё ГДЗ химия 10 класс Рудзитис Г Е , Фельдман Ф Г М: Просвещение Химия в старших классах – увлекательный и невероятно интересный предмет Школьники знакомятся с такими понятиями, как углеводами и углеродами, альдегидами, карбоновыми кислотами, спиртами и фенолами, эфирами и жирами, изучают строение органических соединений Курс химии как чрезвычайно интересный, так и достаточно сложный А ученики выпускных классов смогут повторить материал Учителя и репетиторы также могут использовать решебник для подготовки к урокам и проверки знаний своих учащихся Читать далее Скрыть Химия 10 класс Рудзитис Г Е , Фельдман Ф Г — ГДЗ domashkasu › gdz/klass10/himiya/10-himiya-rudzitis Сохранённая копия Показать ещё с сайта Пожаловаться Информация о сайте Рудзитис Г Е Химия за 10 класс — ГДЗ Химия Класс 10 Учебник Рудзитис Г Е Подробнее Химия 10 класс Другие решебники Алгебра и начала анализа Задачник 10-11 класс, Мордкович А Г Читать ещё Рудзитис Г Е Химия за 10 класс — ГДЗ Предмет Химия Класс 10 Учебник Рудзитис Г Е Подробнее Химия 10 класс Рудзитис Г Е , Фельдман Ф Г Найти Все решебники по химии Другие решебники Алгебра и начала анализа Задачник 10-11 класс, Мордкович А Г Дидактические материалы по алгебре и началам анализа для 10 класса , Ивлев БМ, Саакян СМ, Шварцбурд СИ Химия , 10 класс , Габриелян ОС, Ф НМаскаев, СЮПономарев, ВИТеренин ГДЗ ГДЗ за 6 класс ГДЗ за 7 класс ГДЗ за 8 класс ГДЗ за 9 класс ГДЗ за 10 класс ГДЗ за 11 класс ГДЗ ГДЗ по алгебре Скрыть Зажим КРЕП КОМП за 10 ф за 1060 р – Доставка/самовывоз Зажимы для троса Распродажа Акции Адрес магазина в ННовгороде nnvseinstrumentiru Не подходит по запросу Спам или мошенничество Мешает видеть результаты Информация о сайте реклама Гарантия 100% Покупайте у профессионалов! Контактная информация +7 (800) 550-37-70 пн-вс 8:00-20:00 Нижний Новгород Скачать: химия 10 класс / litresru litresru Не подходит по запросу Спам или мошенничество Мешает видеть результаты Информация о сайте реклама Школьные учебники скачивайте онлайн в электронном формате на ЛитРес Контактная информация +7 (800) 333-27-37 круглосуточно Магазин на Маркете 18+ Вместе с « решебник химия 10 класс герудзитис фгфельдман за 2000 год » ищут: решебник химия 10 класс габриелян решебник химия 10 класс габриелян профильный уровень решебник химия 10 класс рудзитис фельдман решебник химия 10 класс габриелян базовый уровень решебник химия 10 класс решебник химия 10 класс габриелян углубленный уровень решебник химия 10 решебник химия 10 класс рудзитис решебник химия 10 класс новошинский базовый уровень гдз химия 10 класс кузнецова гара базовый уровень решебник 1 2 3 4 5 дальше Браузер Все новые вкладки с анимированным фоном 0+ Скачать
(PDF) Связность курсов физики и химии в группе терминов
Связность курсов физики и химии в группе из
терминов
Гнитецкая Татьяна Николаевна
1, a
, Пурышева Наталья Сергеевна
2, б
, Иванова Елена Б.
3, с
1, 3
Школа естественных наук, Дальневосточный федеральный университет,
Россия, Владивосток, ул. Суханова, 8, 6
1
2
Физико-информационный факультет.Московский Государственный Педагогический Университет.
Россия, г. Москва, Малая Пироговская ул., 29, 119992
a
e-mail: [email protected],
b-с
e-mail: lena — iv @ mail. ru
Ключевые слова: межпредметные связи, емкость кластера, связность физики и химии,
формирование межпредметного кластера физики и химии.
Аннотация. В данной статье представлены результаты сравнения связности между старшими
школьными курсами физики и химии.Расчет связности
проводился в рамках графовой модели межпредметных связей, разработанной Гнитецкой Татьяной Н. На этой модели основано межпредметное пространство
курсов физики и химии. Количественные характеристики
этой модели используются для установления иерархии физических терминов, используемых в химии, и химических терминов
, используемых в физике для всех комбинаций рассматриваемых курсов физики и химии. Рассчитаны количественные
Рассчитаны количественные
значений связанности между курсами физики и химии; Они
используются в качестве основы для выбора курсов физики и химии исходя из позиции
связности.
Введение
Очевидно, что подготовка специалистов в области физико-химических технологий начинается в средней школе, а
— не в университетах. Целостность и всесторонняя структура предметов
физики и химии в старших классах школы определяют последующий уровень способности учащихся понимать
сложные химические законы окружающей среды.Очень важно установить связи с предметами
, такими как физика, химия, биология и другими, с самых ранних этапов изучения химии. [1]
Студентам будет легче преодолевать барьеры новых знаний, если они будут изучать одни и те же природные явления
по разным предметам во взаимосвязи друг с другом.
Иными словами, при изучении
предметов естествознания целесообразно определить межпредметные связи и сделать акцент на них. Существует множество исследовательских работ, описывающих межпредметные ссылки на качественном уровне
Существует множество исследовательских работ, описывающих межпредметные ссылки на качественном уровне
. Нами разработана количественная модель межпредметных связей в графах и информационных представлениях
. Основные принципы функционирования моделей описаны в
работах [1, 8, 9].
Применение нашей модели межпредметных связей к различным педагогическим задачам описано в
многих статьях [статьи — Scopus].В данной статье дается описание и предлагается решение
проблемы объединения межпредметного содержания школьных учебников химии и физики
на примере начального курса химии, описанного тремя разными авторами
и физики, описанной тремя группами авторов.
Связность учебников физики и химии через группу физических терминов.
Расчет содержательной связанности различных учебников физики и химии на основе графовой модели межпредметных связей
проводится в несколько этапов.Первый этап предполагает формирование
прямых межпредметных пространств Физика — Химия и обратная Химия — Физика для каждой пары из
учебников. В соответствии с нашим определением межпредметных связей, курс физики является базовым в прямом межпредметном пространстве
В соответствии с нашим определением межпредметных связей, курс физики является базовым в прямом межпредметном пространстве
и представлен группой физических терминов, используемых в содержании
Advanced Materials Research Vols. 1033-1034 (2014) pp 1391-1394 Отправлено: 24.07.2014
Онлайн доступно с 01 октября 2014 г. на www.Scientific.net Принято: 03.08.2014
© (2014) Trans Tech Publications, Швейцария
doi: 10.4028 / www.scientific.net / AMR.1033-1034.1391
Все права защищены. Никакая часть содержания этого документа не может быть воспроизведена или передана в любой форме и любыми средствами без письменного разрешения TTP,
www.ttp.net. (ID: 77.35.50.132-03 / 10 / 14,03: 24: 51)
Ацетилен реагирует с бромной водой. Эксперименты по химии
Описание экспериментов и текст — Ph.Д. Павел Беспалов.
Взаимодействие ацетилена с хлором
Насыпьте в цилиндр небольшое количество кристаллов перманганата калия и бросьте кусок карбида кальция. Затем в баллон наливаем соляную кислоту. В сосуде наблюдаются вспышки, стенки цилиндра покрыты сажей. При взаимодействии соляной кислоты с перманганатом калия выделяется газообразный хлор
Затем в баллон наливаем соляную кислоту. В сосуде наблюдаются вспышки, стенки цилиндра покрыты сажей. При взаимодействии соляной кислоты с перманганатом калия выделяется газообразный хлор
16 HCI + 2KMnO 4 = 5CI 2 + 2 KCI + 2 MnCI 2 + 8H 2 O
Карбид кальция с соляной кислотой дает ацетилен
CaC 2 + 2 HCI = C 2 H 2 + CaCI 2
Хлор взаимодействует с ацетиленом с образованием хлористого водорода и угля
C 2 H 2 + CI 2 = 2C + 2 H CI
Оснащение: цилиндр , шпатель.
Техника безопасности. Соблюдайте правила работы с горючими газами. Опыт нужно проводить только на тяге. После эксперимента наполните цилиндр водой.
Взаимодействие этилена с бромной водой
Этилен получают нагреванием смеси этилового спирта с концентрированной серной кислотой. Выделившийся этилен пропускают через раствор брома в воде, который называется бромной водой. Бромная вода очень быстро обесцвечивается. Бром присоединяется к этилену по месту двойной связи. Образуется 1,2-дибромэтан.
Бром присоединяется к этилену по месту двойной связи. Образуется 1,2-дибромэтан.
CH 2 = CH 2 + Br 2 = Канал 2 Br — Канал 2 Br
Реакция обесцвечивания водного раствора брома служит качественной реакцией на ненасыщенность органических соединений.
Оснащение:
Техника безопасности.
Взаимодействие ацетилена с бромной водой
Ацетилен получают под действием воды на карбид кальция. Пропустим выделившийся ацетилен через бромную воду. Наблюдаем обесцвечивание бромной воды. Бром присоединяется к ацетилену по тройной связи. При этом образуется соединение с четырьмя атомами брома в молекуле — 1,1,2,2-тетрабромэтан.
CH ≡ CH + 2 Br 2 = CHBr 2 — CHBr 2
Обесцвечивание бромной воды свидетельствует об отсутствии ацетилена.
Оборудование: Колба Вюрца, делительная воронка, газоотводная трубка, химический стакан или пробирка, штатив.
Техника безопасности. Эксперимент проводить на тяге. Соблюдайте правила работы с горючими газами.
Взаимодействие ацетилена с раствором перманганата калия
Ацетилен получают под действием воды на карбид кальция. Когда ацетилен пропускается через подкисленный раствор перманганата калия, мы наблюдаем быстрое изменение цвета раствора.Ацетилен окисляется в месте разрыва тройной связи с образованием продукта окисления — щавелевой кислоты. В избытке перманганата калия щавелевая кислота окисляется до диоксида углерода и воды.
Изменение цвета раствора перманганата калия свидетельствует о ненасыщенности ацетилена.
Оборудование: Колба Вюрца, делительная воронка, газоотводная трубка, стакан, подставка.
Техника безопасности. Соблюдайте правила работы с горючими газами.
Взаимодействие этилена с раствором перманганата калия.
Этилен получают нагреванием смеси этилового спирта с концентрированной серной кислотой. Опускаем газоотводную трубку с выделившимся этиленом в подкисленный раствор перманганата калия. Раствор быстро обесцвечивается. В этом случае этилен окисляется до этиленгликоля двухатомного спирта.
CH 2 = CH 2 + [O] + H-OH = CH 2 IT — Канал 2 IT
Эта реакция представляет собой качественную реакцию двойной связи.
Оборудование: Колба Würz, капельная воронка, промывочная бутылка, газоотводная трубка, химический стакан или пробирка, штатив.
Техника безопасности.
Соблюдайте правила работы с горючими газами, концентрированными кислотами и легковоспламеняющимися жидкостями.
Взрыв смеси ацетилена с кислородом
Смесь ацетилена и кислорода при воспламенении взрывается с большой силой. Поэтому смело экспериментировать только с небольшими объемами смеси — в этом нам поможет мыльный раствор. Добавьте перекись водорода в фарфоровый раствор с водой и мыльным раствором. В полученный раствор добавляем катализатор — диоксид марганца. Выделение кислорода начинается немедленно.
Добавьте перекись водорода в фарфоровый раствор с водой и мыльным раствором. В полученный раствор добавляем катализатор — диоксид марганца. Выделение кислорода начинается немедленно.
2H 2 O 2 = 2H 2 O + O 2
Окуните в эту смесь небольшой кусочек карбида кальция. При взаимодействии с водой дает ацетилен.
CaC 2 + 2 H 2 O = C 2 H 2 + Ca (OH) 2
На поверхности раствора из-за наличия мыла образуются пузырьки, наполненные смесью ацетилена и кислорода.При воспламенении пузырьков происходят сильные взрывы смеси ацетилена и кислорода.
Оборудование: ступка фарфоровая, горелка.
Техника безопасности. Соблюдайте правила работы с горючими газами. Можно воспламенить лишь небольшое количество смеси.
Сжигание ацетилена
Получим ацетилен из карбида кальция и воды. Закрываем колбу пробкой с газоотводной трубкой. В конец газоотводной трубки вставляется инъекционная игла.Через некоторое время, когда ацетилен полностью вытеснит воздух из колбы, воспламеняем выделяющийся газ. Ацетилен горит ярким белым пламенем. Когда горит ацетилен, образуется углекислый газ и вода.
Ацетилен горит ярким белым пламенем. Когда горит ацетилен, образуется углекислый газ и вода.
2СН ≡ СН + 5О 2 → 4СО 2 + 2Н 2 О
Поднесем пробирку к пламени горящего ацетилена. Сажа оседает на пробирке. При недостатке кислорода ацетилен не успевает полностью выгореть и выделяет углерод в виде сажи. Свечение пламени обусловлено высоким содержанием углерода в ацетилене и высокой температурой его пламени, в котором нагреваются несгоревшие частицы углерода.
Комплектация: колба круглодонная, пробка с иглой от медицинского шприца, тренога.
Техника безопасности. Соблюдайте правила работы с горючими газами. Ацетилен можно воспламенить только после взятия пробы на чистоту.
Сжигание этилена
Этилен получают нагреванием смеси этилового спирта с концентрированной серной кислотой. Смесь готовят из одной части спирта и трех частей серной кислоты.Серная кислота действует как дегидратирующий агент. При нагревании смеси выделяется этилен.
C 2 H 5 OH = C 2 H 4 + H 2 O
Собираем этилен в баллон, вытесняя воду. Этилен — бесцветный газ, мало растворимый в воде. Этилен горит на воздухе с образованием диоксида углерода и воды.
C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O
Оборудование: Колба Вюрца, делительная воронка, промывочный баллон, газоотводная трубка, подставка, баллон.
Техника безопасности. Соблюдайте правила работы с горючими газами, концентрированными кислотами и легковоспламеняющимися жидкостями.
Получение ацетиленида меди
Ацетилен получают под действием воды на карбид кальция. Атомы водорода в молекуле ацетилена очень подвижны. Поэтому их легко заменить металлами. Пропустим ацетилен через аммиачный раствор хлорида меди (I). Образуется красный осадок ацетиленида меди (I).
CH ≡ CH + 2 CuCI → CuC ≡ CCu ↓ + 2 HCI
Оснащение:
Техника безопасности. Соблюдайте правила работы с горючими газами. Получите только небольшое количество ацетиленида меди. Высушенный ацетиленид меди — очень опасное взрывчатое вещество. Он разрушается обработкой концентрированной соляной кислотой.
Соблюдайте правила работы с горючими газами. Получите только небольшое количество ацетиленида меди. Высушенный ацетиленид меди — очень опасное взрывчатое вещество. Он разрушается обработкой концентрированной соляной кислотой.
Получение ацетиленида серебра
Ацетилен получают под действием воды на карбид кальция.Атомы водорода в молекуле ацетилена очень подвижны. Поэтому их легко заменить металлами. Пропустим ацетилен через аммиачный раствор оксида серебра. Ацетиленид серебра выпадает в осадок.
CH ≡ CH + A г 2 O → AgC ≡ CAg ↓ + H 2 О
Оборудование: Колба Вюрца, делительная воронка, газоотводная трубка, химический стакан или пробирка, полипропиленовая воронка, фильтровальная бумага, подставка.
Техника безопасности. Соблюдайте правила работы с горючими газами. Получите только небольшое количество ацетиленида серебра. Высушенный ацетиленид серебра — очень опасное взрывчатое вещество. Он разрушается обработкой концентрированной соляной кислотой.
Высушенный ацетиленид серебра — очень опасное взрывчатое вещество. Он разрушается обработкой концентрированной соляной кислотой.
Хрупкость ацетиленидов металлов
Ацетилениды металлов являются нестабильными соединениями. Во влажном состоянии ацетиленид серебра стабилен; при высыхании легко взрывается. Поднесем к сухому ацетилиду серебра тлеющий осколок — он взорвется.Проведем аналогичный эксперимент с ацетилидом меди (I). Как и ацетиленид серебра, ацетиленид меди (I) стабилен во влажном состоянии, но легко разлагается при сушке. Горящий осколок, доведенный до высыхания ацетиленида меди (I), приводит к взрыву. Это дает зеленое пламя.
Оборудование: лента огнезащитная, осколок.
Техника безопасности. Можно получить и разложить только небольшое количество ацетиленида серебра и меди. Высушенные ацетилениды серебра и меди являются опасными взрывчатыми веществами.Ацетилениды разрушаются обработкой концентрированной соляной кислотой.
Алкины (иначе ацетиленовые углеводороды) представляют собой углеводороды, содержащие тройную связь между атомами углерода, с общей формулой Cnh3n-2. Атомы углерода в тройной связи находятся в состоянии sp-гибридизации.
Молекула ацетилена содержит тройную связь, бром ее разрушает и присоединяет к ацетилену. Образуется терабромэтан. Бром расходуется на образование тетрабромэтана. Бромная вода (желтая) — обесцвечивается.
Эта реакция протекает с меньшей скоростью, чем в ряду этиленовых углеводородов. Реакция также протекает поэтапно:
HC ≡ CH + Br 2 → CHBr = CHBr + Br 2 → CHBr 2 — CHBr 2
ацетилен → 1,2-дибромэтан → 1,1,2,2-тетрабромэтан
Обесцвечивание бромной воды свидетельствует об отсутствии ацетилена.
В растворе перманганата калия ацетилен окисляется, при этом молекула разрывается в месте тройной связи, раствор быстро обесцвечивается.
3НC ≡ СН + 10KMnO 4 + 2H 2 O → 6CO 2 + 10KOH + 10MnO 2
Эта реакция является качественной реакцией двойной и тройной связи.
Если ацетилен пропускается через аммиачный раствор оксида серебра, атомы водорода в молекуле ацетилена легко заменяются металлами, поскольку они обладают высокой подвижностью. В этом эксперименте атомы водорода заменены атомами серебра. Образуется ацетиленид серебра — желтый осадок (взрывчатое вещество).
CH ≡ CH + OH → AgC≡CAg ↓ + NH 3 + H 2 O
Эта реакция является качественной реакцией тройной связи.
Разработка урока химии
10 класс
Урок 8
Тема урока: Алкин. Ацетилен, его получение пиролизом метана и карбидным методом. Химические свойства ацетилена: горение, обесцвечивание бромной воды, добавление хлороводорода и гидратация. Применение ацетилена в зависимости от свойств. Реакция полимеризации винилхлорида.Поливинилхлорид и его применение.
Задачи урока:
— Обобщенная формула, номенклатура, физические свойства представителей гомологического ряда алкинов, их структура, химические свойства первого представителя гомологического ряда алкинов — ацетилена, применение.
— Развивать общеобразовательные компетенции, логическое мышление.
Чтобы повысить познавательный интерес студентов, показать важность знаний по органической химии.
Тип урока: УПНЗ
Информационно-методическая поддержка: слайды, схемы, сборники материалов, таблицы по теме урока.
Характеристика деятельности студентов: фронтальная, индивидуальная, работа за доской.
Типы управления: Опрос.
На занятиях
I. Организационный момент урока
II.Обновление знаний
Обзор основных понятий:
Углеводороды
Насыщенные и ненасыщенные соединения
Алкин: формула серии, первый представитель серии, основные свойства, способы получения, применение.
III. Проверка домашнего задания
IV. Представление нового материала
Алкин — непредельные углеводороды, в молекулах которых помимо одинарных C-C-связей содержится одна тройная C≡ С-связь.
Общая формула ряда: ИЗ n H 2н-2
Особенности номенклатуры alc и новые
Принадлежность углеводорода к классу алкенов отражается суффиксом –In:
ИЗ 2 H 2 CH≡ CH этин (ацетилен)
ИЗ 3 H 4 CH≡ C-CH 3 пропин
ИЗ 4 H 6 CH≡ C-CH 2 -CH 3 бутин-1
и др.
Правила наименования соединений остаются такими же, как и для алкенов, только суффикс заменяется на –In .
Изомерия алкенов
Изомерия структуры углеродной цепи.
Изомерия положения тройной связи.
Межклассовая изомерия.
Структурная изомерия.
Приведите примеры изомеров каждого типа, назовите их!
Особенности строения молекул (например, ацетилена)
В ацетилене углерод находится в состоянии сп — гибридизация (одно- и 1р-орбитальные).Каждый атом углерода в молекуле этилена имеет 2 гибрида sp — орбитали и две негибридные p-орбитали. Оси гибридных орбиталей расположены в одной плоскости, а угол между ними составляет 180 °. Такие орбитали каждого атома углерода пересекаются с орбиталями других атомов углерода и орбитали двух атомов канала, образуя σ. -соединения C-C и C-H.
Схема обучения σ-связей в молекуле ace Тайлена
Четыре негибридных p-орбитали атомов углерода перекрываются во взаимно перпендикулярных плоскостях, которые расположены перпендикулярно плоскости σ -соединения.Вот как два π- коммуникация.
ИЗ ≡ С = σ + 2 π
Схема образования π-связи в молекуле а Тайлена
Структура молекулы ацетилена
Физические свойства
Ацетилен — газ, легче воздуха, мало растворим в воде, без запаха.Образует с воздухом взрывоопасные смеси.
В ряду алкинов температура кипения увеличивается с увеличением молекулярной массы.
Опишите физические свойства ацетилена в виде таблицы в своем блокноте!
Прием
Способы производства ацетилена:
Карбид кальция … (лабораторный метод)
CaC 2 + 2H 2 О → С 2 H 2 + Са (ОН) 2
Получение карбида кальция (в промышленности):
CaO + 3C CaC 2 + CO
оксид кальция кокс карбид кальция
CaCO 3 CaO + CO 2
карбонат кальция оксид кальция
Термическое разложение метана.
2-канальный 4 ОТ 2 H 2 + 3H 2
Способы получения гомологов ацетилена — углеводородов ряда алкинов:
Дегидрогалогенирование — отщепление двух молекул галогенида водорода от дигалогеналканов, содержащих два атома галогена либо у соседних, либо у одного атома углерода:
Реакция протекает под действием спиртового раствора щелочей на производные галогенов.
2 H 5 ITCH 3 — CBr 2 — CH 3 + 2КОН
КАН 3 -C ≡ CH + 2KVr + 2H 2 О КОМПАНИИ,
2,2 — дибромпропан пропин
Химические свойства
6 взаимодействия с галогенами
Реакции присоединения
Качественная реакция на наличие кратных связей — обесцвечивание бромной воды!
Реакции присоединения проходят в две стадии.
ацетальдегид
С металлами.
Продукт реакции — ацетилениды — малорастворимые, нестабильные, взрывоопасные вещества!
Образование серовато-белого осадка ацетиленида серебра или красно-коричневого осадка ацетиленида меди — качественная реакция на концевую тройную связь!
Горение.
Реакции окисления.
Ацетилен может полимеризоваться в бензол и винилацетилен.
Полимеризация винилхлорида
Прочный пластик, искусственная кожа, клеенка, диэлектрики и т. Д. Получают из поливинилхлорида (ПВХ).
Использование ацетилена
Сырье в органическом синтезе (производство волокон, красок, лаков, лекарств, ПВХ, хлорпренового каучука, уксусной кислоты, растворителей и др.))
При резке и сварке металлов.
V. Консолидация знаний.
Решение задач и упражнения
стр. 54 — упражнение 1,3,5,6.
с.55 — упражнение 8
с.55 — задачи 1.
В я … Отражение. Краткое содержание урока
VI я … Домашнее задание
пункт 13,
с. 55 — задания 2, 3
Объясните различия между молекулярной структурой этилена и ацетилена.
Какой углеводород является ближайшим гомологом этина?
Составьте уравнения реакции, с помощью которых можно проводить следующие преобразования, укажите условия реакции, назовите продукты реакции:
ОПРЕДЕЛЕНИЕ
Ненасыщенные (ненасыщенные) углеводороды — углеводороды, содержащие кратные (двойные или тройные) связи.Среди непредельных углеводородов выделяют алкены (содержат одну двойную связь), алкадиены (содержат две двойные связи) и алкины (содержат три двойные связи).
ОПРЕДЕЛЕНИЕ
Алкин — непредельные углеводороды, молекулы которых содержат одну тройную связь, в названии алкинов есть суффикс –в. Общая формула алкинов — C n H 2 n -2.
Таблица 1. Гомологические ряды алкинов.
Чтобы дать название алкину, необходимо выбрать самую длинную углеводородную цепь, содержащую тройную связь.Нумерация цепочки начинается с края, ближе к которому находится тройная связь.
Изомерия
Для алкинов, начиная с пентина, характерна изомерия углеродного скелета:
CH≡C-CH 2 -CH 2 -CH 3 (пентин-1)
CH≡C-CH (CH 3) -CH 3 (3-метилбутин1)
, начиная с бутина, все алкины характеризуются изомерией положения тройной связи:
CH≡C-CH 2 -CH 3 (бутин-1)
CH 3 -C≡C-CH 3 (бутин-2)
Для алкинов характерна межклассовая изомерия с алкадиенами, поэтому веществу состава C 4 H 6 соответствуют три разных вещества — бутин-1, бутин-2 и бутадиен-1,3.
Алкиновая структура
Атомы углерода тройной связи в молекулах алкинов находятся в sp-гибридизации: две σ-связи расположены на одной линии под углом 180 ° C друг к другу, две π-связи образованы p-электронами соседних атомы углерода и расположены во взаимно перпендикулярных плоскостях. Тройная связь — это комбинация одной σ- и двух π-связей.
Физические свойства алкинов
В нормальных условиях C 2 -C 4 — газы, C 5 -C 16 — жидкости, начиная с C 18 — твердые вещества.Температуры алкинов выше, чем у соответствующих алкенов.
Получение
Существуют промышленные и лабораторные методы получения ацетилена. Так, в промышленности ацетилен получают высокотемпературным крекингом метана:
2CH 4 → CH≡CH + 3H 2
В лаборатории ацетилен получают гидролизом карбида кальция:
CaC 2 + 2H 2 O = Ca (OH) 2 + C 2 H 2
Для получения алкинов чаще всего используются:
— реакции дегидрирования алканов и алкенов
CH 3 -CH 3 → CH≡CH + 2H 2
CH 2 = CH 2 → CH≡CH + H 2
— реакции элиминирования дигалогенированных производных
(CH 3) 3 -CCl 2 -CH 3 + 2KOH → (CH 3) 3 -C≡CH + 2KCl + 2H 2 O
— реакции ацетиленидов с первичными галогеналканами
CH≡CNa + CH 3 -CH 2 -CH 2 -Br → CH≡C- (CH 2) 3 -CH 3 + NaBr
Химические свойства алкинов
Алкины характеризуются реакциями присоединения, протекающими по нуклеофильному механизму, например:
— гидрирование — добавление воды в присутствии 18% серной кислоты, сульфата ртути (II) и нагревание до 90 ° C (реакция Кучерова), в результате чего образуются альдегиды
CH≡CH + H 2 O → → CH 3 -CH = O
— галогенирование — добавление галогенов, протекающее в две стадии
CH≡CH + Br 2 → CHBr = CHBr + Br 2 → CHBr 2 -CHBr 2
— гидрогалогенирование — присоединение галогенидов водорода, также протекающее в две стадии, и добавление второй молекулы галогенида водорода происходит по правилу Марковникова (присоединение галогенидов водорода к тройной связи сложнее, чем к двойной)
CH≡CH + HCl → CH 2 = CHCl + HCl → CH 3 -CHCl 2
Алкины с концевой тройной связью характеризуются слабыми кислотными свойствами… Такие алкины способны образовывать соли при взаимодействии с активными металлами:
2R-C≡C-H + 2Na → 2R-C≡C-Na + H 2
Ацетилинид серебра легко образуется и осаждается при пропускании ацетилена через аммиачный раствор оксида серебра:
СH≡CH + Ag 2 O → Ag- С≡C-Ag ↓ + H 2 O
Ацетилен способен тримеризироваться — при пропускании ацетилена над активированным углем при 60 ° C образуется бензол:
3C 2 H 2 → C 6 H 6
Алкины характеризуются реакциями окисления и восстановления.Таким образом, алкины легко окисляются перманганатом калия. В результате этой реакции образуются карбоновые кислоты:
R-C≡C-R ‘+ [O] + H 2 O → R-COOH + R’-COOH
В присутствии металлических катализаторов алкины присоединяют молекулы водорода:
CH 3 -C≡CH + H 2 → CH 3 -CH = CH 2 + H 2 → CH 3 -CH 2 -CH 3
Качественные реакции на тройную связь — это реакции обесцвечивания раствора бромной воды и перманганата калия, а также реакция с аммиачным раствором оксида серебра в случае концевого положения тройной связи.
Примеры решения проблем
ПРИМЕР 1
ПРИМЕР 2
| Задача | Когда смесь пропана и ацетилена пропускали через бутыль с бромной водой, вес бутылки увеличивался на 1,3 г. При полном сгорании того же количества исходной смеси углеводородов выделилось 14 литров (н.у.) окиси углерода (IV). Определите массовую долю пропана в исходной смеси. |
| Решение | Ацетилен абсорбируется бромной водой: НC ≡ СН + 2Вr 2 → НСВr 2 -СНВr 2 1.3 г — масса ацетилена, следовательно, количество ацетиленового вещества: v (C 2 H 2) = 1,3 / 26 = 0,05 моль При сгорании этого количества ацетилена по уравнению 2C 2 H 2 + 5O 2 = 4CO 2 + 2H 2 O Выделено: 2-0,05 = 0,1 моль CO 2 Общее количество CO 2: 14 / 22,4 = 0,625 моль При сжигании пропана в соответствии с уравнением C 3 H 8 + 5O 2 = ZCO 2 + 4H 2 O Выстояло 0.625 — 0,1 = 0,525 моль CO 2 при реагировании 0,525 / 3 = 0,175 моль C 3 H 8 Масса пропана: 0,175 — 44 = 7,7 г. Общая масса смеси углеводородов: 1,3 + 7,7 = 9,0 г Массовая доля пропана составляет: w (C 3 H 8) = 7,7 / 9,0 = 0,856, или 85,6%. |
| Ответ | Массовая доля пропана 85,6%. |
Одновременно демонстрируются эксперименты по получению ацетилена и изучению его свойств.Получение ацетилена. Самый доступный способ получения ацетилена — взаимодействие карбида кальция с водой:
CaC 2 + 2H 2 O C 2 H 2 + Ca (OH) 2
Реакционную колбу не следует брать в слишком малом объеме. , так как в процессе реакции образующаяся густая жидкость разбухает и пена может уноситься газом через патрубок. В случае использования колбы увеличенного размера пройдет много времени, пока весь воздух не будет вытеснен из устройства, а если вы дождетесь этого момента, произойдет большая потеря ацетилена.Удобно использовать колбу на 250 мл. В случае использования колбы большей вместимости эксперименты с ацетиленом можно начать с реакций, не требующих вытеснения воздуха, что позволит проводить их достаточно экономично.
Когда к карбиду кальция добавляют воду, реакция всегда очень бурная; поэтому ацетилен расходуется непроизвольно, и его может не хватить, чтобы показать все запланированные эксперименты. Получить более тихий и равномерный ток ацетилена можно двумя способами: добавить этиловый спирт к карбиду кальция и только потом впустить воду или использовать насыщенный раствор хлорида натрия вместо воды.
В колбу помещают 7-8 штук карбида кальция размером с горошину, плотно вставляют пробку с воронкой, наливают в воронку насыщенный раствор хлорида натрия и несколько капель его капают в колбу. колба. Дальнейшее добавление раствора проводят так, чтобы установился равномерный поток газа со скоростью, позволяющей подсчитывать пузырьки. Студентов привлекает тот факт, что реакция, в отличие от производства этилена и метана, протекает без нагрева.Растворение ацетилена в воде … Ацетилен растворяется в воде лучше, чем метан и этилен.
1. Пропустите ацетилен через воду в пробирке в течение нескольких минут. После этого воду нагревают до кипения и к отверстию пробирки подносят зажженную занозу. Ацетилен, выделяющийся из воды, вспыхивает.
2. Баллон или пробирку с чистым (без воздуха) ацетиленом накрывают отверстием в стакан с тонированной холодной водой. При качании баллона (пробирки) уровень воды в нем заметно поднимается.Сжигание ацетилена … Полное сгорание ацетилена выражается уравнением:
2С 2 Н 2 + 5O 2 4СO 2 + 2Н 2 O
Внешняя картина горения и развиваемая при этом температура сильно зависят от объемного соотношение газов.
Ацетилен, собранный в баллоне, воспламеняется методом вытеснения воды. Газ горит дымным пламенем. По мере движения пламени внутри цилиндра увеличивается образование сажи, поскольку горение в цилиндре протекает даже при большем недостатке кислорода.Взрыв ацетилена кислородом … Смесь ацетилена и кислорода при воспламенении взрывается с большой силой. Поэтому эксперимент можно проводить в стальном баллоне или в такой оболочке, разрыв которой не опасен. Лучше всего показать взрыв ацетилена в мыльных пузырях.
Ацетилен из прибора и кислород из газометра одновременно подают в мыльную воду, заранее приготовленную в железной чашке из расчета 1 г мыла на 30-40 мл воды и 4-5 мл глицерина.Реакция ацетилена с бромом и раствором перманганата калия. Эксперименты, иллюстрирующие недостаток ацетилена, можно провести двумя способами: а) пропуская ацетилен в бромистую воду и раствор перманганата калия, б) переливая эти растворы в цилиндры с ацетиленом.
При демонстрации опытов по первому способу обесцвечивание растворов (особенно бромной воды) происходит довольно медленно. Перемешивание растворов стеклянной палочкой несколько ускоряет процесс.
При демонстрации опытов вторым способом газ с растворами в баллонах встряхивают; обесцвечивание происходит быстрее.
Исходя из строения ацетилена, студенты обычно правильно формулируют уравнения его реакций с бромом:
Реакцию ацетилена с перманганатом калия, как и реакцию этилена, можно здесь рассматривать только в общих чертах. Сжигание ацетилена в хлоре … Ацетилен, как и другие углеводороды, горит в хлоре, образуя хлористый водород и уголь:
C 2 H 2 + CI 2 2C + 2HCI
1. Изогнутая стеклянная трубка, содержащая горящий ацетилен, медленно вводится в баллон с хлором. Ацетилен продолжает гореть в хлоре, образуя сажу. Вы можете заполнить баллон хлором в классе, налив в него немного измельченного перманганата калия и добавив концентрированную соляную кислоту.
2. В баллон с хлором постепенно вводится изогнутая трубка, через которую поступает ацетилен (предварительно проверено на
Stot).Ацетилен легко воспламеняется в хлоре. Опыт показывает высокую реакционную способность ацетилена.
3. Налейте немного отбеливателя в стеклянный цилиндр и залейте разбавленной соляной кислотой. Туда бросают несколько кусочков карбида кальция. Через некоторое время в цилиндре наблюдаются вспышки пламени, которые иногда гаснут, затем появляются снова и перекатываются сверху вниз.
При реакции отбеливателя с кислотой выделяется хлор:
CaCIOCl + 2HCI CaCI 2 + H 2 O + CI 2
, а при взаимодействии карбида кальция с водой — ацетилен (см.Эксперименты с ПВХ … При ознакомлении с ПВХ следует учитывать его отношение к нагреванию, химическим веществам и растворителям. Последние два эксперимента здесь не описываются, так как они проводятся так же, как и с полиэтиленом.
A) Кусочки виниловой пластмассы или пленки ПВХ (клеенка, изоляция) осторожно нагревают в пробирке или фарфоровой чашке.
Убедитесь, что полимер не разжижается, а разлагается. К выделившимся газообразным продуктам разложения подводят влажную лакмусовую бумагу и затем палочку, смоченную в растворе аммиака.В первом случае наблюдается покраснение бумаги, во втором — образование белой дымки. Сделан вывод о выделении хлористого водорода при разложении поливинилхлорида.
Б) Кусочки поливинилхлорида нагревают в пробирке, закрытой пробкой со сливной трубкой. Газообразные продукты разложения переносятся в пробирку с водой. К полученному водному раствору добавить немного раствора нитрата серебра и 1-2 капли азотной кислоты … Наблюдается образование осадка хлористого серебра, что свидетельствует о выделении хлористого водорода при разложении полимера.
эффективных способов. Химия. Руководство для самообучения. Книга для тех, кто хочет сдавать экзамены, а также понимает и любит химию. Элементы общей, неорганической и органической химии
Как самому выучить химию с нуля: эффективные способы. Химия. Руководство для самообучения. Книга для тех, кто хочет сдавать экзамены, а также понимает и любит химию. Элементы общей, неорганической и органической химии
Это сообщение, которое вы получилиНеорганическая химия — основная отрасль химии.К тому же это простейший раздел химии, органическая химия намного сложнее. Вот почему мы начнем изучение химии с неорганической химии. Как вы уже знаете из неорганической химии — — это наука о химических элементах и их неорганических соединениях. Что такое химический элемент ? Химический элемент — это абстрактное понятие, которое относится к простому веществу, состоящему из атомов одного вида. Каждый химический элемент имеет порядковый номер в периодической таблице, который совпадает с числом протонов в атомном ядре.Необходимо отличать сам химический элемент от вещества, которое он обозначает. Химический элемент — это просто название атомов вещества. Но само вещество, даже состоящее из одного атома, может быть в разных формах. Углерод является ярким примером этого. Он может быть в виде черных углей, оставшихся после пожара, в виде брикетов угля или торфа, используемых для обогрева печи, в виде графитового стержня внутри карандаша и даже в виде алмазов. Все они представляют собой разновидности одного и того же химического элемента — углерода.Единственная разница в том, как атомы расположены по отношению друг к другу. Например, в алмазе атомы углерода образуют трехмерную пространственную решетку в виде тетраэдра (пирамиды):
Именно благодаря этой решетке алмаз очень твердый. Графит имеет другую форму кристаллической решетки, поэтому он мягкий и его частицы легко отслаиваются друг от друга:
Чтобы понять химические процессы, а также почему вещество может иметь различную структуру, необходимо знать структуру атомов.Сейчас посмотрим.
Так что же такое атом? И это ядро, расположенное в центре атома, вокруг которого вращаются электроны. При этом не следует представлять, что они летают прямо вокруг ядра, как спутники вокруг Земли или планета вокруг Солнца. На самом деле, что электроны, эти протоны, эти другие элементарные частицы — это такая неизвестная непонятная штуковина, с очень экзотическими свойствами, которые могут одновременно находиться в разных местах … Следовательно, электроны как бы «размазаны» по своей оси. орбиты.И такие электронные орбиты в атомах называются орбиталями .
Ядро состоит из нейтронов и протонов. Нейтроны — это нейтрально заряженные частицы, протоны — положительно заряженные частицы, а электроны — отрицательно заряженные. Следовательно, между последними существуют силы электромагнитного притяжения, в результате чего электроны обычно не улетают от атомов. Да, они обычно не улетают, потому что иногда электроны все же отрываются от их ядер.По какой причине? Например, если к веществу приложено электрическое поле, которое оттянет электроны от атомов (электричество). Или какая-то элементарная частица, такая как фотон (кусочек света), может его выбить. Но обсуждение физики выходит за рамки этих уроков, здесь у нас химия. Итак, идем дальше.
Как вы думаете, ядро может притягивать электрон от соседнего атома? Почему нет? Между ними действуют такие силы электромагнитного взаимодействия. Правда, у другого атома тоже есть ядро, которое не даст электрону улететь.Но сила притяжения никуда не исчезает. Как вы думаете, что произойдет с атомами, находящимися достаточно близко друг к другу? Правильно, они как-нибудь будут взаимодействовать. С одной стороны, ядра пытаются отобрать электроны у соседа, создавая силу притяжения, с другой стороны, электроны соседних атомов будут отталкивать друг друга. Таким образом, атомы будут смещены на такое расстояние, чтобы эти силы уравновесились. Если все атомы одинаковые, то получается кристаллическая решетка (если это твердое тело), или, например, для газов образуются двухатомные молекулы.Вариантов, конечно, больше, но мы рассмотрим их позже в соответствующих разделах.
А если атомы разные? Затем они могут образовывать разные связки друг с другом, которые обычно называют химическими связями … Существуют следующие типы химических связей:
1 . Ковалентная неполярная связь. Это связано с перекрытием так называемых электронных облаков двух атомов. Я уже сказал, что электрон в атоме не находится в одном месте, а как бы размазан по своей орбите (орбитали).Этот электрон, «размазанный» по пространству, и есть электронное облако. То есть те же облака частично перекрывают друг друга ковалентной неполярной связью. Такая связь характерна для простой молекулы, например, H 2 — водород, O 2 — кислород.
2. Ковалентная полярная связь. Фактически, это то же самое, что и ковалентная неполярная связь, но один из атомов слегка притягивает к себе электрон другого атома.
3. Ионная связь. В случае такой связи один из атомов теряет электрон, а другой «захватывает» его себе.В результате оба они становятся ионами с противоположными зарядами, которые, как известно, притягиваются.
4. Связка металлическая. Все атомы в куске металла связаны этой связью. Его суть заключается в том, что атомы металла не могут удерживать один из электронов и легко теряют его. Следовательно, свободные электроны легко циркулируют между атомами.
5. Водородная связь. Это связь, образованная между атомом водорода в одной молекуле и сильно электроотрицательным атомом в другой молекуле. Электроотрицательность — это способность атомов притягивать электроны от других атомов к себе. Наибольший электроотрицательный эффект наблюдается у галогенов — фтора, хлора, а также у сильных окислителей, например, кислорода. Суть такой связи состоит в том, что одна молекула, содержащая сильный электроотрицательный атом, притягивает атом водорода от другой молекулы.
Может возникнуть вопрос: почему водород образует такие связи?
Это объясняется тем, что атомный радиус водорода очень мал.Кроме того, вытесняя или отдавая свой единственный электрон, водород приобретает относительно высокий положительный заряд, из-за чего водород одной молекулы взаимодействует с атомами электроотрицательных элементов, имеющих частичный отрицательный заряд, который входит в состав других молекул ( HF, h3O, Nh4) …
Водородная связь обычно обозначается точками или пунктирными линиями, потому что она представляет собой нечто среднее между химической связью (ковалентной, ионной) и нормальной молекулярной связью: намного слабее первой, но сильнее последней.
Также в неорганической химии принято классифицировать неорганические вещества. Сначала они группируются на простые и сложные.
Простые вещества — это вещества, состоящие только из одного элемента. Они, в свою очередь, делятся на группы:
Металлы. Это вещества, обладающие ярко выраженными металлическими свойствами, а именно: высокой теплопроводностью и электропроводностью и характерным металлическим блеском, твердостью. К металлам относятся такие вещества, как железо (Fe), медь (Cu), натрий (Na), калий (K), литий (Li), серебро (Ag), золото (Au) и другие.Химические свойства металлов заключаются в том, что они легко отдают свой электрон с последних орбиталей.
Неметаллы. Это вещества с типичными неметаллическими свойствами: плохая электропроводность, среди неметаллов есть много веществ, которые при комнатной температуре находятся в газообразном состоянии, например, кислород (O 2), азот (N 2). Но среди неметаллов есть и твердые вещества, например сера (S 2), кремний (Si). Химические свойства неметаллов включают тот факт, что они легче забирают электроны себе, чем отдают их.
Инертные газы. Существует целая группа химических элементов, атомы которых ни с чем не взаимодействуют и не образуют никаких соединений. При комнатной температуре такие вещества находятся в газообразном состоянии. Это гелий (He), неон (Ne), аргон (Ar) и другие. Такие газы называются инертными газами .
Сложные вещества также группируются:
Оксиды. Одним из компонентов этих веществ является кислород.
Гидроксилы. Одним из компонентов таких соединений является гидроксильная группа (ОН — кислород + водород). Чисто такие соединения щелочные.
Кислоты. Комбинация водорода с кислотной группой, такие вещества очень часто химически активны, вступая в реакцию со многими веществами, включая даже коррозию многих металлов.
Соль. Если вы замените атом водорода в кислоте атомом металла, вы получите соль. Например, формула соляной кислоты HCl.И форум хлорида натрия получен из него.
Бинарные соединения. Это соединения двух элементов, например, сероводорода H 2 S (ядовитый и очень пахнущий газ).
Карбонаты. Соли и сложные эфиры угольной кислоты (H 2 CO 3)
Карбиды. Соединения металлов и неметаллов с углеродом.
Цианиды. Соли синильной кислоты (HCN).
Оксиды углерода. Они были отнесены к группе отелей, потому что неясно, угарный газ или карбид кислорода.но все еще общепринято, что сочетание углерода с кислородом и есть монооксид углерода.
Прочие экзотические соединения.
На этом небольшой экскурс по неорганической химии закончен, на следующем уроке начнется сама химия.
Химия считается одним из самых сложных и сложных предметов. Более того, возникают сложности в освоении этого предмета как у школьников, так и у студентов. Почему? Школьники ждут от урока фокусов, интересных переживаний и демонстраций.Но после первых уроков разочарование: лабораторная работа, реагентов не так много, в основном приходится учить новую терминологию, выполнять объемную домашнюю работу. Химический язык полностью отличается от повседневного, поэтому вам нужно учить термины и названия в ускоренном темпе. Кроме того, нужно уметь логически мыслить и применять математические знания.
Можете ли вы выучить химию самостоятельно?
Нет ничего невозможного. Несмотря на сложность науки, химию можно выучить с нуля.В некоторых случаях, когда тема особенно сложна или требует дополнительных знаний, вы можете воспользоваться услугами онлайн-репетитора … Самый удобный способ обучения — с помощью репетиторов по химии по Skype. Дистанционное обучение позволяет подробно изучить конкретную тему или прояснить сложные моменты. Вы можете связаться с квалифицированным преподавателем по Skype в любое время.
Чтобы процесс обучения был эффективным, необходимо несколько факторов:
- Мотивация. В любом деле нужна цель, к которой нужно стремиться.Неважно, для чего учат химию — для поступления в медицинский институт или на биологический факультет, просто для саморазвития. Главное — поставить цель и определить способ ее достижения. Мотивация будет основным движущим фактором, который заставит вас продолжить самостоятельное обучение.
- Важность деталей … За короткое время узнать много информации просто невозможно. Чтобы эффективно изучать химию и уметь правильно использовать знания, нужно обращать внимание на детали: формулы, решать большое количество примеров, задач.Для качественного усвоения материала требуется систематизация информации: самостоятельно изучают новую тему, кроме того, решают задачи и примеры, изучают формулы и т. Д.
- Проверка знаний. Для закрепления пройденного материала рекомендуется периодически делать проверочные работы … Умение разбираться и логически анализировать позволяет усваивать знания лучше, чем «зубрежка». Учителя рекомендуют периодически делать тесты и тесты для себя.Не будут лишними повторы пройденного материала. Самостоятельно выучить химию помогают решебники и пособия по самообучению.
- Практика и снова практика … Недостаточно иметь хорошие теоретические знания, нужно уметь применять их на практике, решая задачи. Практические занятия помогают выявить слабые места в знаниях и закрепить пройденный материал. Кроме того, развиваются аналитические навыки и логическое построение цепочки решений. Решая примеры и задачи, вы делаете выводы и систематизируете полученные знания.Когда задачи станут абсолютно ясными, можно приступить к изучению следующей темы.
- Учитесь сами. Не знаете, как полностью освоить химию? Попробуйте преподать этот предмет кому-нибудь другому. В ходе объяснения материала выявляются слабые места в знаниях, выстраивается систематичность. Важно не торопиться, уделяя внимание деталям и практичности.
Изучить химию самостоятельно с нулевым уровнем можно, если у вас есть сильная мотивация и время. Если материал сложный, разобраться в тонкостях темы помогут профессиональные репетиторы.Будет ли это очное консультирование или по Skype — зависит только от вас. Необязательно проходить полный курс у репетитора; в некоторых случаях можно взять урок по отдельной теме.
Глава 1.
Общие химические законы и законы по охране окружающей среды.
Где начинается химия?
Это сложный вопрос? Каждый ответит на него по-своему.
В средней школе ученики изучают химию несколько лет. Многие неплохо сдают выпускной экзамен по химии.Но…
Беседы с поступающими, а затем с первокурсниками свидетельствуют о том, что остаточные знания по химии после окончания школы незначительны. Некоторые путаются в различных определениях и химических формулах, в то время как другие не могут воспроизвести даже основные понятия и законы химии, не говоря уже о понятиях и законах экологии.
Они так и не начали химию.
Химия, по-видимому, начинается с глубокого освоения ее основ и, прежде всего, основных понятий и законов.
1.1. Основные химические понятия.
В таблице Д.И. Менделеева рядом с символом элемента стоят числа. Одна цифра обозначает порядковый номер элемента, а вторая — атомную массу. Серийный номер имеет свой физический смысл … Об этом мы поговорим позже, здесь мы остановимся на атомной массе и выделим в каких единицах она измеряется.
Следует сразу отметить, что атомная масса элемента, приведенная в таблице, является относительной величиной.За единицу относительной величины атомной массы была взята 1/12 массы атома углерода, изотопа с массовым числом 12, и она была названа атомной единицей массы / а.е./. Следовательно, 1 а.е.м. равняется 1/12 массы изотопа углерода 12 С. И он равен 1,667 * 10 -27 кг. / Абсолютная масса атома углерода 1,99 * 10 -26 кг. /
Атомная масса , приведенная в таблице, — это масса атома, выраженная в атомных единицах массы. Количество безразмерно. Конкретно для каждого элемента атомная масса показывает, во сколько раз масса данного атома больше или меньше 1/12 массы атома углерода.
То же можно сказать и о молекулярной массе.
Молекулярная масса Масса молекулы, выраженная в атомных единицах массы. Значение тоже относительное. Молекулярная масса конкретного вещества равна сумме атомных масс всех элементов, составляющих молекулу.
Важным понятием в химии является понятие «моль». Мотылек — такое количество вещества, которое содержит 6,02 * 10 23 структурных единиц / атомов, молекул, ионов, электронов и т. Д./. Моль атомов, моль молекул, моль ионов и т. Д.
Масса одного моля данного вещества называется его молярной / или молярной / массой. Он измеряется в г / моль или кг / моль и обозначается буквой «М». Например, молярная масса серной кислоты MH 2 SO4 = 98 г / моль.
Следующее понятие — «Эквивалент». Эквивалентом / E / называется такое весовое количество вещества, которое взаимодействует с одним моль атомов водорода или замещает такое количество в химических реакциях… Следовательно, эквивалент водорода E H равен единице. / E N = 1 /. Эквивалент кислорода E O равен восьми / E O = 8 /.
Различают химический эквивалент элемента и химический эквивалент сложного вещества.
Эквивалент элемента — значение переменной. Это зависит от атомной массы / A / и валентности / B /, которую элемент имеет в конкретном соединении. E = A / B. Например, давайте определим эквивалент серы в оксидах SO 2 и SO 3.В SO 2 E S = 32/4 = 8, а в SO 3 E S = 32/6 = 5,33.
Молярная масса эквивалента, выраженная в граммах, называется эквивалентной массой. Следовательно, эквивалентная масса водорода ME H = 1 г / моль, эквивалентная масса кислорода ME O = 8 г / моль.
Химический эквивалент сложного вещества / кислоты, гидроксида, соли, оксида / — это количество соответствующего вещества, которое взаимодействует с одним моль атомов водорода, то есть с одним эквивалентом водорода или заменяет это количество водорода или любого другого вещества в химические реакции.
Кислотный эквивалент / E K / равен частному от деления молекулярной массы кислоты на количество атомов водорода, участвующих в реакции. Для кислоты H 2 SO 4, когда оба атома водорода вступают в реакцию H 2 SO 4 + 2NaOH = Na 2 SO + 2H 2 O, эквивалент будет равен EH 2 SO4 = MH 2 SO 4 / n H = 98. / 2 = 49
Эквивалент гидроксида / E гидр. / определяется как частное от деления молекулярной массы гидроксида на количество реагирующих гидроксильных групп.Например, эквивалент NaOH будет: E NaOH = M NaOH / n OH = 40/1 = 40.
Солевой эквивалент / E соль / можно рассчитать путем деления его молекулярной массы на произведение количества атомов металла, участвующих в реакции, и их валентности. Таким образом, эквивалент соли Al 2 (SO 4) 3 будет равен E Al 2 (SO 4) 3 = M Al 2 (SO 4) 3/6 = 342 / 2,3 = 342/6 = 57.
Оксидный эквивалент / E ok / можно определить как сумму эквивалентов соответствующего элемента и кислорода.Например, эквивалент CO 2 будет равен сумме эквивалентов углерода и кислорода: E CO 2 = E C + E O = 3 + 8 = 7.
Для газообразных веществ удобно использовать эквивалентные объемы / E V /. Поскольку при нормальных условиях моль газа занимает объем 22,4 литра, по этой величине легко определить эквивалентный объем любого газа. Рассмотрим водород. Молярная масса водорода 2 г занимает объем 22,4 литра, тогда его эквивалентная масса 1 г занимает объем 11.2 литра / или 11200 мл /. Следовательно, E V N = 11,2 л. Эквивалентный объем хлора составляет 11,2 л / E VCl = 11,2 л /. Эквивалентный объем CO составляет 3,56 / E VC O = 3,56 л /.
Химический эквивалент элемента или сложного вещества используется в стехиометрических расчетах обменных реакций, а в соответствующих расчетах окислительно-восстановительных реакций уже используются эквиваленты окисления и восстановления.
Окислительный эквивалент , определяемый как частное от деления молекулярной массы окислителя на количество электронов, которые он принимает в данной окислительно-восстановительной реакции.
Восстановительный эквивалент равен молекулярной массе восстановителя, деленной на количество электронов, которые он отдает в данной реакции.
Запишем окислительно-восстановительную реакцию и определим эквивалент окислителя и восстановителя:
5N 2 aS + 2KMnO 4 + 8H 2 SO 4 = S + 2MnSO 4 + K 2 SO 4 + 5Na 2 SO 4 + 8H 2 O
Окислителем в этой реакции является перманганат калия. Эквивалент окислителя будет равен массе KMnO 4, деленной на количество электронов, принятых окислителем в реакцию (nе = 5).E KMnO 4 = M KMnO 4 / ne = 158/5 = 31,5. Молярно-массовый эквивалент окислителя KMnO 4 в кислой среде равен 31,5 г / моль.
Эквивалент восстановителя Na 2 S будет: E Na 4 S = M Na 4 S / ne = 78/2 = 39. Молярная масса эквивалента Na 2 S составляет 39 г / моль.
В электрохимических процессах, в частности при электролизе веществ, используется электрохимический эквивалент. Электрохимический эквивалент определяется как частное от деления химического эквивалента вещества, выделяемого на электроде, на число Фарадея / F /.Более подробно об электрохимическом эквиваленте будет рассказано в соответствующем абзаце курса.
Валентность … Когда атомы взаимодействуют, между ними образуется химическая связь. Каждый атом может образовывать только определенное количество связей. Количество связей определяет такое уникальное свойство каждого элемента, которое называется валентностью. В самом общем виде валентность — это способность атома образовывать химическую связь … Одна химическая связь, которую способен образовывать атом водорода, принимается за единицу валентности.В этом отношении водород является одновалентным элементом, а кислород двухвалентным, потому что не более двух атомов водорода могут связываться с атомом кислорода.
Умение определять валентность каждого элемента, в том числе в химическом составе, является необходимым условием успешного освоения курса химии.
Такое понятие химии, как степень окисления … Под степенью окисления понимается заряд, который элемент имеет в ионном соединении или будет иметь в ковалентном соединении, если бы полная электронная пара баланса была бы полностью смещен на более электроотрицательный элемент.Степень окисления имеет не только числовое выражение, но и соответствующий знак заряда (+) или (-). Валентность этих знаков не имеет. Например, в H 2 SO 4 степень окисления: водород +1, кислород –2, сера +6, а валентность, соответственно, будет 1, 2, 6.
Валентность и степень окисления в численных значениях не всегда совпадают по величине. Например, в молекуле этилового спирта СН 3 –СН 2 –ОН валентности углерода 6, водорода 1, кислорода 2 и степень окисления, например, углерода первого –3, второго –1: — 3 СН 3 — –1 СН 2 –ОН.
1.2. Основные экологические концепции.
В последнее время понятие «экология» глубоко укоренилось в нашем сознании. Это понятие, введенное еще в 1869 году Э. Геккелем / происходит от греческого oikos — дом, место, жилище, logos, — доктрина / все больше и больше беспокоит человечество.
В учебниках биологии экология определяется как наука о взаимоотношениях между живыми организмами и окружающей их средой. Почти созвучное определение экологии дает Б.Небель в своей книге «Экология» — Экология — наука о различных аспектах взаимодействия организмов друг с другом и с окружающей средой. В других источниках можно найти более широкое толкование. Например, Экология — 1 /. Наука, изучающая взаимоотношения организмов, их системных агрегатов и окружающей среды; 2 /. Совокупность научных дисциплин, изучающих взаимосвязь системных биологических структур / от макромолекул до биосферы / друг с другом и с окружающей средой; 3 /.Дисциплина, изучающая общие закономерности функционирования экосистем на различных иерархических уровнях; 4 /. Комплексная наука, изучающая среду обитания живых организмов; 5 /. Изучение положения человека как вида в биосфере планеты, его связи с экологическими системами и воздействия на них; 6 /. Наука о выживании в окружающей среде. / Н. А. Агиджанян, В. И. Торшик. Экология человека. /. Однако под термином «экология» понимается не только наука, но и само состояние окружающей среды и ее влияние на человека, флору и фауну.
Если вы поступили в вуз, но к этому моменту не разобрались в этой сложной науке, мы готовы раскрыть вам несколько секретов и помочь изучить органическую химию с нуля (для «чайников»). Надо просто читать и слушать.
Основы органической химии
Органическая химия выделена в отдельный подтип в связи с тем, что объектом ее изучения является все, что содержит углерод.
Органическая химия — это раздел химии, изучающий соединения углерода, структуру таких соединений, их свойства и методы соединения.
Как оказалось, углерод чаще всего образует соединения со следующими элементами — H, N, O, S, P. Кстати, эти элементы называют органогенами .
Органические соединения, количество которых сегодня достигает 20 миллионов, очень важны для полноценного существования всех живых организмов. Однако никто не сомневался, иначе человек просто отбросил бы изучение этого неизвестного на задний план.
Цели, методы и теоретические концепции органической химии представлены следующим образом:
- Разделение ископаемого, животного или растительного сырья на отдельные вещества;
- Очистка и синтез различных соединений;
- Раскрытие структуры веществ;
- Определение механики химических реакций;
- Обнаружение взаимосвязи между структурой и свойствами органических веществ.
Немного из истории органической химии
Вы не поверите, но еще в древности жители Рима и Египта кое-что понимали в химии.
Как известно, использовали натуральные красители. И часто приходилось использовать не готовый натуральный краситель, а извлекать его из целого растения (например, ализарин и индиго, содержащиеся в растениях).
Мы также можем вспомнить культуру употребления алкоголя. Секреты производства алкогольных напитков знают каждый народ.Более того, многие древние народы знали рецепты приготовления «горячей воды» из крахмальных и сахаросодержащих продуктов.
Так продолжалось много-много лет, и только в 16-17 веках произошли некоторые изменения, начались небольшие открытия.
В 18 веке некий Шееле научился выделять яблочную, винную, щавелевую, молочную, галловую и лимонную кислоты.
Тогда всем стало ясно, что продукты, которые можно выделить из растительного или животного сырья, имеют много общих черт.При этом они сильно отличались от неорганических соединений … Поэтому министрам науки срочно нужно было выделить их в отдельный класс, и так появился термин «органическая химия».
Несмотря на то, что органическая химия как наука появилась только в 1828 году (именно тогда г-ну Велеру удалось выделить мочевину путем испарения цианата аммония), в 1807 году Берцелиус ввел первый термин в номенклатуре в органической химии для чайников:
Раздел химии, изучающий вещества, полученные из организмов.
Следующим важным шагом в развитии органической химии является теория валентности, предложенная в 1857 году Кекуле и Купером, и теория химической структуры Бутлерова из 1861 года. Уже тогда ученые начали открывать, что углерод четырехвалентен и способен к формирование цепочек.
В целом с тех пор наука регулярно испытывала потрясения и волнения благодаря новым теориям, открытиям цепей и соединений, которые позволили активно развивать органическую химию.
Сама наука возникла из-за того, что научно-технический прогресс не мог стоять на месте. Он продолжал и продолжал идти, требуя новых решений. А когда в отрасли уже не хватало каменноугольной смолы, людям просто пришлось создать новый органический синтез, который со временем перерос в открытие невероятно важного вещества, которое по-прежнему дороже золота, — нефти. Кстати, именно благодаря органической химии родилась его «дочка» — суб-наука под названием «нефтехимия».
Но это совсем другая история, которую вы можете изучить сами. Далее предлагаем вам посмотреть научно-популярный видеоролик об органической химии для чайников:
Что ж, если у вас нет времени и вам срочно нужна помощь профессионалов , вы всегда знаете, где их найти.
Все книги можно скачать бесплатно и без регистрации.
НОВИНКА. В.Н. Верховский, Я.Л. Гольдфарб, Л.М. Сморгонский. Органическая химия. Учебник для 10 класса.1946 год. 156 с. Djvu. 19,2 Мб.
Этот учебник написан практиками и разработан таким образом, чтобы дети понимали химию, а не запоминали различные скороговорки.
По объему представленный материал значительно превышает учебник Цветкова. Очень рекомендую книгу, особенно учителям.
Сравнение этой книги с современными учебниками ясно показывает тенденции современных учебников: учебники пишутся все более абстрактно, скупо по материалу и все более оторваны от практики.
Загрузить.
НОВЫЙ. Никольский А.Б., Суворов А.В. Химия. 2001 год. 512 страниц djvu. 4,1 МБ.
В учебнике нового типа, рассчитанном в первую очередь на формирование химического мышления учащихся, систематически и точно и в то же время наглядно и доступно огромное количество современных общехимических знаний. На современном уровне учение о химическом процессе с упором на механизм реакции. Связь между электронной структурой и химическим поведением веществ.Последовательность и популярность изложения материала, оригинальность контрольных вопросов, наличие иллюстраций способствуют усвоению химических знаний и развитию научного мышления.
Предназначен для студентов вузов, студентов средних специальных учебных заведений, будет полезен преподавателям вузов и учителям школ. Школьникам, не занимающимся ЭГЕотикой, полезно посмотреть даже первые главы.
Загрузить.
Алексинский В.Н. Занимательные эксперименты по химии. 2-е изд. изд. 1995 год. 95 страниц djvu. 1.9 Мб.
Книга для учителей. В книге обсуждаются эксперименты, которые можно использовать не только на внеклассных занятиях, но и при подготовке к урокам. Эксперименты с элементами развлечения способствуют развитию у учащихся способности наблюдать и объяснять химические явления. Пособие поможет учителям пробудить у студентов интерес к изучению химии, развить более глубокое и осознанное усвоение теоретического материала.
Загрузить.
Т.М. Варламов, А. Краков. ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ: БАЗОВЫЙ КУРС. 263 страницы djvu. 2.2 Мб.
В этом пособии изложены основные вопросы общей и неорганической химии, многие из которых вызывают затруднения у студентов и соискателей. Подробно рассмотрены типовые задачи по всем разделам школьного курса химии и задания для самостоятельного решения … Пособие предназначено для студентов подготовительных отделений высших учебных заведений, а также лиц, самостоятельно готовящихся к поступлению в вузы, студентов старших классов общеобразовательных школ, лицеев, гимназий и колледжей.
Загрузить.
Габриелян О.С., Маскаев Ф.Н., Теренин В.И. Химия 10 класс. Учебник. 2002. 304 страницы djvu. 3.9 Мб.
Книга для учителей. Учебник продолжает и развивает курс химии, описанный в учебниках «Химия-8» и «Химия-9» автора О.С. Габриелян. Учебный материал по органической химии представлен с учетом того, что школьники получили исходные сведения об органических веществах в 9 классе. Учебник соответствует минимальному обязательному образовательному содержанию.Материал учебника разделен на два уровня — базовый и продвинутый и дается в связи с экологией, медициной, биологией. Курс дает информацию о жизненно важных веществах: витаминах, ферментах, гормонах, лекарствах. Широко представлен химический эксперимент, в том числе новые практические работы, в ходе которых рассматриваются свойства витаминов, ферментов, лекарств.
Загрузить.
П.А. Гуревич, М.А.Кубешов. Органическая химия. Полезная информация для школьников и учителей — история, теория, проблемы и решения.2004 год. 350 страниц djvu. 4.6 Мб.
Загрузить.
Егоров А.С. изд. Репетитор по химии. 2003 год. 770 страниц PDF. 16,3 Мб.
Пособие содержит подробное изложение основ общей, неорганической и органической химии, а также типовые задачи с решениями и большое количество задач разной степени сложности для самостоятельной работы (в том числе по выбору). Рекомендуется для учащихся школ, гимназий и лицеев, поступающих в химические и биомедицинские вузы.
Загрузить.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для абитуриентов. В 2-х томах. 7-е изд. исправленное доп. 2002 год. 384 + 384 страницы djvu. одним архивом 16,9 Мб.
Книга представляет собой попытку современного, исчерпывающего и систематизированного изложения основ химии, которые должны быть известны в первую очередь поступающим в университеты. Его содержание основано на тщательном анализе программ вступительных экзаменов по химии большинства вузов (химических, медицинских, биологических и др.)), а также конкретные экзаменационные задания.
Учебное пособие предназначено для школьников, абитуриентов и учителей. В пособии излагаются основы современной химии, которые должен понять каждый выпускник средней школы и обязательно знать каждому, кто видит себя учеником — химиком, врачом или биологом XXI века. В новой редакции отражены последние достижения химии и даны новые задания вступительных экзаменов.
Загрузить.
НЕ. Кузьменко и другие.Начала химии. Современный курс для абитуриентов. 2001 год. 360 страниц djvu. 16,3 Мб.
Загрузить.
Кузьменко и др. Химия. Для старшеклассников и поступающих в вузы. Пособие представляет собой учебник и справочник по химии. 525 страниц. Размер 4,7 Мб. djvu.
Загрузить.
Кузьменко, Еремин, Попков. Краткий курс химии. Для поступающих в вузы. 2002 год. 410 страниц PDF. Размер 12,4 Мб.
Учебное пособие предназначено для школьников, абитуриентов и учителей.Пособие излагает современные основы химии в краткой, но информативной и понятной форме. Это основы, которые должен понимать каждый выпускник средней школы, и они обязательно должны быть известны каждому, кто видит себя студентом-химиком, врачом или биологом XXI века. В тех частях: 1. Теоретическая химия, 2. Неорганическая химия. 3. Органическая химия.
Загрузить
T.N. Литвинова, Э. Мельникова, М. Соловьева, Л. Ажипа, Н. Выскубова.Химия в задачах для абитуриентов. 2009 год. 832 стр. PDF. 4.7 Мб.
Сборник содержит более 2500 задач, охватывающих основные темы школьного курса химии. Среди них есть качественные и просчитанные типовые задачи с решениями и задачи разного уровня сложности для самостоятельного решения. На все проблемы даны ответы, а на самые сложные — подробные решения.
По каждой теме дается теоретический материал, преимущественно в виде таблиц — основные понятия, законы химии, формулы, классификации, свойства, способы получения неорганических и органических веществ.
Пособие поможет вам подготовиться к выпускным экзаменам в средней школе, сдаче экзаменов и вступительных экзаменах в университет. Книга адресована старшеклассникам, абитуриентам и учителям.
Загрузить.
Некрашевич И. Химия. 8-11 классы. 2008 год. 304 страницы PDF. 1,7 Мб.
Не кажется ли вам химия сложным и непонятным предметом? Вы не умеете решать химические задачи, составлять уравнения реакций, строить формулы?
Репетитор по химии, который вы держите в руках, может помочь решить эти проблемы.
Загрузить.
Г.К. Прохоров. Качественный химический анализ. Мастерская для школьников. 2002 год. 33 страницы PDF. в общем архиве 424 Кб.
Семинар предназначен для учащихся 9 классов школ с углубленным изучением химии и школы юных химиков для ознакомления с основами аналитической химии.
Подготовлено на химическом факультете МГУ.
Загрузить.
Рудзитис Г.Э., Фельдман Ф.Г. Химия.7-11 класс. В 2 кн. 1985 год. djvu. две книги в одном архиве. 12,3 Мб.
Книга 1. 204 стр. Учебник для 7-11 классов вечерней (сменной) средней общеобразовательной школы … Учебник соответствует действующей школьной программе и обязательному минимальному химическому образованию … Имеет классическую структуру школьного учебника химии и включает в себя все необходимые теоретические и практический материал для изучения курса неорганической химии.
Книга 1. 306 страниц. Учебник для 7-11 классов вечерних (сменных) общеобразовательных школ.Учебник соответствует действующей школьной программе и обязательному минимуму химического образования. Он имеет классическую структуру школьного учебника химии и включает в себя весь необходимый теоретический и практический материал для изучения курса неорганической органической химии. Во второй книге органическая химия занимает половину ее объема. Материал дифференцирован по уровням сложности.
Многочисленные таблицы, схемы и рисунки способствуют усвоению и повторению теоретического и практического материала… Доступность и наглядность изложения основных понятий, определений и законов химии позволяют рекомендовать этот учебник не только для школьного обучения, но и для самообразования.
При изучении химии с нуля лучше использовать этот учебник, а не современные, так как он лучше и понятнее. Это не мое мнение, а мнение профессионального химика.
Загрузить.
Семенов. Химия: пособие для абитуриентов. 1989 год.225 стр. Djvu. 3,7 Мб.
В отличие от изложенных в данном пособии, упор сделан на углубленное повторение основных понятий и законов химии, «ключевых» вопросов, от понимания которых зависит усвоение фактического материала, изучаемого в школе. На небольшом количестве примеров показаны основные закономерности поведения химических систем, общие методики подхода к их рассмотрению, то, как свойства вещества определяют его применение. Следующие вопросы и упражнения выбраны из тех, которые предлагались на вступительных экзаменах в химические университеты или использовались автором на подготовительном факультете Ленинградского государственного университета.Как правило, ответ не требует громоздких вычислений и — нужно просто хорошо усвоить основные законы химии.
Предназначен в первую очередь для абитуриентов, самостоятельно готовящихся к экзамену в вуз, но будет полезен и студентам подготовительных факультетов и курсов.
Загрузить.
Стахеев. Вся химия в 50 таблицах. Представлены все основные понятия ШКОЛЬНОЙ химии. Это своего рода шпаргалка — напоминание. 60 страниц. Размер 1.2 Мб. djvu.
Загрузить.
Хомченко Г.П. Учебник химии для абитуриентов. 2002 год. 480 страниц PDF. Размер 11,6 Мб.
Пособие охватывает все вопросы вступительных экзаменов по химии. Для лучшего усвоения курса химии приводится дополнительная информация. В конце каждой главы приведены типовые задачи с решениями и задачи для самостоятельной работы. Книга предназначена для поступающих в вузы. Его также можно рекомендовать учителям химии для подготовки учащихся к выпускным экзаменам в средней школе.Гид понравился.
Скачать
Черникова Л.П. Шпаргалки по химии. 2003 год. 144 страницы PDF. 2,4 Мб.
Материал разделен на три темы: Основные понятия химии, Общая химия, Органическая химия. Нормальное пособие. Не понимаю, почему такое название.
Домашнее задание по химии. ГДЗ по химии. Мастерская по химии и ГДЗ им
Химия — довольно увлекательная и обширная наука.Именно она помогла людям научиться получать разные материалы и превращать одно вещество в совершенно другое. Он смог использовать дары природы, применив их в современной индустрии, научил нас химии. И яркий тому пример — производство различных лекарств, которые постоянно спасают жизни огромного количества людей.
А в 8-м классе школьникам предстоит познакомиться с этим увлекательным предметом и подготовить прочную базу, на которой знания будут строиться в будущем.Верным помощником и надежным товарищем в этом вопросе для восьмиклассников станет О.С. Габриелян. Заслуженный педагог и специалист по своему делу, в 8 классе написал решебник в школьный учебник.
Коллекция ГДЗ является составной частью учебно-методического комплекса по химии, разработанного для учащихся общеобразовательной школы. Готовые ответы призваны помочь восьмикласснику разобраться со сложными терминами и понятиями, ответить на все вопросы из сорока пяти абзацев и научить правильно составить лабораторную и практическую работу.
сначала ГДЗ по химии за 8 класс Габриелян Дайте основные химические понятия. А с первой главы начнется изучение атомов всех химических элементов. Далее пойдут темы о простых веществах и о соединениях химических элементов. Четвертая глава расскажет об изменениях, происходящих с некоторыми веществами. И самая обширная последняя глава включает информацию о растворении, растворах и процессах ионного обмена и реакций окислительных реакций.
В сборник включены и готовые ответы авторов к химическим семинарам №1 и 2. Первый представляет собой решения алгоритмов практической работы, основанные на простейших операциях с веществом. А именно, школьникам предстоит наблюдать за изменениями, происходящими с горящими свечами, им предстоит проанализировать свойства почвы и воды. Собирать знаки химических реакций И рассчитывать массовую долю сахара в растворе также предстоит восьмиклассникам при заполнении первого цеха.
Второй семинар посвящен свойствам электролитов. Следовательно, его работа будет заключаться в определении ионной реакции; реакции между растворами электролитов; свойств кислот, оснований, оксидов и солей, а также потребуется для решения экспериментальных задач. В конце пособия представлены ответы на лабораторные опыты.
ГДЗ К. рабочая тетрадь по химии за 8 класс Габриелян О.С. Вы можете скачать.
ГДЗ к тетради для оценки качества знаний по химии за 8 класс Габриелян О.С. Можно скачать.
ГДЗ к контрольной и самостоятельной работе по химии для 8 класса Павлова Н.С. Вы можете скачать.
Изображения учебников приведены на страницах сайта исключительно в качестве иллюстративного материала (ст. 1274 ч. 1 части четвертой Гражданского кодекса Российской Федерации)
- Химия 8 класс. Задание. Кузнецова, Левкин Вентана График
- Химия 8 класс. ФГОС Габриелян Падение
- Сборник заданий и упражнений по химии 8 класс Хомченко новая волна
- Химия 8 класс.ФГОС Рудзитис, Фельдман Образование
- Химия 9 класс. Задание. Кузнецова, Левкин Вентана График
- Химия 9 класс. GEF Gabrielyan Drop
- Сборник заданий и упражнений по химии 9 класс Homchenko новая волна
- Химия 9 класс. GEF Rudzitis, Feldman Образование
- Химия 10 класс. Сбросить
- Химия 10 класс. Сборник заданий и упражнений по химии для средней школы
- Химия 10 класс.Рудзитис Г.Э., Фельдман Ф.Г. М .: Просвещение
- ГДЗ по химии 11 класс Габриелян О.С.
- Химия 11 класс цветов Л.А. М .: Humanit. Издательский центр Владос.
- Химия 11 класс Габриелян О.С., Лысова Г.Г. М .: Капля
- Химия 11 класс Габриелян О.С. М .: Капля
- Химия 11 класс. Сборник заданий и упражнений по химии для средней школы Хомченко И.Г. М .: Новая Волна
- Химия 11 класс Рудзитис Г.Е., Фельдман Ф.Г. М.: Просвещение
- Химия 11. Дидактические материалы по химии Радецкий А.М., Горшкова В.П., Кругликова Л.Н. М .: Просвещение
- Контрольно-поверочные работы по химии 8. ГЭФ Габриелян, Дрофа Краснова
- Контрольно-поверочные работы по химии 9. ГЭФ Габриелян, Дрофа Краснова
- Трохегубова Вако
- Приборостроение (КИМ) по химии 8 класс. ФГОС Корощенко экзамен
- Материалы (КИМ) по химии 9 класс.ФГОС Стрельникова Вако.
Рабочие тетради
- Рабочая тетрадь по химии 8 класс Еремин, Капля Дроздов
- Габриелян, Сладков Дрофа
- Тетрадь для оценки качества знаний по химии 8. ГЭФ Габриелян, Моцова Дрофа 8 класс. Габрушева Просвещение
- Тетрадь-тренажер по химии 8 класс. ГЭФ Гара Просветление
- Тетрадь по химии 8 класс. ГЭФ Бобылева, Бирюлин Просвещение
- Рабочая тетрадь по химии 8 класс.Экзамен GEF
- Рабочая тетрадь по химии 8 класс. Экзамен GEF
- Габриелян, Сладков Дрофа
- Тетрадь для оценки качества знаний по химии 9 класс. ГЭФ Габриелян, Моцова Дрофа
- Рабочая тетрадь по химии 9 класс ГЭФ Габрушева
- Просветление Тетрадь-тренажер по химии 9 класс. ГЭФ Гара Просветление
- Контрольная тетрадь по химии 9 класс. ГЭФ Бобылева, Бирюлин Просвещение
- Рабочая тетрадь по химии 9 класс. ГЭФ Боровский. К учебнику Рудзитис Экзамен
- Рабочая тетрадь по химии 9 класс.ФГОС Микитюк. К учебнику Габриелян. Экзамен
- Еремин, Дроп Дроздов
- Рабочая тетрадь по химии 10 класс Габриелян, Сладков Дрофа
- Тетрадь для оценки качества знаний по химии 10 класс Габриелян, Моцова Дрофа
- Рабочая тетрадь по химии 11 класс Габриэлян 906Абриэлян, Слэдков 10-й класс. Углеводороды. Гос Боровский экзамен
Практикум по химии и ГДЗ им
- Химия и школьники, и учителя признают трудными для понимания и усвоения знаний науки.Недаром ее изучение начинается одним из самых последних — курс химии в школах читается только в восьмом классе. Однако это одна из самых востребованных дисциплин как объект выбора на ОГЭ и ЕГЭ, так как результаты экзаменов необходимы для поступления в университеты и колледжи различных направлений — медицинских, биологических, агрономических и других. Своевременно приступив к работе по дисциплине, используя качественные учебники и решебники к ним, студенты смогут хорошо подготовиться и показать высокий результат, текущий и итоговый.
- Чтобы все шансы были на стороне школьников, многие специалисты не только не отрицают, но даже рекомендуют использовать GDZ в разработке. Такая подготовка считается эффективной и действенной, потому что:
— Позволяет выбрать оптимальный набор учебной литературы, исходя из собственных целей и задач. Они могут быть разнообразными — от простого повышения успеваемости по химии до участия и победы в предметных ответах и соревнованиях, проводимых на школьных и внешкольных площадках, в том числе на международных.На Международном Менделеевском турнире российские школьники часто занимают высокие призовые места, побеждают;
— дает возможность самостоятельно планировать время и регулярность работы, ее темп;
— Помогает запомнить принцип правильной записи ответа. Часто грамотно полученный вывод, решение задачи фиксируется неверно. Как следствие — снижение баллов на ЕГЭ, ПРД, диагностике и контроле и даже потеря победы на олимпиаде. Постоянно соблюдая порядок правильного отображения результата, школьники автоматически запоминают его и не допускают досадных ошибок. - Среди актуальных сборников по дисциплинам не только учебники, но и эффективные и интересные мастер-классы по химии. Среди самых популярных и популярных:
— рабочие тетради по тематике;
— контрольные материалы, востребованные в первую очередь у выпускников, так как их тематика максимально приближена к тому, что предлагается в рамках итоговых испытаний;
— контроль и поверка;
— дидактических материалов по химии;
— Кима за успешное обучение;
— Задачи и сборники упражнений по дисциплине.
Некоторые из этих сборников универсальны, другие — специальной направленности и предназначены как практические пособия К конкретному теоретическому учебнику. Авторы, чьи мастерские пользуются наибольшей популярностью у студентов и учителей химии — Хомченко, Кузнецова, Габриелян, Флауэрс, Рудзитис, Радецкий, Трохегубова, Стрельникова.
Решебник по химии для 8 класса Габриелян представляет собой совокупность готовых домашних заданий, включая решенные задачи, рассчитанные уравнения реакций, взятые из учебного пособия Габриелян О.С., которая является классической базой для изучения химии в 8 классах общеобразовательных школ России.
Решебник по химии 8 класс Габриелян О.С. 2013-2019
Задачи и уравнения реакции по курсу химии — это непростые практические задачи, которые могут решить все школьники с первого раза. Особые трудности могут возникнуть у восьмиклассников при подготовке домашнего задания: в 8-м классе ученики задают достаточно большой объем работы по дому, что не позволяет терять много времени на подготовку каждого предмета.
Наш сайт предлагает ГДЗ школьникам по химии для 8 класса Габриеляна, которые позволяют ученикам:
- качественно выполнять домашние задания;
- понимать механизмы решения проблем;
- закрепить теоретический материал, изученный в классе;
- подготовиться к контролю и экзаменам по предмету.
На основе готовых ответов и решений родители могут проверить успеваемость своих детей по химии и помочь им в выполнении домашних заданий.
Наш ресурс имеет комплексное преимущество:
- нужный туториал можно легко найти через поисковую строку;
- нажав на номер задачи в таблице, можно сразу перейти к онлайн-ответу;
- Сайт доступен не только на компьютерах — у него есть актуальная версия для планшетов и телефонов.
Мы следим за обновлениями базы решебников и стремимся к тому, чтобы несколько онлайн-ответов приходилось на одно задание.
Ответы Учебник ГДЗ по химии для 8 класса Габриелян
В настоящее время программа общеобразовательных школ России составлена на основе Учебника Габилян О.С., выпущен издательством «Капля» в 2013 году.
Учебник состоит из вводной части (6 абзацев) и 5 основных глав, в которых рассматриваются такие важные темы, как:
- Строение атома и атомное строение. соединение химических элементов;
- Простые вещества, их свойства;
- Смеси веществ и растворов;
- Реакции ионного обмена;
- Редокс-процессы.
В рамках учебника представлены два химических мастерских (лабораторные работы).Все разделы учебника снабжены практическими вопросами, заданиями, упражнениями, позволяющими эффективно усвоить теорию предмета.
.


