Урок 5. закон постоянства состава веществ. химические формулы. относительная атомная и молекулярная массы. массовая доля химического элемента в соединении — Химия — 8 класс
Закон постоянства состава. Относительная атомная и молекулярная массы. Массовая доля элемента
Атомы, как и молекулы обладают своей массой и размером. Массы атомов очень малы и определить ее путём точных измерений очень трудно, а в XVIII веке было невозможно. Большая заслуга в измерении атомных масс химических элементов принадлежит Джону Дальтону и Йенсу Якобу Берцелиусу, которые первыми попытались определить относительную атомную массу химических элементов.
В настоящее время для измерения массы атомов в качестве эталона принята масса одной двенадцатой части массы атома углерода. Массы атомов измеряют в атомных единицах массы. Такую массу называют относительной атомной массой, её условное обозначение взято от двух английских слов: A – atoms, r – relative (Ar). Значения относительных атомных масс можно узнать по периодической системе химических элементов: Ar (O) = 16. Эта запись означает, что относительная атомная масса кислорода равна 16. При вычислениях обычно используют округлённые значения. Относительную атомную массу хлора округлять до целого числа не принято: Ar (Cl) = 35,5.
Значения относительных атомных масс можно узнать по периодической системе химических элементов: Ar (O) = 16. Эта запись означает, что относительная атомная масса кислорода равна 16. При вычислениях обычно используют округлённые значения. Относительную атомную массу хлора округлять до целого числа не принято: Ar (Cl) = 35,5.

Известно, что в молекуле воды на два атома водорода приходится один атом кислорода: h3O. Химическая формула воды читается «аш-два-о». В серной кислоте на два атома водорода приходится один атом серы и четыре атома кислорода: h3SO4. Химическая формула серной кислоты читается «аш-два-эс-о-четыре». Условную запись состава вещества называют химической формулой. Знаки химических элементов указывают на качественный состав вещества, а индексы – на количественный состав вещества. Если нужно записать несколько молекул вещества, то используют коэффициенты. Тогда 3 молекулы воды можно записать так: 3h3O.
Так же можно рассчитать и относительную молекулярную массу любой молекулы.

Ещё одной важной количественной характеристикой вещества является массовая доля химического элемента, т.е. отношения массы всех атомов данного химического элемента к массе вещества. Обозначается массовая доля греческой буквой омега – ω, вычисляется по формуле:
Например, в молекуле сероводорода массовая доля водорода составляет 5,9 %, а серы 94,1 %. Как определить состав сероводорода?
По условию задачи в ста атомных единицах массы (аем) 5,9 атомных единиц массы водорода и 94,1 атомная единица массы серы. Для того чтобы определить соотношения количества атомов водорода и серы в 100 единицах аем сероводорода, разделим значение аем каждого химического элемента на величину его относительной атомной массы.
Эти числа принимаются в качестве индексов в простейшей формуле данного вещества.

x = 2; y = 1
Ответ: формула сероводорода h3S.
Справочный материал:
• Закон постоянства состава: «Каждое химически чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав» (в начале 20 века было установлено существование веществ с переменным составом)
• Индекс – в химической формуле показывает число атомов данного химического элемента в молекуле данного вещества.
• Химический знак (символ) – условное обозначение химического элемента. Первая буква (заглавная) его латинского названия. Иногда добавляется вторая буква – одна из последующих, обязательно строчная.
• Относительная атомная масса – это величина, которая показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода. Условное обозначение Ar.
 Условное обозначение Mr.
Условное обозначение Mr.• Массовая доля химического элемента в веществе – это отношение массы атомов определённого химического элемента к массе вещества. Представляет собой количественную характеристику вещества. Обозначается ω [омега].
Химия 8 класс. Все формулы и определения. Кратко, таблицы, схемы.
«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
1. Условные обозначения, названия и единицы измерения
некоторых физических величин, используемых в химии
| Физическая величина | Обозначение | Единица измерения |
| Время | t | с |
| Давление | p | Па, кПа |
| Количество вещества | ν | моль |
| Масса вещества | m | кг, г |
| Массовая доля | ω | Безразмерная |
| Молярная масса | М | кг/моль, г/моль |
| Молярный объем | Vn | м3/моль, л/моль |
| Объем вещества | V | м3, л |
| Объемная доля | Безразмерная | |
| Относительная атомная масса | Ar | Безразмерная |
| Относительная молекулярная масса | Mr | |
| Относительная плотность газа А по газу Б | DБ(А) | Безразмерная |
| Плотность вещества | р | кг/м3, г/см3, г/мл |
| Постоянная Авогадро | NA | 1/моль |
| Температура абсолютная | Т | К (Кельвин) |
| Температура по шкале Цельсия | t | °С (градус Цельсия) |
| Тепловой эффект химической реакции | Q | кДж/моль
|
2. Соотношения между единицами физических величин
Соотношения между единицами физических величин
3. Химические формулы в 8 классе
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
- Атом — мельчайшая химически неделимая частица вещества.
- Химический элемент — определённый вид атомов.
- Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов.
- Простые вещества — вещества, молекулы которых состоят из атомов одного вида.
- Сложные вещества — вещества, молекулы которых состоят из атомов разного вида.
- Качественный состав вещества показывает, из атомов каких элементов оно состоит.

- Химическая формула — условная запись качественного и количественного состава вещества посредством химических символов и индексов.
- Атомная единица массы (а.е.м.) — единица измерения массы атома, равная массы 1/12 атома углерода 12С.
- Моль — количество вещества, в котором содержится число частиц, равное числу атомов в 0,012 кг углерода 12С.
- Постоянная Авогадро (Na
- Молярная масса вещества (М) — масса вещества, взятого в количестве 1 моль.
- Относительная атомная масса элемента Аr — отношение массы атома данного элемента m0 к 1/12 массы атома углерода 12С.
- Относительная молекулярная масса вещества Мr — отношение массы молекулы данного вещества к 1/12 массы атома углерода 12С.
 Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента. - Массовая доля химического элемента ω(Х) показывает, какая часть относительной молекулярной массы вещества X приходится на данный элемент.
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
- Химическое уравнение — запись химической реакции с помощью химических формул. Показывает, какие вещества и в каком количестве вступают в реакцию и получаются в результате реакции.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.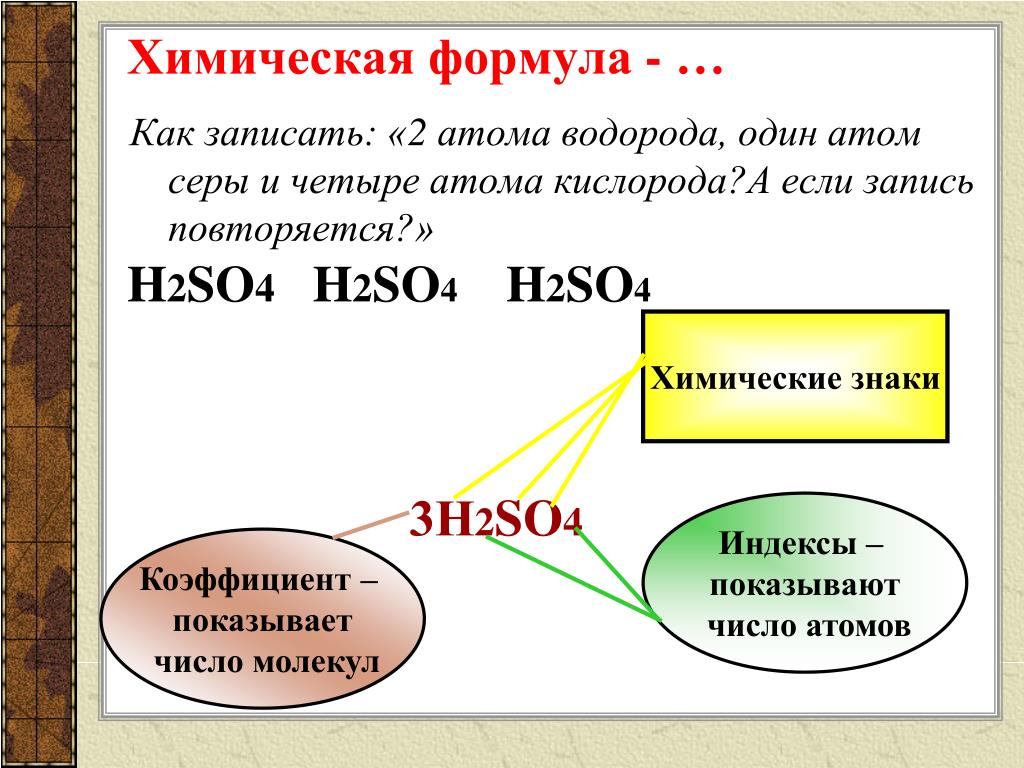
Важнейшие классы неорганических веществ
Воздух. Кислород. Горение
Конспект урока «Химия 8 класс. Все формулы и определения».
Следующая тема: «».
презентация «Химические формулы.Относительная молекулярная масса» | Презентация к уроку по химии (8 класс) на тему:
Слайд 1
“ В природе ничего другого нет, Ни здесь, ни там, в космических глубинах. Все от песчинок малых до планет Из элементов состоит единых” Степан Щипачев Работу выполнила Романова Н.Н, учитель химии и биологии МБОУ «Сизябская СОШ» 2016 годСлайд 2
ПРОВЕРОЧНЫЙ ТЕСТ Задание : подбери соответствие. 1.Аргентум 2.Аурум 3.Гидраргирум 4.Силициум 5.Натрий 6.Плюмбум 7.Фосфор 8.Кальций 9.Купрум 10.Феррум а) Ag б) Cu в) Fe г) C а д) Na е) Hg ж) Pb з) Р и) Si к) Au
Слайд 3
Вещества Простые В состав молекулы входит один вид атомов в состав молекулы веществв состав молекулы в D ещества входит один вид атомов а входит один вид атомов Сложные Молекула вещества состоит из нескольких видов атомов H H C O O H 2 CO 2
Слайд 4
O O O O O Кислород Озон O 2 O 3
Слайд 5
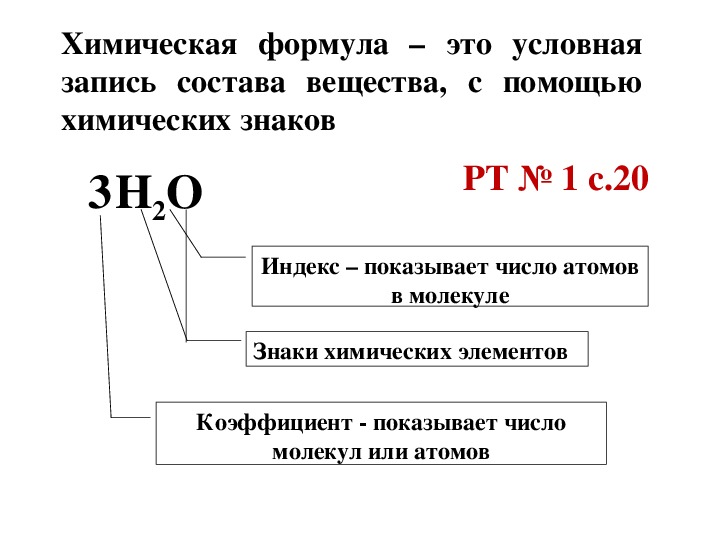
5 H 2 С O 3 Коэффициент — показывает число молекул или атомов Индекс – показывает число атомов в молекуле . Знаки химических элементов.
Знаки химических элементов.
Слайд 6
Химическая формула – это условная запись состава вещества, посредствам химических знаков и символов.
Слайд 7
ФОРМУЛЫ ВЕЩЕСТВ ЧИСЛО МОЛЕКУЛ ЧИСЛО АТОМОВ КАЖДОГО ЭЛЕМЕНТА 3 BaO 2 CO ₂ 5 Al ₂ O ₃ 4 Fe(OH) ₃ Na ₂ CO ₃ 3 2 5 4 1 2 атома натрия 1 атом углерода 3 атома кислорода 3 атома бария 3 атома кислорода 2 атома углерода 4 атома кислорода 10 атомов алюминия 15 атомов кислорода 4 атома железа 12 атомов кислорода 12 атомов водорода Заполните таблицу
Слайд 8
Относительная масса атома m ат (Н) = 0,000 000 000 000 000 000 000 001674 г = 0,1674 ∙10 -23 г m ат (О) = 0,000 000 000 000 000 000 000 026667 г = 2,6667 ∙10 -23 г m ат ( C ) = 0,000 000 000 000 000 000 000 01993 г = 1,993 ∙10 -23 г — Ar – относительная атомная масса 1 а.е.м. – величина равная 1 / 12 массы атома углерода. 1 а.е.м. = m ат (C)/12 = 1,674 ∙ 1 0 -24 г 1а.е.м. = = 1,993 ∙10 -23 г/ 12 = 1,674 ∙ 1 0 -24 г Относительная атомная масса – это величина, показывающая, во сколько раз масса атома больше 1 / 12 массы атома углерода
Слайд 9
m ат (Н) = 0,000 000 000 000 000 000 000 001674 г = 0,1674 ∙10 -23 г m ат (О) = 0,000 000 000 000 000 000 000 026667 г = 2,6667 ∙10 -23 г m ат ( C ) = 0,000 000 000 000 000 000 000 01993 г = 1,993 ∙10 -23 г А r (О) = А r (C) =
Слайд 10
II . Нахождение Ar с помощью периодической системы. Правила округления: — если после запятой стоит цифра меньше 5, то число остается без изменения. — если после запятой стоит цифра 5 или больше 5 , то число увеличивается на единицу. Пример: Fe 55,847 Ar(Fe)=56 Cu 63,546 Ar(Fe)=64 Pb 207,19 Ar(Pb)=207 Ag 107,868 Ar(Ag)=108
Нахождение Ar с помощью периодической системы. Правила округления: — если после запятой стоит цифра меньше 5, то число остается без изменения. — если после запятой стоит цифра 5 или больше 5 , то число увеличивается на единицу. Пример: Fe 55,847 Ar(Fe)=56 Cu 63,546 Ar(Fe)=64 Pb 207,19 Ar(Pb)=207 Ag 107,868 Ar(Ag)=108
Слайд 11
М r (Н 2 О) = 2 ∙ A r (H) + A r (O) = 2∙ 1 + 16 = 18 М r (Н 2 S О 4 ) = ? М r ( Ca(OH) 2 = 40 + 2(16 +1) = 74 Mr(Ca(OH) 2 = 40 + 16 ∙ 2 +1 ∙2 =74 М r ( С uOH ) 2 CO 3 = ? М r (HNO 3 ) = ?
Слайд 12
Тема урока: «Химические формулы. Относительная молекулярная масса»
Слайд 13
3. 5 молекул воды, каждая из которых состоит из двух атомов водорода и одного атома кислорода 1. 2 атома кислорода 2. 4 атома водорода 4 .Молекула глюкозы, которая состоит из 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода Составь формулу 5.Молекула уксусной кислоты состоит из 2 атомов углерода,4 атомов водорода и 2 атомов кислорода 2 O 4H 5H 2 O C 6 H 12 O 6 C 2 H 4 O 2
Слайд 14
1. Один атом хлора 2.Одна молекула сложного вещества, которая состоит из одного атома углерода и двух атомов кислорода 3.Две молекулы простого вещества, каждая из которой состоит из двух атомов водорода 4. две молекулы простого вещества, каждая которой состоит из двух атомов хлора 5.Шесть молекул сложного вещества ,каждая молекула которой состоит из одного атома водорода, одного атома азота и трех атомов кислорода 6.Четыре атома кислорода 7.Одна молекула сложного вещества, состоящая из одного атома кальция, одного атома углерода и четырех атомов кислорода Cl 2H 2 CO 2 6 HNO 3 4O 2 Cl 2 CaCO 3 Найди пару
Один атом хлора 2.Одна молекула сложного вещества, которая состоит из одного атома углерода и двух атомов кислорода 3.Две молекулы простого вещества, каждая из которой состоит из двух атомов водорода 4. две молекулы простого вещества, каждая которой состоит из двух атомов хлора 5.Шесть молекул сложного вещества ,каждая молекула которой состоит из одного атома водорода, одного атома азота и трех атомов кислорода 6.Четыре атома кислорода 7.Одна молекула сложного вещества, состоящая из одного атома кальция, одного атома углерода и четырех атомов кислорода Cl 2H 2 CO 2 6 HNO 3 4O 2 Cl 2 CaCO 3 Найди пару
Слайд 15
Mr ( Н 2 SO 4 ) Mr ( Н 3 Р O 4 ) Mr (SO 3 ) Mr (MgO) 5 Mr ( CH 4 ) 2 Mr ( NaOH ) Mr (NH 3 ) Mr (PH 3 ) САМОСТОЯТЕЛЬНАЯ РАБОТА 98 98 80 40 80 80 17 34
Слайд 16
Домашнее задание 1.Прочитать § 9, 10 2.Найти относительную молекулярную массу молекулы белка молока: М r ( C 1864 H 3031 O 576 N 468 S 26 ) -?
Слайд 17
Вопросы 1.Я узнал много нового 2.На уроке было над чем подумать 3. Думаю,что мне это пригодится в жизни 4.На все возникшие вопрос я получил(а) ответы 5.Я поработал(а) добросовестно
Думаю,что мне это пригодится в жизни 4.На все возникшие вопрос я получил(а) ответы 5.Я поработал(а) добросовестно
Химические формулы. Относительная атомная и молекулярная массы. Массовая доля элемента в соединении | Презентация к уроку по химии (8 класс):
Слайд 1
Химические формулы. Относительная атомная и молекулярная массы. Массовая доля элемента в соединении Урок №6Слайд 2
Химическая формула — это условная запись, отражающая качественный и количественный состав химического соединения (чистого вещества). 3 Na 2 S O 4 Коэффициент Индексы Эле мен ты Три натрий два эс о четыре Na : 3*2 = 6 атомов S : 3*1 = 3 атома О: 3*4 = 12 атомов
Слайд 3
5Al 2 (SO 4 ) 3 Al : 5*2 = 10 атомов S : 5*3*1 = 15 атомов O : 5*3*4 = 60 атомов пять алюминий два эс о четыре трижды Индекс после скобки читается следующим образом: 2 – дважды 3 – трижды, и т.д.
Слайд 4
Правильно прочитайте формулы и укажите число атомов химических элементов 5 CuCl 2 , 10FeSO 4 , 8Al(NO 3 ) 3 , 2AgBr, 4BaI 2 , 6Na 3 PO 4 , Ca 3 (PO 4 ) 2 , MgF 2 , 11CuSO 4 , NaCl , 2Al(ClO 4 ) 3 , 12KNO 3 , 3Fe 2 O 3 , 9Na 2 O, Cu(OH) 2 , 4KOH, 18H 2 O, 6CO 2 , 8HCl, 3H 2 SO 4 , 2HNO 3 Коэффициент или индекс = 1 не читается и не пишется!
Слайд 5
Относительная атомная масса это отношение абсолютной массы атома к 1/12 части абсолютной массы атома изотопа углерода 12 С. Обозначение: A r . Единицы измерения: безразмерная величина . Иногда измеряется в а.е.м . (атомные единицы массы). Абсолютная масса: m a (C) = 1,99·10 -26 кг A r (C) = 12·1,99·10 -26 /1,99·10 -26 = 12
Обозначение: A r . Единицы измерения: безразмерная величина . Иногда измеряется в а.е.м . (атомные единицы массы). Абсолютная масса: m a (C) = 1,99·10 -26 кг A r (C) = 12·1,99·10 -26 /1,99·10 -26 = 12
Слайд 6
Значения A r для химических элементов Находятся в ячейке Периодической системы около символа химического элемента (часто это дробное число). Округляются до целых чисел (кроме A r ( Cl ) с учётом правил округления. A r ( Cl ) = 35,5
Слайд 7
Найдите A r для следующих химических элементов Na, H, N, O, K, Fe, Cl , Ca, Mg, Cu, F, C, Sn , Au, Ag
Слайд 8
Относительная молекулярная масса это отношение абсолютной массы молекулы к 1/12 части абсолютной массы атома изотопа углерода 12 С. Обозначение: М r . Единицы измерения: безразмерная величина . М r = сумме A r Х.Э., умноженных на их число. M r (Ca(H 2 PO 4 ) 2 = 1* A r (Ca)+4* A r (H)+2* A r (P)+8* A r (O) = = 1*40+4*1+2*31+8*16 = 234
Слайд 9
Рассчитайте M r для следующих химических соединений M r (O 2 ) = M r (H 2 O) = M r (C 6 H 12 O 6 ) = M r (CO 2 ) = M r (NaHCO 3 ) = M r (Ca(NO 3 ) 2 = M r ((NH 4 ) 2 Cr 2 O 7 ) =
Слайд 10
Массовая доля химического элемента в соединении это величина, которая показывает, какую часть в соединении составляет химический элемент. Обозначение: ω Единицы измерения: безразмерная или %. n – число атомов химического элемента
Обозначение: ω Единицы измерения: безразмерная или %. n – число атомов химического элемента
Слайд 11
Пример расчёта массовой доли (%) химических элементов в серной кислоте ( H 2 SO 4 ) M r (H 2 SO 4 ) = 2*1+32+4*16 = 98
Слайд 12
Домашнее задание §6, ответить на вопросы 1-8 стр. 43, вычислить массовую долю элементов в HClO 4 , HNO 3 , Al 2 (SO 4 ) 3
Конспект урока Химические формулы. Относительные атомная и молекулярная массы
Автор: Учитель химии и биологии Карякина Екатерина Николаевна.
МБОУ СОШ № 139 городского округа Самара.
Конспект урока по химии для 8 класса.
Тема:Химические формулы. Относительные атомная и молекулярнаямассы. Массовая доля элемента в соединении.
Цели урока
учебные:
— изучить понятия: химическая формула, индекс, коэффициент; записи и чтение формул.
— изучить различия между относительными, атомной и молекулярными массами;
— изучит понятие массовой доли химического элемента и научиться ее рассчитывать.
развивающие:
— развить у учащихся умение делать несложные, логические построения на основе химических знаний;
— развить умение использовать в нестандартных ситуациях исследовательской деятельности знания из различных разделов школьных дисциплин (физика, алгебра), при необходимости находить недостающую информацию в справочной и учебной литературе;
воспитательная:
— воспитать личностную рефлексию, то есть умение осмысливать свои действия и себя в проблемной исследовательской ситуации;
— воспитать самоорганизацию и самооценку учащихся при выполнении исследовательских заданий на уроке.
Оборудование: таблицы «Относительные атомная и молекулярная массы», индивидуальные карточки задания для учеников, таблица Д.И.Менделеева.
Ход урока
I. Организационный момент
Учитель настраивает учеников на работу во время урока. Разъясняет все этапы урока и действия учащихся на каждом из них.
— Ребята сегодня каждый из Вас станет исследователем и будет «добывать новые знания»: выяснять состав химических формул, правила их записи и чтения; выводить формулу массовой доли химического элемента и рассчитывать ее.
II. Изучение новой темы
1. Слово учителя.
— Каждый атом любого химического элемента имеет свою массу, также как и любое физическое тело, окружающее нас, в том числе и мы с Вами. Но в отличии от нас, масса атомов очень мала. Поэтому учеными была принята за эталон масса 1/12 массы атома углерода 612С (как самая легкая) и масса остальных атомов сравнивалась с массой этого эталона, отсюда и название «Относительная атомная масса» от англ. «relative» относителен. Данная величина не имеет единиц измерения и обозначается Ar. Численное значение относительной атомной массы любого элемента прописано в периодической таблице Д.И. Менделеева.
Если вещество образовано несколькими элементами (одинаковыми или разными), то речь уже идет о молекулах и «Молекулярной относительной массе». Она складывается из атомных масс всех химических элементов образующих молекулу, умноженные на количество этих атомов. Так же не имеет единиц измерения и обозначаетсяMr.Например:
Так же не имеет единиц измерения и обозначаетсяMr.Например:
Mr (O2) =Ar (O) ·2 = 16 · 2 = 32;
Mr (H2O) = Ar (H) · 2 + Ar (O) = 1· 2 +16 = 18;
Mr (H2SO4) = Ar (H) · 2 + Ar (S) + Ar (O) · 4 = 1· 2 + 32 + 16 · 4 = 98;
Учитель неоднократно напоминает ученикам, что значение Ar находим в периодической системе Д.И. Менделеева под знаком химического элемента. Значение атомных масс разных химических элементов складываются между собой. Если одинаковых атомов в молекуле несколько, от их численное значение атомных масс умножается на количество этих атомов. (закрепление новой темы будет происходить при выполнении самостоятельной работы в исследовательской части урока)
2. Исследовательская часть (самостоятельная работа учеников под руководством учителя), при возникновении затруднений у учеников учитель должен быть очень осторожен и не в коем случае, не давать ученикам прямой правильный ответ, то есть «готовые знания» они должны добыть их сами. Лучше «подталкивать» ученика к правильному решению наводящими вопросами, стимулирующими мыслительную деятельность, необходимость связывать уже имеющиеся знание из других областей с новым материалом. Это необходимо для того, чтобы не нарушить процесс исследования учеников и добиться наилучшего результата при изучении нового материала, поскольку знания, добытые самостоятельно удерживаются в долговременной памяти, нежели готовая информация.
Лучше «подталкивать» ученика к правильному решению наводящими вопросами, стимулирующими мыслительную деятельность, необходимость связывать уже имеющиеся знание из других областей с новым материалом. Это необходимо для того, чтобы не нарушить процесс исследования учеников и добиться наилучшего результата при изучении нового материала, поскольку знания, добытые самостоятельно удерживаются в долговременной памяти, нежели готовая информация.
Примерные вопросы:
— Как ты думаешь?
— Представь, что изменится если…?
— Как изменится, и что это значит?
— Подумай, где еще ты встречался с этим понятием? и т.д.
Учитель раздает ученикам карточки – задания, акцентирует их внимание на том, что это самостоятельная исследовательская работа, но при необходимости вы (учитель) обязательно поможете и направите работу каждого ученика в правильном направлении.
Карточки – задания
Тема: Химическая формула. Относительные, атомная и молекулярные массы. Массовая доля химических элементов.
Относительные, атомная и молекулярные массы. Массовая доля химических элементов.
Условная запись состава химического вещества, при помощи символов химических элементов, индексов и коэффициентов – называется химической формулой |
Задание 1. Химическая формула ее состав, запись и произношение.
А. Исследуй качественный и количественный состав химических формул. Проанализируй, что каждый из них обозначает в формуле.
Формула | Качественный состав |
O3 | кислород (O) |
H2 | водород (H) |
Al2O3 | алюминий (Al) и кислород (O) |
Формула | Количественный состав |
O3 | три атома кислорода |
H2 | два атома водорода |
Al2O3 | два атома алюминия и три атома кислорода |
Выводы:
1) Качественный состав химической формулы показывает: ____________________________________ образуют вещество.
2) Количественный состав химической формулы показывает:
____________________________________ образуют вещество.
В. Проанализируй запись, как ты думаешь, что показывает индекс и коэффициент в химической формуле.
2Al2O3
коэффициент индекс
индекс – это _____________, которое показывает_______________ в веществе, записывается______________________ символа химического элемента;
коэффициент – это _______________, которое показывает количество _____________ химического вещества, записывается ______________ химической формулой;
В. Исследуй правила чтения формул.
Формула | Произношение |
O2 | «о» — два |
H2 | «аш» — два |
Al2O3 | алюминий – два – «о» — три |
MgS | магний — эс |
1. коэффициент
коэффициент
2. символ химического элемента* и его индекс (если есть.)
3.следующий символ химического элемента и его индекс.
* при прочтении химической формулы читается произношение символа химического элемента, а не его название.
Самостоятельная работа.
(закрепление нового материала)
1.1. Запиши качественный состав каждой формулы:
O3 __________________ K2O _______________________
Cl2 __________________ MgCO3 ____________________
MgO ________________ NaOH _____________________
H2SO4 _______________ FeSO3 _____________________
H3PO4________________ H2Cl2O7 ____________________
1.2. Запиши количественный состав каждой формулы:
O3 __________________ K2O _______________________
Cl2 __________________ MgCO3 ____________________
MgO ________________ NaOH _____________________
H2SO4 _______________ FeSO3 _____________________
H3PO
Формула атомной массы
Атомная масса элемента равна средневзвешенному значению изотопов этого элемента. Изотопы — это атомы, которые имеют один и тот же атомный номер (количество протонов), но другое количество нейтронов. Число протонов определяет идентичность атома, а изотопы имеют одинаковые атомные номера, поэтому атомы принадлежат к одному элементу. Количество нейтронов неодинаково, поэтому массы изотопов не будут одинаковыми. Атомная масса измеряется в атомных единицах массы (а.е.м.), где одна а.е.м. примерно эквивалентна массе отдельного протона или нейтрона.
Изотопы — это атомы, которые имеют один и тот же атомный номер (количество протонов), но другое количество нейтронов. Число протонов определяет идентичность атома, а изотопы имеют одинаковые атомные номера, поэтому атомы принадлежат к одному элементу. Количество нейтронов неодинаково, поэтому массы изотопов не будут одинаковыми. Атомная масса измеряется в атомных единицах массы (а.е.м.), где одна а.е.м. примерно эквивалентна массе отдельного протона или нейтрона.
Изотопы элемента не встречаются в природе в равных процентах, поэтому для определения атомной массы элемента необходимо использовать средневзвешенное значение. Изотопы, встречающиеся в более высоких процентах, будут иметь большее влияние на атомную массу, в то время как изотопы, встречающиеся в более низких процентах, будут иметь меньший эффект.
Атомная масса находится путем умножения массы изотопа на его относительное содержание, а затем сложения индивидуальных масс вместе.
Вопросы по формуле атомной массы:
1. Рассчитайте атомную массу хлора, используя информацию, представленную в следующей таблице.
Рассчитайте атомную массу хлора, используя информацию, представленную в следующей таблице.
Ответ:
Чтобы найти атомную массу хлора, атомная масса каждого изотопа умножается на относительное содержание (процентное содержание в десятичной форме), а затем индивидуальные массы складываются.
34,96885 x 0,7578 = 26,50
36,96590 x 0,2422 = 8,95
26,50 + 8,95 = 35,45
Атомная масса хлора 35.45 а.е.м.
2. Рассчитайте атомную массу никеля, используя информацию, представленную в следующей таблице.
Ответ:
Чтобы найти атомную массу никеля, атомная масса каждого изотопа умножается на относительное содержание (процентное содержание в десятичной форме), а затем индивидуальные массы складываются.
57, x 0,680769 = 39,4406
59, x 0,262231 = 15,7157
60,
x 0,011399 = 0,6945561. х 0,036345 = 2,2508
63,
x 0,009256 = 0,59172
39,4406 + 15,7157 + 0,69455 + 2,2508 + 0,59172 = 58,69337
Атомная масса никеля равна 58,69337 а. е.м.
е.м.
Определение, формула, моль, атомная масса ~ ChemistryGod
В химии молярная масса является важной величиной. Он измеряет массу моля данного вещества.
Оглавление
Определение
Молярная масса данного вещества определяется как масса образца, деленная на моли этого вещества в образце.Другими словами, это масса на моль вещества.
Обычно обозначается символом M .
Единица
Стандартная единица — г моль −1 . Единица СИ — кг моль −1 , однако это очень редко.
Моль
Мы знаем, что один моль вещества состоит из 6,02214076 × 10 23 элементарных частиц. Это число (также известное как постоянная Авогадро) приблизительно равно 6.022 × 10 23 . Таким образом, в одном моль углерода содержится 6.022 × 10 23 атомов углерода.
Когда мы говорим, что молярная масса углерода составляет 12,0 г / моль -1 , это означает, что один моль углерода весит 12,01 г. Другими словами, 6,022 × 10 23 атомов углерода весят 12,01 г.
Другими словами, 6,022 × 10 23 атомов углерода весят 12,01 г.
Важное значение молярной массы
В химии вычисления связаны с химическими реакциями и стехиометрией. Расчеты часто включают такие величины, как молярность, моляльность, мольная доля, молярный объем. Все это связано с количеством родинок.Хотя нет прямого способа измерить количество молей любого вещества, количество молей можно рассчитать, зная молярную массу вещества. Молярная масса связывает массу вещества с его молями. Таким образом, зная молярную массу, мы можем определить количество молей, содержащихся в данной массе образца.
Позвольте мне прояснить ситуацию на примере хлорида натрия. Молярная масса хлорида натрия известна; это 58,44 г моль -1 . Если нам нужно измерить один моль хлорида натрия, нет инструмента, который мог бы измерить его напрямую.Но мы знаем, что 58,44 г хлорида натрия эквивалентны 1 моль его. Итак, мы отмеряли 58,44 г NaCl на весах, что эквивалентно 58,44 г. Следовательно, у нас есть измеренный моль NaCl.
Следовательно, у нас есть измеренный моль NaCl.
[Источник изображения: Викимедиа]
Вот некоторые из важных моментов, касающихся молярной массы:
- Это объемное свойство, а не атомарное свойство вещества .
- Это интенсивное свойство. Таким образом, он не зависит от размера выборки.
- Зависит от процентов от содержания образца. Таким образом, он может варьироваться в зависимости от земного местоположения.
- Используется для преобразования массы вещества в его моль и наоборот.
Атомная масса и молярная масса
Атомная масса и молярная масса путают друг с другом. Но это две разные величины с определением. В таблице ниже описаны различия между ними.
| Атомная масса | Молярная масса |
Атомная масса представляет собой сумму масс протонов, нейтронов и электронов.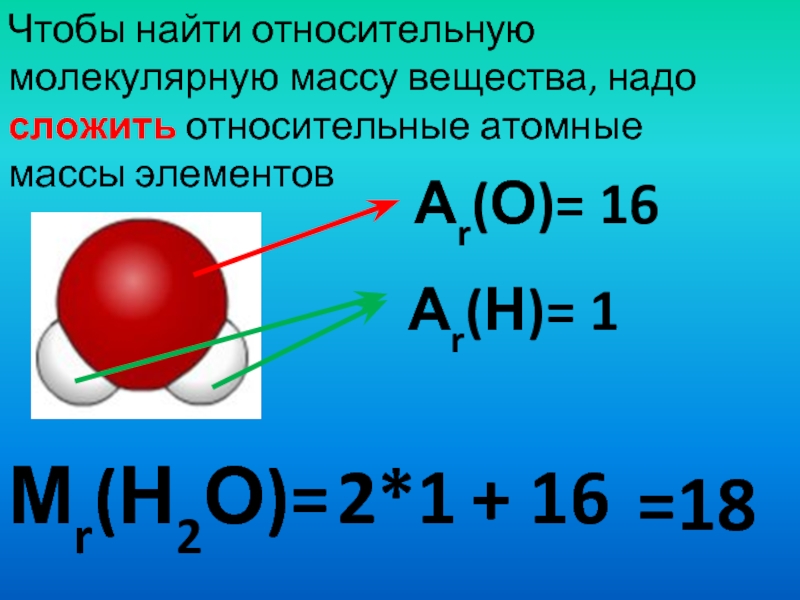 | Это масса моля вещества. |
| Обозначается цифрой м a . | Используемое обозначение — M . |
| Он имеет единицу единой единицы массы (u) или атомную единицу массы (а.е.м.). | г моль −1 — стандартная единица измерения молярной массы. |
| Атомная масса — это атомное свойство. | Это объемное имущество. |
| Не учитывает изотопы. | Существование изотопов учитывается, поскольку они являются объемным свойством. |
| Атомная масса для конкретного изотопного элемента постоянна. Он не меняется от образца к образцу. Например, атомная масса углерода-12 равна 12 ед. Это верно для всех атомов углерода-12 во Вселенной. | Он может варьироваться от образца к образцу в зависимости от процентного содержания компонентов в образце. |
Средняя атомная масса к молярной массе
Если известна средняя атомная масса ( m a ) или средняя молекулярная масса, мы можем преобразовать ее в молярную массу ( M ) с помощью постоянная молярной массы ( M u ).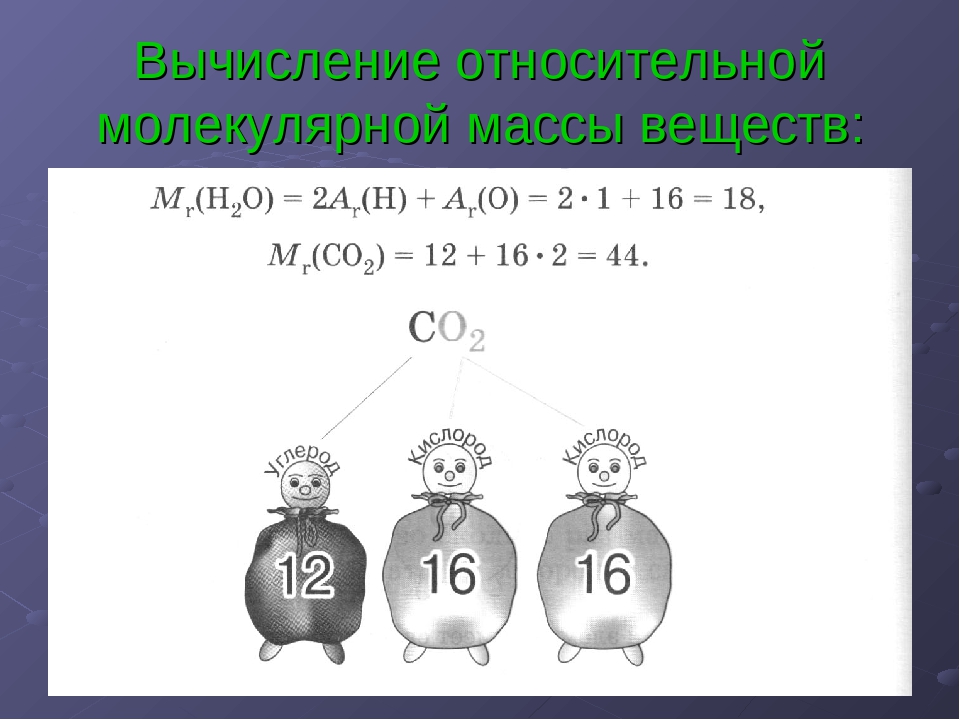
Средняя атомная масса измеряется в единой единице массы (u). Единая единица массы связана с постоянной молярной массы ( M u ) константой Авогадро ( N A ).
m a — средняя атомная масса или средняя масса атома. Итак, масса одного моля атома равна m a × N A . Но это количество находится в единой единице массы (u). Приведенное выше уравнение может преобразовать u в г моль -1 .
Таким образом, средняя атомная масса, деленная на одну унифицированную единицу массы, умноженная на постоянную молярной массы, дает молярную массу.
Точное значение M u составляет 0,99999999965 (30) г моль −1 . Но это значение примерно равно 1 г · моль −1 .
Из приведенного выше уравнения мы можем сказать, что числовое значение молярной массы и средней атомной массы приблизительно равны. Это верно и для молекул.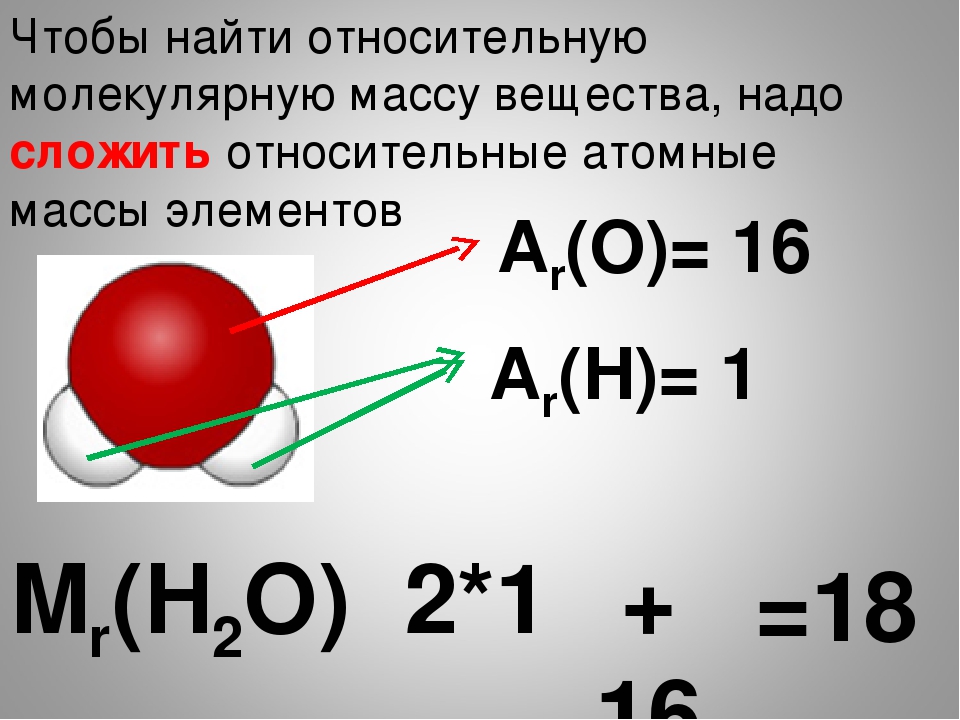 В таблице ниже перечислены элементы (и соединения) со средней атомной массой и средней молярной массой.
В таблице ниже перечислены элементы (и соединения) со средней атомной массой и средней молярной массой.
Элемент (или компонент) | Средняя атомная масса (или средняя молекулярная масса) (u) | Divide (÷) | Единица унифицированной массы (ед.) | Множественная (×) | Константа молярной массы ( M u ) | Равно (=) | Молярная масса (1 г моль — 1 ) | |||||
Водород (H) | 1.008 u | ÷ | 1 u | × | 1 г моль −1 | = | 1.00118 г моль Углерод (C) | 12,011 u | ÷ | 1 u | × | 1 г моль −1 | 12117
Кислород (O) | 15. | ÷ | 1 u | ×1 моль11 | ×1 моль | = | 15,999 г моль −1 | |||||
Азот (N) | 14,007 u | ÷ | ÷ | ÷ | 1 г моль −1 | = | 14.007 г моль −1 | |||||
Калий (K) | 39.098 u | ÷ | 1 u | ×1 моль1 моль | ×1 моль | = | 39,098 г моль −1 | |||||
Кальций (Ca) | 40.078 u | ÷ | ÷ | ÷ | 1 г моль −1 | = | 40.078 г моль −1 | |||||
Хлор (Cl) | 35,45 u | ÷ | 1 u | × | × | = | 35,45 г моль −1 | |||||
Водородный газ (H 2 ) | 2,016 ед. | × | 1 г моль −1 | = | 2.016 г моль −1 | |||||||
Вода (H 2 O) | 18,015 u | ÷ | 1 u | 9117= | 18,015 г моль −1 | |||||||
Метан (CH 4 ) | 16.04 u ÷ 9118 | × | 1 г моль -1 | = | 16.04 г моль −1 | |||||||
Диоксид азота (NO 2 ) | 46,006 u | ÷ | 1 u 003 | −1 | = | 46,006 г моль −1 | ||||||
Аммиак (NH 3 ) | 17,0000 ÷ | × | 1 г моль −1 | = | 17. | |||||||
Глюкоза (C 6 H 12 O 6 ) | 180,156 u | ÷ 0003 | 9117 | 1 г моль −1 | = | 180,156 г моль −1 |
Атомный вес к молярной массе
Атомная масса (также известная как A r ) — безразмерная величина, имеющая числовое значение средней атомной массы.Средняя атомная масса и атомный вес связаны следующим уравнением.
Из двух приведенных выше уравнений
Следовательно, умножение атомной массы на постоянную молярной массы дает молярную массу.
Итак, мы можем вычислить молярную массу любого соединения так же, как мы вычисляем атомный вес составляющих его элементов.
Рассмотрим пример глюкозы. Молекулярная формула глюкозы: C 6 H 12 O 6 ; в нем шесть атомов углерода, двенадцать атомов водорода и шесть атомов кислорода. Молярная масса глюкозы — это сумма относительных атомных масс всех атомов в молекулярной формуле.
Молярная масса глюкозы — это сумма относительных атомных масс всех атомов в молекулярной формуле.
| Элемент | Атомная масса | Молярная масса (г моль −1 ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Углерод (C) | 12.011 | 12.011 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Водород (H) | 1.008 | 1.008 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кислород (O) | 15,999 | 15,999 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная масса глюкозы (C 6 H 12 O 6 ) | Масса180,156 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Элемент | Число атомов | Молярная масса (г моль −1 ) | Всего | |||
| Углерод (C) | 18 | 12.011 | 216,198 | |||
| Водород (H) | 34 | 1,008 | 34,272 | |||
| Кислород (O) | 2 | 15,999 | Молекулярный атом 18 H 34 O 2 ) | 282,468 г моль −1 |
Следовательно, молярный состав олеиновой кислоты составляет 282,468 г моль −1 .
Пример 2: Определение молярной массы соли Рейнеке
Соль Рейнеке представляет собой красную кристаллическую соль с хромом в центре, как показано на рисунке выше.Атом хрома окружен шестью атомами азота, четырьмя атомами углерода и четырьмя атомами серы. Молекулярная формула: C 4 H 12 N 7 OCrS 4 .
Рисунок 4: Соль Рейнеке| Элемент | Молярная масса 9011 г Молярная масса | −1 )Всего | |||||
| Углерод (C) | 4 | 12.011 | 48,044 | ||||
| Водород (H) | 12 | 1,008 | 12,096 | ||||
| Азот (N) | 7 | 14,007 | 15,999 | 15,999 | |||
| Хром (Cr) | 1 | 51,996 | 51,996 | ||||
| Сера (S) | 4 | 32,07 9128 | 32,065 9126 | ||||
354. 444 г моль −1 444 г моль −1 |
Пример 3: Определение молярной массы воздуха
Воздух представляет собой смесь. В основном он на 79% состоит из азота (N 2 ) и (21%) кислорода (O 2 ). Другими компонентами являются аргон (Ar), диоксид углерода (CO 2 ), вода (H 2 O), гелий (He) и т. Д., Но эти компоненты находятся в небольшой доле и ими можно пренебречь.
Молярная масса азота (N 2 ) и кислорода (O 2 ) составляет 28,014 г моль -1 и 31.998 г / моль -1 соответственно.
| Молекулы | Доля | Молярная масса (г моль −1 ) | Всего | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Азот (N 2 )8 | 22,13 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кислород (O 2 ) | 0,21 | 31,998 | 5,88 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная масса воздуха | ≈ 28 г моль0 −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Элемент | Атомный вес (г / моль) |
| Ба | 137,327 |
| C | 12,0107 |
| Ca | 40,078 |
| Cr | 51.9961 |
| ЧАС | 1,00794 |
| Mg | 24.3050 |
| N | 14.0067 |
| Na | 22,989770 |
| О | 15,9994 |
| п | 30,973761 |
Используйте данные из приведенной выше таблицы Менделеева, чтобы ответить на следующие вопросы.
Химические расчеты — —— GCE Study Buddy ——
(Кредит Мустафе Асифу) Скачать презентацию здесьстехиометрия
стехиометрия
Быстрые заметки
- Моль: ровно 12 г углерода-12
- A число вогадро: Число атомов / молекул в одном моль вещества = 6,02 x 1023
- Молярная масса: Масса одного моля вещества (элемента или соединение)
- Молярная масса = Mr
- Mr = сложение массы каждого элемента в соединении
- Единица = г / моль
- Закон определенных пропорций: Соединение всегда содержит точно такую же пропорцию элементы по массе.

- Процентный выход: Измерьте эффективность эксперимента
- Эмпирическая формула: простейшая форма соотношения
- Молярный объем: Объем, занимаемый 1 моль любого газа при комнатной температуре.
- Ограничивающий реагент: Реагент полностью расходуется в химической реакции
- Избыточный реагент: Реагенты, оставшиеся после химической реакции
Относительная атомная масса
Сравнение атомных масс с атомом углерода- Для сравнения с атомом углерода используется атом углерода-12.
- Масса изотопа в 12 раз больше, чем масса атома водорода, поэтому количество атомов углерода-12 эквивалентно массе одного атома водорода.
- Относительная атомная масса: средняя масса одного атома элемента (усреднение изотопов) по сравнению с массой атома углерода-12.
- Относительные атомные массы уже указаны в периодической таблице над каждой химической формулой.

Относительная молекулярная масса и относительная формула массы
- Используя Ar, мы вычисляем относительные массы молекул и ионных соединений
- Молекулы содержат атомы, соединенные вместе, e.г. Cl 2
- Средняя масса (молекулярная масса) Cl 2 = сложить относительные массы обоих атомов.
- Относительная молекулярная масса:
- средняя масса одной молекулы вещества (усреднение изотопов) по сравнению с массой атома углерода-12.
- То же, что и относительная молекулярная масса, но только для ионов
- общее количество Ar всех атомов в формуле ионного соединения
Пример. Относительная формула массы MgSO 4 ?
Mr = 24 + 32 + 4 (16) = 120
Процентный состав
Напр.Определите, в каких оксидах железа Fe 2 O 3 или Fe 3 O 4 больше железа.
Решение
Mr (Fe 2 O 3 ) = 2 (56) + 3 (16) = 160
Процентное содержание Fe в Fe 2 O 3
=
= (2 x 56) / 160 x 100%
= 70%
Mr (Fe 3 O 4 ) = 3 (56) + 4 (16) = 232
Процентное содержание Fe в Fe 2 O 3 = x 100%
= x 100%
= 72%
Следовательно, Fe 3 O 4 имеет более высокий состав железа, чем Fe 2 O 3 .
Расчет массы элемента в соединении
Используйте пример Fe 2 O 3 в приведенном выше примере.
Массовая доля железа в оксиде железа (III) составляет 70%.
Следовательно, чтобы рассчитать массу железа в 200 г соединения оксида железа (III), получим (0,7 x 200) г = 140 г
Пример. Определите массу железа в 200 г Fe 2 O 3 .
Mr (Fe 2 O 3 ) = 2 (56) + 3 (16) = 160
Масса Fe в Fe 2 O 3
=
= (2 x 56 ) / 160 x 200 г
= 140 г
Расчет массы воды в соединении
Соединение с массой воды «гидратировано», и его формула содержит H 2 O.
Напр. Рассчитайте массу воды в 12,5 г гидратированного сульфата меди, CuSO 4 .5H 2 O
Масса 5H 2 O в CuSO 4 .5H 2 O
=
= (5 x 18) / 250 x 12,5 г
= 4,5 г
Моль
Подсчет частиц- Единица для частиц = моль
- Символ = моль
- 1 моль = 6 x 10 23 атомов
Молей частиц — Расчет числа молей
Пример 1: Сколько молекул в 6 x 10 24 молекул воды, H 2 O?= 5 моль
Пример 2: вычислить количество молекул в 0.25 моль CO 2 . Следовательно, сколько атомов присутствует?
Число частиц = 0,25 моль x 6 x 10 23
= 1,5 x 10 23 молекул
Число атомов = общее число атомов в CO 2 x число частиц
= 3 x 1,5 x 10 23
= 4,5 x 10 23 атомов
Молярная масса
- Молярная масса — масса одного моля любого вещества
- Для веществ, состоящих из атомов
- Это Ar элемента в граммах.
 Например. Ar (C) = 12, молярная масса = 12 г
Например. Ar (C) = 12, молярная масса = 12 г - Для веществ, состоящих из молекул
- Это Ar вещества в граммах. Например. Ar (H 2 O) = 18, молярная масса = 18 г
- Для веществ, состоящих из ионов
- Это Ar вещества в граммах. Например. Ar (NaCl) = 58,5, молярная масса = 58,5 г
n = m / Mr
m = n x Mr
m = 0.4 x 56 = 22,4 г
Напр. Газообразный фторгидрид аргона, HArF, первое известное соединение благородного газа, имеет молярную массу 60 г. Найдите количество молей атома аргона в 6,66 г HArF.
n (HArF) = 6,66 / 60
= 0,111 моль
n (Ar) = 0,111 моль x 1 атом Ar в HArF
= 0,111 моль
Различные виды химических формул
- Молекулярная формула — показывает фактическую формулу и виды присутствующих атомов, например C 2 H 6
- Эмпирическая формула — показывает простейшее целочисленное отношение присутствующих атомов, т.
 е.г. C 2 H 6 , соотношение 1: 3, поэтому C 1 H 3 , просто CH 3
е.г. C 2 H 6 , соотношение 1: 3, поэтому C 1 H 3 , просто CH 3 - Структурная формула — показывает, как атомы соединяются в молекуле. Он может быть представлен в виде шариковой модели или схематично.
Расчет эмпирической формулы соединения
Найдите эмпирическую формулу оксида магния, состоящего из 0,32 г кислорода и 0,96 г магния.Шаг 1: найдите количество молей двух элементов.
n (Mg) = 0,96 / 24
= 0,04 моль
n (O) = 0,32 / 16
= 0,02 моль
Шаг 2: Разделите моль на наименьшее число.
Mg = 0,04 / 0,02
= 2
O = 0,02 / 0,02
= 1
Следовательно, эмпирическая формула Mg 2 O
Расчет эмпирической формулы на основе процентного состава
Оксид серы состоит из 40% серы и 60% кислорода.Возьмем сумму 100% за 100 г.
Шаг 1: найдите количество молей двух элементов.
n (S) = 40/32
= 1,25 моль
n (O) = 60/16
= 3,75 моль
Шаг 2: Разделите моль на наименьшее число.
S = 1,25 / 1,25
= 1
O = 3,75 / 1,25
= 3
Таким образом, эмпирическая формула SO 3
Переход от эмпирической формулы к молекулярной формуле
Найдите молекулярную формулу пропена, CH 2 , имеющий молекулярную массу 42.Молекулярная формула будет C n H 2n
Относительная молекулярная масса = 12n (из углерода Ar) + 2n (2 x водород Ar) = 14n
14 n = 42
n = 42/14 = 3
Следовательно -> C 3 H 6
Молярный объем газов
Закон Авогадро:
Равный объем газов при одинаковой температуре и объеме содержит равное количество частицы или молекулы.
Молярный объем газа:
- объем, занимаемый одним моль газа
- Все газы при комнатной температуре и давлении (rtp) = 24dm 3
- 1dm 3 = 1000cm 3
Напр.
 Каково количество молей 240 см 3 Cl 2 при комнатной температуре? = 0,01 моль
Каково количество молей 240 см 3 Cl 2 при комнатной температуре? = 0,01 мольМолярный объем и молярная масса
Газы имеют одинаковый объем, но не обязательно одинаковую массуПример: водород -> 2 г, диоксид углерода -> 44 г
Например.Найдите объем 7 г N 2 при комнатной температуре.
Шаг 1: Найдите число молей из массы азота
n = 7/28
= 0,25 моль
Шаг 2: Найдите объем азота, теперь по формуле газа
0,25 моль = объем газа / 24
Объем газа = 0,25 моль x 24
= 6 дм 3 (или 6000 см 3 )
Концентрация растворов
Концентрация раствора показывает количество растворенного вещества в объеме раствораРасчет количества растворенного вещества
Моль растворенного вещества (n) = Концентрация (моль / дм 3 ) x Объем раствора (дм 3 )Пример.Какова масса растворенного вещества в 600 см 3 1,5 раствора NaOH?
Объем раствора в дм3 = 0,60 дм 3
n = 1,5 x 0,60
= 0,9 моль
Число молей NaOH = m / Mr
0,9 = m / 40
m = 0,9 x 40
= 36g
Расчеты с использованием химических уравнений
Построение химических уравнений
Напр. 1: Реакция между водородом и кислородом
1: Реакция между водородом и кислородом Словесное уравнение: кислород + водород -> вода
Чтобы написать химическое уравнение, мы используем символы атомов / молекул:
O 2 + H 2 -> H 2 O
Уравновесить уравнение!
O 2 + 2H 2 -> 2H 2 O
Расчеты по уравнениям
Реагирующие массы- В каждом уравнении каждый атом является рациональным по отношению друг к другу.
- Предположим, мы хотим найти моль атомов X, которые прореагировали с образованием 0,25 моля атомов Y.
- Мы всегда ставим атом, который хотим найти, как числитель, а знаменатель — это атом, который мы знаем.
Напр. X + 2Z -> 2Y
1. Сначала найдите соотношение:
2. Затем умножьте соотношение на число. моль Y, чтобы найти реагирующий моль X.
1/2 x 0,25 = 0,125 моль
Следовательно, 0,125 моль X прореагировало с 0,25 моль Y.
3.Чтобы найти реагирующую массу X, например Y задается как 35 г, мы просто умножаем моль на массу Y, поскольку они всегда находятся в соотношении:
0,125 x 35 = 4,375 г
Реагирующие массы и объемы
Сначала найдите отношение молей и умножьте моль объема газа, который вы хотите найти, с объемом газа при комнатной температуре (24 дм 3 )
Пример
MgCl 2 образуется в результате реакции Mg и HCl в соответствии с уравнением:
Mg (с ) + 2HCl (водн.) -> MgCl 2 (т) + H 2 (г)
Найдите количество газообразного водорода в см3, образовавшегося при 14.В реакцию вступает 6 г HCl.
m (HCl) = 14,6 / 36,5
= 0,4 моль
Умножьте соотношение на моль HCl = 1/2 x 0,4 = 0,2 моль
Умножьте моль на молярный объем газа при комнатной температуре. = 0,2 x 24 дм 3 = 4,8 дм 3
1 дм 3 = 1000 см 3
Следовательно, 4,8 дм 3 x 1000 = 4800 см 3
4800 см 3 газа составляет сформировано
Примеры вопросов
1 моль CO 2 равен-6. 02 x 10 23 молекул
02 x 10 23 молекул
— 2 моля O
— 1 моль C
— 44,0095 граммов
— 22,4 л при комнатной температуре
— 31,9988 граммов O
— 12,0107 граммов C
MCQ Вопросы
1. Один моль каждого из следующих соединений сжигается в избытке кислорода. Какое соединение будет производить только три моля углекислого газа и три моля пара?а. C 3 H 8
б. C 3 H 7 OH
c.C 3 H 7 CO 2 H
д. CH 3 CO 2 CH 3 2. 20 см 3 монооксида углерода реагируют с 10 см 3 кислорода. Уравнение реакции показано:
2CO + O 2 -> 2CO 2
Какой объем диоксида углерода будет производиться?
а. 10 см 3
б. 20 см 3
c. 30 см 3
г. 40 см 3
3. Что имеет массу, равную массе одного моля воды?
Что имеет массу, равную массе одного моля воды?
а. 24 дм 3 воды
б. один моль пара
c. одна молекула воды
d. два моля молекул водорода и один моль молекул водорода
4. Образец кислорода массой 8 г содержит такое же количество атомов, что и 16 г элемента X. Какова относительная атомная масса Ar для X?
а. 4
г. 8
с. 16
г. 32
5. Какое количество одинаково для одного моля этанола и одного моля этана?
а.масса
б. количество атомов
c. количество молекул
d. объем при комнатной температуре
6. Какой ион присутствует в наибольшей концентрации в водном растворе сульфата натрия с концентрацией 2 моль / дм 3 ?
а. ионы водорода
b, гидроксид-ионы
c. ион натрия
d. сульфат-ион
7. Магний реагирует с соляной кислотой. Какое решение даст самую быструю начальную скорость реакции?
а. 40 г HCl в 1000 см 3 воды
40 г HCl в 1000 см 3 воды
б.20 г HCl в 1000 см 3 воды
c. 10 г HCl на 100 см 3 воды
d. 4 г HCl в 50 см. 3 воды
8. Один моль гидратированного сульфата меди (II), CuSO 4 . 5H 2 O растворяется в воде. Сколько молей ионов содержит раствор?
а. 1
г. 2
с. 6
г. 7
9. Каково отношение объема 2 г водорода к объему 16 г метана, оба объема при r.t.p.?
а. 1 к 1
б. 1 по 2
с. 1 по 8
г. От 2 до 1
10. Что из следующего содержит такое же количество молекул, как 9 г воды?
а. 2 г газообразного водорода
б. 14 г газообразного азота
c. 32 г газообразного кислорода
г. 44 г углекислого газа
11. Кальций реагирует с водой, как показано.
Ca (s) + 2H 2 O (l) -> Ca (OH) 2 (вод.) + H 2 (г)
Какая общая масса раствора остается при 40 г кальция реагирует со 100 г воды?
а. 58 г
58 г
г. 74 г
г. 138 г
г. 140 г
12. 20 см 3 кислорода вступают в реакцию с 20 см 3 оксида углерода. Каковы объемы оставшихся газов при исходной температуре и давлении?
| кислорода / см 3 | оксида углерода / см 3 | диоксида углерода / см 3 0118 | 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| b | 0 | 0 | 40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| c | 10 | 0 | 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| d | 10 13.Какая масса кислорода содержится в 72 г чистой воды? а. 16 г г. 32 г г. 64 г г. 70 г 14. Объем этана, C 2 H 6 , при комнатной температуре. имеет массу 20 г. 16. Какая масса алюминия в 204 г оксида алюминия, Al 2 O 3 ? а. 26г б. 27г с. 54г г. 108g 17. Уравнение горения водорода: 2H 2 (г) + O 2 (г) —> 2H 2 O (г) Один моль водорода газ заставляют реагировать с одним моль газообразного кислорода.Что будет после реакции? а. Только 1 моль пара b. c. 1 моль пара + 1 моль газообразного водорода г. 2 моль пара + 0,5 моль газообразного кислорода 18. Соединение SO 2 Cl 2 реагирует с водой в соответствии с уравнением: SO 2 Cl 2 + 2 h3 O —> H 2 SO 4 + 2HCl Сколько молей гидроксида натрия нейтрализует раствор, образованный одним моль SO 2 Cl 2 и избытком воды? а.1 б. 2 с. 3 г. 4 19. Сколько атомов содержится в (NH 4 ) SO 4 ? а. 15 г. 14 с. 10 г. 7 20. 3Cu + 8HNO 3 -> XCu (NO 3 ) 2 + 2NO + YH 2 O Каковы подходящие значения X и Y для сбалансированной реакции уравнение выше? а. X = 3, Y = 8 б. в. X = 3, Y = 4 г. X = 4, Y = 8 21. Какое массовое процентное содержание кальция в карбонате кальция? а. 4% б. 12% г. 40% г. 44% 22. Какие из следующих соединений содержат такое же процентное содержание азота по массе, что и цианат аммония, NH 4 CNO? а. NH 4 NO 3 b. NH 4 Cl 2 c.N 2 H 2 г. (NH 2 ) 2 CO 23. Углеводород содержит 20% углерода и 80% водорода. Какова его молекулярная формула, если относительная молекулярная масса 30? а. CH 3 б. CH 4 c. C 2 H 6 д. C 2 H 4 24. 0,1 моль металла X (Ar = 27) сожгли в кислороде, получив оксид с массой 5.1гр. Какова формула оксида металла, если его относительная молекулярная масса 30? а. б. ХО 2 с. X 2 O 3 г. X 2 O 25. 100см 3 газообразного водорода содержит n молекул. Сколько молекул содержится в 100 см. 3 газообразного метана (CH 4 ) при одинаковой температуре и давлении? а. № б. н / 5 с.5н / 2 г. 2n / 5 26. Что из следующего состоит из наибольшего числа атомов? а. 4г H 2 б. 8 г O 2 c. 71 г Cl 2 г. 72dm 3 газообразного аргона при RTP 27. Что из следующего состоит из наибольшего количества молекул? а. 32 г О 2 б. 18 г воды c. 28г N 2 г.4 г H 2 28. Какая из следующих формул для ионных соединений неверна? а. Mg (OH) 2 б. КФ г. Al г. 29. Какая максимальная масса хрома Cr может быть извлечена из 76 г оксида хрома (III)? а. 38г б. 48г г. 52г г. 152г 30.Сколько атомов кислорода содержится в 0,2 моля N 2 O 5 ? а. 6,02 x 10 23 б. 4,05 x 10 23 c. 3,01 x 10 22 г. 6,02 x 10 21 Ответы MCQ1. d2. b 3. b 4. d 5. c (закон Авогадро) 6. c 7. c 8. b 9. a 10. b 11. c (количество молей Ca = 40/40 = 1; количество молей воды = 100/18. Таким образом, Ca является ограничивающим реагентом, а H 2 O присутствует в избытке.Масса выделившегося / потерянного газообразного водорода = 2 г. Масса раствора = 140 — 2 = 138 г) 12. c 13. c 14. c 15. b 16. d 17. b 18. d 19. a 20. c 21. 22. d 23. c 24. d 25. a 26. a 27. d 28. d 29. c 30. aСтруктурированный вопрос Рабочие решения1. Когда железо нагревается в паре сухого хлора, получается хлорид, содержащий 34.5% по массе железа.а. вычислить эмпирическую формулу этого хлорида б. относительная молекулярная масса этого хлорида (Mr) составляет 325, 1a. молярное соотношение Fe: Cl = 34,5 / 56: (100 — 34,5) / 35,5 Следовательно, эмпирическая формула FeCl 3 1bi.пусть молекулярная формула будет (FeCl 3 ) n nx (56 + 3 x 35,5) = 325 Следовательно, молекулярная формула будет Fe 2 Cl 6 1bii . 2. ХФУ — это соединения, которые содержат только углерод, хлор и фтор. Они загрязняют атмосферу и разрушают озон в верхних слоях атмосферы. а. CFC11 имеет следующий состав по массе C: 8.7% Рассчитайте эмпирическую формулу CFC11 b. «CFC12» имеет молекулярную формулу CF 2 C l2 . Его можно получить реакцией фтороводорода HF с тетрахлорметаном CCl 4 CCl 4 + 2HF -> CCl 2 F 2 + 2HCl Какая максимальная масса CFC12 что можно сделать из 10,0 г фтороводорода? Решение 2a.
Эмпирическая формула 2б.  Mr HF = 20 Mr HF = 20 Mr CF 2 C l2 = 121 2 x 20 г HF дают 121 г CF 2 C l2 Следовательно, 10 г HF дают (121/40 ) x 10 = 30,25 г CF 2 C l2 3. Супероксид калия, KO 2 представляет собой твердое ионное вещество. Его можно использовать в космических кораблях для подачи кислорода в соответствии со следующим уравнением. 4 KO 2 (s) + 2H 2 O (l) -> 4KOH (s) + 3O 2 (g) Образовавшийся гидроксид калия удаляет диоксид углерода. а. показывают, что 1,0 г супероксида калия будет поставлять около 0,25 дм 3 кислорода при комнатной температуре и давлении. би. назовите соединение, образующееся при реакции двуокиси углерода с твердым гидроксидом калия bii. приведем уравнение образования этого соединения c. Запасы кислорода в больницах хранятся в баллонах. Раствор 3a.Mr of KO 2 = 71 следовательно, 1,0 г KO 2 дает (72/284) x 1 = 0,25 дм 3 из O 2 при комнатной температуре 3bi. карбонат калия 3bii. CO 2 (г) + 2KOH (т) -> K 2 CO3 (т) + H 2 O (л) 3ci. вместе с ацетиленом при сварке 3cii. кислород получают фракционной перегонкой жидкого воздуха 4.Многие автомобили оснащены подушками безопасности, которые надуваются при аварии. Подушки безопасности содержат твердый азид натрия, NaN 3 , который быстро разлагается с образованием натрия и азота. Азот заполняет подушку безопасности. а. построить уравнение, включая символы состояний, для разложения азида натрия. г. при столкновении воздушная подушка заполняется азотом 72 дм 3 при комнатной температуре и давлении. Какая масса азида натрия необходима для обеспечения азота? г.Азид натрия, NaN 3 реагирует с разбавленной соляной кислотой с образованием хлорида натрия и соединения A. и. какова эмпирическая формула соединения А? ii. Постройте уравнение реакции между азидом натрия и разбавленной соляной кислотой. Решение 4a. 2NaN 3 (s) -> 2Na (s) + 3N 2 (g) 4b.нет. молей азота = 72/24 = 3 шт. молей NaN 3 требуется = 2 масса NaN 3 = 2 x (23 + 3 x 14) = 130 г 4ci.
Эмпирическая формула: N 3 H 4cii. 5. Свинцово-белый пигмент, используемый в старых картинах, содержит карбонат свинца (II). Он темнеет на воздухе, содержащем следы сероводорода, из-за образования сернистого свинца (II), PbS. Белый цвет можно восстановить, обработав картину водным раствором перекиси водорода, которая превращает сульфид свинца (II) в сульфат свинца (II) и воду. ai. Напишите химическое уравнение реакции сульфида свинца (II) с пероксидом водорода. aii. Рассчитайте объем 0,100 моль / дм 3 пероксида водорода, необходимый для реакции с 0,25 г сульфида свинца (II). б. Элемент германий (Ge) когда-то был важным компонентом транзисторов. На приведенной ниже блок-схеме показано, как германий можно получить из руды германита. При такой обработке 1,00 г германита присутствующий германий полностью превратился в 0,177 г хлорида, содержащего 33.9% по массе германия. и. Определите эмпирическую формулу хлорида. ii. Запишите валентность германия в хлориде. iii. Рассчитайте процентное содержание германия в германите Раствор ai. PbS + 4H 2 O 2 —> PbSO 4 + 4H 2 O aii. нет. молей PbS = Масса / Mr = 0.25 / (207 + 32) = 0,001046 1 моль PbS реагирует с 4 молями H 2 O 2 0,001046 моль PbS реагирует с 0,001046 / 1 x 4 = 0,004184 моль H 2 O 2 Объем H 2 O 2 требуется = нет. молей / концентрация = 0,004184 / 0,100 = 0.0418 дм 3 би.
-> Эмпирическая формула =000 GeCl 4 biвалентность = 4 biii. = 0,0600 г % германия в германите = 0,0600 / 1,00 x 100% = 6,00% (3 sf) 6. Вычислить число молей: а. 62,1 г BaCl 2 b. H 2 SO 4 дюйм 55 см 3 из 0.25 моль / дм 3 H 2 SO 4 раствор c. 17 дм 3 газообразного азота N 2 Растворы6a. МР BaCl 2 = 208 шт. моль BaCl 2 = 62,1 / 208 = 0,2985 моль -> 0,3 моль (2 dp) 6b. нет. моль H 2 SO 4 = концентрация x объем = 0,25 x 55/1000 = 0,01375 -> 0,01 моль (2 dp) 6c.МР N 2 газ = 28 шт. моль N 2 газ = 17/28 = 0,6071 моль -> 0,61 моль (2 dp) 7. Вычислить a. концентрация 32 г КОН в 500 см 3 воды b. c. объем 100 г CO 2 при нормальном атмосферном давлении и температуре Растворы 7a.Мистер КОН = 56 шт. моль КОН = 32/56 = 0,5714 моль -> 0,57 моль (2 dp) конц КОН = количество моль / (500/1000) = 1,14 моль / дм 3 7b. Mr Fe 2 O 3 = 160 Масса извлеченного Fe = (56 x 2) / 160 x 14,9 = 10,43 г 7c. Г-н СО 2 = 44 шт. моль CO 2 = 100/44 = 2,272 моль -> 2,27 моль (2 dp) об. CO 2 = 2,27 моль x 24 дм 3 = 54.48 дм 3 8. Раствор 250 см 3 этанола в воде содержал 22,3 г этанола, C 2 H5OH. Рассчитайте концентрацию этанола в г / дм 3 и моль / дм 3 . Растворы 8. МР этанола = 46 конц этанола в моль / дм 3 = 89,2 / 46 = 1,94 моль / дм 3 CBSE Class 9 Science Notes for Chapter 3 for 2020-21В этой статье представлены научные заметки CBSE Class 9 по главе 1 «Атомы и молекулы». Эти примечания к главе подготовлены экспертами в данной области и охватывают все важные темы главы. Между этими заметками вы можете попробовать вопросы, заданные из обсуждаемого набора тем. Эти вопросы помогут вам отслеживать свой уровень подготовки и разобраться в предмете. Программа CBSE по естествознанию, класс 9, 2020-2021 гг. Основные темы, освещенные в CBSE Class 9 Science, Atoms and Molecules: Chapter Notes:
Также прочтите: Полный учебный материал по классу 9 CBSE на 2020-2021 годы Ключевые примечания к главе «Атомы и молекулы»: Законы химического соединения: Процесс соединения двух или более элементов с образованием новых соединений регулируется определенными законами, называемыми законами химического соединения. 1. Закон сохранения массы. 2. Закон постоянных пропорций. 1. Закон сохранения массы (Лавуазье в 1744 году): Этот закон гласит, что масса не может быть создана или разрушена в результате химической реакции. 2. Закон постоянных пропорций (Пруст в 1797 г.): Этот закон гласит, что в химическом веществе элементы всегда присутствуют в определенных пропорциях по массе. Например, соотношение водорода и кислорода в чистой воде всегда 1: 8 по весу. Этот закон также называется законом определенных пропорций или законом постоянных пропорций . Атомная теория Дальтона Согласно атомной теории Дальтона, вся материя, будь то элемент, соединение или смесь, состоит из маленьких частиц, называемых атомами Постулаты атомной теории Дальтона:
Ответьте на следующие вопросы: Q. 3 г углерода при сжигании в 8 г кислорода дает 11 г диоксида углерода. Какая масса углекислого газа образуется при сжигании 3 г углерода в 50 г кислорода? К. . Водород и кислород соединяются в соотношении 1: 8 по массе с образованием воды. Какая масса газообразного кислорода потребуется для полной реакции с 3 г газообразного водорода? Какой закон сочетания будет определять ответ? Q. Q. 12 г порошка магния воспламенили в контейнере, содержащем 20 г чистого кислорода. После завершения реакции было обнаружено, что 12 г кислорода осталось непрореагировавшим. Покажите, что это согласно закону постоянных пропорций. 2Mg + O 2 → 2MgO Атомов: Самая маленькая крошечная частица материи, которая не может быть разделена дальше, называется атомом, т.е.е., атом — самый маленький строительный блок материи. Например: натрий (Na), водород (H), кислород (O) и т. Д. Названия атомов или элементов и их символы:
Атомная масса Атомная масса элемента может быть определена как средняя относительная масса атома элемента по сравнению с массой атома углерода (изотопа C-12), взятой как 12 а.е.м. Грамм Атомная масса: Атомная масса элемента, выраженная в граммах, называется атомной массой в граммах. Молекулы: Группа из двух или более чем двух атомов одного и того же или разных элементов, которые химически связаны вместе, называется молекулой. Например: два атома водорода (H 2) и один атом кислорода (O 2 ) реагируют друг с другом и образуют одну молекулу воды. Атомарность: Число атомов, присутствующих в молекуле элемента или соединения, известно как его атомность. Например, атомарность кислорода (O 2 ) равна 2, а атомарность озона (O 3 ) равна 3. Молекулы элементов: Молекулы элемента состоят из атомов одного типа. Например, молекула кислорода состоит из двух атомов кислорода и образует двухатомную молекулу O 2 . Молекулы соединений: Атомы разных элементов соединяются в определенных пропорциях, образуя молекулы соединений. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода с образованием трехатомной молекулы H 2 O. Ион: Это электрически заряженный атом или группа атомов. Он образуется в результате потери или приобретения атомом одного или нескольких электронов. Ионы бывают двух типов: (i) Катион: это положительно заряженный ион, образующийся в результате потери одного или нескольких электронов атомом Например: атом натрия, теряет один электрон, образуя ион натрия Na Na — e — → Na + (ii) Анион: это отрицательно заряженный ион, который образуется в результате усиления одного или нескольких электронов атомом. Например, атом хлора получает один электрон с образованием хлорид-иона Cl —. Cl + e — → Класс — Валентность: Он определяется объединяющей мощностью (или мощностью) элемента. В зависимости от валентности элементы можно классифицировать следующим образом: (i) Моновалентный катион: имеющий катионную валентность 1. Например: ион натрия (Na + ).Ион калия (K + ), ион водорода (H + ). Моновалентный анион: с анионной валентностью -1. Например: хлорид-ион (Cl — ), бромид-ион (Br — ) (ii) Двухвалентный катион: с катионной валентностью 2, Например: ион магния (Mg 2+ ), ион железа (Fe 2+ ). Двухвалентный анион: Имеет анионную валентность -2. Например: оксид-ион (O 2-), сульфид-ион (S 2-). (iii) Трехвалентные катионы: имеющие катионную валентность 3. Например: ион алюминия (Al 3+ ), ион железа (Fe 3+ ). Трехвалентный анион: Имеет анионную валентность -3. Например: нитрид-ион (N -3 ), фосфат-ион (PO 4 3- ) и т. Д. Формула простых и молекулярных соединений: Этапы построения химической формулы соединения: (i) При написании химических формул соединений записывайте составляющие элементы с указанием их валентностей, записывая соответствующие элементы. (ii) Затем перекрестите валентности объединяющихся атомов, как показано в следующих примерах. Шаги для представления химической формулы соединения: (i) Валентности или заряды ионов должны быть сбалансированы. (ii) Для соединения, состоящего из металла и неметалла, сначала пишется символ металла. (iii) В соединениях, образованных многоатомными ионами, ион заключен в скобки перед записью числа, чтобы указать соотношение. Молекулярная масса: Количество раз, когда молекула соединения тяжелее 1/12 массы атома C-12, называется его молекулярной массой. Молекулярная масса равна сумме атомных масс всех атомов, присутствующих в одной молекуле вещества. Например, молекулярная масса H 2 O = 2 × масса одного атома водорода + масса одного атома кислорода = 2 × 1 + 16 = 18 ед. Формула единицы массы: Это сумма атомных масс всех атомов в формульной единице соединения. Формула единицы массы используется для веществ, составляющими частицами которых являются ионы. Например, формульная единица массы ионного NaCl = 23 + 35,5 = 58,5 ед. Mole Concept:
1 моль = 6,023 × 10 23 частиц = Масса 1 моль частиц в граммах
1 моль атомов = грамм атомной массы 1 моль молекулы = грамм молекулярной массы
Количество частиц, присутствующих в одном моль (т.е. 6,023 x 10 23 частиц), называется числом Авогадро или постоянной Авогадро. Ответьте на следующие вопросы: Q. Различайте атомы и молекулы. Q. Определите понятие моля и молярную массу. Q. Представьте следующие молекулы с помощью химической формулы: (a) Хлорид алюминия (б) Карбонат кальция (c) Нитрат меди (d) Азотная кислота Q. Перевести 20 г воды в моль. Q. Рассчитайте количество молекул серы (S8), присутствующих в 16 г твердой серы. Также проверьте: CBSE Class 9 Science Chapter Notes — All Chapters . ➤
|

 Соотношения между единицами физических величин
Соотношения между единицами физических величин
 Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента.
Относительная молекулярная масса равна сумме относительных атомных масс химических элементов, образующих соединение, с учётом числа атомов данного элемента. 999 u
999 u
 031 г моль −1
031 г моль −1 


 — коэффициент Ван ‘т Гоффа.
— коэффициент Ван ‘т Гоффа.

 моль.
моль.

 Например. Ar (C) = 12, молярная масса = 12 г
Например. Ar (C) = 12, молярная масса = 12 г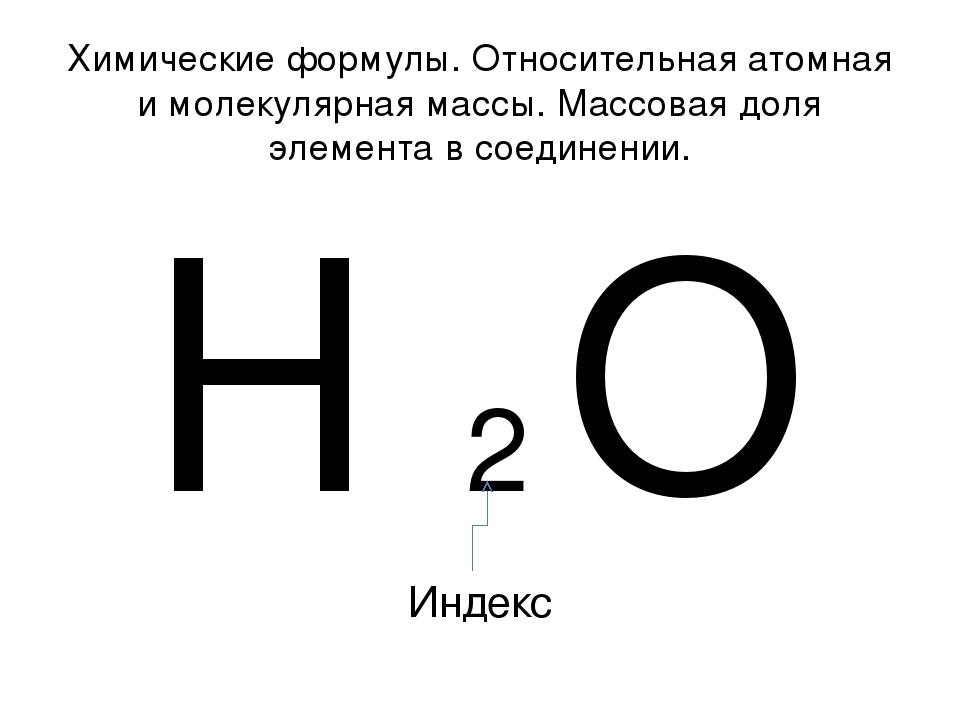 е.г. C 2 H 6 , соотношение 1: 3, поэтому C 1 H 3 , просто CH 3
е.г. C 2 H 6 , соотношение 1: 3, поэтому C 1 H 3 , просто CH 3  Какова масса равного объема пропена, C 3 H 6 при комнатной температуре?
Какова масса равного объема пропена, C 3 H 6 при комнатной температуре?  1 моль пара + 0,5 моль газообразного кислорода
1 моль пара + 0,5 моль газообразного кислорода X = 4, Y = 3
X = 4, Y = 3 ХО
ХО Ca 2 Cl
Ca 2 Cl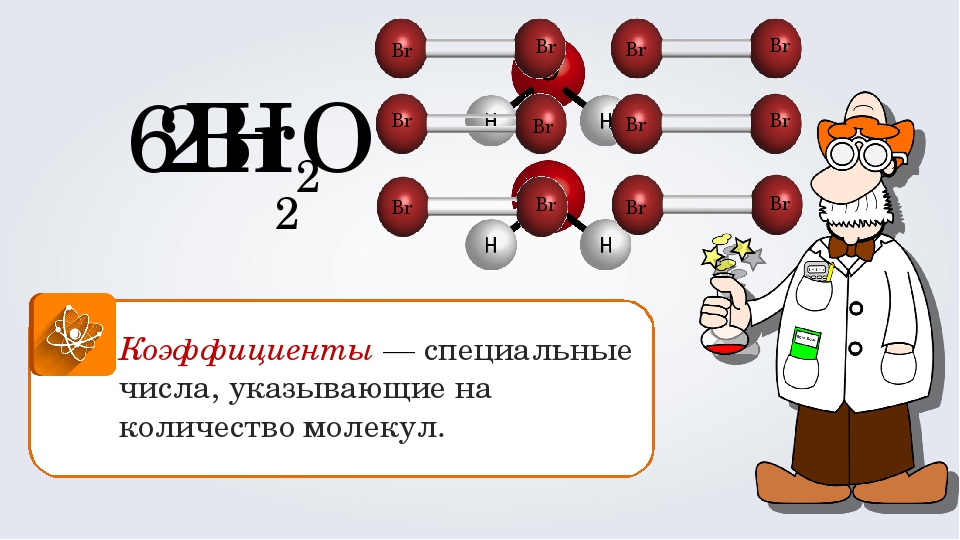 c
c 2Fe (s) + 3Cl 2 (g) -> Fe 2 Cl 6 (s)
2Fe (s) + 3Cl 2 (g) -> Fe 2 Cl 6 (s) кратко опишите, как кислород получается из воздуха
кратко опишите, как кислород получается из воздуха
 NaN 3 + HCl -> NaCl + N 3 H
NaN 3 + HCl -> NaCl + N 3 H  Масса германия в хлориде германия = 33,9 / 100 x 0,177
Масса германия в хлориде германия = 33,9 / 100 x 0,177 масса железа (Fe), которое может быть извлечено из 14,9 г оксида железа (II) (Fe 2 O 3 )
масса железа (Fe), которое может быть извлечено из 14,9 г оксида железа (II) (Fe 2 O 3 )  Концентрация этанола в г / дм 3 = 22,3 / (250/1000) = 89,2 г / дм 3
Концентрация этанола в г / дм 3 = 22,3 / (250/1000) = 89,2 г / дм 3  Это:
Это:
 Какой постулат атомной теории Дальтона объясняет закон определенных пропорций?
Какой постулат атомной теории Дальтона объясняет закон определенных пропорций?




