Урок 8 класса Химические формулы Относительная молекулярная масса
Урок 8 класса. Химические формулы. Относительная молекулярная масса 28. 09. 2016 1
Химические формулы Коэффициенты 6 Fe(OH)3 3 Sn. O 2 10 HNO 3 Индексы 29. 09. 2016 2
Молекулярная масса – масса молекулы, выраженная в атомных единицах массы. Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 атома углерода 12 С. Относительная молекулярная масса обозначается записью Mr. C/12 H 2 O 29. 09. 2016 3
Молярная масса Моль – количество вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов углерода содержится в 12 г изотопа 12 С. Молярная масса (М) – это масса одного моль вещества. Численное значение равно относительной молекулярной массе, только молярная масса имеет размерность [г/моль]. 29. 09. 2016 4
Молярная масса Моль – количество вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов углерода содержится в 12 [г] изотопа 12 С.
Химическая формула и информация Химическая формула вещества H 2 Название вещества Водород Простое или сложное вещество Простое Качественный состав Только атомы водорода Количественный состав 2 атома в одной молекуле Относительная молекулярная масса 1+1 = 2 Молярная масса 2 29. 09. 2016 6
Химическая формула и информация Химическая формула вещества H 2 Название вещества Водород Простое или сложное вещество Простое Качественный состав Только атомы водорода Количественный состав 2 атома в одной молекуле Относительная молекулярная масса 1+1 = 2 Молярная масса 2 29. 09. 2016 7
Химическая формула и информация Химическая формула вещества H 2 O Название вещества Вода Простое или сложное вещество Сложное Качественный состав Атомы водорода и кислорода Количественный состав 2 атома водорода, 1 кислорода Относительная молекулярная масса 1+1+16 = 18 Молярная масса 18 29.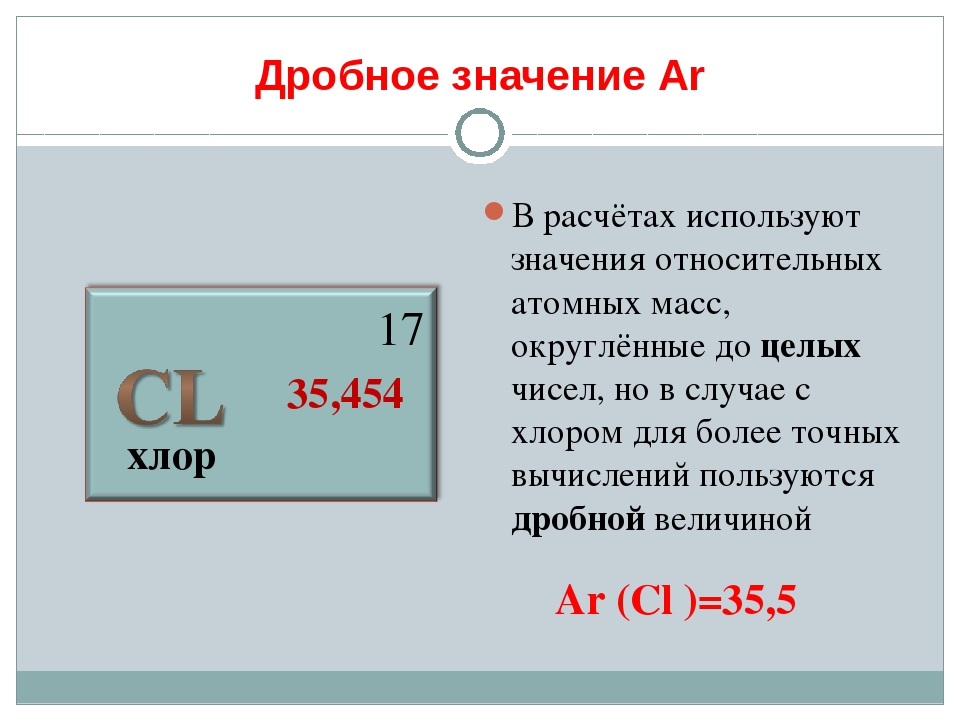
Химическая формула и информация Химическая формула вещества H 2 O Название вещества Вода Простое или сложное вещество Сложное Качественный состав Атомы водорода и кислорода Количественный состав 2 атома водорода, 1 кислорода Относительная молекулярная масса 1+1+16 = 18 Молярная масса 18 29. 09. 2016 9
Химическая формула и информация Химическая формула вещества Au Название вещества Золото Простое или сложное вещество Простое Качественный состав Атомы золота Количественный состав Не молекулярное соединение Относительная молекулярная масса 1+1+16 = 18 Молярная масса 18 29. 09. 2016 10
Химическая формула и информация Химическая формула вещества Au Название вещества Золото Простое или сложное вещество Простое Качественный состав Атомы золота Количественный состав Не молекулярное соединение Относительная молекулярная масса (197) Молярная масса 197 29. 09. 2016 11
Химическая формула и информация Химическая формула вещества Au Название вещества Золото Простое или сложное вещество Простое Качественный состав Атомы золота Количественный состав Не молекулярное соединение Относительная молекулярная масса (197) Формульные единицы Формульная масса Молярная масса 29.
Химическая формула и информация Химическая формула вещества H[Au. Cl 4] Название вещества Тетрахлораурат (III) водорода Простое или сложное вещество Сложное Качественный состав Атомы золота, хлора, водорода Количественный состав 1 атом золота, 4 хлора, 1 водорода Относительная молекулярная масса 197+1+4*35. 5 = 340 Молярная масса 340 29. 09. 2016 13
Химическая формула и информация Химическая формула вещества H[Au. Cl 4] Название вещества Тетрахлораурат (III) водорода Простое или сложное вещество Сложное Качественный состав Атомы золота, хлора, водорода Количественный состав 1 атом золота, 4 хлора, 1 водорода Относительная молекулярная масса 197+1+4*35. 5 = 340 Молярная масса 340 29. 09. 2016 14
Царская водка и нобелевская премия или «Легенда о растворении» Нобелевская медаль 29. 09. 2016 15
Царская водка и нобелевская премия или «Легенда о растворении» + Царская водка – смесь концентрированных азотной HNO 3 и соляной HCl кислот, взятых в соотношении 1: 3 по объёму 29. 09. 2016 6
09. 2016 6
Царская водка и нобелевская премия или «Легенда о растворении» + 29. 09. 2016 = 17
Урок 4. Химические формулы. Относительная атомная и молекулярная массы. | Поурочные планы по химии 8 класс
Цель: сформировать у учащихся понятия «химическая формула», «индекс»,
«коэффициент», «относительная атомная масса», относительная
молекулярная масса»
Ход урока
I. Проверка домашнего задания.
а) Химическая разминка.
Учитель показывает карточки с символами химических элементов, учащиеся называют их.
б) Проверка упр. 2, 3, 4, стр.18 учебника.
II. Изучение нового материала.
Изучение нового материала.
— Состав простых и сложных веществ можно выразить химической формулой.
Химическая формула простого вещества записывается в виде знака — символа элемента. Например, медь — простое вещество — обозначается Сu; сера — S и т.д. У некоторых простых веществ молекула состоит из двух атомов. Например, из двухатомных молекул состоят некоторые неметаллы в газообразном состоянии: водород Н2 (читается «аш-два»), кислород О2 («о-два»), хлор Сl2 («хлор-два»). Из этих формул видно, что число, записанное справа внизу у символа элемента, означает число атомов в молекуле. Его называют
Сложные вещества состоят из атомов разных элементов. Например, вода Н2О («аш-два-о»), углекислый газ СО2 («це-о-два»), поваренная соль NaCl («натрий-хлор»).
Итак, запишем в тетради:
Химическая
формула показывает, атомы каких элементов и в каких количествах соединены
между собой.
Числа, которые показывают, сколько атомов содержится в молекуле, называется индексами.
¯
Коэффициент ®3Н2О — Химическая формула
Коэффициент — это число перед формулой, которое означает число молекул данного вещества.
Относительная атомная масса (Аr) элемента есть отношение массы атома данного элемента к 1/12 массы атома углерода; это безразмерная величина.
Например: Аr(Н2) = 1 · 2 = 2
Аr(S) = 32
Аr(Сl2 ) = 35,5
Относительная
молекулярная масса (Мr) вещества представляет собой сумму относительных
атомных масс элементов, образующих данное вещество.
III. Закрепление.
Выполнение упражнений в «Рабочей тетради»: стр.14, упр.2; стр.16, упр.8, 9, 10.
IV. Домашнее задание: §5; стр.20, упр.1 — 5.
Технологическая карта урока «Химические формулы. Относительная атомная и молекулярная массы»
Объясняет новый материал, используя ЭОР и учебник.
— Что должно быть отражено в письменной записи о веществе? Какая характеристика вещества позволяет не путать одно вещество с другим? (состав, строение)
— Химические формулы отображают состав вещества. Выразим с помощью символов состав самого распространённого вещества на Земле – воды.
Осуществляет работу в группах.
Задание группам: рассмотрите модель молекулы воды, посоветуйтесь и изобразите химическую формулу данного вещества.
Подводит к формулированию понятия «химическая формула», «индекс».
— Какие элементы входят в состав молекулы воды?
— Как обозначаются эти элементы?
— Сколько атомов кислорода в молекуле воды?
— Сколько атомов водорода в молекуле воды?
— Как вы думаете, как показать, что в состав молекулы воды входит один атом кислорода и два атома водорода?
— Число атомов элемента принято обозначать с помощью индексов – цифр, которые ставятся внизу справа от химического знака. Индекс «1» в химических формулах не пишется. Если возле химического знака нет никаких индексов, это означает, что в состав молекулы входит один такой атом.
Н2О – химическая формула воды.
Читается: «Аш-два-о».
Химическая формула – условная запись состава вещества при помощи химических знаков и индексов.
— Индекс – цифра, показывающая число атомов каждого химического элемента в молекуле.
— Знаки отражают качественный состав вещества, а индексы – количественный состав. Т.е. химическая формула показывает какие элементы и в каком количестве входят в состав вещества.
Предлагает обучающимся записать три молекулы воды и на основании обсуждения различных вариантов записи подводит их к пониманию отличия коэффициента от индекса.
— 3Н2О — три молекулы сложного вещества воды, каждая из которых состоит из двух атомов водорода и одного атома кислорода.
Читается: «три-аш-два-о»
Коэффициент – число перед формулой, означающее число молекул данного вещества.
— Чем отличается индекс от коэффициента? (Индекс показывает число атомов данного элемента в составе молекулы, а коэффициент показывает число молекул)
— Аналогично записывают число свободных атомов:
5О – пять атомов кислорода
— Как вы думаете, чем отличаются атомы разных химических элементов? (прежде всего по массе)
— Предположите, в каких единицах измеряется масса атомов химических элементов?
— Масса атомов и молекул очень мала, поэтому ими пользоваться при решении задач очень неудобно. Невозможно взять 10 молекул кислорода и взвесить их на школьных весах. Масса атома кислорода в килограммах равна 26,667 ∙ 10-27 кг, т.е. 25 нулей после запятой. Масса атома водорода – 0,1674 ∙ 10-26 кг. Поэтому для микромира используют особую единицу измерения.
Невозможно взять 10 молекул кислорода и взвесить их на школьных весах. Масса атома кислорода в килограммах равна 26,667 ∙ 10-27 кг, т.е. 25 нулей после запятой. Масса атома водорода – 0,1674 ∙ 10-26 кг. Поэтому для микромира используют особую единицу измерения.
— Масса атомов химических элементов, указанная в ПСХЭ Д.И.Менделеева, называется относительной молекулярной массой Ar.
“r”- первая буква слова «relative», в переводе с англ. «относительный».
Рядом с этим обозначением в скобках записывается знак химического элемента: Ar(О).
— Для того чтобы определить массу, нужен эталон, гирька. За такую гирьку принят самый лёгкий атом — атом водорода, его масса условно взята за единицу. Относительные атомные массы показывают во сколько раз атом данного элемента тяжелее атома водорода.
Рассмотрим пример: на с.40 учебника.
— Скажите, будут ли единицы измерения у относительной атомной массы? (Нет)
— В каждой клетке ПСХЭ Д.И.Менделеева под порядковым номером элемента приведены значения относительных атомных масс элементов. Значения относительных атомных масс нужно округлять до целых чисел у всех элементов кроме хлора — Ar(Cl) = 35,5.
Организует коллективную проверку по уточнению и конкретизации понятий.
Формулирует задание.
— Найдите значения относительных атомных масс химических элементов из таблицы 1, с.35 учебника в ПСХЭ Д.И.Менделеева.
— Для расчёта массы молекул используется относительная молекулярная м асса вещества Мr.
— Относительную молекулярную массу вычисляют путём сложения произведений относительных атомных масс химических элементов, входящих в состав вещества на соответствующие индексы в химической формуле (с учётом числа атомов).
Mr (H2O) = 2Ar (H) + Ar(O) = 2∙1 + 16 = 2+16 = 18
Проводит релаксационные упражнения для обучающихся.
Воспринимают информацию, сообщаемую учителем.
Выдвигают свои мнения.
Работают в группах.
Различают качественный состав вещества (какие химические элементы входят в состав молекулы) и количественный (сколько атомов химических элементов входит в состав молекулы). Делают вывод, что вещества целесообразно обозначать с помощью знаков химических элементов и цифр, которые отражают и качественный и количественный состав, формулируют определение понятий «химическая формула», «индекс» и записывают в тетрадях.
Выдвигают свои предположения.
Формулируют определение «коэффициент» и записывают в тетрадях
Высказывают свои мнения
Слушают вопросы учителя.
Участвуют в коллективной беседе
Выдвигают свои версии
Воспринимают информацию, сообщаемую учителем.
Выдвигают предположения
Проговаривают по цепочке
Выполняют упражнения
Относительная атомная и молекулярная массы. Массовая доля ХЭ.
1 а.е.м. = 1,66057 ∙ 10—24 г = 1/12 m ат.(C)
Относительная атомная масса Ar – величина, которая показывает, во сколько раз масса атома больше
- 1 а.е.м.,
- числа 1, 66057 ∙ 10—24 г или
- 1/12 массы атома С.
Например,
относительная атомная масса атома кислорода равна 15,994.
Записать это следует так, Ar(O) = 16.
Всегда используем округлённое значение Ar, исключение представляет относительная атомная масса атома хлора:
Ar(Cl) = 35,5
Повторите правила округления.
Выполните интерактивное задание. Относительные атомные массы некоторых элементов.
2) ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА
Относительная молекулярная масса Мr – величина, которая показывает, во сколько раз масса молекулы больше
- 1 а.е.м.,
- числа 1, 66057 ∙ 10—24 г или
- 1/12 массы атома С.
Находится как сумма относительных атомных масс атомов, образующих молекулу, с учетом индексов.
Mr(h3SO4) = Ar(H) ∙ 2 + Ar(S) + Ar(O) ∙ 4 = 1∙ 2 + 32 + 16 ∙ 4 = 98
Mr(h3O) = Ar(H) ∙ 2 + Ar(O) = 1∙ 2 + 16 = 18
Выполните интерактивное задание. Расчеты относительных молекулярных масс некоторых веществ.
3) МАССОВАЯ ДОЛЯ ХИМИЧЕСКОГО ЭЛЕМЕНТА
Массовая для элемента в данном веществе (W(дубль-вэ)) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
где
W – массовая доля химического элемента (ХЭ) в веществе,
n– индекс в химической формуле,
Ar– относительная атомная масса ХЭ,
Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях единицы:
W(элемента) = 20% или 0,2.
Задача.
Вычислите массовые доли элементов (%) в фосфорной кислоте H3PO4, с точностью до сотых.
Алгоритм решения задачи.
Выполните интерактивное задание. Расчет массовой доли в веществе.Урок №10. Относительная молекулярная масса. Химические формулы
Химическая формула — это условная запись качественного и количественного состава вещества при помощи химических знаков и индексов.
Что обозначают записи?
H2— это одна молекула водорода (аш-два), в её состав входят два атома водорода.5O2 — это пять молекул кислорода (пять-о-два), в состав одной молекулы входят два атома кислорода.
6Fe — это шесть атомов железа
(шесть-феррум).
3H2SO4 — это три
молекулы серной кислоты (три-аш-два-эс-о-четыре), в состав одной молекулы
серной кислоты входят два атома водорода, один атом серы, четыре атома
кислорода.
Относительная молекулярная масса
Относительная молекулярная масса (Mr)— безразмерная величина, показывающая, во
сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Относительная молекулярная масса вещества равна сумме относительных атомных
масс всех химических элементов, образующих данное соединение, с учетом числа атомов каждого элемента (индексов. )[1]
)[1]
Примеры:
Mr (N2) = 2 Ar (N) = 2 ·14 = 28
Mr (B2O3) = 2 · Ar(B) + 3 · Ar(O) = 2 · 11 + 3 · 16 = 70
Mr (KAl(SO4)2) = 1 · Ar(K)
+ 1 · Ar(Al) + 1· 2 · Ar(S) + 2· 4 · Ar(O) =
= 1 · 39 + 1 · 27 + 1 · 2 · 32 + 2 · 4 ·16 = 258
УПРАЖНЕНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ТЕМЫ
№1. Вычислите относительные молекулярные массы следующих веществ: KOH, Fe2O3, HNO3, Al2(SO4)3
№2. Напишите, что обозначают следующие записи, в скобках указаны названия незнакомых веществ:4S,
7H2O,
4O3 (озон),
2NaCl (поваренная соль),
3H2CO3 (угольная кислота).
6C12H22O11 (сахар)?
№3. РАБОТАЙТЕ С ТРЕНАЖЁРАМИ
ТРЕНАЖЁР 1
ТРЕНАЖЁР 2
ТРЕНАЖЁР 3
ТРЕНАЖЁР 4
ТРЕНАЖЁР 5
ТРЕНАЖЁР 6
[1] В. В.Еремин,А.АДроздов,Н.ЕКузьменко,В.В.Лунин Химия 8 М. 2004
В.Еремин,А.АДроздов,Н.ЕКузьменко,В.В.Лунин Химия 8 М. 2004
План-конспект урока химические формулы относительная атомная и молекулярная массы
ПЛАН-КОНСПЕКТ
УРОКА.
Химические формулы. Относительная
атомная и молекулярная массы.
ФИО (полностью) | Петрова Марина Михайловна | |
Место работы | МБОУ Деевская СОШ | |
Должность | учитель | |
Предмет | химия | |
Класс | 8 | |
Тема и номер урока в теме | Введение. | |
Базовый учебник | О.С.Габриелян |
Цель урока:
Личностные:
1.Развитие ответственного отношения к учению, готовности и способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию.
2.Формирование целостного мировоззрения, соответствующего современному уровню развития науки.
.
Метапредметные:
1.Развитие умений самостоятельно ставить и формулировать для себя новые задачи в учёбе и познавательной деятельности.
2. Развитие
умений определять
способы действий в рамках предложенных
условий и требований.
Развитие
умений определять
способы действий в рамках предложенных
условий и требований.
3.Развитие умение соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата.
4.Развитие компетентности в области использования информационно-коммуникационных технологий .
Предметные:
формирование первоначальных представлений о веществах: понятия «химическая формула», «индекс», «коэффициент», «относительные атомная и молекулярная массы».
овладение основами химической грамотности: умение писать и читать формулы веществ.
формирование навыков расчёта относительной молекулярной массы вещества.
Тип урока — урок введения
нового материала с использованием
электронно-образовательных ресурсов
нового поколения и самостоятельной
деятельности учащихся.
Формы работы учащихся: индивидуальная, в парах.
Необходимое техническое оборудование: персональный компьютер, интерактивная доска.
12.Структура и ход урока
Таблица 1.
СТРУКТУРА И ХОД УРОКА
№ | Этап урока | Название используемых ЭОР (с указанием порядкового номера из Таблицы 2) | Деятельность учителя (с указанием действий с ЭОР, например, демонстрация) | Деятельность ученика | Время (в мин. |
1 | 2 | 3 | 5 | 6 | 7 |
11 | Организационный момент. Проверка домашнего задания. | Доброжелательные слова приветствия. Объясняет задание: на доске знаки химических элементов (2 варианта), необходимо написать название и произношение каждого элемента. После выполнения работы на доске появляются ответы. Фиксирует результаты работы. | Выполняют задание. | 6 | |
22 | Активация познавательной деятельности. | Учитель: «Мы живём в мире веществ и знаем как с помощью букв записать слова «вода», «соль», «сахар», но каждое вещество можно выразить химическим языком. Как слова записываются с помощью букв, так каждое вещество можно выразить с помощью химических знаков и символов». Формулирует цели урока. | Записывают в тетради тему урока. | 3 | |
3 | Изучение нового материала: а) понятие «химическая
формула» (рассказ учителя с элементами
беседы). | Учитель предлагает выразить состав самого распространённого вещества на земле – воды с помощью химических знаков. Вопрос: какие элементы входят в состав воды и как они записываются? Записывает знаки на доске. Число атомов элемента принято обозначать с помощью цифр-индексов. Вывод: знаки отражают качественный состав вещества, а индексы — количественный. Вместе с детьми учитель формулирует определение химической формулы. Если необходимо отобразить несколько одинаковых молекул, тогда следует поставить соответствующую цифру перед формулой. Учитель вводит понятие «коэффициент». Задание: записать три молекулы
серной кислоты , если известно, что
в состав молекулы входят 2 атома
водорода, 1 атом серы и 4 атома кислорода. | Отвечают на вопросы, записывают в тетрадь определение и примеры формул веществ. Выполняют задание в тетради и у доски. | 12 | |
б) относительная атомная масса в) относительная молекулярная масса. | Модуль №1. Относительная атомная масса. Модуль №2. Относительная молекулярная масса. | Учитель демонстрирует ЭОР,
делает комментарии к фрагментам,
обращает особое внимание на обозначения. | Просмотр фрагментов ЭОР, запись в тетради обозначений относительной атомной и молекулярной масс. | ||
4. | Формулирование вопросов к изученному материалу. | Задаёт вопросы: -как обозначаются относительная атомная и молекулярная массы? -почему они называются относительными? -как найти относительную молекулярную массу вещества? | Отвечают на вопросы. | 4 | |
55 | Закрепление изученного материала | Модуль
№3. | Учитель объясняет задание, контролирует его выполнение. | Знакомятся с заданием, задают вопросы по его выполнению. Отрабатывают навыки по вычислению относительной молекулярной массы веществ. | 8 |
6 | Формулирование выводов урока. Домашнее задание. | Вместе с учащимися формулирует выводы урока. Комментирует домашнее задание: параграф 5, стр.20. упр. №4 | С
помощью учителя формулируют выводы
урока. | 4 | |
7 | Рефлексия. | Учитель предлагает учащимся закончить предложения: сегодня на уроке я узнал …, я понял…, я научился…. | Заканчивают предложения. Делятся своими впечатлениями. | 3 |
Приложение к плану-конспекту урока
Химические формулы. Относительная атомная и молекулярная массы.
Таблица 2.
ПЕРЕЧЕНЬ ИСПОЛЬЗУЕМЫХ НА ДАННОМ УРОКЕ ЭОР
№ | Название ресурса | Тип, вид ресурса | Форма
предъявления информации (иллюстрация,
презентация, видеофрагменты, тест,
модель и т. | Гиперссылка на ресурс, обеспечивающий доступ к ЭОР |
1 2 3 | Относительная атомная массаОтносительная молекулярная масса веществаТренажер «Вычисление относительной молекулярной массы веществ» | Инфомационный. лекция Информационный лекция Практика, упражнение | Текст, звук, таблица, формулы Текст, звук, таблица, формулы Текст, звук, таблица, формулы | Относительная
атомная массаОтносительная молекулярная масса веществаТренажер «Вычисление относительной молекулярной массы веществ» |
Химические формулы.
 Относительные атомная и молекулярная массы
Относительные атомная и молекулярная массыМодель Дж. Дальтона и Й.Я. Берцелиуса
В начале 19 в. (спустя 150 лет после работ Роберта Бойля) английский ученый Джон Дальтон предложил способ определения массы атомов химических элементов. Рассмотрим суть этого метода.
Дальтон предложил модель, в соответствии с которой в молекулу сложного вещества входит только по одному атому различных химических элементов. Например, он считал, что молекула воды состоит из 1 атома водорода и 1 атома кислорода. В состав простых веществ по Дальтону тоже входит только один атом химического элемента. Т.е. молекула кислорода должна состоять из одного атома кислорода.
И тогда, зная массовые доли элементов в веществе, легко определить во сколько раз масса атома одного элемента отличается от массы атома другого элемента. Таким образом, Дальтон считал, что массовая доля элемента в веществе определяется массой его атома.
Ученый заметил, что масса атома водорода самая маленькая, т.к. нет сложного вещества, в котором бы массовая доля водорода была бы больше массовой доли другого элемента. Поэтому он предложил массы атомов элементов сравнивать с массой атома водорода. И таким путем вычислил первые значения относительных (относительно атома водорода) атомных масс химических элементов.
Атомная масса водорода была принята за единицу. А значение относительной массы серы получилось равным 17. Но все полученные значения были либо приблизительными, либо неверными, т.к. техника эксперимента того времени была далека от совершенства и установка Дальтона о составе вещества была неверной.
В 1807 – 1817 гг. шведский химик Йёнс Якоб Берцелиус провел огромное исследование по уточнению относительных атомных масс элементов. Ему удалось получить результаты, близкие к современным.
Массы атомов очень малы.
Абсолютные массы некоторых атомов:
m(C) =1,99268 ∙ 10-23 г
m(H) =1,67375 ∙ 10-24 г
m(O) =2,656812 ∙ 10-23 г
В настоящее время в физике и химии принята единая система измерения.
Введена атомная единица массы (а.е.м.)
m(а.е.м.) = 1/12 m(12C) = 1,66057 ∙ 10-24 г.
· Ar(H) = m(атома) / m (а.е.м.) = 1,67375 ∙ 10-24 г/1,66057 ∙ 10-24 г = 1,0079 а.е.м.
Ar – показывает, во сколько раз данный атом тяжелее 1/12 части атома 12С, это безразмерная величина.
Относительная атомная масса — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная атомная масса безразмерная величина
Например, относительная атомная масса атома кислорода равна 15,994 (используем значение из периодической системы химических элементов Д. И. Менделеева).
И. Менделеева).
Записать это следует так, Ar(O) = 16. Всегда используем округлённое значение, исключение представляет относительная атомная масса атома хлора:
Ar(Cl) = 35,5
Связь между абсолютной и относительной массами атома представлена формулой: m(атома) = Ar ∙ 1,66 ∙ 10 -27 кг
III. Относительная молекулярная масса
В химии не используют значения абсолютных масс молекул, а пользуются величиной относительная молекулярная масса. Она показывает, во сколько раз масса молекулы больше 1/12 массы атома углерода. Эту величину обозначают Mr.
Относительная молекулярная масса равна сумме относительных атомных масс входящих в нее атомов. Вычислим относительную молекулярную массу воды.
Вы знаете, что в состав молекулы воды входят два атома водорода и один атом кислорода. Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
Тогда ее относительная молекулярная масса будет равна сумме произведений относительной атомной массы каждого химического элемента на число его атомов в молекуле воды:
Посмотрите презентацию: “Вычисление относительной молекулярной массы серной кислоты”:
| 2. Как рассчитать относительную формула масса или относительная молекулярная масса RFM / RMM или просто M r Как рассчитать относительную молекулярную массу? RMM Как рассчитать относительную формулу массы? RFM Есть ли разница между RMM и RFM? Имеет ли значение, является ли соединение ионным или ковалентный? Относительная молекулярная масса / относительная формула массы
определяется как сумма всех индивидуальных атомных масс ВСЕХ атомов в
по формуле (M r ). Если отдельные атомные массы всех атомов в формуле сложены, вы вычислили относительная формула массы Атомные массы указаны внизу страницы например для ионных соединений, например NaCl = 23 + 35,5 58,5) или молекулярный масса для ковалентных элементов или соединений … например M r из N 2 = 28 от (2 x 14) или соединения e.грамм. M r из C 6 H 12 O 6 = 180 из [(6 x 12) + (12 x 1) + (6 x 16)], и более примеров расчета относительной формулы Далее по странице вы получите атомные массы из таблицы Менделеева. В сбалансированном уравнении химических символов общее количество относительная формула масс реагентов равна общей относительной формуле массы продуктов (см. закон сохранения массовых расчетов). Если честно, термин относительная формула массы может использоваться с любыми соединение, будь то ионное или ковалентное — просто кажется НЕПРАВИЛЬНЫМ говорить о молекулярной массе ионного соединения, когда оно не состоит из молекул, но это для пуристов! Сокращение M r может использоваться для
формула любого элемента или соединения и, повторюсь, «это не имеет значения.
Тогда как относительный атомный масса (раздел 1.Относительная атомная масса) применяется только к одному атому, имеющему как минимум два атома. атомов в формуле требуется термин относительная формула масса или относительная молекулярная масса использоваться. ВНИМАНИЕ: наиболее распространенной ошибкой является использование атомных / протонных номеров вместо атомных масс, к сожалению кроме водорода они разные ! Примеры расчета относительной формулы массы или относительной молекулярной массы: Как рассчитать относительную молекулярную массу = Как для расчета относительной формулы массы Молекулярная / формульная масса = всего
все атомные массы ВСЕХ атомов в молекуле / соединении. Остерегайтесь скоб, например (ОН) 2 означает, что нужно сложить две группы OH!
Тесты для самооценки по относительной формуле массы или относительной массы молекулярная масса ВИКТОРИНА по расчету формула / молекулярная масса Выше представлена типичная таблица Менделеева, используемая в спецификациях по науке и химии GCSE в расчет относительной массы по формуле или расчет относительной молекулярной массы, и я «обычно» использовал эти значения в своих расчетах на примере, чтобы охватить большинство учебные программы
ВИКТОРИНА по расчету формула / молекулярная масса ДРУГИЕ РАСЧЕТНЫЕ СТРАНИЦЫ
расчет относительной формулы расчета массы
относительная молекулярная масса. |
3.
 2: Формула и молекулярная масса
2: Формула и молекулярная массаЦели обучения
- Для определения эмпирической формулы соединения по его массовому составу.
- Вывести молекулярную формулу соединения на основе его эмпирической формулы.
Когда новое химическое соединение, такое как потенциально новое лекарство, синтезируется в лаборатории или выделяется из природного источника, химики определяют его элементный состав, его эмпирическую формулу и структуру, чтобы понять его свойства.В этом разделе основное внимание уделяется тому, как определить эмпирическую формулу соединения, а затем использовать ее для определения молекулярной формулы, если молярная масса соединения известна.
Формула и молекулярная масса
По формуле вес вещества представляет собой сумму атомных масс каждого атома в его химической формуле . Например, вода (H 2 O) имеет вес по формуле:
\ [2 \ times (1.0079 \; а.е.м.) + 1 \ times (15. 9994 \; amu) = 18.01528 \; amu \]
9994 \; amu) = 18.01528 \; amu \]
Если вещество существует в виде дискретных молекул (как с атомами, которые химически связаны между собой ), то химическая формула — это молекулярная формула , а вес формулы равен молекулярная масса .Например, углерод, водород и кислород могут химически связываться с образованием молекулы сахара , глюкозы с химической и молекулярной формулой C 6 H 12 O 6 . Формульный вес и молекулярный вес глюкозы составляют:
\ [6 \ раз (12 \; amu) + 12 \ times (1.00794 \; amu) + 6 \ times (15.9994 \; amu) = 180.0 \; amu \]
Ионные вещества не связаны химически и не существуют в виде дискретных молекул. Однако они действительно объединяются в дискретных соотношениях ионов.Таким образом, мы можем описать их формулы веса, но не их молекулярный вес . Например, столовая соль (\ (\ ce {NaCl} \)) имеет формульный вес:
.
\ [23,0 \; amu + 35,5 \; amu = 58,5 \; amu \]
Состав в процентах от формул
В некоторых типах анализов важно знать массовых процентов каждого типа элемента в соединении. Закон определенных пропорций гласит, что химическое соединение всегда содержит одинаковую пропорцию элементов по массе; то есть процентный состав — процентное содержание каждого элемента, присутствующего в чистом веществе — составляет , константа (хотя есть исключения из этого закона).Возьмем, например, метан (\ (CH_4 \)) с формулой и молекулярной массой:
.\ [1 \ times (12.011 \; amu) + 4 \ times (1.008) = 16.043 \; amu \]
относительные (массовые) проценты углерода и водорода равны
\ [\% C = \ dfrac {1 \ times (12.011 \; amu)} {16.043 amu} = 0,749 = 74.9 \% \]
\ [\% H = \ dfrac {4 \ times (1.008 \; amu)} {16.043 \; amu} = 0,251 = 25,1 \% \]
Более сложным примером является сахароза (столовый сахар), которая содержит 42,11% углерода, 6,48% водорода и 51. 41% кислорода по массе. Это означает, что 100,00 г сахарозы всегда содержат 42,11 г углерода, 6,48 г водорода и 51,41 г кислорода. Сначала молекулярная формула сахарозы (C 12 H 22 O 11 ) используется для расчета массового процента составляющих элементов; затем массовый процент можно использовать для определения эмпирической формулы .
41% кислорода по массе. Это означает, что 100,00 г сахарозы всегда содержат 42,11 г углерода, 6,48 г водорода и 51,41 г кислорода. Сначала молекулярная формула сахарозы (C 12 H 22 O 11 ) используется для расчета массового процента составляющих элементов; затем массовый процент можно использовать для определения эмпирической формулы .
Согласно молекулярной формуле каждая молекула сахарозы содержит 12 атомов углерода, 22 атома водорода и 11 атомов кислорода.Следовательно, моль молекул сахарозы содержит 12 моль атомов углерода, 22 моль атомов водорода и 11 моль атомов кислорода. Эта информация может использоваться для расчета массы каждого элемента в 1 моль сахарозы, что дает молярную массу сахарозы. Эти массы затем можно использовать для расчета процентного состава сахарозы. С точностью до трех десятичных разрядов вычисления следующие:
\ [\ text {масса C / моль сахарозы} = 12 \, моль \, C \ times {12.011 \, г \, C \ over 1 \, mol \, C} = 144.132 \, g \, C \ label {3.1.1a} \]
\ [\ text {масса H / моль сахарозы} = 22 \, моль \, H \ times {1,008 \, г \, H \ over 1 \, mol \, H} = 22,176 \, г \, H \ label {3.1.1b} \]
\ [\ text {масса O / моль сахарозы} = 11 \, моль \, O \ times {15.999 \, г \, O \ over 1 \, mol \, O} = 175.989 \, g \, O \ label {3.1.1c} \]
Таким образом, 1 моль сахарозы имеет массу 342,297 г; Обратите внимание, что более половины массы (175,989 г) составляет кислород, а почти половина массы (144,132 г) — углерод.
Массовый процент каждого элемента в сахарозе — это масса элемента, присутствующего в 1 моль сахарозы, деленная на молярную массу сахарозы, умноженную на 100 для получения процента. Результат отображается с двумя десятичными знаками:
\ [\ text {мас.% C в сахарозе} = {\ text {масса C / моль сахарозы} \ over \ text {молярная масса сахарозы}} \ times 100 = {144,132 \, г \, C \ более 342,297 \, г / моль} \ раз 100 = 42,11 \% \]
\ [\ text {мас.% H в сахарозе} = {\ text {масса H / моль сахарозы} \ over \ text {молярная масса сахарозы}} \ times 100 = {22.176 \, г \, H \ более 342,297 \, г / моль} \ раз 100 = 6,48 \% \]
\ [\ text {мас.% O в сахарозе} = {\ text {масса O / моль сахарозы} \ over \ text {молярная масса сахарозы}} \ times 100 = {175.989 \, g \, O \ over 342.297 \, г / моль} \ раз 100 = 51,41 \% \]
Это можно проверить, убедившись, что сумма процентов всех элементов в составе составляет 100%:
\ [42,11 \% + 6,48 \% + 51,41 \% = 100,00 \% \]
Если сумма не 100%, в расчетах допущена ошибка.(Однако округление до правильного числа десятичных знаков может привести к тому, что общее количество будет немного отличаться от 100%.) Таким образом, 100,00 г сахарозы содержат 42,11 г углерода, 6,48 г водорода и 51,41 г кислорода; с точностью до двух знаков после запятой процентный состав сахарозы действительно составляет 42,11% углерода, 6,48% водорода и 51,41% кислорода.
Рисунок \ (\ PageIndex {1} \): процентный и абсолютный состав сахарозыТакже можно рассчитать массовые проценты, используя атомные массы и молекулярные массы с атомными единицами массы.Поскольку ответ представляет собой соотношение, выраженное в процентах, единицы массы отменяют, являются ли они граммами (с использованием молярных масс) или атомными единицами массы (с использованием атомных и молекулярных масс).
Пример \ (\ PageIndex {1} \): NutraSweet
Аспартам — это искусственный подсластитель, продаваемый как NutraSweet and Equal. Его молекулярная формула \ (\ ce {C14h28N2O5} \).
Молекулярная структура аспартама. (CC BY-NC-SA 3.0; анонимно)- Рассчитайте массовый процент каждого элемента в аспартаме.
- Рассчитайте массу углерода в пакете Equal 1,00 г, предполагая, что это чистый аспартам.
Дано : молекулярная формула и масса образца
Запрошено : массовый процент всех элементов и масса одного элемента в образце
Стратегия :
- Используйте атомные массы из периодической таблицы, чтобы вычислить молярную массу аспартама.
- Разделите массу каждого элемента на молярную массу аспартама; затем умножьте на 100, чтобы получить проценты.
- Чтобы найти массу элемента, содержащегося в заданной массе аспартама, умножьте массу аспартама на массовый процент этого элемента, выраженный в десятичной дроби.
Решение :
а.
A Мы вычисляем массу каждого элемента в 1 моль аспартама и молярную массу аспартама, здесь с точностью до трех знаков после запятой:
\ [14 \, C (14 \, моль \, C) (12.011 \, г / моль \, C) = 168.154 \, г \ nonumber \]
\ [18 \, H (18 \, моль \, H) (1.008 \, г / моль \, H) = 18,114 \, г \ nonumber \]
\ [2 \, N (2 \, моль \, N) (14.007 \, г / моль \, N) = 28.014 \, г \ nonumber \]
\ [+5 \, O (5 \, моль \, O) (15.999 \, г / моль \, O) = 79.995 \, г \ nonumber \]
\ [C_ {14} H_ {18} N_2O_5 \ text {молярная масса аспартама} = 294,277 \, г / моль \ nonumber \]
Таким образом, более половины массы 1 моля аспартама (294,277 г) составляет углерод (168,154 г).
B Чтобы вычислить массовый процент каждого элемента, мы разделим массу каждого элемента в соединении на молярную массу аспартама, а затем умножим на 100, чтобы получить проценты, которые здесь указаны с двумя десятичными знаками:
\ [масса \% \, C = {168.154 \, g \, C \ более 294,277 \, g \, аспартам} \ times 100 = 57,14 \% C \ nonumber \]
\ [масса \% \, H = {18,114 \, г \, H \ более 294,277 \, г \, аспартам} \ times 100 = 6,16 \% H \ nonumber \]
\ [масса \% \, N = {28,014 \, г \, N \ более 294,277 \, г \, аспартам} \ раз 100 = 9,52 \% \ nonumber \]
\ [масса \% \, O = {79,995 \, г \, O \ более 294,277 \, г \, аспартам} \ раз 100 = 27,18 \% \ nonumber \]
В качестве проверки мы можем сложить проценты:
\ [57.14 \% + 6,16 \% + 9,52 \% + 27,18 \% = 100,00 \% \ nonumber \]
Если вы получили общую сумму, которая отличается от 100% более чем примерно на ± 1%, значит, в вычислении должна быть ошибка.
г. C Масса углерода в 1,00 г аспартама рассчитывается следующим образом:
\ [\ text {масса C} = 1,00 \, г \, аспартам \ раз {57,14 \, г \, C \ более 100 \, г \, аспартам} = 0,571 \, г \, C \ nonumber \]
Упражнение \ (\ PageIndex {1} \): оксид алюминия
Рассчитайте массовый процент каждого элемента в оксиде алюминия (Al 2 O 3 ).Затем рассчитайте массу алюминия в 3,62 г образца чистого оксида алюминия.
- Ответ
52,93% алюминия; 47,08% кислорода; 1,92 г Al
Определение эмпирической формулы пенициллина
Подобно тому, как эмпирическая формула вещества может использоваться для определения его процентного состава, процентный состав образца может использоваться для определения его эмпирической формулы, которая затем может использоваться для определения его молекулярной формулы.Такая процедура фактически использовалась для определения эмпирических и молекулярных формул первого открытого антибиотика: пенициллина.
Антибиотики — это химические соединения, избирательно убивающие микроорганизмы, многие из которых вызывают заболевания. Хотя сегодня антибиотики часто воспринимаются как должное, пенициллин был открыт всего около 80 лет назад. Последующая разработка широкого спектра других антибиотиков для лечения многих распространенных заболеваний в значительной степени способствовала значительному увеличению продолжительности жизни за последние 50 лет.Открытие пенициллина — это исторический детектив, в котором ключевую роль сыграло использование массовых процентов для определения эмпирических формул.
В 1928 году Александр Флеминг, молодой микробиолог из Лондонского университета, работал с обычной бактерией, вызывающей фурункулы и другие инфекции, такие как заражение крови. Для лабораторных исследований бактерии обычно выращивают на поверхности геля, содержащего питательные вещества, в небольших плоских чашках для культивирования. Однажды Флеминг заметил, что одна из его культур была заражена голубовато-зеленой плесенью, похожей на плесень, обнаруженную на испорченном хлебе или фруктах.Такие несчастные случаи довольно часты, и большинство лабораторных работников просто выбросили бы культуры. Однако Флеминг заметил, что бактерии растут повсюду на геле, за исключением контаминации плесени (часть (а) на рисунке \ (\ PageIndex {2} \)), и предположил, что плесень должна производить вещество, которое либо убил бактерии или предотвратил их рост. Чтобы проверить эту гипотезу, он вырастил плесень в жидкости, а затем отфильтровал жидкость и добавил ее к различным культурам бактерий.Жидкость убила не только бактерии, которые первоначально изучал Флеминг, но и целый ряд других болезнетворных бактерий. Поскольку плесень была членом семейства Penicillium (названного по имени их карандашообразных ветвей под микроскопом) (часть (b) на рисунке \ (\ PageIndex {2} \)), Флеминг назвал активный ингредиент в бульоне пенициллином.
Рисунок \ (\ PageIndex {2} \): Penicillium. а) плесень Penicillium растет в культуральной посуде; на фото показано его влияние на рост бактерий. (b) На этой микрофотографии Penicillium видны его палочкообразные и карандашные ветви.Название происходит от латинского penicillus, что означает «кисть».Хотя Флеминг не смог выделить пенициллин в чистом виде, медицинское значение его открытия стимулировало исследователей в других лабораториях. Наконец, в 1940 году два химика из Оксфордского университета, Говард Флори (1898–1968) и Эрнст Чейн (1906–1979), смогли выделить активный продукт, который они назвали пенициллин G. В течение трех лет пенициллин G получил широкое распространение. его использовали для лечения пневмонии, гангрены, гонореи и других болезней, и его использование значительно увеличило выживаемость раненых солдат во время Второй мировой войны.В результате своей работы Флеминг, Флори и Чейн разделили Нобелевскую премию по медицине в 1945 году.
Как только им удалось выделить чистый пенициллин G, Флори и Чейн подвергли это соединение процедуре, называемой анализом горения (описанной далее в этом разделе), чтобы определить, какие элементы присутствовали и в каких количествах. Результаты таких анализов обычно выражаются в массовых процентах. Они обнаружили, что типичный образец пенициллина G содержит 53,9% углерода, 4.8% водорода, 7,9% азота, 9,0% серы и 6,5% натрия по массе. Сумма этих чисел составляет всего 82,1%, а не 100,0%, что означает, что должен быть один или несколько дополнительных элементов. Разумным кандидатом является кислород, который является обычным компонентом соединений, содержащих углерод и водород; не думайте, что «недостающая» масса всегда связана с кислородом. Это может быть любой другой элемент. Однако по техническим причинам непосредственный анализ кислорода затруднен. Если предположить, что вся недостающая масса обусловлена кислородом, тогда пенициллин G содержит (100.0% — 82,1%) = 17,9% кислорода. Из этих массовых процентов можно определить эмпирическую формулу и, в конечном итоге, молекулярную формулу соединения.
Чтобы определить эмпирическую формулу из массовых процентов элементов в таком соединении, как пенициллин G, массовые проценты должны быть преобразованы в относительное количество атомов. Для удобства предположим, что образец соединения составляет 100,0 г, хотя размеры образцов, используемых для анализа, обычно намного меньше, обычно в миллиграммах.Это предположение упрощает арифметику, поскольку массовый процент углерода 53,9% соответствует 53,9 г углерода в 100,0 г образца пенициллина G; аналогично 4,8% водорода соответствует 4,8 г водорода в 100,0 г пенициллина G; и так далее для других элементов. Затем каждую массу делят на молярную массу элемента, чтобы определить, сколько молей каждого элемента присутствует в пробе 100,0 г:
\ [{масса \, (г) \ по молярной \, \, массе \, \, (г / моль)} = (г) \ влево ({моль \ по г} \ справа) = моль \ метка {3 .3.2a} \]
\ [53.9 \, g \, C \ left ({1 \, mol \, C \ over 12.011 \, g \, C} \ right) = 4.49 \, mol \, C \ label {3.3.2b} \ ]
\ [4.8 \, g \, H \ left ({1 \, mol \, H \ over 1.008 g \, H} \ right) = 4.8 \, mol \, H \ label {3.3.2c} \]
\ [7.9 \, g \, N \ left ({1 \, mol \, N \ over 14.007 \, g \, N} \ right) = 0.56 \, mol \, N \ label {3.3.2d} \ ]
\ [9 \, g \, S \ left ({1 \, mol \, S \ over 32.065 \, g \, S} \ right) = 0.28 \, mol \, S \ label {3.3.2e} \ ]
\ [6.5 \, g \, Na \ left ({1 \, mol \, Na \ over 22.990 \, g \, Na} \ right) = 0.28 \, mol \, Na \ label {3.3.2f} \]
Таким образом, 100,0 г пенициллина G содержит 4,49 моль углерода, 4,8 моль водорода, 0,56 моль азота, 0,28 моль серы, 0,28 моль натрия и 1,12 моль кислорода (при условии, что вся недостающая масса составляла кислород). Число значащих цифр в количестве молей элементов варьируется от двух до трех, потому что некоторые аналитические данные были представлены только двумя значащими цифрами.
Эти результаты дают отношения молей различных элементов в образце (4,49 моль углерода к 4,8 моль водорода и 0,56 моль азота и т. Д.), Но они не являются целочисленными отношениями, необходимыми для эмпирического расчета. формула — эмпирическая формула выражает относительное количество атомов в наименьших возможных целых числах. Чтобы получить целые числа, разделите количество молей всех элементов в образце на количество молей элемента, присутствующего в наименьшем относительном количестве, которым в этом примере является сера или натрий.Результатом будут индексы элементов в эмпирической формуле. С двумя значащими цифрами результаты таковы:
\ [C: {4.49 \ over 0.28} = 16 \, \, \, \, \, H: {4.8 \ over 0.28} = 17 \, \, \, \, \, N: {0.56 \ over 0.28 } = 2.0 \ label {3.3.3a} \]
\ [S: {0,28 \ более 0,28} = 1,0 \, \, \, \, \, Na: {0,28 \ более 0,28} = 1,0 \, \, \, \, \, O: {1,12 \ более 0,28 } = 4.0 \ label {3.3.3b} \]
Таким образом, эмпирическая формула пенициллина G: C 16 H 17 N 2 NaO 4 S.Другие эксперименты показали, что пенициллин G на самом деле является ионным соединением, которое содержит катионы Na + и анионы [C 16 H 17 N 2 O 4 S] — в соотношении 1: 1. Сложная структура пенициллина G (рисунок \ (\ PageIndex {3} \)) не была определена до 1948 года.
Рисунок \ (\ PageIndex {3} \): Структурная формула и шарообразная модель аниона пенициллина GВ некоторых случаях один или несколько индексов в формуле, вычисляемой с помощью этой процедуры, могут не быть целыми числами.Означает ли это, что интересующее нас соединение содержит нецелое число атомов? Нет; Ошибки округления в расчетах, а также экспериментальные ошибки в данных могут привести к нецелым отношениям. Когда это происходит, необходимо принять решение при интерпретации результатов, как показано в примере 6. В частности, отношения 1,50, 1,33 или 1,25 предполагают, что вам следует умножить все индексы в формуле на 2, 3 или 4 соответственно. Только если отношение находится в пределах 5% от целого значения, следует рассмотреть возможность округления до ближайшего целого числа.
Пример \ (\ PageIndex {2} \): фосфат кальция в зубной пасте
Рассчитайте эмпирическую формулу ионного соединения фосфата кальция, основного компонента удобрений и полирующего агента в зубных пастах. Элементный анализ показывает, что он содержит 38,77% кальция, 19,97% фосфора и 41,27% кислорода.
Дано : процентный состав
Запрошено : эмпирическая формула
Стратегия :
- Возьмем образец весом 100 г и вычислим количество молей каждого элемента в этом образце.
- Получите относительное количество атомов каждого элемента в соединении, разделив количество молей каждого элемента в 100-граммовой пробе на количество молей элемента, присутствующего в наименьшем количестве.
- Если отношения не являются целыми числами, умножьте все нижние индексы на одно и то же число, чтобы получить целые значения.
- Поскольку это ионное соединение, определите анион и катион и запишите формулу так, чтобы заряды были сбалансированы.
Решение :
A 100 г образца фосфата кальция содержит 38.77 г кальция, 19,97 г фосфора и 41,27 г кислорода. Разделив массу каждого элемента в образце 100 г на его молярную массу, можно получить количество молей каждого элемента в образце:
\ [\ text {моль Ca} = 38,77 \, г \, Ca \ times {1 \, моль \, Ca \ более 40,078 \, г \, Ca} = 0,9674 \, моль \, Ca \ nonumber \]
\ [\ text {моль P} = 19,97 \, г \, P \ раз {1 \, моль \, P \ более 30,9738 \, г \, P} = 0,6447 \, моль \, Ca \ nonumber \]
\ [\ text {молей O} = 41,27 \, g \, O \ times {1 \, mol \, O \ более 15.9994 \, g \, O} = 2.5800 \, mol \, O \ nonumber \]
B Чтобы получить относительное количество атомов каждого элемента в соединении, разделите количество молей каждого элемента в 100-граммовой пробе на количество молей элемента в наименьшем количестве, в данном случае фосфора:
\ [P: {0,6447 \, моль \, P \ более 0,6447 \, моль \, P} = 1.000 \, \, \, \, Ca: {0,9674 \ более 0,6447} = 1,501 \, \, \, \ , O: {2,5800 \ более 0,6447} = 4,002 \ nonumber \]
C Мы могли бы записать эмпирическую формулу фосфата кальция как Ca 1.501 P 1.000 O 4.002 , но эмпирическая формула должна показывать отношения элементов в виде небольших целых чисел. Чтобы преобразовать результат в интегральную форму, умножьте все индексы на 2, чтобы получить Ca 3,002 P 2,000 O 8,004 . Отклонение от интегральных атомных отношений невелико и может быть объяснено незначительными экспериментальными ошибками; следовательно, эмпирическая формула Ca 3 P 2 O 8 .
D Ион кальция (Ca 2 + ) является катионом, поэтому для сохранения электрической нейтральности фосфор и кислород должны образовывать многоатомный анион.Из главы 2 «Молекулы, ионы и химические формулы» мы знаем, что фосфор и кислород образуют фосфат-ион (PO 4 3-; см. Таблицу 2.4). Поскольку в эмпирической формуле присутствуют два атома фосфора, должны присутствовать два иона фосфата. Итак, запишем формулу фосфата кальция как Ca 3 (PO 4 ) 2 .
Упражнение \ (\ PageIndex {2} \): нитрат аммония
Вычислите эмпирическую формулу нитрата аммония, ионного соединения, содержащего 35.00% азота, 5,04% водорода и 59,96% кислорода по массе. Хотя нитрат аммония широко используется в качестве удобрения, он может быть взрывоопасным. Например, он был основным компонентом взрывчатки, использованной во время взрыва в Оклахома-Сити в 1995 году.
Федеральное здание Альфреда П. Мурра было разрушено в результате бомбардировки Оклахома-Сити с помощью химических взрывчатых веществ (быстрые химические реакции, в результате которых образуется огромное количество газов).- Ответ
N 2 H 4 O 3 — NH 4 + NO 3 —, записывается как NH 4 NO 3
От эмпирической формулы к молекулярной формуле
Эмпирическая формула дает только относительное количество атомов в веществе в минимально возможном соотношении.Для ковалентного вещества химики обычно больше интересуются молекулярной формулой, которая дает фактическое количество атомов каждого типа, присутствующих в молекуле. Однако без дополнительной информации невозможно узнать, является ли формула пенициллина G, например, C 16 H 17 N 2 NaO 4 S или целым кратным, таким как C 32 H 34 N 4 Na 2 O 8 S 2 , C 48 H 51 N 6 Na 3 O 12 S 3 , или (C 16 H 17 N 2 NaO 4 S) n , где n — целое число.(Фактическая структура пенициллина G показана на рисунке \ (\ PageIndex {3} \)).
Рассмотрим глюкозу, сахар, который циркулирует в нашей крови, обеспечивая топливо для тела и мозга. Результаты анализа горения глюкозы показывают, что глюкоза содержит 39,68% углерода и 6,58% водорода. Поскольку горение происходит в присутствии кислорода, невозможно напрямую определить процентное содержание кислорода в соединении с помощью анализа горения; необходимы другие более сложные методы. Если предположить, что оставшийся процент приходится на кислород, тогда глюкоза будет содержать 53.79% кислорода. Таким образом, образец глюкозы весом 100,0 г будет содержать 39,68 г углерода, 6,58 г водорода и 53,79 г кислорода. Чтобы рассчитать количество молей каждого элемента в образце 100,0 г, разделите массу каждого элемента на его молярную массу:
\ [моль \, C = 39,68 \, g \, C \ times {1 \, mol \, C \ over 12.011 \, g \, C} = 3.304 \, mol \, C \ label {3.3.4a} \]
\ [моль \, H = 6.58 \, g \, H \ times {1 \, mol \, H \ over 1.0079 \, g \, H} = 6.53 \, mol \, H \ label {3.3.4b} \]
\ [молей \, O = 53,79 \, g \, O \ times {1 \, mol \, O \ over 15.9994 \, g \, O} = 3.362 \, mol \, O \ label {3.3.4c} \]
Еще раз, индексы элементов в эмпирической формуле находятся путем деления количества молей каждого элемента на количество молей элемента, присутствующего в наименьшем количестве:
\ [C: {3.304 \ over 3.304} = 1.000 \, \, \, \, H: {6.53 \ over 3.304} = 1.98 \, \, \, \, O: {3.362 \ over 3.304} = 1.018 \ ]
Отношение кислород: углерод равно 1.018, или приблизительно 1, а соотношение водород: углерод составляет приблизительно 2. Таким образом, эмпирическая формула глюкозы — CH 2 O, но какова ее молекулярная формула?
Многие известные соединения имеют эмпирическую формулу CH 2 O, включая формальдегид, который используется для сохранения биологических образцов и имеет свойства, которые сильно отличаются от сахара, циркулирующего в крови. На данный момент неизвестно, является ли глюкоза CH 2 O, C 2 H 4 O 2 или любой другой (CH 2 O) n .Однако экспериментально определенная молярная масса глюкозы (180 г / моль) может быть использована для решения этой дилеммы.
Сначала вычислите формульную массу, молярную массу формульной единицы, которая представляет собой сумму атомных масс элементов в эмпирической формуле, умноженную на их соответствующие индексы. Для глюкозы,
\ [\ text {формула массы} CH_2O = \ left [1 \, моль C \ left ({12.011 \, g \ over 1 \, mol \, C} \ right) \ right] + \ left [2 \ , mol \, H \ left ({1.0079 \, g \ over 1 \, mol \, H} \ right) \ right] + \ left [1 \, mol \, O \ left ({15.5994 \, mol \, O \ over 1 \, mol \, O} \ right) \ right] = 30,026 г \ label {3.3.5} \]
Это намного меньше наблюдаемой молярной массы 180 г / моль.
Во-вторых, определите количество формульных единиц на моль. Для глюкозы рассчитайте количество единиц (CH 2 O), то есть n в (CH 2 O) n , разделив молярную массу глюкозы на формулу массы CH 2 O :
\ [n = {180 \, г \ более 30,026 \, г / CH_2O} = 5,99 \ приблизительно 6 CH_2O \, \ text {формульные единицы} \ label {3.3.6} \]
Каждая глюкоза содержит шесть формульных единиц CH 2 O, что дает молекулярную формулу глюкозы (CH 2 O) 6 , которую чаще записывают как C 6 H 12 O 6 . Молекулярные структуры формальдегида и глюкозы, оба из которых имеют эмпирическую формулу CH 2 O, показаны на рисунке \ (\ PageIndex {4} \).
Рисунок \ (\ PageIndex {4} \): Структурные формулы и шаровые модели для (а) формальдегида и (б) глюкозыПример \ (\ PageIndex {3} \): Кофеин
Рассчитайте молекулярную формулу кофеина, соединения, содержащегося в кофе, чае и напитках колы, которое оказывает заметное стимулирующее действие на млекопитающих.Химический анализ кофеина показывает, что он содержит 49,18% углерода, 5,39% водорода, 28,65% азота и 16,68% кислорода по массе, а его экспериментально определенная молярная масса составляет 196 г / моль.
Дано : процентный состав и молярная масса
Запрошено : молекулярная формула
Стратегия :
- Допустим, 100 г кофеина. Из приведенных процентных соотношений используйте процедуру, приведенную в примере 6, для расчета эмпирической формулы кофеина.
- Рассчитайте массу по формуле, а затем разделите экспериментально определенную молярную массу на массу по формуле. Это дает количество присутствующих формульных единиц.
- Умножьте каждый индекс в эмпирической формуле на количество формульных единиц, чтобы получить молекулярную формулу.
Решение :
A Начнем с деления массы каждого элемента в 100,0 г кофеина (49,18 г углерода, 5,39 г водорода, 28,65 г азота, 16,68 г кислорода) на его молярную массу.Это дает количество молей каждого элемента в 100 г кофеина.
\ [моль \, C = 49,18 \, г \, C \ times {1 \, mol \, C \ over 12.011 \, g \, C} = 4.095 \, mol \, C \ nonumber \]
\ [моль \, H = 5,39 \, г \, H \ раз {1 \, моль \, H \ более 1,0079 \, г \, H} = 5,35 \, моль \, H \ nonumber \]
\ [моль \, N = 28,65 \, г \, N \ раз {1 \, моль \, N \ более 14,0067 \, г \, N} = 2,045 \, моль \, N \ nonumber \]
\ [моль \, O = 16.68 \, g \, O \ times {1 \, mol \, O \ более 15.9994 \, g \, O} = 1.043 \, mol \, O \ nonumber \]
Чтобы получить относительное количество атомов каждого присутствующего элемента, разделите количество молей каждого элемента на количество молей элемента, присутствующего в наименьшем количестве:
\ [O: {1.043 \ over 1.043} = 1.000 \, \, \, \, C: {4.095 \ over 1.043} = 3.926 \, \, \, \, H: {5.35 \ over 1.043} = 5.13 \ , \, \, \, N: {2.045 \ over 1.043} = 1.960 \ nonumber \]
Эти результаты достаточно типичны для реальных экспериментальных данных.Ни одно из атомных соотношений не является точно целым, но все они находятся в пределах 5% от целых значений. Как и в примере 6, разумно предположить, что такие небольшие отклонения от целых значений вызваны небольшими экспериментальными ошибками, поэтому округлите их до ближайшего целого числа. Таким образом, эмпирическая формула кофеина: C 4 H 5 N 2 O.
B Молекулярная формула кофеина может быть C 4 H 5 N 2 O, но это также может быть любое целое кратное этого числа.Чтобы определить действительную молекулярную формулу, мы должны разделить экспериментально определенную молярную массу на формульную массу. Формула массы рассчитывается следующим образом:
\ [4C \, \, \, (4 \, atom \, C) (12.011 \, g / atom \, C) = 48.044 \, g \ nonumber \]
\ [5H \, \, \, (5 \, atom \, H) (1.0079 \, g / atom \, H) = 5.0395 \, g \ nonumber \]
\ [2N \, \, \, (2 \, atom \, N) (14.0067 \, g / atom \, N) = 28.0134 \, g \ nonumber \]
\ [+ 1O \, \, \, (1 \, atom \, O) (15.9994 \, г / атом \, О) = 15.9994 \, г \ nonumber \]
\ [C_4H_5N_2O \, \, \, \, \ text {формула массы кофеина} = 97,096 \, г \ nonumber \]
Разделив измеренную молярную массу кофеина (196 г / моль) на расчетную массу по формуле, получим
\ [{196 г / моль \ более 97,096 г / C_4H_5N_2O} = 2,02 \ приблизительно 2 \, C_4H_5N_2O \, \ text {единицы эмпирической формулы} \ nonumber \]
C В кофеине две формулы C 4 H 5 N 2 O, поэтому молекулярная формула должна быть (C 4 H 5 N 2 O) 2 = C 8 H 10 N 4 O 2 .Состав кофеина следующий:
Упражнение \ (\ PageIndex {3} \): Хладон-114
Рассчитайте молекулярную формулу фреона-114, который содержит 13,85% углерода, 41,89% хлора и 44,06% фтора. Экспериментально измеренная молярная масса этого соединения составляет 171 г / моль. Как и фреон-11, фреон-114 является широко используемым хладагентом, который участвует в разрушении озонового слоя.
- Ответ
\ [C_2Cl_2F_4 \ nonumber \]
Сводка
Эмпирическая формула вещества может быть рассчитана на основе его процентного состава, а молекулярная формула может быть определена на основе эмпирической формулы и молярной массы соединения.Эмпирическая формула вещества может быть рассчитана на основе экспериментально определенного процентного состава, процентного содержания каждого элемента, присутствующего в чистом веществе по массе. Во многих случаях эти проценты можно определить анализом горения. Если молярная масса соединения известна, молекулярная формула может быть определена по эмпирической формуле.
Авторы и авторство
Расчет относительной молекулярной массы Учебное пособие по химии
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Концепции относительной молекулярной массы
На схеме справа показан ящик, содержащий 3 шара:
|
|
Если красный шар имеет массу 16 г, а черный шар имеет массу 1 г, то масса всех трех шаров в коробке равна 16 + 1 + 1 = 18 г.
Мы могли бы написать математическое выражение, чтобы найти общую массу шаров в коробке:
масса (общая) = масса (красный шар) + 2 × масса (черный шар)
масса (общая) = 16 + 2 × 1 = 16 + 2 = 18 г
Химики часто думают об атомах как о действительно крошечных шариках и называют это теорией частиц материи.
Если каждый шар в квадрате представляет собой атом, составляющий молекулу воды, H 2 O, то на диаграмме ниже показан ящик, содержащий молекулу воды, в которой
|
|
Если атом кислорода имеет массу 16, а атом водорода имеет массу 1, то масса всех трех атомов в молекуле воды равна 16 + 1 + 1 = 18.
Мы могли бы написать математическое выражение, чтобы найти общую массу всех атомов в молекуле воды:
масса (молекула воды) = масса (атом кислорода) + 2 × масса (атом водорода)
масса (молекула воды) = 16 + 2 × 1 = 16 + 2 = 18
Это именно то, что мы делаем, когда вычисляем относительную молекулярную массу соединения:
- Используйте химическую формулу, чтобы определить, сколько атомов каждого элемента присутствует в соединении.
компунд X a Y b содержит:
a атомов элемента X
b атомов элемента Y
- Напишите математическое выражение для расчета общей массы всех элементов в соединении (называемой относительной молекулярной массой соединения).
M r (X a Y b ) = относительная молекулярная масса соединения X a Y b
M r (X) = относительная атомная масса элемента X
M r (Y) = относительная атомная масса элемента Y
a = количество атомов элемента X
b = количество атомов элемента Y
M r (X a Y b ) = a × M r (X) + b × M r (Y)
- Используйте Периодическую таблицу, чтобы найти относительную атомную массу (атомный вес) каждого элемента
M r (X) = относительная атомная масса элемента X = некоторое число
M r (Y) = относительная атомная масса элемента Y = другое число
- Подставьте значения относительной атомной массы (атомной массы) каждого элемента в уравнение, а затем решите уравнение, чтобы найти относительную молекулярную массу соединения.
Рабочие примеры расчетов относительной молекулярной массы
Расчет относительной молекулярной массы двухатомной молекулы
Окись углерода — это двухатомная молекула, состоящая из двух атомов: атома углерода (C) и атома кислорода (O).
Окись углерода имеет молекулярную формулу CO
Рассчитайте относительную молекулярную массу (M r ) соединения окиси углерода, CO.
- Что вас просят сделать?
Расчет относительной молекулярной массы окиси углерода
M r (CO) =?
- Какая информация (данные) дана в вопросе?
Химическая формула окиси углерода: CO
- Какая связь между химической формулой и ее относительной молекулярной массой?
Относительная молекулярная масса = сумма относительных атомных масс каждого элемента в соединении
Молекула окиси углерода (CO) содержит 1 атом углерода (C) и 1 атом кислорода (O).
относительная молекулярная масса (CO) = 1 × относительная атомная масса (C) + 1 × относительная атомная масса (O)
M r (CO) = 1 × M r (C) + 1 × M r (O)
- Используйте Периодическую таблицу, чтобы найти относительную атомную массу (атомный вес) для каждого присутствующего элемента:
M r (C) = относительная атомная масса C (углерода) = 12.01
M r (O) = относительная атомная масса O (кислорода) = 16.00
- Рассчитайте относительную молекулярную массу окиси углерода, подставив значения в выражение, чтобы найти M r (CO)
M r (CO) = 1 × M r (C) + 1 × M r (O)
M r (CO) = (1 × 12,01) + (1 × 16,00) = 28,01
Расчет относительной молекулярной массы трехатомной молекулы
Углекислый газ — трехатомная молекула, состоящая из 3 атомов.
Двуокись углерода имеет молекулярную формулу CO 2
Каждая молекула двуокиси углерода состоит из 1 атома углерода (C) и 2 атомов кислорода (O).
Рассчитайте относительную молекулярную массу (M r ) соединения двуокиси углерода, CO 2 .
- Что вас просят сделать?
Расчет относительной молекулярной массы диоксида углерода
M r (CO 2 ) =?
- Какая информация (данные) дана в вопросе?
Химическая формула диоксида углерода: CO 2
- Какая связь между химической формулой и ее относительной молекулярной массой?
относительная молекулярная масса = сумма относительных атомных масс каждого элемента в соединении
Молекула диоксида углерода (CO 2 ) состоит из 1 атома углерода (C) и 2 атомов кислорода (O).
Относительная молекулярная масса(CO 2 ) = 1 × относительная атомная масса (C) + 2 × относительная атомная масса (O)
M r (CO 2 ) = 1 × M r (C) + 2 × M r (O)
- Используйте Периодическую таблицу, чтобы найти относительную атомную массу (атомный вес) для каждого присутствующего элемента:
M r (C) = относительная атомная масса C (углерода) = 12.01
M r (O) = относительная атомная масса O (кислорода) = 16.00
- Рассчитайте относительную молекулярную массу диоксида углерода, подставив значения в выражение, чтобы найти M r (CO 2 )
M r (CO 2 ) = 1 × M r (C) + 2 × M r (O)
M r (CO 2 ) = (1 × 12.01) + (2 × 16,00) = 12,01 + 32,00 = 44,01
Расчет относительной молекулярной массы многоатомного соединения
Гидроксид кальция — многоатомное соединение, состоящее из множества «атомов».
Гидроксид кальция имеет формулу Ca (OH) 2
Соединение состоит из ионов кальция Ca 2+ и гидроксид-ионов OH —
На каждый 1 ион кальция приходится 2 гидроксид-иона.
Каждый гидроксид-ион, OH — , состоит из 1 атома кислорода (O) и 1 атома водорода (H).
Рассчитайте относительную молекулярную массу (M r ) соединения гидроксида кальция, Ca (OH) 2
- Что вас просят сделать?
Расчет относительной молекулярной массы гидроксида кальция.
M r (Ca (OH) 2 ) =?
- Какая информация (данные) дана в вопросе?
Химическая формула гидроксида кальция: Ca (OH) 2
- Какая связь между химической формулой и ее относительной молекулярной массой?
Относительная молекулярная масса = сумма относительных атомных масс каждого элемента в соединении
Гидроксид кальция содержит один атом Са (фактически ион) и два гидроксид-иона.
Каждый гидроксид-ион состоит из одного атома водорода и одного атома кислорода.
Итак, гидроксид кальция содержит 1 атом кальция (Ca), 2 атома кислорода (O) и 2 атома водорода (O).
относительная молекулярная масса гидроксида кальция = 1 × относительная атомная масса (Ca) + 2 × относительная атомная масса (O) + 2 × относительная атомная масса (H)
M r (Ca (OH) 2 ) = 1 × M r (Ca) + 2 × M r (O) + 2 × M r (H)
- Используйте Периодическую таблицу, чтобы найти относительную атомную массу (атомный вес) для каждого присутствующего элемента:
M r (Ca) = относительная атомная масса кальция = 40.08
M r (H) = относительная атомная масса водорода = 1,008
M r (O) = относительная атомная масса кислорода = 16.00
- Рассчитайте относительную молекулярную массу гидроксида кальция, подставив значения в выражение, чтобы найти M r (Ca (OH) 2 )
M r (Ca (OH) 2 ) = 1 × M r (Ca) + 2 × M r (O) + 2 × M r (H)
M r (Ca (OH) 2 ) = (1 × 40.08) + (2 × 16,00) + (2 × 1,008) = 40,08 + 32,00 + 2,016 = 74,10
В качестве альтернативы, относительная молекулярная масса = относительная атомная масса кальция + (2 × относительная молекулярная масса гидроксид-ионов)
M r (Ca (OH) 2 ) = 40,08 + [2 × (16,00 + 1,008)] = 40,08 + [2 × 17,008] = 40,08 + 34,016 = 74,10
Что такое относительная атомная масса и относительная молекулярная масса элемента?
Что такое относительная атомная масса и относительная молекулярная масса элемента?
Формула относительной атомной массы
Более раннее развитие относительной атомной массы
- Атом очень крошечный.Поэтому определить его массу путем взвешивания невозможно. Итак, химики сравнивают массу атома со стандартным атомом.
- Масса атома по сравнению со стандартным атомом известна как его относительная атомная масса (Ar). У него нет единицы.
- Сначала химики использовали атом водорода как стандартный атом, потому что он самый легкий. Масса одного атома водорода была принята за 1 единицу.
- Например, атом гелия в 4 раза тяжелее атома водорода, поэтому относительная атомная масса гелия равна 4.
- Однако многие элементы не могут реагировать с водородом. Таким образом, относительные массы этих элементов не могут быть определены экспериментально. Кроме того, наличие водорода в виде газа при комнатной температуре затрудняет обращение с ним.
- Итак, атом кислорода заменил водород как стандартный атом.
- Однако проблемы возникли, когда было обнаружено существование трех изотопов кислорода. Химики использовали в качестве стандарта природный кислород, содержащий все три изотопа, тогда как физики использовали изотоп кислород-16 в качестве стандарта.
Люди тоже спрашивают
Относительная атомная масса (A
r ) на основе углерода-12Наконец, в 1961 году на международном уровне был согласован новый единый стандарт атома углерода-12.
- Масса одного атома углерода-12 была приписана ровно 12 единицам.
- Carbon-12 был выбран по нескольким причинам.
(a) Углерод-12 уже использовался в качестве эталона в масс-спектрометрах.
(b) Многие элементы могут сочетаться с углеродом -12.
(c) Углерод-12 существует в твердом виде при комнатной температуре, поэтому с ним легко обращаться.
(d) Углерод-12 — самый распространенный изотоп углерода, его содержание составляет около 98,89%. Таким образом, масса ровно 12 единиц, приписываемая одному атому углерода-12, является точным значением. - На основе шкалы углерода-12 относительная атомная масса (A r ) элемента определяется как средняя масса одного атома элемента по сравнению с одной двенадцатой массой атома углерода-12.
- Например, средняя масса одного атома натрия в 23 раза больше, чем масса одной двенадцатой атома углерода-12.Следовательно, относительная атомная масса натрия равна 23.
- Настоящие относительные атомные массы элементов основаны на шкале углерода-12 и могут быть найдены в Периодической таблице элементов.
Примечание:
- Почему относительная атомная масса элемента не имеет единицы?
Ответ:
Относительная атомная масса не является реальной массой атома. Это всего лишь сравнительное значение. Следовательно, относительная атомная масса не имеет единицы. - Относительные атомные массы для большинства элементов являются целыми числами.Однако относительная атомная масса хлора принята равной 35,5 и не является целым числом. Почему?
Ответ:
Обратите внимание, что относительная атомная масса определяется на основе средней массы элементов. Для большинства элементов только один из их изотопов встречается в большом количестве. Следовательно, их относительные атомные массы очень близки к целым числам и, следовательно, могут быть округлены в большую сторону. Природный хлор в значительных количествах состоит из двух изотопов — 75% хлора-35 и 25% хлора-37. Следовательно, относительная атомная масса оказывается равной 35.5 и поэтому не может быть округлен.
Задачи относительной атомной массы и решения
1. Подсчитайте, во сколько раз 3 атома кальция тяжелее 5 атомов углерода.
[Относительная атомная масса: C, 12; Ca, 40]
Раствор:
2. Сколько атомов магния будут иметь ту же массу, что и два атома серебра?
[Относительная атомная масса: Mg, 24; Ag, 108]
Раствор:
Относительная молекулярная масса (M
r ) и относительная формульная масса (F r )- Относительная молекулярная масса вещества — это средняя масса молекулы вещества по сравнению с одной двенадцатой массой одного атома углерода-12.
- Например, относительная молекулярная масса воды равна 18. Это означает, что средняя масса одной молекулы воды в 18 раз больше, чем масса одной двенадцатой части атома углерода-12.
- Молекула состоит из нескольких атомов. Следовательно, относительная молекулярная масса вещества рассчитывается путем сложения относительных атомных масс всех атомов, присутствующих в молекуле вещества.
- По этой причине важно сначала знать молекулярную формулу вещества.
- В таблице ниже показано, как рассчитать относительные молекулярные массы некоторых веществ.
Вещество Молекулярная формула Относительная молекулярная масса, M r Газообразный водород H 2 2 (1) = 2 Кислород О 2 2 (16) = 32 Вода H 2 O 2 (1) + 16 = 18 Пропан К 3 В 8 3 (12) + 8 (1) = 44 Этанол C 2 H 5 OH 2 (12) + 5 (1) + 16 + 1 = 46 Таблица: Относительные молекулярные массы некоторых веществ
[Относительная атомная масса: H, 1; С, 12; О, 16] - Термин «относительная молекулярная масса» может использоваться только для веществ, состоящих из молекул.Для ионных соединений вместо этого используется термин « относительная формула масса » или F r .
- Подобно относительной молекулярной массе, относительная формульная масса ионного соединения рассчитывается путем сложения относительных атомных масс всех атомов, указанных в его формуле.
- В таблице ниже показан расчет относительных формульных масс некоторых ионных соединений.
Таблица: Относительные формулы масс некоторых ионных соединенийВещество Молекулярная формула Относительная формула массы, F r Натрия хлорид NaCl 23 + 35.5 = 58,5 Калий
оксидК 2 О 2 (39) + 16 = 94 Медь (II)
хлоридCuCl 2 64 + 2 (35,5) = 135 Нитрат цинка Zn (НЕТ 3 ) 2 65+ 2 [14 +3 (16)]
= 189Алюминий
сульфатAI 2 (SO 4 ) 3 2 (27) + 3 [32 +4 (16)] = 342 Гидратированная
медь (II)
сульфатCuSO 4 .5H 2 O 64 + 32 + 4 (16) + 5 [2 (1) + 16] = 250 Относительная атомная масса: H, 1; N 14; О, 16; Na, 23; Аl, 27; S, 32; Cl, 35,5; К, 39; Cu, 64; Zn, 65]
- Если мы знаем относительную молекулярную или формульную массу соединения, мы можем узнать относительную атомную массу любого неизвестного элемента в соединении.
Проблемы относительной молекулярной массы и относительной формулы массы с решениями
1. Рассчитайте относительную молекулярную массу аммиака.
[Относительная атомная масса: H, 1; N, 14]
Раствор:
Молекулярная формула аммиака NH 3 .
Относительная молекулярная масса аммиака
= A r азота + (3 x A r водорода)
= 14 + 3 (1)
= 17
2. Относительная формульная масса соединения с формулой Y 2 SO 4 равна 142. Рассчитайте относительную атомную массу элемента Y.
[Относительная атомная масса: O, 16; S, 32]
Решение:
Пусть относительная атомная масса элемента Y = y
Учитывая, что относительная формула массы Y 2 SO 4 = 142
Следовательно, 2y + 32 + 4 (16) = 142
2y + 96 = 142
2y = 46
y = 46/2
= 23
Итак, относительная атомная масса элемента Y равна 23.
Определение относительной атомной массы и относительной молекулярной массы элемента
Цель: Исследовать понятия относительной атомной массы и относительной молекулярной массы, используя аналогию.
Материалы: Болты 5 см, гайки и кнопки.
Аппарат: Весы с двумя чашами.
Процедура:
1. Болт помещается на одну чашу весов, как показано на рисунке ниже.
2. На другой противень помещено достаточно кнопок, чтобы уравновесить две сковороды.
3. Подсчитывается и записывается количество использованных кнопок.
4. Шаги с 1 по 3 повторяются с использованием гайки, болта с гайкой и болта с двумя гайками, по одной вместо болта.
Результаты:
| Объект | Количество используемых кнопок | Относительная масса объекта (по сравнению с канцелярской кнопкой) |
| Болт | 20 | 20 |
| Гайка | 5 | 5 |
| Болт с гайкой | 25 | 25 |
| Болт с двумя гайками | 30 | 30 |
Обсуждение:
- В этом упражнении
(a) кнопка, болт и гайка представляют собой атомы трех элементов.Кнопка
(б) принята за эталон для сравнения масс. Масса одной канцелярской кнопки приписывается 1 единице.
(c) болт с гайкой и болт с двумя гайками представляют собой две молекулы, состоящие из «элементов» болта и гайки. - Так как масса одного болта эквивалентна массе 20 канцелярских кнопок, масса одного болта составляет 20 единиц. Следовательно,
- Таким же образом относительная атомная масса ореха равна 5.
- Было обнаружено, что:
(a) относительная молекулярная масса болта с одной гайкой
= относительная атомная масса болта + относительная атомная масса гайки = 20 + 5 = 25
(b) относительная молекулярная масса болта с двумя гайками
= относительная атомная масса болта + (2 x относительная атомная масса гайки)
= 20 + 2 (5)
= 30 - Точно так же относительная молекулярная масса вещества эквивалентна сумме относительных атомных масс всех атомов, составляющих одну молекулу вещества.
- Этим действием доказано, что нам не нужно знать фактическую массу атомов или молекул, чтобы определить их относительные массы.
Заключение:
Относительную атомную или молекулярную массу можно определить путем сравнения массы одного атома или молекулы с массой стандартного атома соответственно.
Расчет молярной массы и калькулятор молекулярной массы (EnvironmentalChemistry.com)
Чтобы понять концепцию расчета молярной массы, важно понимать молярную единицу.Мол, также называемый моль, является основной единицей измерения в химии. По определению, в современной химии один моль представляет собой количество атомов углерода ровно в 12 граммах изотопа углерода 12. Помните, что углерод-12 имеет атомную массу 12 (шесть нейтронов и шесть протонов).
Один моль чего-либо, однако, содержит 6.0221367E 23 этого объекта. Это число известно как число Авогадро.
- Примеры:
- 1 моль углерода = 6,0221367E 23 атомов углерода
- 1 моль бананов = 6.0221367E 23 бананов
(Разве вы не рады, что они не продают бананы на крот?) - 1 моль бананов = 6.0221367E 23 бананов
Очевидно, что было бы невозможно отсчитать 6.0221367E 23 атомов. Однако помните, что 1 моль углерода-12 = 12 граммов = 6,0221367E 23 атомов. Было установлено, что 1 моль любого элемента = атомная масса этого элемента, выраженная в граммах. Поскольку магний имеет атомную массу 24, один моль магния весит 24 грамма и содержит 6,0221367E 23 атомов магния.Моль любой молекулы = молекулярная масса этой молекулы, выраженная в граммах. Чтобы определить вес одного моля бананов, нужно было бы получить средний вес банана и умножить его на 6,0221367E 23 , тогда мы могли бы взвесить этот вес бананов и пасто, у нас был бы моль бананы. Конечно, этого никто никогда не сделает. Он просто демонстрирует, что моль чего-либо = 6.0221367E 23 , и мы можем измерить моль чего-либо, посчитав это или взвесив.Поскольку атомы слишком малы для подсчета, мы должны взвесить моль атомов.
Молярная масса — это единица, позволяющая ученым рассчитать вес любого химического вещества, будь то элемент или соединение. Молярная масса — это сумма всех атомных масс в формуле. После определения молярной массы вещества будет легко измерить один моль этого вещества.
Расчет молярной массы вещества состоит из следующих этапов (мы будем использовать серную кислоту, H 2 SO 4 , в качестве примера):
- Составьте список каждого элемента и количество атомов каждый элемент, присутствующий в веществе.
- H 2
S 1
O 4
- H 2
- Перейдите к периодической таблице и определите среднюю атомную массу (атомный вес) каждого элемента.
- H 1,00794
S 32,066
O 15,9994
- H 1,00794
- Умножьте каждую атомную массу на количество атомов в формуле.
- H 1,00794 * 2 = 2,015
S 32,066 * 1 = 32,066
O 15,9994 * 4 = 63,998
- H 1,00794 * 2 = 2,015
- Сложите результаты третьего шага:
- 2,015 + 32,066 + 63,998 = 98,079 = молярная масса серной кислоты
В этом примере результаты округлены до правильного числа десятичных знаков.(Поскольку приведенная выше средняя атомная масса серы имеет только 3 десятичных знака, точность не может быть определена за пределами этой точки).
Эти расчеты потребуются, прежде чем можно будет определить молярность или нормальность раствора и многие другие формулы стехиометрии (количественные отношения между химическими веществами в химическом уравнении).
- Попробуйте эти формулы, а затем сравните свои результаты с результатами, полученными на калькуляторе ниже:
- H 2 O
- NH 3
- C 2 H 4 O 2
- K 2 Cr 2 O 7
- NH 3
Калькулятор молекулярной массы
В формулах можно одновременно открывать не более двух скобок, и молекула кристаллизации должна быть помещена последней.
- Примеры:
- 3BeO.Al2O 3 ,6 (SiO 2 ) = (BeO) 3.Al2O3,6 (SiO2)
- (BaH 2 O) 2 Mn 5 5 O 10 = (Bah3O) 2Mn5O10
- (KMgCl 3 ) .6H 2 O = (KMgCl3) .6h3O
- (BaH 2 O) 2 Mn 5 5 O 10 = (Bah3O) 2Mn5O10
Связанные ресурсы
- Молярные различия, молярность и нормальность между молярностью, молярностью и нормальностью.
- Периодическая таблица элементов
Предоставляет исчерпывающие данные о химических элементах, включая множество свойств, названия элементов на многих языках, химические соединения, наиболее известные нуклиды. - Анатомия атома
Отвечает на многие вопросы, касающиеся структуры атомов.
Цитирование этой страницы
Если вам нужно процитировать эту страницу, вы можете скопировать этот текст:
Роберта Барбалас, Кеннет Барбалас. Расчет молярной массы и калькулятор молекулярной массы. EnvironmentalChemistry.com. 1996. Доступно в Интернете: 28.10.2021
https://EnvironmentalChemistry.com/yogi/reference/molar.html
.
Ссылка на эту страницу
Если вы хотите разместить ссылку на эту страницу со своего веб-сайта, блога и т. Д.скопируйте и вставьте этот код ссылки (красный) и измените его в соответствии со своими потребностями:
echo Расчет молярной массы и молекулярный вес Калькулятор (EnvironmentalChemistry.com) — Учебное пособие по расчетам молярной массы с примерами и калькулятором молекулярной массы для помощи в расчетах.
.
УВЕДОМЛЕНИЕ: Хотя ссылки на статьи приветствуются, НАШИ СТАТЬИ НЕ МОГУТ БЫТЬ КОПИРОВАТЬ ИЛИ ПОВТОРНО Публикация НА ДРУГИМ ВЕБ-САЙТЕ НИ ПРИ КАКИХ ОБСТОЯТЕЛЬСТВАХ.
ПОЖАЛУЙСТА, если вам понравилась опубликованная нами статья, просто дайте ссылку на нее на нашем сайте, не публикуйте ее повторно.
% PDF-1.3
%
658 0 obj>
эндобдж
xref
658 2515
0000000016 00000 н.
0000054097 00000 п.
0000050596 00000 п.
0000054192 00000 п.
0000054396 00000 п.
00000 00000 п.
00000 00000 п.
00000 00000 п.
00000 00000 п.
00000 00000 п.
00000 00000 п.
00000 00000 п.
00000 00000 п.
00000 00000 н.
00002 00000 н.
00002 00000 н.
00002 00000 н.
00002 00000 н.
00003 00000 н.
00003 00000 п.
00003 00000 н.
00003 00000 п.
00003 00000 н.
00003 00000 н.
00003 00000 н.
0000392699 00000 н.
0000392859 00000 н.
0000393019 00000 н.
0000393176 00000 н.
0000393336 00000 н.
0000393496 00000 н.
0000393653 00000 п.
0000393816 00000 н.
0000393976 00000 н.
0000394146 00000 н.
0000394366 00000 н.
0000394526 00000 н.
0000394689 00000 н.
0000394849 00000 н.
0000395009 00000 н.
0000395229 00000 н.
0000395389 00000 н.
0000395546 00000 н.
0000395706 00000 н.
0000395866 00000 н.
0000396026 00000 н.
0000396186 00000 п.
0000396343 00000 п.
0000396503 00000 н.
0000396663 00000 н.
0000396888 00000 н.
0000397091 00000 н.
0000397251 00000 н.
0000397408 00000 н.
0000397571 00000 н.
0000397731 00000 н.
0000397891 00000 н.
0000398051 00000 н.
0000398211 00000 н.
0000398371 00000 н.
0000398531 00000 н.
0000398691 00000 п.
0000398851 00000 н.
0000399054 00000 н.
0000399214 00000 н.
0000399377 00000 н.
0000399534 00000 н.
0000399694 00000 н.
0000399854 00000 н.
0000400011 00000 н.
0000400171 00000 н.
0000400331 00000 п.
0000400491 00000 п.
0000400648 00000 н.
0000400808 00000 п.
0000400965 00000 н.
0000401122 00000 н.
0000401351 00000 н.
0000401527 00000 н.
0000401743 00000 н.
0000401903 00000 н.
0000402066 00000 н.
0000402223 00000 н.
0000402380 00000 н.
0000402595 00000 н.
0000402755 00000 н.
0000402912 00000 н.
0000403072 00000 н.
0000403232 00000 н.
0000403392 00000 н.
0000403552 00000 н.
0000403712 00000 н.
0000403872 00000 н.
0000404032 00000 н.
0000404269 00000 н.
0000404481 00000 н.
0000404641 00000 п.
0000404798 00000 н.
0000404961 00000 н.
0000405121 00000 н.
0000405281 00000 п.
0000405441 00000 н.
0000405601 00000 п.
0000405761 00000 н.
0000405918 00000 н.
0000406078 00000 н.
0000406238 00000 п.
0000406460 00000 н.
0000406620 00000 н.
0000406783 00000 н.
0000406943 00000 н.
0000407103 00000 н.
0000407263 00000 н.
0000407420 00000 н.
0000407580 00000 н.
0000407740 00000 н.
0000407900 00000 н.
0000408057 00000 н.
0000408217 00000 н.
0000408377 00000 н.
0000408534 00000 н.
0000408764 00000 н.
0000408959 00000 н.
0000409177 00000 н.
0000409337 00000 н.
0000409500 00000 н.
0000409660 00000 н.
0000409820 00000 н.
0000410029 00000 н.
0000410189 00000 п.
0000410346 00000 н.
0000410509 00000 п.
0000410669 00000 н.
0000410829 00000 н.
0000410989 00000 п.
0000411149 00000 н.
0000411309 00000 н.
0000411469 00000 н.
0000411673 00000 н.
0000411878 00000 н.
0000412038 00000 н.
0000412195 00000 н.
0000412358 00000 н.
0000412518 00000 н.
0000412678 00000 н.
0000412838 00000 н.
0000413001 00000 н.
0000413161 00000 п.
0000413318 00000 н.
0000413478 00000 н.
0000413638 00000 п.
0000413850 00000 н.
0000414010 00000 н.
0000414173 00000 н.
0000414333 00000 п.
0000414493 00000 п.
0000414653 00000 п.
0000414810 00000 н.
0000414970 00000 н.
0000415130 00000 н.
0000415290 00000 н.
0000415447 00000 н.
0000415607 00000 н.
0000415764 00000 н.
0000415921 00000 н.
0000416125 00000 н.
0000416326 00000 н.
0000416529 00000 н.
0000416689 00000 н.
0000416852 00000 н.
0000417012 00000 н.
0000417169 00000 н.
0000417372 00000 н.
0000417532 00000 н.
0000417689 00000 н.
0000417852 00000 н.
0000418012 00000 н.
0000418172 00000 н.
0000418332 00000 н.
0000418492 00000 н.
0000418655 00000 н.
0000418815 00000 н.
0000419028 00000 н.
0000419236 00000 п.
0000419396 00000 н.
0000419553 00000 н.
0000419716 00000 н.
0000419876 00000 н.
0000420036 00000 н.
0000420196 00000 н.
0000420356 00000 н.
0000420519 00000 н.
0000420679 00000 н.
0000420839 00000 н.
0000420999 00000 н.
0000421209 00000 н.
0000421369 00000 н.
0000421532 00000 н.
0000421695 00000 н.
0000421855 00000 н.
0000422015 00000 н.
0000422172 00000 п.
0000422332 00000 н.
0000422492 00000 н.
0000422652 00000 п.
0000422809 00000 н.
0000422969 00000 н.
0000423129 00000 н.
0000423289 00000 н.
0000423491 00000 н.
0000423696 00000 п.
0000423914 00000 п.
0000424074 00000 н.
0000424237 00000 н.
0000424394 00000 н.
0000424551 00000 п.
0000424764 00000 н.
0000424924 00000 н.
0000425081 00000 н.
0000425244 00000 н.
0000425404 00000 н.
0000425564 00000 н.
0000425724 00000 н.
0000425887 00000 н.
0000426050 00000 н.
0000426210 00000 н.
0000426426 00000 н.
0000426656 00000 н.
0000426816 00000 н.
0000426973 00000 н.
0000427136 00000 н.
0000427296 00000 н.
0000427456 00000 н.
0000427616 00000 н.
0000427779 00000 н.
0000427942 00000 н.
0000428102 00000 п.
0000428262 00000 н.
0000428422 00000 н.
0000428644 00000 н.
0000428804 00000 н.
0000428967 00000 н.
0000429127 00000 н.
0000429290 00000 н.
0000429450 00000 н.
0000429607 00000 н.
0000429767 00000 н.
0000429930 00000 н.
0000430093 00000 н.
0000430250 00000 н.
0000430410 00000 п.
0000430570 00000 п.
0000430727 00000 н.
0000430938 00000 п.
0000431144 00000 н.
0000431366 00000 н.
0000431526 00000 н.
0000431689 00000 н.
0000431849 00000 н.
0000432006 00000 н.
0000432236 00000 н.
0000432396 00000 н.
0000432553 00000 н.
0000432716 00000 н.
0000432876 00000 н.
0000433036 00000 н.
0000433196 00000 н.
0000433363 00000 п.
0000433526 00000 н.
0000433686 00000 н.
0000433914 00000 н.
0000434140 00000 п.
0000434300 00000 п.
0000434457 00000 н.
0000434620 00000 н.
0000434780 00000 н.
0000434940 00000 п.
0000435100 00000 п.
0000435263 00000 п.
0000435426 00000 п.
0000435586 00000 п.
0000435746 00000 н.
0000435906 00000 н.
0000436132 00000 н.
0000436292 00000 н.
0000436455 00000 н.
0000436618 00000 н.
0000436781 00000 н.
0000436941 00000 п.
0000437098 00000 н.
0000437258 00000 н.
0000437425 00000 н.
0000437588 00000 н.
0000437748 00000 н.
0000437908 00000 н.
0000438065 00000 н.
0000438283 00000 п.
0000438485 00000 н.
0000438661 00000 п.
0000438824 00000 н.
0000438984 00000 н.
0000439147 00000 н.
0000439304 00000 н.
0000439461 00000 п.
0000439637 00000 п.
0000439797 00000 н.
0000439957 00000 н.
0000440114 00000 п.
0000440277 00000 н.
0000440437 00000 п.
0000440597 00000 п.
0000440757 00000 н.
0000440924 00000 н.
0000441094 00000 н.
0000441254 00000 н.
0000441468 00000 н.
0000441641 00000 н.
0000441804 00000 н.
0000441964 00000 н.
0000442121 00000 н.
0000442284 00000 н.
0000442444 00000 н.
0000442604 00000 н.
0000442764 00000 н.
0000442934 00000 н.
0000443104 00000 н.
0000443264 00000 н.
0000443424 00000 н.
0000443584 00000 н.
0000443763 00000 н.
0000443923 00000 н.
0000444083 00000 н.
0000444246 00000 н.
0000444413 00000 н.
0000444580 00000 н.
0000444740 00000 н.
0000444897 00000 н.
0000445057 00000 н.
0000445224 00000 н.
0000445394 00000 п.
0000445551 00000 п.
0000445711 00000 н.
0000445871 00000 п.
0000446031 00000 н.
0000446244 00000 н.
0000446426 00000 н.
0000446596 00000 н.
0000446759 00000 н.
0000446919 00000 н.
0000447082 00000 н.
0000447239 00000 н.
0000447393 00000 н.
0000447560 00000 н.
0000447720 00000 н.
0000447880 00000 н.
0000448037 00000 н.
0000448200 00000 н.
0000448360 00000 н.
0000448520 00000 н.
0000448680 00000 н.
0000448900 00000 н.
0000449060 00000 н.
0000449217 00000 н.
0000449387 00000 н.
0000449550 00000 н.
0000449710 00000 н.
0000449867 00000 н.
0000450030 00000 н.
0000450190 00000 н.
0000450350 00000 н.
0000450510 00000 п.
0000450735 00000 н.
0000450895 00000 н.
0000451055 00000 н.
0000451215 00000 н.
0000451382 00000 н.
0000451542 00000 н.
0000451702 00000 н.
0000451865 00000 н.
0000452085 00000 н.
0000452245 00000 н.
0000452402 00000 н.
0000452562 00000 н.
0000452785 00000 н.
0000452942 00000 н.
0000453102 00000 п.
0000453262 00000 н.
0000453419 00000 п.
0000453582 00000 н.
0000453778 00000 н.
0000453941 00000 н.
0000454104 00000 п.
0000454264 00000 н.
0000454427 00000 н.
0000454587 00000 н.
0000454744 00000 н.
0000454907 00000 н.
0000455067 00000 н.
0000455227 00000 н.
0000455384 00000 п.
0000455547 00000 н.
0000455707 00000 н.
0000455867 00000 н.
0000456027 00000 н.
0000456239 00000 п.
0000456399 00000 н.
0000456559 00000 н.
0000456722 00000 н.
0000456885 00000 н.
0000457045 00000 н.
0000457202 00000 н.
0000457365 00000 н.
0000457525 00000 н.
0000457685 00000 н.
0000457845 00000 н.
0000458066 00000 н.
0000458223 00000 п.
0000458383 00000 п.
0000458543 00000 н.
0000458706 00000 н.
0000458866 00000 н.
0000459026 00000 н.
0000459189 00000 н.
0000459408 00000 п.
0000459568 00000 н.
0000459725 00000 н.
0000459885 00000 н.
0000460104 00000 п.
0000460261 00000 п.
0000460421 00000 н.
0000460581 00000 н.
0000460738 00000 н.
0000460901 00000 н.
0000461077 00000 н.
0000461237 00000 н.
0000461400 00000 н.
0000461560 00000 н.
0000461720 00000 н.
0000461877 00000 н.
0000462037 00000 н.
0000462197 00000 н.
0000462357 00000 п.
0000462514 00000 н.
0000462674 00000 н.
0000462834 00000 н.
0000462994 00000 н.
0000463154 00000 п.
0000463355 00000 п.
0000463515 00000 н.
0000463675 00000 н.
0000463838 00000 п.
0000464001 00000 н.
0000464161 00000 п.
0000464318 00000 н.
0000464481 00000 н.
0000464641 00000 п.
0000464801 00000 п.
0000464961 00000 н.
0000465166 00000 н.
0000465326 00000 н.
0000465486 00000 н.
0000465646 00000 п.
0000465806 00000 н.
0000465966 00000 н.
0000466126 00000 н.
0000466289 00000 н.
0000466485 00000 н.
0000466645 00000 н.
0000466802 00000 н.
0000466962 00000 н.
0000467170 00000 н.
0000467327 00000 н.
0000467487 00000 н.
0000467647 00000 н.
0000467804 00000 н.
0000467967 00000 н.
0000468134 00000 н.
0000468294 00000 н.
0000468457 00000 п.
0000468617 00000 н.
0000468780 00000 н.
0000468940 00000 н.
0000469097 00000 н.
0000469257 00000 н.
0000469417 00000 н.
0000469580 00000 н.
0000469737 00000 н.
0000469897 00000 н.
0000470057 00000 н.
0000470217 00000 н.
0000470422 00000 п.
0000470582 00000 н.
0000470742 00000 н.
0000470905 00000 н.
0000471068 00000 н.
0000471228 00000 н.
0000471385 00000 н.
0000471548 00000 н.
0000471708 00000 н.
0000471868 00000 н.
0000472028 00000 н.
0000472231 00000 н.
0000472391 00000 н.
0000472551 00000 н.
0000472711 00000 н.
0000472871 00000 н.
0000473031 00000 н.
0000473191 00000 н.
0000473354 00000 н.
0000473559 00000 н.
0000473719 00000 н.
0000473876 00000 н.
0000474036 00000 н.
0000474239 00000 н.
0000474396 00000 н.
0000474556 00000 н.
0000474713 00000 н.
0000474870 00000 н.
0000475033 00000 н.
0000475203 00000 н.
0000475363 00000 н.
0000475526 00000 н.
0000475686 00000 н.
0000475849 00000 н.
0000476009 00000 н.
0000476166 00000 н.
0000476326 00000 н.
0000476486 00000 н.
0000476646 00000 н.
0000476803 00000 н.
0000476966 00000 н.
0000477126 00000 н.
0000477286 00000 н.
0000477446 00000 н.
0000477643 00000 п.
0000477803 00000 н.
0000477963 00000 н.
0000478123 00000 н.
0000478286 00000 н.
0000478446 00000 н.
0000478603 00000 н.
0000478766 00000 н.
0000478926 00000 н.
0000479086 00000 н.
0000479300 00000 н.
0000479460 00000 н.
0000479620 00000 н.
0000479780 00000 н.
0000479937 00000 н.
0000480097 00000 н.
0000480257 00000 н.
0000480420 00000 н.
0000480617 00000 н.
0000480777 00000 н.
0000480934 00000 н.
0000481094 00000 н.
0000481305 00000 н.
0000481462 00000 н.
0000481622 00000 н.
0000481779 00000 н.
0000481933 00000 н.
0000482093 00000 н.
0000482260 00000 н.
0000482420 00000 н.
0000482583 00000 н.
0000482743 00000 н.
0000482906 00000 н.
0000483066 00000 н.
0000483223 00000 н.
0000483383 00000 н.
0000483543 00000 н.
0000483703 00000 н.
0000483860 00000 н.
0000484020 00000 н.
0000484180 00000 н.
0000484340 00000 н.
0000484500 00000 н.
0000484694 00000 n
0000484854 00000 n
0000485014 00000 n
0000485174 00000 n
0000485337 00000 n
0000485497 00000 n
0000485654 00000 n
0000485817 00000 n
0000485977 00000 n
0000486137 00000 n
0000486297 00000 n
0000486491 00000 n
0000486654 00000 n
0000486814 00000 n
0000486974 00000 n
0000487131 00000 n
0000487291 00000 n
0000487451 00000 n
0000487614 00000 n
0000487811 00000 n
0000487971 00000 n
0000488128 00000 n
0000488288 00000 n
0000488482 00000 n
0000488639 00000 n
0000488799 00000 n
0000488956 00000 n
0000489113 00000 n
0000489276 00000 n
0000489439 00000 n
0000489599 00000 n
0000489762 00000 n
0000489925 00000 n
00004 00000 n
00004 00000 n
00004 00000 n
00004 00000 n
00004 00000 n
00005 00000 n
00005 00000 n
00005 00000 n
00005 00000 n
00005 00000 n
00005 00000 n
00005 00000 n
00005 00000 n
00005 Любая молекулярная теория изначально работает с молекулами одинаковой длины. Но настоящие полимеры полидисперсны, то есть все полимеры представляют собой смеси молекул разной длины, и последние характеризуются молекулярно-массовым распределением (MMD). О MMD MMD характеризуется функцией w (M), где dw — массовая доля фракции с молекулярной массой MM от M до (M + dM). MMD по своему физическому смыслу является дискретным, поскольку значения MM изменяются дискретно.Однако этим удобно пренебречь и рассматривать MMD как непрерывную из-за малых шагов в аргументе распределения. Во многих случаях полезно работать с некоторыми средними значениями MMD: M¯n = ∫0∞w (M) MdM M¯w = ∫0∞w (M) dM M¯z = ∫0∞Mw (M) dM M¯z + 1 = ∫0∞M2w (M) dM Согласно модели трубки, θ d для монодисперсных полимеров определяется броуновским движением (или диффузией) макромолекулы в целом. Однако, если контурная трубка образована более короткими молекулами (как в полидисперсном полимере), обновление трубки происходит в более коротком временном масштабе и обеспечивает дополнительный механизм релаксации, при этом времена релаксации отличаются по сравнению с θ d . 65 Это означает, что спектр релаксации полидисперсного полимера не является простой смесью времен релаксации фракций, образующих MMD полидисперсного полимера. Центральная проблема при переходе от монодисперсного полимера к полидисперсным образцам заключается в построении «правила смешения », то есть формулировке закона суммирования входов различных фракций, которые будут соответствовать наблюдаемым вязкоупругим свойствам. Это относится как к интегральным константам, так и к самому спектру релаксации. Основные и прикладные интересы были сосредоточены на наиболее легко измеряемых параметрах, таких как ньютоновская вязкость, η 0 , податливость в установившемся режиме, Js0, модуль плато, GN0, коэффициент нормальных напряжений,, частота кроссовера, ω c (частота, при которой G ′ = G ″), кривизна кривой потока (см. главу 3) и так далее. В многочисленных публикациях доказано, что при расчетах вязкости во многих случаях справедливо следующее правило смешения: 66 [2.6.18] η0 = KM¯wα , где параметр масштабирования α обычно принимается равным α = 3,4–3,5, хотя возможны и другие значения от 3,2 до 3,9. Наличие фракций с низким ММ и разветвленности влияет на величину α. Предварительный фактор K зависит от молекулярной структуры и температуры и не является предметом данного обсуждения. Предполагается, что это уравнение справедливо для высокомолекулярных полимеров, где вся MMD лежит выше некоторого критического значения MM, M c . Очень впечатляющая иллюстрация зависимости η0 (M¯W) показана на рис. 2.6.5, а некоторые другие примеры представлены в главе 3 (рис. 3.3.2) и в главе 6 (рис. 6.2.1 и 6.2.2). Многочисленные экспериментальные данные показывают, что во многих случаях уравнение 2.6.18 справедливо при изменении вязкости на 6-8 десятичных порядков. Однако иногда требуются поправки к уравнению 2.6.18. Более общее уравнение для (MM, MMD) выглядит следующим образом: 67 Рисунок 2.6.5. Зависимость вязкости от ММ для полиэтиленов.Незакрашенные кружки относятся к литературным данным. [2.6.19] η0 = K¯M¯wα (Mw¯M¯n) b (Mz¯M¯w) c где b ≈ 0,24; c ≈ 0,44. Соответствие установившемуся состоянию, Js0, в первую очередь зависит от более высокого среднего значения MM. Обычно используется следующее уравнение: 68 [2.6.20] Js0 = kM¯z + 1M¯zM¯wM¯n где k — эмпирическая константа. Многие публикации подтверждают существование сильной зависимости соответствия установившегося режима от более высоких средних значений MMD. Эти два примера (для вязкости и соответствия установившемуся режиму) демонстрируют, что различные реологические параметры зависят в основном от различных средних значений MM. Довольно сложно ожидать, что какой-то очень общий закон смешения можно будет легко написать, и формулировка правила смешения все еще является серьезным вызовом для молекулярных теорий полидисперсных полимеров. Также стоит отметить, что экспериментальные кривые монодисперсных полимеров достаточно гладкие. То же самое и с большинством промышленных полидисперсных полимеров. Однако из опыта использования смесей двух монодисперсных полимеров в качестве модели полидисперсного образца оказывается, что обе фракции ведут себя — до некоторой степени — как независимые, и иногда можно предположить, что они не полностью смешиваются. Затем релаксационные свойства обеих фракций разделяются, как на рис.2.6.6 и дать четкие отдельные пики. Короткая релаксационная сторона спектра кажется одинаковой для обеих фракций. Тогда есть основания полагать, что гладкий спектр полидисперсных полимеров является следствием наложения множества пиков, отвечающих за каждую фракцию. Рисунок 2.6.6. Спектр логарифмической релаксации (нормированный на модуль плато G N ) смеси двух образцов монодисперсного полистирола: 80% полимера с M = 177 * 10 3 и 20% полимера с M = 60 * 10 3 .Полоски показывают возможные ошибки расчетов. Правила смешивания полидисперсных полимеров, обсуждаемые в современной литературе 69 : на основе некоторых аргументов молекулярной модели. Обычно их получают эмпирически и подтверждают эксперименты, проведенные с довольно ограниченным числом полимеров. Хотя существует некоторая степень независимости в реологическом поведении фракций в смеси, обычно предполагается, что релаксационные свойства фракций, входящих в смесь, изменяются в результате межмолекулярного взаимодействия.Довольно общий вид правила смешивания, отражающий это явление, был сформулирован для функции релаксации G (t) в следующем виде: 70 [2.6.21] G (t) GN0 = (∫0 ∞F1 / β (t, m) w (m) mdm) β где m = M / M 0 — восстановленная MM, M 0 — MM мономерного звена в полимерной цепи, м e = M / M e и M e — средний MM между двумя соседними зацеплениями. Это значение находится как: [2.6.22] Me = ρRTGN0 , а GN0 — значение модуля плато, ρ — плотность, R — универсальная газовая постоянная, а T — абсолютная температура. Функция F (t, m) в уравнении 2.6.21 отражает эффект смешения, а масштабный коэффициент происходит из молекулярной модели смешения: для модели рептаций β = 1 («правило линейного смешения») и для модели. двойного отражения β = 2 («правило квадратичного смешения»). В некоторых публикациях также обсуждалась модель, сочетающая линейные и квадратичные правила перемешивания. 71 Центральным моментом формулировки правила смешения является форма ядра F (t, m), отражающая взаимное влияние различных фракций в полидисперсном полимере. 72 На основе очень точных экспериментальных данных для полистирола и статистического сравнения различных ядер было обнаружено 69 , что наилучшее соответствие может быть достигнуто при β = 3,84 ± 0,1 и ядре, представленном как: [2.6.23] F (t, m) = e − t / θ0 (m) , где максимальное (конечное) время релаксации θ 0 связано с MM по стандартному закону масштабирования: [2.6.24] θ0 = kmα и масштабный показатель α ≈ 3,5 (точнее, для полистирола α = 3.67). Это правило смешивания (с β, близким к стандартному значению 3,5) более реалистично, чем теоретические значения β (1 или 2), потому что оно напрямую связано с естественным правилом смешивания при расчете вязкости через M¯W, как в Уравнение 2.6.18. Вязкость рассчитывается из [2.6.25] η0 = [w (Mi) Mi1 / α] α Следует отметить, что окончательные результаты расчетов, по крайней мере, для некоторых полимеров с умеренно широкой MMD, показывают, что вязкость не очень чувствительна к выбору масштабного коэффициента (3.5 или другое). Также сложно проверить, какой коэффициент правильный. 73 Высокое значение масштабного коэффициента (~ 3,5) по сравнению с меньшим теоретическим значением (1 или 2) может быть объяснено трудностями в оценке релаксационного спектра, ответственного за медленные релаксационные процессы. 74 Уравнение 2.6.21 включает режимы релаксации только для фракций с m> m e . Измеренный спектр релаксации включает все типы молекулярных движений и может рассматриваться как состоящий из двух частей: для m [2.6.26] F (θ) = Fentangl (θ) + Frapid (θ) В уравнении используется только первая часть (эффект запутывания). 2.6.21, но не второй член, который отражает быстрые молекулярные движения, происходящие между соседними звеньями. Было показано 73 , что коэффициент масштабирования в уравнении 2.6.21 оказывается близким к 2, если включены быстрые молекулярные движения, как предсказывает модель двойного отражения (сцепления). Концепция взаимосвязи между MMD и релаксационными свойствами полимера рассматривается с двух точек зрения.Во-первых, это правило смешения, которое позволяет рассчитывать вязкоупругие свойства полидисперсных полимеров. Решение скрыто в уравнении 2.6.21 при соответствующем выборе показателя β и ядра F (t, m). Во-вторых, определение MMD на основе результатов реологических измерений, проведенных в диапазоне линейного вязкоупругого поведения. Неважно, используется ли для этой цели релаксационная кривая или частотная зависимость динамических модулей. Также необходимо найти функцию w (m), входящую в уравнение 2.6.21, т.е. с математической точки зрения для решения первого рода интегрального уравнения Фредгольма. Для этого метода требуются некоторые необходимые предварительные действия. Прежде всего, должно быть известно правило смешивания, т. Е. Ядро должно быть записано в аналитической форме и выбран масштабный коэффициент β. Используются разные типы ядер. С практической точки зрения может быть не важно, какое ядро выбрано. Обычно чем проще, тем удобнее производить расчеты, но даже сложные формы можно обрабатывать современными компьютерными методами).Затем необходимо сформулировать, как будет определяться MMD. Первая задача включает определение параметров MMD, предполагая, что его форма известна априори . Функция w (m) подставляется в уравнение 2.6.21, и результаты расчетов сравниваются с экспериментальными данными. Параметры MMD — это подгоночные коэффициенты, определяемые стандартной процедурой. В промышленном синтезе форма MMD определяется химией процесса. Исследования обычно отслеживают изменения MMD, вызванные изменением технологических условий.Найти MMD неизвестного образца сложнее. Более надежные результаты получаются от одномодального MMD, т.е. MMD имеет единственный максимум. Однако некоторые мультимодальные материалы MMD готовятся и используются для технологических приложений и лабораторных экспериментов, и эти материалы трудно изучать. На основе уравнения 2.6.21 было получено следующее аналитическое уравнение: 69 , 73 , которое помогает определить MMD, используя измеренный спектр релаксации: [2.6.27] w (M) = 1β (αGN0) 1 / βhentangl (m) [∫me∞hentangl (m ′) m′dm ′] 1β − 1 , где h entangl — это логарифмический спектр релаксации, относящийся только к модам релаксации перепутанности, т.е.е., полученный, как указано в уравнении 2.6.25, после извлечения части, связанной с процессами быстрой релаксации, m ‘- переменная интегрирования, а M — молекулярная масса. Спектр h entangl как функция m определяется следующим образом: [2.6.28] hentangl (m) = hentangl [θ (m)] в соответствии с уравнением 2. 00000 п.
00000 00000 п.
00000 00000 п.
00000 00000 п.
00000 00000 п.
00000
00000 п.
00000 00000 п.
00000 00000 п.
00000 00000 п.
00000
00000 п.
00000 00000 п.
00000 00000 н.
00000
00000 п.
00000
00000 п.
00000 00000 н.
00002 00000 н.
00002 00000 н.
00002 00000 н.
00003
00000 н.
00003 00000 n
00004 00000 n
00004 00000 n
00005
00000 n
00004
00000 n
00004 00000 n
0000492642 00000 n
0000492799 00000 n
0000492962 00000 n
0000493122 00000 n
0000493282 00000 n
0000493442 00000 n
0000493596 00000 n
0000493759 00000 n
0000493919 00000 n
0000494079 00000 n
0000494236 00000 n
0000494396 00000 n
0000494556 00000 n
0000494719 00000 n
0000494873 00000 n
0000495033 00000 н.
0000495190 00000 n
0000495350 00000 n
0000495507 00000 n
0000495664 00000 н.
0000495824 00000 n
0000495981 00000 n
0000496138 00000 n
0000496298 00000 n
0000496461 00000 n
0000496621 00000 n
0000496784 00000 n
0000496947 00000 n
0000497110 00000 n
0000497292 00000 n
0000497452 00000 n
0000497612 00000 n
0000497772 00000 n
0000497929 00000 n
0000498092 00000 n
0000498252 00000 n
0000498412 00000 n
0000498572 00000 n
0000498729 00000 n
0000498889 00000 n
0000499052 00000 n
0000499212 00000 n
0000499375 00000 n
0000499535 00000 n
0000499692 00000 n
0000499855 00000 n
0000500015 00000 n
0000500175 00000 n
0000500335 00000 n
0000500492 00000 n
0000500655 00000 n
0000500815 00000 n
0000500975 00000 n
0000501135 00000 n
0000501295 00000 n
0000501455 00000 n
0000501618 00000 n
0000501775 00000 n
0000501935 00000 n
0000502092 00000 n
0000502252 00000 n
0000502409 00000 n
0000502591 00000 n
0000502751 00000 n
0000502914 00000 n
0000503094 00000 n
0000503254 00000 n
0000503417 00000 n
0000503584 00000 n
0000503747 00000 n
0000503926 00000 n
0000504086 00000 n
0000504246 00000 n
0000504406 00000 n
0000504563 00000 n
0000504726 00000 n
0000504886 00000 n
0000505046 00000 n
0000505206 00000 n
0000505363 00000 n
0000505523 00000 n
0000505690 00000 n
0000505853 00000 n
0000506016 00000 n
0000506176 00000 n
0000506333 00000 n
0000506496 00000 n
0000506656 00000 n
0000506816 00000 n
0000506976 00000 n
0000507133 00000 n
0000507274 00000 n
0000507441 00000 n
0000507601 00000 n
0000507761 00000 n
0000507921 00000 n
0000508081 00000 n
0000508241 00000 n
0000508404 00000 n
0000508561 00000 n
0000508721 00000 n
0000508878 00000 n
0000509038 00000 n
0000509195 00000 n
0000509352 00000 n
0000509512 00000 n
0000509691 00000 n
0000509858 00000 n
0000510039 00000 n
0000510199 00000 n
0000510362 00000 n
0000510529 00000 n
0000510692 00000 n
0000510885 00000 n
0000511045 00000 n
0000511208 00000 n
0000511368 00000 n
0000511525 00000 n
0000511692 00000 n
0000511852 00000 n
0000512012 00000 n
0000512172 00000 n
0000512329 00000 n
0000512489 00000 n
0000512656 00000 n
0000512819 00000 n
0000512986 00000 n
0000513146 00000 n
0000513303 00000 n
0000513466 00000 n
0000513626 00000 n
0000513786 00000 n
0000513946 00000 n
0000514103 00000 n
0000514260 00000 n
0000514423 00000 n
0000514583 00000 n
0000514743 00000 n
0000514903 00000 n
0000515066 00000 n
0000515226 00000 n
0000515389 00000 n
0000515546 00000 n
0000515706 00000 н.
0000515863 00000 n
0000516023 00000 n
0000516180 00000 n
0000516337 00000 n
0000516497 00000 н.
0000516690 00000 n
0000516857 00000 n
0000517020 00000 n
0000517183 00000 n
0000517353 00000 n
0000517526 00000 n
0000517689 00000 n
0000517878 00000 n
0000518041 00000 n
0000518208 00000 n
0000518368 00000 n
0000518525 00000 n
0000518692 00000 n
0000518833 00000 n
0000518993 00000 n
0000519153 00000 n
0000519313 00000 n
0000519473 00000 n
0000519640 00000 n
0000519785 00000 n
0000519948 00000 n
0000520118 00000 n
0000520278 00000 n
0000520435 00000 n
0000520598 00000 n
0000520758 00000 н.
0000520918 00000 n
0000521078 00000 n
0000521238 00000 n
0000521401 00000 п.
0000521568 00000 n
0000521709 00000 n
0000521869 00000 n
0000522029 00000 n
0000522192 00000 n
0000522362 00000 n
0000522522 00000 n
0000522685 00000 n
0000522845 00000 n
0000523005 00000 n
0000523162 00000 n
0000523322 00000 n
0000523482 00000 n
0000523642 00000 n
0000523802 00000 n
0000523978 00000 n
0000524148 00000 n
0000524289 00000 n
0000524430 00000 n
0000524597 00000 n
0000524767 00000 n
0000524943 00000 n
0000525119 00000 n
0000525282 00000 n
0000525455 00000 n
0000525622 00000 н.
0000525798 00000 n
0000525958 00000 n
0000526115 00000 n
0000526291 00000 n
0000526448 00000 n
0000526608 00000 n
0000526768 00000 n
0000526928 00000 n
0000527091 00000 n
0000527254 00000 n
0000527430 00000 n
0000527584 00000 n
0000527754 00000 n
0000527930 00000 n
0000528090 00000 n
0000528247 00000 n
0000528410 00000 n
0000528570 00000 n
0000528730 00000 n
0000528890 00000 n
0000529053 00000 n
0000529213 00000 n
0000529386 00000 n
0000529540 00000 n
0000529700 00000 n
0000529876 00000 n
0000530043 00000 n
0000530203 00000 n
0000530366 00000 n
0000530529 00000 n
0000530689 00000 n
0000530846 00000 n
0000531006 00000 n
0000531169 00000 n
0000531332 00000 n
0000531492 00000 n
0000531662 00000 n
0000531838 00000 n
0000531992 00000 n
0000532146 00000 n
0000532309 00000 n
0000532536 00000 n
0000532763 00000 n
0000532933 00000 n
0000533157 00000 n
0000533317 00000 n
0000533474 00000 n
0000533709 00000 n
0000533869 00000 n
0000534029 00000 n
0000534189 00000 n
0000534362 00000 n
0000534541 00000 n
0000534759 00000 n
0000534992 00000 n
0000535152 00000 n
0000535309 00000 n
0000535472 00000 n
0000535632 00000 n
0000535792 00000 n
0000535952 00000 n
0000536125 00000 n
0000536285 00000 n
0000536519 00000 n
0000536679 00000 n
0000536839 00000 n
0000537076 00000 n
0000537236 00000 n
0000537399 00000 n
0000537575 00000 п.
0000537735 00000 n
0000537892 00000 n
0000538052 00000 n
0000538225 00000 n
0000538401 00000 n
0000538561 00000 n
0000538731 00000 n
0000538960 00000 n
0000539120 00000 n
0000539293 00000 n
0000539527 00000 n
0000539755 00000 n
0000539922 00000 n
0000540142 00000 n
0000540302 00000 n
0000540459 00000 n
0000540680 00000 n
0000540840 00000 н.
0000541000 00000 n
0000541160 00000 n
0000541351 00000 n
0000541530 00000 n
0000541747 00000 n
0000541976 00000 n
0000542136 00000 n
0000542293 00000 n
0000542456 00000 n
0000542616 00000 n
0000542776 00000 n
0000542936 00000 n
0000543127 00000 n
0000543287 00000 н.
0000543514 00000 n
0000543674 00000 n
0000543834 00000 n
0000544061 00000 n
0000544221 00000 n
0000544384 00000 n
0000544575 00000 n
0000544735 00000 n
0000544892 00000 n
0000545052 00000 n
0000545243 00000 n
0000545419 00000 n
0000545579 00000 n
0000545749 00000 n
0000545968 00000 n
0000546201 00000 n
0000546424 00000 n
0000546632 00000 n
0000546799 00000 n
0000547014 00000 n
0000547174 00000 n
0000547334 00000 n
0000547543 00000 n
0000547703 00000 n
0000547863 00000 n
0000548079 00000 n
0000548255 00000 n
0000548463 00000 n
0000548681 00000 n
0000548841 00000 n
0000548998 00000 n
0000549161 00000 n
0000549321 00000 n
0000549481 00000 n
0000549641 00000 n
0000549860 00000 n
0000550020 00000 n
0000550223 00000 n
0000550383 00000 n
0000550543 00000 n
0000550762 00000 n
0000550922 00000 n
0000551085 00000 n
0000551299 00000 n
0000551459 00000 n
0000551616 00000 n
0000551776 00000 n
0000551992 00000 n
0000552183 00000 n
0000552343 00000 n
0000552506 00000 n
0000552712 00000 n
0000552928 00000 n
0000553131 00000 n
0000553291 00000 n
0000553508 00000 n
0000553668 00000 n
0000553869 00000 n
0000554026 00000 n
0000554186 00000 n
0000554343 00000 n
0000554553 00000 n
0000554713 00000 n
0000554873 00000 n
0000555033 00000 n
0000555250 00000 n
0000555442 00000 n
0000555657 00000 n
0000555859 00000 n
0000556016 00000 n
0000556176 00000 n
0000556333 00000 n
0000556496 00000 n
0000556656 00000 n
0000556816 00000 n
0000556976 00000 n
0000557196 00000 n
0000557353 00000 n
0000557565 00000 n
0000557725 00000 n
0000557885 00000 n
0000558095 00000 n
0000558252 00000 n
0000558412 00000 n
0000558575 00000 n
0000558799 00000 n
0000558959 00000 n
0000559116 00000 n
0000559276 00000 n
0000559494 00000 n
0000559688 00000 n
0000559848 00000 n
0000560008 00000 n
0000560214 00000 n
0000560430 00000 n
0000560621 00000 n
0000560781 00000 n
0000560999 00000 n
0000561159 00000 n
0000561350 00000 n
0000561507 00000 n
0000561670 00000 n
0000561827 00000 n
0000562039 00000 n
0000562199 00000 n
0000562359 00000 n
0000562519 00000 n
0000562730 00000 n
0000562903 00000 n
0000563121 00000 n
0000563309 00000 n
0000563466 00000 n
0000563626 00000 n
0000563783 00000 n
0000563946 00000 n
0000564106 00000 n
0000564269 00000 n
0000564429 00000 n
0000564635 00000 n
0000564792 00000 n
0000565004 00000 n
0000565164 00000 n
0000565324 00000 n
0000565515 00000 n
0000565675 00000 n
0000565835 00000 n
0000565998 00000 n
0000566212 00000 n
0000566372 00000 n
0000566529 00000 n
0000566689 00000 n
0000566895 00000 n
0000567071 00000 n
0000567231 00000 n
0000567388 00000 n
0000567603 00000 n
0000567820 00000 n
0000567999 00000 n
0000568153 00000 n
0000568364 00000 n
0000568524 00000 n
0000568703 00000 n
0000568857 00000 n
0000569017 00000 n
0000569174 00000 n
0000569379 00000 n
0000569536 00000 n
0000569696 00000 n
0000569856 00000 n
0000570087 00000 n
0000570260 00000 n
0000570445 00000 n
0000570627 00000 n
0000570781 00000 n
0000570941 00000 n
0000571098 00000 n
0000571258 00000 n
0000571418 00000 n
0000571578 00000 n
0000571738 00000 n
0000571963 00000 n
0000572120 00000 n
0000572308 00000 n
0000572468 00000 n
0000572628 00000 n
0000572810 00000 n
0000572967 00000 n
0000573127 00000 n
0000573287 00000 n
0000573512 00000 n
0000573672 00000 n
0000573829 00000 n
0000573989 00000 n
0000574216 00000 n
0000574389 00000 n
0000574546 00000 n
0000574703 00000 n
0000574894 00000 n
0000575103 00000 n
0000575284 00000 n
0000575480 00000 n
0000575634 00000 n
0000575797 00000 n
0000575983 00000 n
0000576226 00000 n
0000576386 00000 n
0000576574 00000 n
0000576753 00000 n
0000576999 00000 n
0000577156 00000 n
0000577343 00000 n
0000577510 00000 n
0000577752 00000 n
0000577999 00000 n
0000578159 00000 n
0000578310 00000 n
0000578498 00000 n
0000578691 00000 n
0000578851 00000 n
0000579076 00000 n
0000579236 00000 n
0000579445 00000 n
0000579605 00000 n
0000579768 00000 n
0000579984 00000 n
0000580147 00000 n
0000580368 00000 n
0000580528 00000 n
0000580710 00000 n
0000580870 00000 n
0000581049 00000 n
0000581206 00000 n
0000581369 00000 n
0000581548 00000 n
0000581708 00000 n
0000581887 00000 n
0000582047 00000 n
0000582220 00000 n
0000582380 00000 n
0000582553 00000 n
0000582710 00000 n
0000582870 00000 n
0000583040 00000 n
0000583197 00000 n
0000583367 00000 n
0000583524 00000 n
0000583691 00000 n
0000583848 00000 n
0000584015 00000 n
0000584172 00000 n
0000584332 00000 n
0000584502 00000 n
0000584662 00000 n
0000584825 00000 n
0000584985 00000 n
0000585148 00000 n
0000585308 00000 n
0000585471 00000 n
0000585628 00000 n
0000585788 00000 n
0000585955 00000 n
0000586112 00000 n
0000586275 00000 n
0000586435 00000 n
0000586598 00000 n
0000586758 00000 n
0000586921 00000 n
0000587078 00000 n
0000587238 00000 n
0000587401 00000 n
0000587558 00000 n
0000587721 00000 n
0000587878 00000 n
0000588038 00000 n
0000588195 00000 n
0000588355 00000 n
0000588512 00000 n
0000588669 00000 n
0000588832 00000 n
0000588989 00000 n
0000589152 00000 n
0000589312 00000 n
0000589472 00000 n
0000589632 00000 n
0000589795 00000 n
0000589949 00000 n
00005 00000 n
00005 00000 n
00005 00000 n
00005 Molecular Mass — an overview
2.6.3 ВЯЗКОУПРУЖНОСТЬ ПОЛИДИСПЕРСНЫХ ПОЛИМЕРОВ
и так далее.Нижняя граница в этих интегралах довольно формальна, поскольку ММ не может равняться нулю. среднечисловое MM: средневзвешенное MM : z-среднее MM: z + 1- средний MM:

 Предмет химии.
Урок №4
Предмет химии.
Урок №4 )
) Взаимопроверка
в парах: анализируют ответы, оценивают
работу друг друга.
Взаимопроверка
в парах: анализируют ответы, оценивают
работу друг друга.
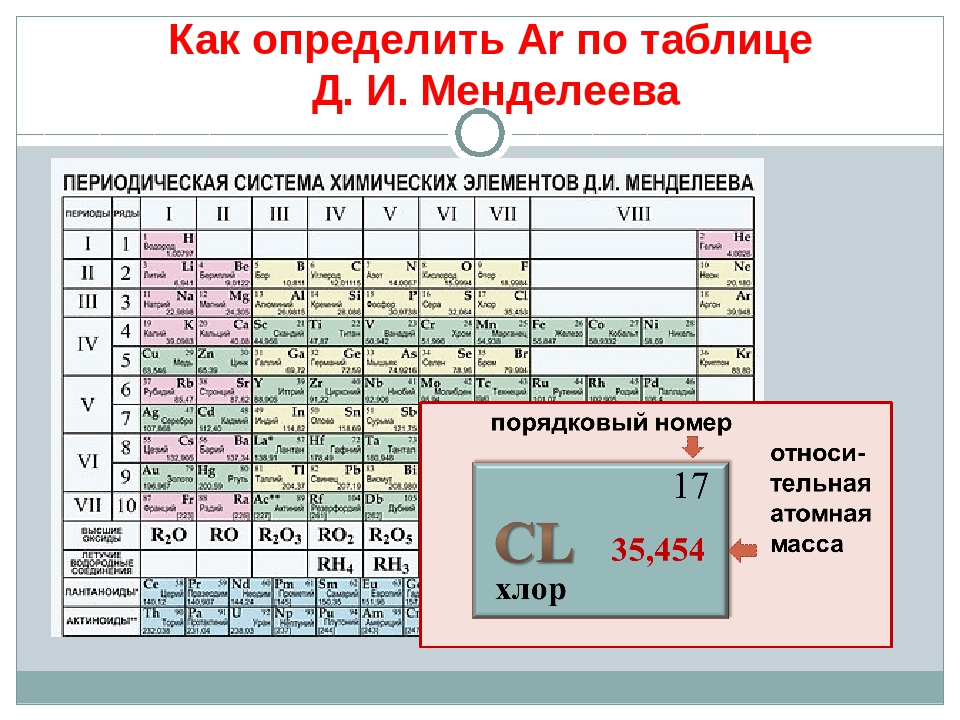 Проверяет выполнение у доски,
отрабатывают навыки произношения
формул.
Проверяет выполнение у доски,
отрабатывают навыки произношения
формул.
 Тренажер «Вычисление относительной
молекулярной массы веществ».
Тренажер «Вычисление относительной
молекулярной массы веществ». Записывают домашнее задание.
Записывают домашнее задание. д.)
д.)
 является ли соединение ионным или ковалентным ‘.
является ли соединение ионным или ковалентным ‘.
 3: Состав вода H 2 O
3: Состав вода H 2 O  грамм. ионные соединения, такие как гидроксид магния (см. выше),
грамм. ионные соединения, такие как гидроксид магния (см. выше), масса.
масса. 5 (его 160, если вы используете Cu = 64)
5 (его 160, если вы используете Cu = 64) (относящиеся к реагирующим массам и формуле
масса)
(относящиеся к реагирующим массам и формуле
масса) Редакция KS4. Научный расчет расчетов относительной формулы массы.
относительная молекулярная масса Дополнительная
Тройная награда за науку Курсы отдельных наук по науке помогают относительной формуле
массовые расчеты относительной молекулярной массы редакция учебника
Уровень GCSE / IGCSE / O Химия относительная формула расчет массы относительная
Информация об исследовании молекулярной массы Заметки для пересмотра для AQA GCSE
Расчет относительной молекулярной массы по формуле науки, расчет относительной молекулярной массы, Edexcel GCSE Science / IGCSE Chemistry
расчет относительной формулы массы относительная молекулярная масса и OCR 21st Century Science, OCR Gateway
Наука расчет относительной формулы массы относительная молекулярная масса WJEC gcse science chemistry
расчет относительной формулы массы относительная молекулярная масса CEA / CEA gcse science chemistry O
Уровень химии (пересмотреть курсы, равные 8 классу США, 9 класс относительному 10 классу
формула расчета массы расчет относительной молекулярной массы) Уровень
Примечания к пересмотру относительной массы по формуле GCE Advanced Subsidiary Level
расчеты относительной молекулярной массы AS Продвинутый уровень A2 IB Пересмотр
расчет относительного
формула расчета массы относительная молекулярная масса
AQA GCE Chemistry OCR GCE Chemistry Как рассчитать относительную формулу расчета массы
Как рассчитать относительную
молекулярная масса Edexcel GCE Химия Солтерс Химия относительная формула масса
расчеты относительной молекулярной массы CIE
Химия относительная формула расчет массы относительная молекулярная масса, WJEC GCE AS A2 Chemistry
Как рассчитать относительную формулу расчета массы относительной молекулярной массы, CCEA / CEA GCE AS A2 Chemistry revision
расчет относительной формулы массы относительный курс молекулярной массы для
студенты доуниверситетского образования (равные 11 и 12 классам США и AP с отличием / отличием)
уровень относительная формула вычисления массы Как рассчитать относительную молекулярную массу руководство по пересмотру gcse chemistry revision
бесплатные подробные заметки о том, как рассчитать относительную формулу
масса, чтобы помочь пересмотреть химию igcse
Заметки о пересмотре химии igcse о том, как вычислять относительные
формула масса O уровень химия
Не требующие пересмотра подробные примечания о том, как рассчитать относительный
формула массы, чтобы помочь пересмотреть gcse
бесплатные подробные заметки по химии о том, как рассчитать относительный
формула массы, чтобы помочь пересмотреть уровень O
бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как
рассчитать относительную формулу массы для gcse
бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как
рассчитать относительную формулу массы для
Бесплатный онлайн-сайт по химии igcse, который поможет пересмотреть уровень O
как рассчитать относительную формулу массы химия как добиться успеха в вопросах по
как рассчитать относительную формулу массы для gcse
химия как добиться успеха в igcse химия как добиться успеха
по химии уровня O хороший сайт для бесплатных вопросов по
как рассчитать относительную массу по формуле, чтобы помочь сдать вопросы по химии gcse
как рассчитать относительную формулу массы товара
сайт бесплатно помогите пройти igcse химия с доработкой
заметки о том, как рассчитать относительную массу по формуле хороший сайт для бесплатной помощи для прохождения уровня O
химия gcse химия пересмотр
бесплатные подробные заметки о том, как рассчитать относительную молекулярную
масса, чтобы помочь пересмотреть химию igcse
Заметки о пересмотре химии igcse о том, как вычислять относительные
молекулярная масса O уровень химия
Не требующие пересмотра подробные примечания о том, как рассчитать относительный
молекулярная масса, чтобы помочь пересмотреть gcse
бесплатные подробные заметки по химии о том, как рассчитать относительный
молекулярная масса, чтобы помочь пересмотреть уровень O
бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как
рассчитать относительную молекулярную массу для gcse
бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как
рассчитать относительную молекулярную массу для
Бесплатный онлайн-сайт по химии igcse, который поможет пересмотреть уровень O
как рассчитать относительную молекулярную массу, химию как добиться успеха в вопросах по
как рассчитать относительную молекулярную массу для gcse
химия как добиться успеха в igcse химия как добиться успеха
по химии уровня O хороший сайт для бесплатных вопросов по
как рассчитать относительную молекулярную массу, чтобы помочь сдать вопросы по химии gcse
как рассчитать относительную молекулярную массу товара
сайт бесплатно помогите пройти igcse химия с доработкой
примечания о том, как рассчитать относительную молекулярную массу хороший веб-сайт для бесплатной помощи для прохождения уровня O
химия
Редакция KS4. Научный расчет расчетов относительной формулы массы.
относительная молекулярная масса Дополнительная
Тройная награда за науку Курсы отдельных наук по науке помогают относительной формуле
массовые расчеты относительной молекулярной массы редакция учебника
Уровень GCSE / IGCSE / O Химия относительная формула расчет массы относительная
Информация об исследовании молекулярной массы Заметки для пересмотра для AQA GCSE
Расчет относительной молекулярной массы по формуле науки, расчет относительной молекулярной массы, Edexcel GCSE Science / IGCSE Chemistry
расчет относительной формулы массы относительная молекулярная масса и OCR 21st Century Science, OCR Gateway
Наука расчет относительной формулы массы относительная молекулярная масса WJEC gcse science chemistry
расчет относительной формулы массы относительная молекулярная масса CEA / CEA gcse science chemistry O
Уровень химии (пересмотреть курсы, равные 8 классу США, 9 класс относительному 10 классу
формула расчета массы расчет относительной молекулярной массы) Уровень
Примечания к пересмотру относительной массы по формуле GCE Advanced Subsidiary Level
расчеты относительной молекулярной массы AS Продвинутый уровень A2 IB Пересмотр
расчет относительного
формула расчета массы относительная молекулярная масса
AQA GCE Chemistry OCR GCE Chemistry Как рассчитать относительную формулу расчета массы
Как рассчитать относительную
молекулярная масса Edexcel GCE Химия Солтерс Химия относительная формула масса
расчеты относительной молекулярной массы CIE
Химия относительная формула расчет массы относительная молекулярная масса, WJEC GCE AS A2 Chemistry
Как рассчитать относительную формулу расчета массы относительной молекулярной массы, CCEA / CEA GCE AS A2 Chemistry revision
расчет относительной формулы массы относительный курс молекулярной массы для
студенты доуниверситетского образования (равные 11 и 12 классам США и AP с отличием / отличием)
уровень относительная формула вычисления массы Как рассчитать относительную молекулярную массу руководство по пересмотру gcse chemistry revision
бесплатные подробные заметки о том, как рассчитать относительную формулу
масса, чтобы помочь пересмотреть химию igcse
Заметки о пересмотре химии igcse о том, как вычислять относительные
формула масса O уровень химия
Не требующие пересмотра подробные примечания о том, как рассчитать относительный
формула массы, чтобы помочь пересмотреть gcse
бесплатные подробные заметки по химии о том, как рассчитать относительный
формула массы, чтобы помочь пересмотреть уровень O
бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как
рассчитать относительную формулу массы для gcse
бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как
рассчитать относительную формулу массы для
Бесплатный онлайн-сайт по химии igcse, который поможет пересмотреть уровень O
как рассчитать относительную формулу массы химия как добиться успеха в вопросах по
как рассчитать относительную формулу массы для gcse
химия как добиться успеха в igcse химия как добиться успеха
по химии уровня O хороший сайт для бесплатных вопросов по
как рассчитать относительную массу по формуле, чтобы помочь сдать вопросы по химии gcse
как рассчитать относительную формулу массы товара
сайт бесплатно помогите пройти igcse химия с доработкой
заметки о том, как рассчитать относительную массу по формуле хороший сайт для бесплатной помощи для прохождения уровня O
химия gcse химия пересмотр
бесплатные подробные заметки о том, как рассчитать относительную молекулярную
масса, чтобы помочь пересмотреть химию igcse
Заметки о пересмотре химии igcse о том, как вычислять относительные
молекулярная масса O уровень химия
Не требующие пересмотра подробные примечания о том, как рассчитать относительный
молекулярная масса, чтобы помочь пересмотреть gcse
бесплатные подробные заметки по химии о том, как рассчитать относительный
молекулярная масса, чтобы помочь пересмотреть уровень O
бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как
рассчитать относительную молекулярную массу для gcse
бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как
рассчитать относительную молекулярную массу для
Бесплатный онлайн-сайт по химии igcse, который поможет пересмотреть уровень O
как рассчитать относительную молекулярную массу, химию как добиться успеха в вопросах по
как рассчитать относительную молекулярную массу для gcse
химия как добиться успеха в igcse химия как добиться успеха
по химии уровня O хороший сайт для бесплатных вопросов по
как рассчитать относительную молекулярную массу, чтобы помочь сдать вопросы по химии gcse
как рассчитать относительную молекулярную массу товара
сайт бесплатно помогите пройти igcse химия с доработкой
примечания о том, как рассчитать относительную молекулярную массу хороший веб-сайт для бесплатной помощи для прохождения уровня O
химия