| 1. |
Электронная оболочка атома
Сложность: лёгкое |
1 |
| 2. |
Определи химический элемент
Сложность: лёгкое |
1 |
3.
|
Электронная схема атома
Сложность: лёгкое |
1 |
| 4. |
Элементы с одинаковым внешним электронным слоем
Сложность: среднее |
2 |
5.
|
Внешний электронный слой
Сложность: среднее |
2 |
| 6. |
Верные утверждения о строении атома
Сложность: среднее |
2 |
7.
|
Электроны в атоме
|
2 |
| 8. |
Энергетические уровни
Сложность: сложное |
3 |
9.
|
Масса нуклида
Сложность: сложное |
3 |
| 10. |
Массовая доля нейтронов
Сложность: сложное |
4 |
Открытый урок по химии 8 класс по теме ««Электроны.
 Строение электронных оболочек атомов химических элементов № 1
Строение электронных оболочек атомов химических элементов № 1Технологическая карта урока. Химии 8 класс
«Электроны. Строение электронных оболочек атомов химических элементов № 1 — 20»Тип урока
Учебное занятие по изучению и первичному закреплению новых знаний и способов деятельности
Цели
сформировать у учащихся представления об электронной оболочке атома и энергетических уровнях;
рассмотреть электронное строение атомов элементов первых трех периодов.
Планируемые образовательные результаты
Предметные
Метапредметные
Личностные
научиться составлять электронные формулы атомов элементов первых трех периодов ПСХЭ; объяснять зависимость и закономерные изменения свойств химических элементов от электронного строения их атомов; анализировать, делать выводы, обобщать полученные знания;
самостоятельно использовать материалы учебника и справочные таблицы, применять ранее полученные знания
регулятивные: следовать определенному алгоритму при составлении электронных формул; проводить рефлексию своих действий по выполнению заданий самостоятельно и при помощи одноклассников, вносить необходимые изменения в свои действия на основе принятых правил;
познавательные: выделять информацию из текста учебника; высказывать суждения, обосновывать и доказывать свой выбор, приводя факты, взятые из материалов учебника; использовать знаки, символы, схемы для выполнения заданий; находить закономерности, устанавливать причинно- следственные связи между реальными объектами и явлениями; осуществлять поиск информации в соответствии с поставленной задачей, используя различные ресурсы информационной среды;
коммуникативные: уметь слушать собеседника, понимать и /или принимать его точку зрения; оценивать высказывания и действия партнера, сравнивать их со своими высказываниями; формулировать высказывания, задавать вопросы, адекватные ситуации и учебной задаче; проявлять инициативу в ситуации общения;
проявлять интерес к предлагаемой деятельности и с учетом собственных интересов;
оценивать свою деятельность, определяя по заданным критериям ее успешность или неуспешность и способы ее корректировки, бережно и уважительно относиться к людям и результатам их деятельности;
руководствоваться этическими нормами (сотрудничество, взаимопомощь, ответственность) при выполнении групповой работы
№ этапа
Этап урока
Деятельность
учителя
учащихся
1
Организационный момент.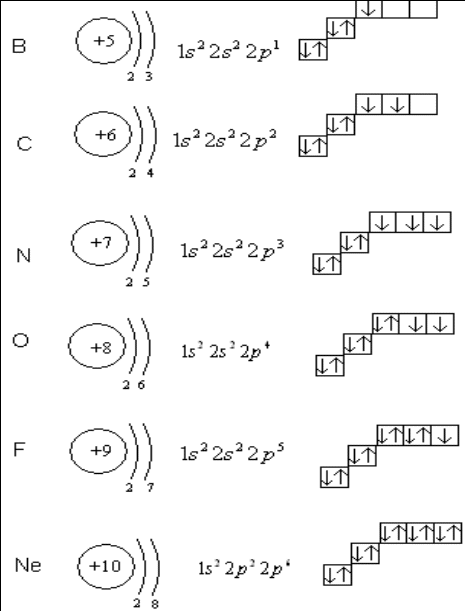
Учащиеся разбиты на 3 команды. Здравствуйте! Сегодня у нас необычный урок. На нашем уроке присутствует много гостей. А гостям принято показывать самое лучшее. Давайте покажем им, как хорошо мы знаем химию. А для этого нужно не так уж и много: не отвлекаться, быть активными и внимательными. На уроке останемся только мы и химия.
Приветствуют учителя и гостей, организуют рабочее место.
2
Актуализация знаний.
Что мы изучали на прошлом уроке? Вспомним основные понятия. Слушаем стих, ваша задача понять о чём стих:
Смотрю в ночное небо,
Молекул целый рой,
Никто из нас там не был,
И даже мы с тобой,
Молекулы созвездий,
Планеты — электрон,
И только свет. Известий,
Не шлёт нам небосклон.
Я думаю что в мире,
Где мал для нас масштаб,
Молекулы в эфире,
Созвездий стороют ряд,
И микрочеловечки,
Там на небо глядят,
И двигают беспечно,
Молекулярный ряд!
Из чего состоит молекула? (молекулы состоят из атомов) (Например если я скажу Al2O3 что здесь будет атомом, а что молекулой).

Из чего состоит атом? (Основные 2 части: ядро и электронные оболочки)
Из чего состоит ядро? (Из протонов и нейтронов)
Из чего состоят электронные оболочки? (Из электронов)
Чему равно общее количество электронов в атоме? (Порядковому номеру) Например сколько электронов в атоме водорода (1),
Что такое энергетический уровень? (Это количество электронных оболочек в атоме)
Как определить число энергетических уровней? (Например: сколько энергетических уровней в атоме водорода -1, в атоме лития – 2 и тд. )
Ребята знаете ли вы как распределить электроны по энергетическим уровням?
Как вы думаете чему мы сегодня научимся делать? (распределять электроны по энергетическим уровням)
Записываем тему урока: «Электроны. Строение электронных оболочек атомов химических элементов»
Отвечают на вопросы
Стих о молекулах
Нет
Записывают тему урока
3
Изучение нового материала.
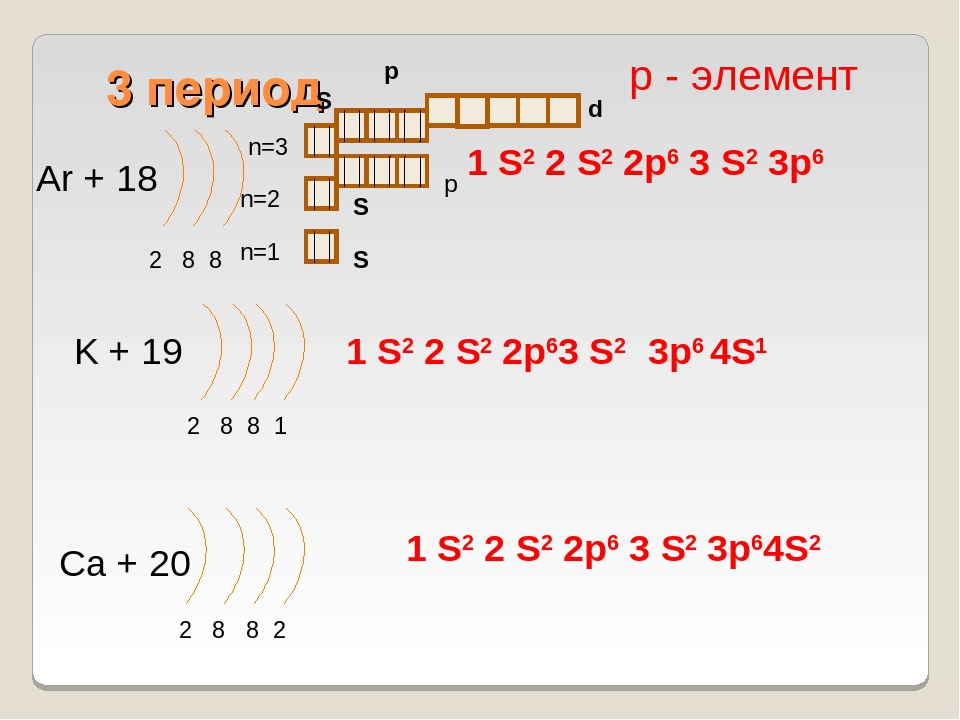
Мы с вами знаем, что в химии, как и в любой другой науке существует свой язык, с помощью которого мы можем описать состав веществ, их свойства.
Например, качественный и количественный состав веществ можно записать в виде … (химических формул). Что бы вам сегодня было легче меня понимать давайте представим, что ПСХЭ Д.И. Менделеева это частный сектор, который состоит из домов. Каждый дом имеет своё количество этажей, и равно это количество номеру периода. Например сколько этажей у домика водорода – 1, лития – 2, натрия – 3, калия – 4 и т.д. Если сказать на языке химии то атом водорода состоит из 1 эн.уровня или эл-ой оболочки, натрий из 2 эн.уровней и т.д.
У каждого дома есть жельцы – это электроны. Сколько электронов у атома вадорода – 1, у атома лития – 3, берилия – 4 и т.д.
Знаете ли вы сколько максимально жильцов (электронов может жить на каждом этаже?
Записываем в тетради формулу 2n2 (с помощью нее мы с вами определим максимальное число жильцов на каждом этаже или максимальное количество электронов на каждом энергетическом уровне).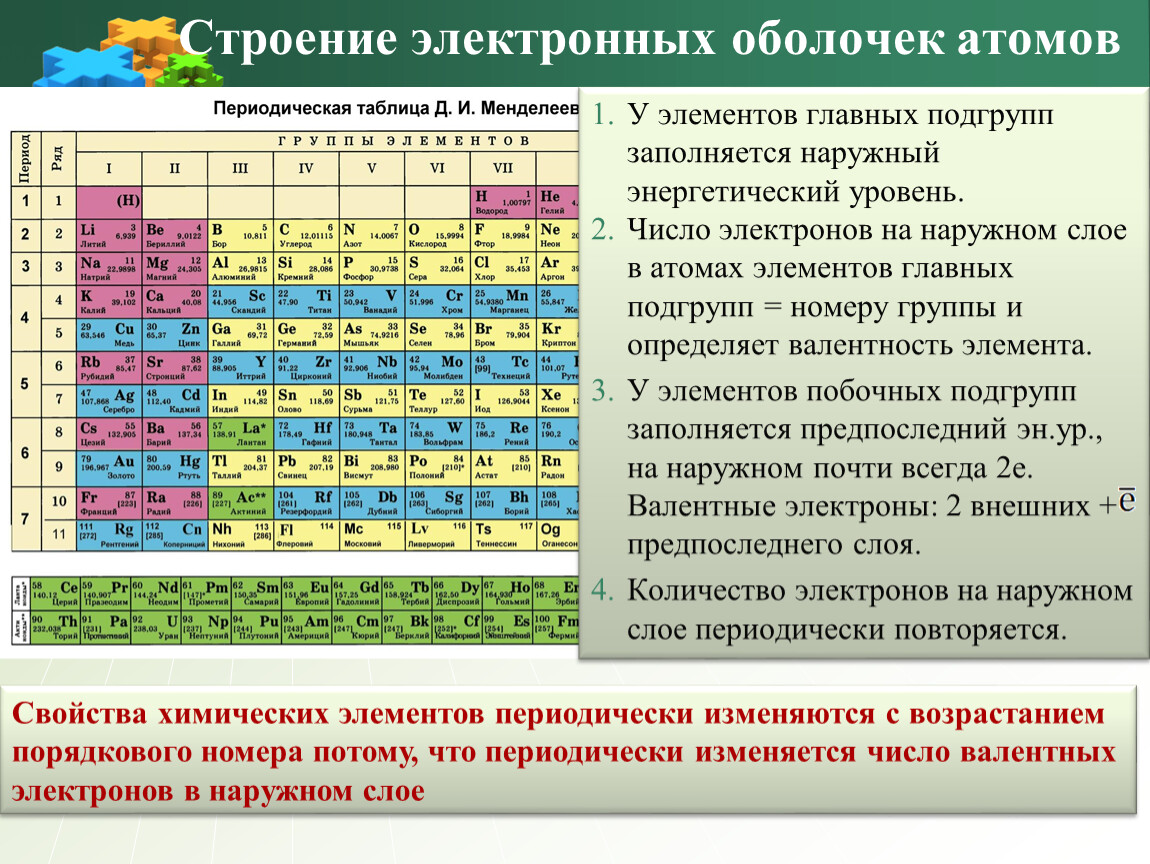
Считаем вместе: 1 уровень – 2 эл., 2 уровень – 8 эл., 3 уровень – 18 эл., 4567 уровни максимально по 32 эл.
В любом доме жильцы живут в чём? (в квартирах) В химии их называют орбиталями. Выделяют: S – орбиталь в виде 1(1 комнатная квартира) клетки, в которой могут жить максимально 2 жильца, т.е. 2 электрона P – 3 клетки, d – 5 клеток и f – 7 клеток.
Учащиеся слушают учителя, поддерживают беседу, отвечают на вопросы учителя.
Нет
Рисуют орбитали и электроны
4
Работа по теме урока. Восприятие и осмысление учащимися нового материала.
Ребята, а теперь можно начать расселять жильцов по квартирам (электроны по орбиталям). Первые 2 примера показываю я, а все следующие показываете вы. Учитель показывает пример написания электронной формулы (электронной конфигурации) на примере атома водорода и атома лития. А сейчас начинаем работу в командах:
По 1 человеку от команды к доске написать электронные формулы следующих элементов В, С, N.
 Остальные работают в тетрадях и поднимают руки если есть ошибки. Учитель комментирует работу детей у доски.
Остальные работают в тетрадях и поднимают руки если есть ошибки. Учитель комментирует работу детей у доски.Следующая партия задание прежнее – написать электронную конфигурацию следующих элементов Al, Si, P.
Задание на местах на скорость. Расписать электронную конфигурацию атома Сl кто быстрее. (учитель раздаёт командам листок с элементом, где они расписывают электронную формулу на скорость и вешают готовый листок к доске).
Аналогичное задание на местах на скорость. Расписать электронную конфигурацию Ca кто быстрее. (учитель раздаёт командам листок с элементом, где они расписывают электронную формулу на скорость и вешают готовый листок к доске).
Учащиеся внимательно слушают объяснение учителя и записывают примеры в тетрадь.
Выход учащихся к доске по желанию.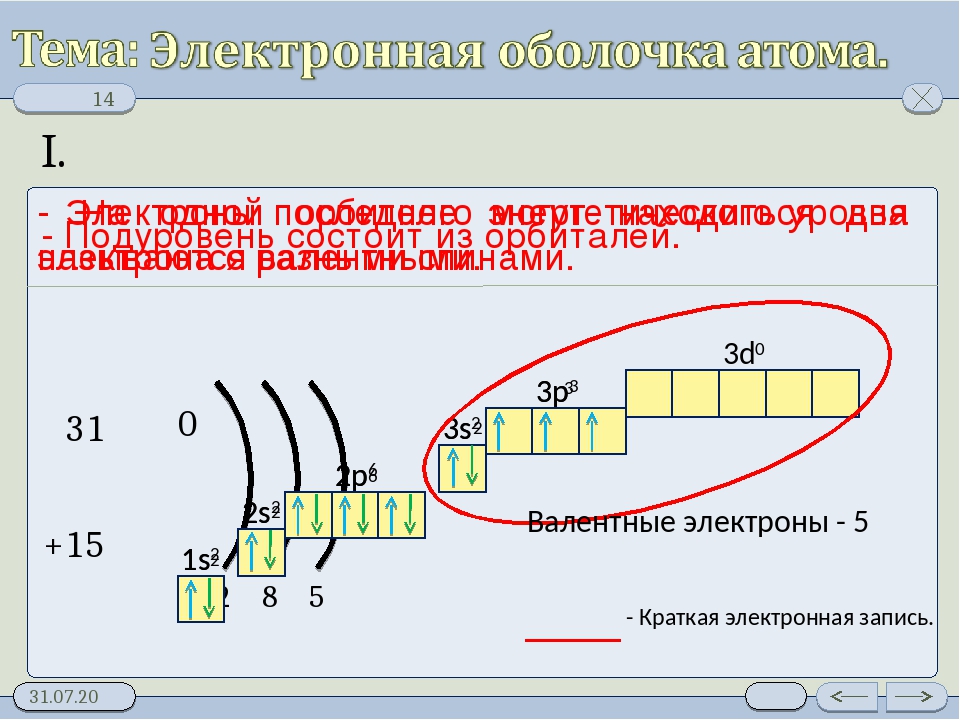
Работа в тетрадях и с доской.
Обсудить совместно кто быстрее и без ошибок сделал.
5
Рефлексия.
Учитель предлагает учащимся выполнить творческое задание «Синквейн» к слову «УРОК». (Раздать учащимся правила написания синквейна) Правила следующие:
Первая строчка стихотворения — это его тема. Представлена она всего одним словом и обязательно существительным.
Вторая строка состоит из двух слов, раскрывающих основную тему, описывающих ее. Это должны быть прилагательные. Допускается использование причастий.
В третьей строчке три слова, посредством использования глаголов или деепричастий, описываются действия, относящиеся к слову, являющемуся темой синквейна.
Четвертая строка — это уже не набор слов, а целая фраза, при помощи которой составляющий высказывает свое отношение к теме.
 В данном случае это может быть как предложение, составленное учеником самостоятельно, так и крылатое выражение, пословица, поговорка, цитата, афоризм, обязательно в контексте раскрываемой темы.
В данном случае это может быть как предложение, составленное учеником самостоятельно, так и крылатое выражение, пословица, поговорка, цитата, афоризм, обязательно в контексте раскрываемой темы.Пятая строчка — всего одно слово, которое представляет собой некий итог, резюме. Чаще всего это просто синоним к теме стихотворения.
Например синквейн к слову кошка: 1. Кошка 2. Игривая, быстрая 3. Бегает, играет, царапает 4. Кошка это мой любимый питомец 5. Животное.
На выполнение синквейна вам даётся 3 минуты. Засекает время.
По истечении времени заслушать ответы учащихся.
Пример: 1.Урок 2. Интересный, последний, скучный 3. Учит, дисциплинирует
4. Это было мне уроком на всю жизнь. 5. Школа, учитель, детство
Внимательно слушают учителя. Работают в группах, составляют синквейн. Читают в слух получившиеся примеры.
6
Подведение итогов урока.
Подвести итог занятию. Поблагодарить всех за работу. Оценить работу выделившихся учащихся.
Слушают учителя.
7.
Домашнее задание.
Изучить текст учебника параграф 9, расписать электронные конфигурации элементов S, K.
Записывают задание на дом.
«Строение электронных оболочек атомов». Вариант 3
- Категория: Самостоятельные работы по химии. 8 класс
{module Адаптивный блок Адсенс в начале статьи}
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ
ВАРИАНТ 3
1. Заполните таблицу. Определите элемент и его электронную формулу.
|
Распределение электронов по энергетическим уровням |
Элемент |
Электронная формула |
| 1) +15 2, 8, 5 | P | 1s22s22p63s23p3 |
| 2) +7 2, 5 | N | 1s22s22p3 |
| 3) +2 2 | He | 1s2 |
Ответ: Сходными свойствами обладают Р и N, так как на внешнем энергетическом уровне у этих элементов по пять электронов.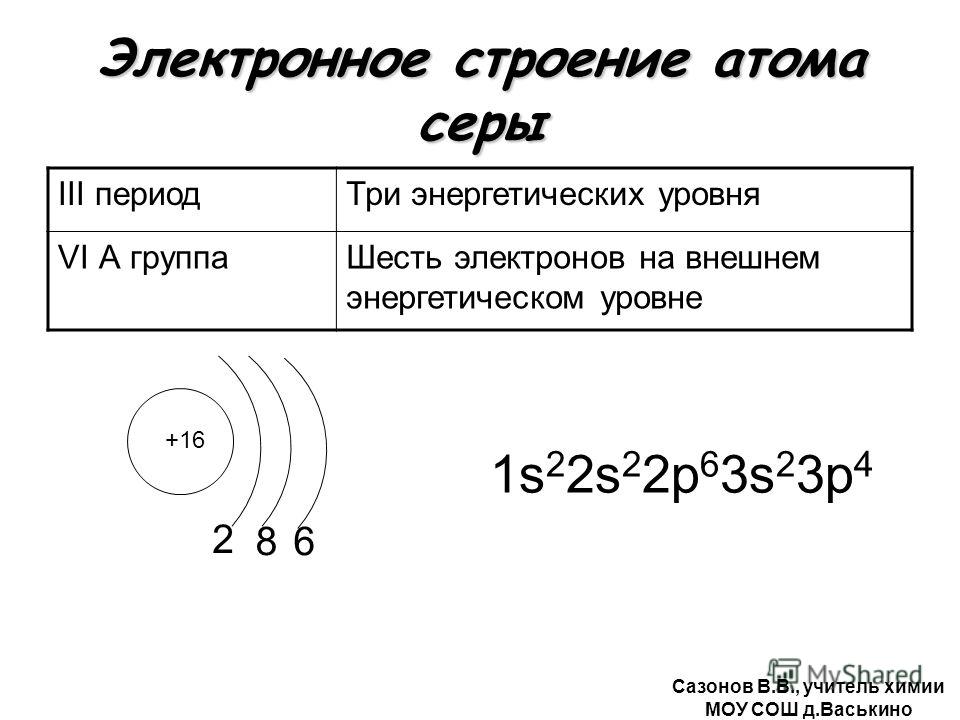
2. Напишите электронные формулы элементов хлора и бора. Укажите для каждого элемента:
Ответ:
Cl — 1s22s22p63s23p5, а) 3, б) 2, в) 7;
B — 1s22s22p1, а) 2, б) 1, в) 3.
3. Выберите правильные утверждения:
а) атомы элементов одного периода содержат одинаковое число энергетических уровней;
б) максимальное число электронов на s-орбитале равно двум;
в) сходными свойствами обладают атомы химических элементов с одинаковым числом энергетических уровней.
Ответ: а, б.
{module Адаптивный блок Адсенс в конце статьи}
Строение электронных оболочек и характер химических элементов — Учебник по Химии. 8 класс. Григорович
Учебник по Химии. 8 класс. Григорович — Новая программа
Вспомните:
• металлические элементы образуют простые вещества металлы и вещества преимущественно с основными свойствами;
• неметаллические элементы образуют неметаллы и вещества преимущественно с кислотными свойствами; металлы активно реагируют с неметаллами.
Радиус атома
У электронной оболочки нет четких границ, поэтому радиус атомов определяют по расстоянию между ядрами соединенных атомов. Размер ядра атома по сравнению с размером атома мизерный, поэтому размер атомного ядра никоим образом не влияет на размер атомов (рис. 15.1). Радиус атомов полностью обусловлен числом электронных слоев (энергетических уровней).
Рис. 15.1. Размеры ядра чрезвычайно малы (в десятки тысяч раз меньше размеров самого атома)
В главных подгруппах с увеличением порядкового номера элемента (сверху вниз) увеличивается число занятых энергетических уровней. Поэтому радиус атомов химических элементов одной группы увеличивается (рис. 15.2).
Рис. 15.2. Изменение радиусов атомов химических элементов: наибольший радиус у атомов Цезия (244 пм), а наименьший — у атомов Гелия (28 пм), 1 пм = 10-12 м
У атомов химических элементов одного периода число заполняемых электронных слоев одинаково. Это означает, что и радиус их атомов должен быть одинаковым. Но в периоде с увеличением порядкового номера химического элемента заряд ядра постепенно возрастает. Электроны с увеличением заряда ядра притягиваются к нему сильнее, и потому в периоде радиус атомов постепенно уменьшается (рис. 15.2, с. 77).
Это означает, что и радиус их атомов должен быть одинаковым. Но в периоде с увеличением порядкового номера химического элемента заряд ядра постепенно возрастает. Электроны с увеличением заряда ядра притягиваются к нему сильнее, и потому в периоде радиус атомов постепенно уменьшается (рис. 15.2, с. 77).
Причина инертности инертных элементов
Зная электронное строение атома, можно предсказать характер химических элементов и свойства их соединений. Эти свойства обусловлены электронами, которые находятся на внешних энергетических уровнях. Такие электроны называют валентными. Рассмотрим влияние строения внешнего электронного уровня на характер элементов.
Среди химических элементов особую группу составляют инертные элементы. Их особенность заключается в том, что они не «стремятся» образовывать соединения. У атомов инертных элементов чрезвычайно устойчивая электронная оболочка, которая обусловливает их химическую инертность. В чем заключается причина ее устойчивости? Проанализируем строение внешнего электронного уровня инертных элементов:
У атомов Гелия на внешнем уровне находится два электрона. Это максимальная вместимость первого энергетического уровня, т. е. у атомов Гелия электронная оболочка полностью заполнена. У атомов Неона электронная оболочка также содержит максимальное число электронов — восемь. Атомы других инертных элементов (Аргон, Криптон и др.) на внешнем уровне содержат по 8 электронов. Их внешний энергетический уровень хоть и не заполнен полностью, но это соответствует заполненным s- и р-орбиталям на внешнем уровне. Именно этим и объясняется химическая инертность данных элементов: они вообще не вступают в химические реакции.
Это максимальная вместимость первого энергетического уровня, т. е. у атомов Гелия электронная оболочка полностью заполнена. У атомов Неона электронная оболочка также содержит максимальное число электронов — восемь. Атомы других инертных элементов (Аргон, Криптон и др.) на внешнем уровне содержат по 8 электронов. Их внешний энергетический уровень хоть и не заполнен полностью, но это соответствует заполненным s- и р-орбиталям на внешнем уровне. Именно этим и объясняется химическая инертность данных элементов: они вообще не вступают в химические реакции.
Таким образом, атомы с завершенными энергетическими уровнями или на внешнем уровне которых содержится восемь электронов, обладают повышенной химической устойчивостью.
Металлический и неметаллический характер химических элементов
Атомы всех других химических элементов стремятся иметь такую же электронную оболочку, как у инертных элементов. Для этого они отдают или присоединяют электроны, чтобы их электронная оболочка стала такой же, как у атомов ближайшего инертного элемента.
Отдавая или присоединяя электроны, атом превращается в заряженную частицу, которую называют ионом. Различают катионы — ионы с положительным зарядом и анионы — отрицательно заряженные ионы.
Если электронов на внешнем энергетическом уровне мало, то их легче отдать, что характерно для металлических элементов. А если электронов на внешнем уровне много, то такие атомы присоединяют электроны, что характерно для неметаллических элементов.
Атомы большинства неметаллических элементов могут также и отдавать электроны, но главное отличие заключается в том, что атомы металлических элементов способны только отдавать электроны, а неметаллических — и отдавать, и принимать.
• Небольшое число электронов на внешнем уровне (обычно 1-3) характерно для металлических элементов
• Четыре и больше электронов на внешнем уровне характерно для неметаллических элементов
Рассмотрим щелочной элемент Натрий — элемент главной подгруппы I группы. Простое вещество, образованное Натрием, — активный металл. Высокая химическая активность натрия объясняется наличием в его атомах единственного валентного электрона, который он легко отдает в химических реакциях. Теряя этот электрон, атом Натрия превращается в положительно заряженный ион Na+ с электронной формулой инертного элемента Неона:
Высокая химическая активность натрия объясняется наличием в его атомах единственного валентного электрона, который он легко отдает в химических реакциях. Теряя этот электрон, атом Натрия превращается в положительно заряженный ион Na+ с электронной формулой инертного элемента Неона:
Ионы Na+ входят в состав всех соединений Натрия, например соды и поваренной соли. В отличие от атомов Натрия, ионы Натрия химически инертны и почти безвредны для организма (рис. 15.3, с. 80). Весь Натрий, который содержится в организме человека (около 90 г), находится именно в виде ионов.
Рис. 15.3. Щелочные металлы — литий, натрий, калий (изображены слева на каждом стекле) — состоят из атомов соответствующих металлических элементов и являются мягкими и блестящими веществами с высокой реакционной способностью. Ионы этих щелочных элементов, которые входят в состав хлоридов (изображены справа), химически инертны
Рассмотрим галоген Флуор — элемент главной подгруппы VII группы. Простое соединение, образованное Флуором, — активный неметалл. Высокая химическая активность фтора объясняется тем, что в его атомах на внешнем уровне находится семь электронов. До его завершения не хватает лишь одного электрона, поэтому для них наиболее характерным является процесс присоединения электрона. Например, атом Флуора, присоединяя один электрон, превращается в ион F—, у которого электронная формула инертного элемента Неона:
Простое соединение, образованное Флуором, — активный неметалл. Высокая химическая активность фтора объясняется тем, что в его атомах на внешнем уровне находится семь электронов. До его завершения не хватает лишь одного электрона, поэтому для них наиболее характерным является процесс присоединения электрона. Например, атом Флуора, присоединяя один электрон, превращается в ион F—, у которого электронная формула инертного элемента Неона:
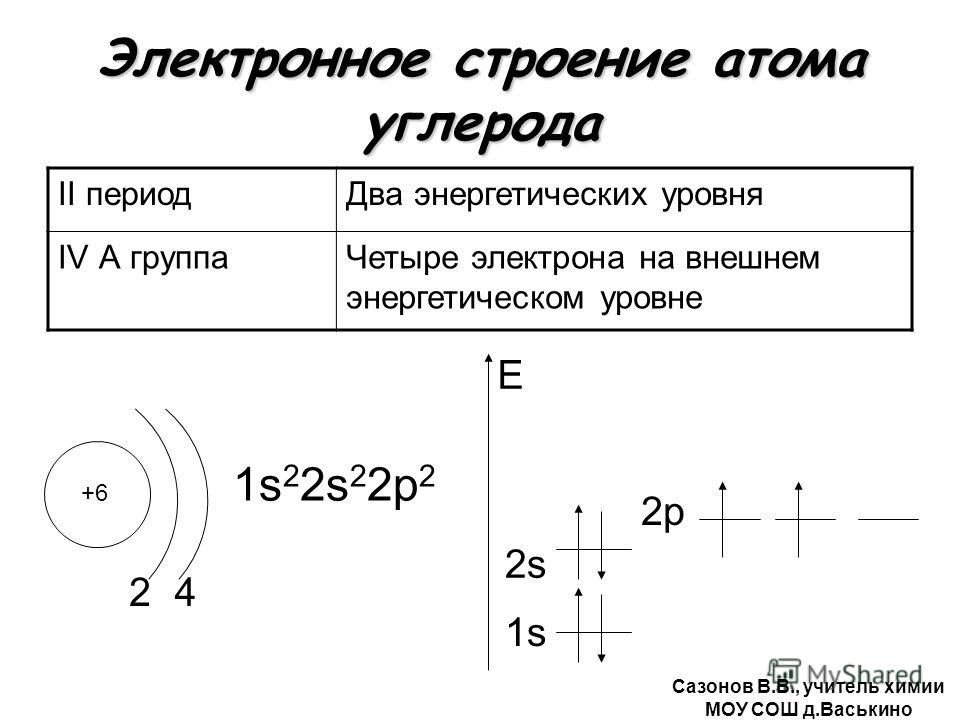
Рассмотрим Карбон — элемент главной подгруппы IV группы. Его атомы на внешнем уровне содержат по четыре электрона. Они могут принять электронную конфигурацию Гелия, отдав четыре электрона, или электронную конфигурацию Неона, присоединив четыре электрона:
Таким образом, Карбон может проявлять как металлические, так и неметаллические свойства. Но Карбон относят к неметаллическим элементам, так как главная особенность неметаллических элементов — способность присоединять электроны, и она преобладает над способностью их отдавать.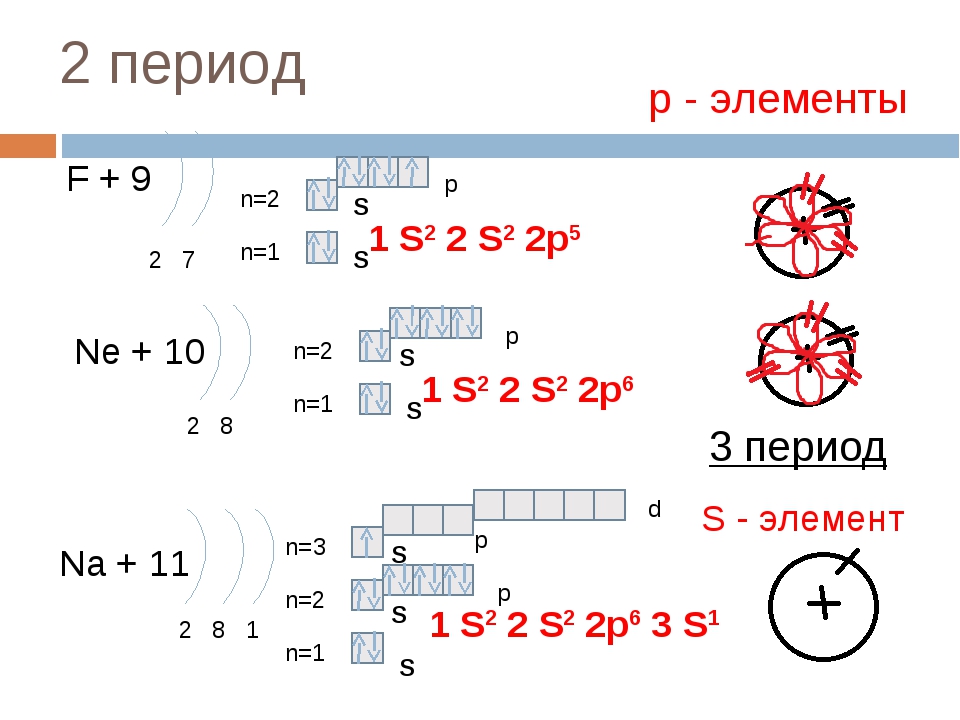
В атомах переходных элементов (d-элементов) на внешнем уровне, как правило, находится два электрона. Благодаря этому все переходные элементы являются металлическими. Все f-элементы (лантаноиды и актиноиды) также являются металлическими.
Электронные формулы ионов можно определить по формулам атомов, прибавив к ним или отняв от них нужное число электронов.
Например, электронная формула атома Лития — 1s22s1, а катиона Лития Li+ — 1s2, что совпадает с электронной формулой Гелия.
При образовании анионов присоединенные электроны занимают свободные места на орбиталях. Например, формула атома Хлора 1s22s22p63s23p5, а аниона Сl— — 1s22s22p63s23p6, что совпадает с электронной формулой Аргона.
Изменение металлических и неметаллических свойств
У различных химических элементов — металлических или неметаллических — разная химическая активность. Это так же обусловлено числом валентных электронов на внешнем электронном уровне их атомов.
Элементам I группы нужно отдать один электрон, а II группы — два электрона. Один электрон отдать легче, чем два. Следовательно, чем больше электронов на внешнем электронном уровне, тем атомам сложнее их отдавать, поэтому с увеличением числа электронов на внешнем уровне (в периодах) металлические свойства элементов ослабевают.
Чем больше электронов не хватает до завершения электронного уровня, тем тяжелее их присоединять, поэтому, чем меньше электронов на внешнем уровне, тем слабее проявляются неметаллические свойства элементов.
В периоде с увеличением порядкового номера металлические свойства элементов и образованных ими простых веществ ослабляются, а неметаллические — усиливаются (рис. 15.4, с. 82).
Рис. 15.4. Изменение характера элементов 3-го периода и образованных ими простых веществ
У элементов одной группы на внешнем уровне находится одинаковое число электронов. Например, у атомов щелочных элементов по одному электрону, но они расположены на разных уровнях: у атомов Лития — на втором, Натрия — на третьем и т. д. Чем дальше от ядра расположены валентные электроны, тем слабее они притягиваются к ядру. Поэтому атомы Натрия отдают электроны легче, чем атомы Лития.
С увеличением радиуса атомов внешние электроны легче терять, поэтому металлические свойства в группах усиливаются. Вместе с тем неметаллические свойства элементов в группах с увеличением радиуса атомов ослабевают. Металлические свойства элементов одной подгруппы сильнее всего выражены у элементов с наибольшим радиусом (наибольшим порядковым номером), а неметаллические — у элементов с наименьшим радиусом (наименьшим порядковым номером) (рис. 15.5).
Рис. 15.5. Изменение характера элементов V группы и образованных ими простых веществ
Среди всех химических элементов наиболее активным металлическим элементом является Франций (поскольку Франций в природе не встречается, а получен искусственно, то среди существующих элементов наиболее активным является металлический элемент — Цезий). А наиболее активный неметаллический элемент — Флуор.
С увеличением порядкового номера:
• в периодах металлические свойства ослабевают, а неметаллические — усиливаются
• в главных подгруппах металлические свойства усиливаются, а неметаллические — ослабевают
Как вы смогли заметить, свойства элементов и их соединений обусловлены строением электронных оболочек их атомов. А значит, и периодичность изменения этих свойств связана с периодичностью повторений электронной конфигурации атомов.
Выводы
1. Радиус атомов определяется размером электронной оболочки. В периодах радиус атомов уменьшается, а в группах — увеличивается.
2. Свойства элементов и их соединений обусловлены строением электронных оболочек атомов. Металлические свойства проявляют главным образом элементы, у атомов которых на внешних уровнях находится не больше четырех электронов. Атомы неметаллических элементов содержат на внешнем уровне четыре и больше электронов.
3. В периодах металлические свойства элементов с увеличением порядкового номера ослабевают, а в группах — усиливаются. Неметаллические свойства, наоборот, в периодах усиливаются, а в группах — ослабевают.
Контрольные вопросы
1. Чем обусловлены металлические и неметаллические свойства элементов?
2. Как определить число валентных электронов в электронных оболочках атомов химических элементов главных подгрупп?
3. Почему атомы принимают (отдают) электроны в химических реакциях?
4. Почему инертные элементы не вступают в химические реакции?
5. Какие частицы называют ионами?
6. Как изменяется сила притяжения валентных электронов к ядру в периоде и в подгруппе?
7. Как изменяются металлические и неметаллические свойства элементов в группах и периодах Периодической системы с увеличением порядкового номера? Чем объясняются такие изменения?
8. Что определяет радиус атомов? Как он изменяется в периодах и группах?
Задания для усвоения материала
1. Выпишите из данного перечня отдельно символы: а) атомов; б) катионов; в) анионов; г) молекул.
2. Запишите электронные конфигурации; а) атома Хлора и иона Сl—; б) атома Магния и иона Мg+2.
3. Сколько протонов и электронов содержит; а) атом Алюминия; б) ион Аl+3?
4. Атом какого элемента содержит столько же электронов, сколько их в ионе Na+?
5. Сравните электронное строение ионов S-2, Сl—, К+, Са+2 со строением атома Аргона.
6. Сколько электронов не хватает до завершения внешнего энергетического уровня атомам: а) Оксигена; б) Хлора; в) Фосфора?
7. У иона некоторого элемента Е+2 такое же электронное строение, как и у атома Аргона. Определите этот элемент.
8. По Периодической системе определите число электронов, которое максимально может отдавать и присоединять атом Фосфора.
9. Почему существенно отличаются свойства элементов главных подгрупп I и VII групп? Поясните ответ с точки зрения строения их электронных оболочек.
10. В чем заключается отличие электронной оболочки иона Натрия от электронных оболочек: а) атома Натрия; б) атома Неона; в) иона К+?
11. Почему элементы Флуор и Хлор обладают сходными свойствами?
Строение электронных оболочек атомов. (Тема 9)
—Нейтроны
Протоны
+
+
—
+
—
Электроны
Количество электронов в оболочке атома
соответствует числу протонов в ядре атома.
4 электрона
9 электронов
30 электронов
Орбиталь — пространство вокруг ядра
атома, где наиболее вероятно
нахождение данного электрона
Орбитали составляют
энергетические уровни.
Электронная оболочка атомов первого периода
содержит один энергетический уровень.
Электронная оболочка атомов второго периода
содержит по два энергетических уровня.
Электронная оболочка атомов третьего периода
содержит по три энергетических уровня.
Сколько электронных оболочек имеют атомы
магния (Mg), меди (Cu), серебра (Ag)
3 энергетических
уровня
Сколько электронных оболочек имеют атомы
магния (Mg), меди (Cu), серебра (Ag)
4 энергетических
уровня
Сколько электронных оболочек имеют атомы
магния (Mg), меди (Cu), серебра (Ag)
5 энергетических
уровней
Максимальное число электронов, находящихся на энергетическом
уровне можно определить по следующей формуле:
2n2
номер энергетического уровня
Максимальное количество электронов на первом уровне:
2⋅12= 2
Максимальное количество электронов на втором уровне:
2⋅22= 8
Максимальное количество электронов на третьем уровне:
2⋅32= 18
Максимальное количество электронов на четвёртом уровне:
2⋅42= 32
Один электрон на
внешнем уровне
Три электрона на
внешнем уровне
Пять электронов на
внешнем уровне
Пять электронов на
внешнем уровне
Пять электронов на
внешнем уровне
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
1. Определим общее число электронов
в электронной оболочке по
порядковому номеру элемента в
Периодической таблице:
гелий (Не) – имеет два электрона,
бор (B) – имеет пять электронов,
кислород (O) – имеет восемь
электронов,
фтор (F) – имеет девять электронов.
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
Определим число заполняемых
электронами энергетических уровней в
электронной оболочке по номеру
периода:
гелий (Не) – один энергетический
уровень, заполненный двумя
электронами,
бор (B), кислород (O) и фтор (F) – два
энергетических уровня, заполненных
свойственным им количеством
электронов.
Гелий
Бор
Кислород
Фтор
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
А теперь определим число электронов
на каждом энергетическом уровне на
наших примерах:
Гелий (Не) – два электрона на
единственном энергетическом уровне.
Гелий
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
Бор (B) – пять электронов, из которых
два располагаются на первом
энергетическом уровне, максимально
заполнив его, а оставшиеся три на
внешнем, втором энергетическом
уровне, что соответствует номеру
группы бора.
Бор
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
Кислород (O) – восемь электронов, из
которых два располагаются на первом
энергетическом уровне, максимально
заполнив его, а оставшиеся шесть на
внешнем, втором энергетическом
уровне, что соответствует номеру
группы кислорода.
Кислород
Построение схемы строения электронных оболочек
на примере гелия (Не), бора (B), кислорода (O), фтора (F)
Фтор (F) – девять электронов, из
которых два располагаются на первом
энергетическом уровне, максимально
заполнив его, а оставшиеся семь на
внешнем, втором энергетическом
уровне, что соответствует номеру
группы фтора.
Фтор
s-, p-, d- и f-орбитали
s — орбиталь
p — орбиталь
s – орбиталь Водорода
s – орбиталь Гелия
Электронные формулы атомов химических элементов
Н – 1S1
He – 1S2
Li – 1S22S1
Mg – 1S22S22p63S2
B – 1S22S22p1
Электронные формулы химических
элементов первых трёх периодов
Н – 1S1
He – 1S2
Li – 1S22S1
Ne – 1S22S22p6
Be – 1S22S2
Ar – 1S22S22p63S23p6
B – 1S22S22p1
AI – 1S22S22p63S23p1
C – 1S22S22p2
Si – 1S22S22p63S23p2
N – 1S22S22p3
P – 1S22S22p63S23p3
O – 1S22S22p4
S – 1S22S22p63S23p4
F – 1S22S22p5
CI – 1S22S22p63S23p5
Тема 6. Строение электронных оболочек атомов.
Часть I
1. Совокупность электронов в атоме называется электронной оболочкой.
2. Электроны на электронной оболочке атома располагаются по электронным слоям, или энергетическим уровням.
3. Номер периода соответствует числу электронных слоёв в атоме химического элемента.
4. Номер группы соответствует числу электронов на внешнем энергетическом уровне.
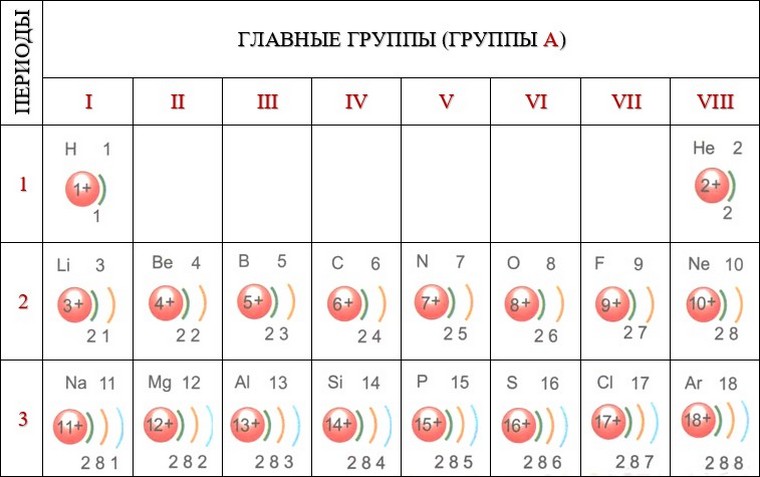
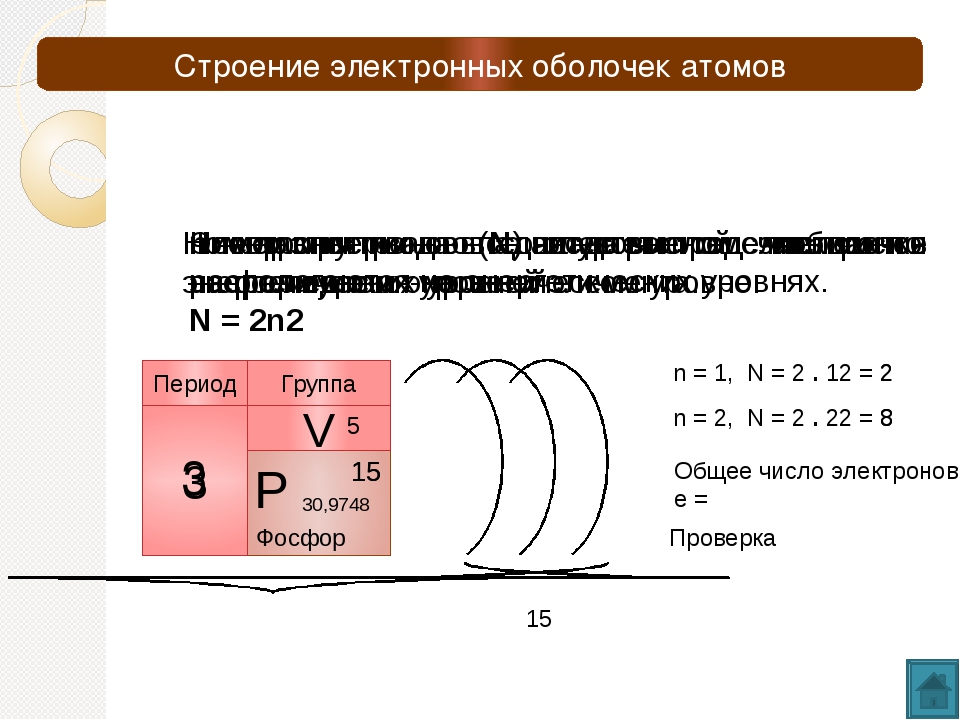
5. Запишите схемы строения электронных оболочек атомов химических элементов с порядковыми номерами с 1-го по 10-й в таблице Д. И. Менделеева, а также калия и кальция.
Часть II
1. В приведённом перечне: мышьяк, теллур, германий, йод, селен, полоний, астат, — число элементов, в атомах которых по шесть электронов на внешнем энергетическом уровне, равно:
3) трём.
2. Атомы химических элементов 4-го периода имеют одинаковое число:
3) энергетических уровней.
3. Установите соответствие между символом химического элемента (в заданном порядке) и числом электронов на внешнем энергетическом уровне его атома. Из букв, соответствующих правильным ответам, вы составите название установки, которая позволит человечеству ещё глубже познать строение атома: коллайдер.
4. Установите соответствие между символом химического элемента (в заданном порядке) и числом энергетических уровней в электронной оболочке атома. Из букв, соответствующих правильным ответам, вы составите название частиц, из которых, в свою очередь, состоят протоны и нейтроны: кварки.
5. Верны ли следующие суждения?
А. Число электронов в электронной оболочке атома Cl равно 7.
Б. Число электронов на внешнем энергетическом уровне атома Br равно 35.
4) Оба суждения неверны.
6. Вычеркните «лишний» химический элемент из ряда
P, Be, S, N, Ne, Ca, H
По признаку завершённости внешнего электронного слоя атома.
7. Предложите алгоритм составления электронной схемы атома химического элемента.
1. Определить общее число электронов на оболочке по порядковому номеру;
2. Определить число энергетических уровней по номеру периода;
3. Определить число внешних электронов по номеру группы;
4. Рассчитать число электронов на предпоследнем уровне, предварительно указав число электронов на всех уровнях.
8. Сравните строение электронных оболочек атомов Ca и Mg.
1) сходство: на внешнем уровне есть одинаковое число электронов, равное 2
кальций 2е8е8е2е, магний 2е8е2е.
2) различие: в числе энергетических уровней, у кальция 4, у магния 3.
ГДЗ (ответы) Химия 8 класс Григорович А.В., 2016 §15 Строение электронных оболочек и характер химических элементов » Допомога учням
Другие задания смотри здесь…
Контрольные вопросы
Вопрос 1 Чем обусловлены металлические и неметаллические свойства элементов? Строением электронных оболочек атомов. Металлические свойства проявляют преимущественно элементы, у атомов которых на внешних уровнях находится меньше четырех электронов, а неметаллические ― четыре и более.
Вопрос 2 Как определить число валентных электронов в электронных оболочках атомов химических элементов главных подгрупп? По номеру группы, в которой размещен элемент, поскольку валентные электроны ― это электроны внешнего энергетического уровня.
Вопрос 3 Почему атомы принимают (отдают) электроны в химических реакциях? Потому, что хотят иметь устойчивую электронную оболочку, которая есть в атоме ближайшего инертного элемента.
Вопрос 4 Почему инертные элементы не вступают в химические реакции?
Имеют чрезвычайно устойчивую электронную оболочку атома (энергетический уровень заверш, все электроны спаренные), что обуславливает их химическую инертность.
Вопрос 5 Какие частицы называют ионами? Заряженные частицы, которые образуются в результате присоединения или отдачи атомом электронов.
Вопрос 6 Как изменяется сила притяжения валентных электронов к ядру в периоде и в подгруппе?
В периоде с ростом заряда ядер и уменьшения радиуса, усиливается сила притяжения ядром электронов внешнего энергетического уровня, свойство отдавать электроны ослабляется, а присоединять ― усиливается.
В группе главной подгруппы растет радиус атома, а чем дальше от ядра расположены валентные электроны, тем меньше они притягиваются к ядру, ослабляется связь с внешним энергетическим уровнем, способность отдавать электроны усиливается, а способность присоединять электроны ослабевает.
Вопрос 7 Как изменяются металлические и неметаллические свойства элементов в группах и периодах Периодической системы с увеличением порядкового номера?
В группах с увеличением порядкового номера элементов металлические свойства усиливаются, а неметаллические ― ослабевают.
В периодах с увеличением порядкового номера элементов металлические свойства ослабевают, а неметаллические ― усиливаются.
Чем объясняются такие изменения? Строением электронных оболочек атомов.
Вопрос 8 Что определяет радиус атомов? Радиус атомов полностью обусловлен числом электронных слоев (энергетических уровней).
Как он изменяется в периодах и группах? В периодах слава направо радиус атома уменьшается, а в группах снизу вверх ― увеличивается.
Задания для усвоения материала
Упражнение 1 Выпишите из данного перечня Na, Na+, О, O2, О2-, Fe, SO42-, Mg2+, HNO3, NO3—, NH4—, NO2 отдельно символы:
а) атомов
Na, O, Fe
б) катионов
Na+, Mg2+, NH4+
в) анионов
O2-, SO42-, NO3—
г) молекул
O2, NO2, HNO3
Объяснение: атомы ― электронейтральные частицы. Молекулы состоят из атомов. Ионы ― это заряженные частицы, образованные из атома присоединением или потерей электронов. Катионы ― ионы с положительным зарядом, а анионы ― ионы с отрицательным зарядом.
Упражнение 2 Запишите электронные конфигурации:
а) атома Хлора и иона Cl−
1s22s22p63s23p5 і 1s22s22p63s23p6
Атом Хлора, присоединяя один электрон, превращается в ион Хлора.
б) атома Магния и иона Mg+2
1s22s22p63s2 і 1s22s22p6
Атом Магния, теряя два электрона, превращается в ион Магния.
Упражнение 3 Сколько протонов и электронов содержит:
а) атом Алюминия
Протонов 13 и электронов 13
Объяснение: на число протонов в ядре атома указывает порядковый номер Алюминия (№13), а число протонов и электронов одинаковое (13).
б) ион Al+3
Протонов 13 и электронов 10
Объяснение: на число протонов в ядре атома указывает порядковый номер Алюминия (№13), а ион образуется в результате потери атомом трех электронов, поэтому число электронов в ионе равно: 13-3=10
Упражнение 4 Атом какого элемента содержит столько же электронов, сколько их в ионе Na+?
Атом Неона Ne
Объяснение: ион Na+ содержит 11 протонов (порядковый №11) и 10 электронов (11-1=10), потому что образуется из атома вследствие потери им одного электрона. Столько же электронов содержит атом Неона (порядковый номер №10).
Упражнение 5 Сравните электронное строение ионов S–2, Cl–, K+, Ca+2 со строением атома Аргона. Одинаковое строение.
| S2- 1s22s22p63s23p6.
Сl— 1s22s22p63s23p6. К+ 1s22s22p63s23p6. Са2+ 1s22s22p63s23p6. |
Упражнение 6 Сколько электронов не хватает до завершения внешнего энергетического уровня атомам:
а) Оксигена
Два электрона
б) Хлора
Один электрон
в) Фосфора
Пять электронов
Объяснение: завершенный энергетический уровень содержит 8 электронов. У атома Оксигена на внешнем энергетическом уровне 6 электронов (совпадает с номером группы для элементов главных подгрупп), ему к завершению не хватает 2 (8-6=2) электрона, для Хлора ― 1 (8-7=1) электрон, для Фосфора ― 3 (8-5=3) электрона.
Упражнение 7 У иона некоторого элемента E+2 такое же электронное строение, как и у атома Аргона. Определите этот элемент. Кальций Са
Объяснение: атом Аргона содержит 18 электронов (число электронов = протонное число = порядковый номер элемента). Ион Е2+ образуется в результате потери атомом двух электронов. По условию ион имеет такое же строение, что и атом Аргона, поэтому атом элемента Е содержит 18+2=20 электронов. Этим элементом является Кальций Са.
Упражнение 8 По Периодической системе определите число электронов, которое максимально может отдавать и присоединять атом Фосфора. Максимально может отдавать пять, а присоединять три электрона.
Объяснение: атом фосфора на последнем энергетическом уровне содержит пять электронов (для элементов главных подгрупп указывает номер группы), поэтому может максимально отдавать пять электронов или присоединять три, чтобы их электронная оболочка стала такой, как у атомов ближайшего инертного элемента.
Упражнение 9 Почему существенно отличаются свойства элементов главных подгрупп I и VII групп? Поясните ответ с точки зрения строения их электронных оболочек. Существенно отличают числом электронов на внешнем энергетическом уровне. Щелочные элементы содержат один электрон, а галогены ― семь. Простые вещества щелочных элементов являются типичными металлами, а галогенов ― неметаллами.
Упражнение 10. В чем заключается отличие электронной оболочки иона Натрия от электронных оболочек:
а) атома Натрия
Ион Натрия содержит на один электрон меньше, чем атом Натрия.
б) атома Неона
Разный заряд ядра атома (11 і 10)
в) иона K+
Разный заряд ядра атома (11 і 19), разное число энергетических уровней (2 і 3)
Упражнение 11 Почему элементы Флуор и Хлор обладают сходными свойствами? Находятся в одной (VII) группе главной подгруппы, то есть являются электронными аналогами.
Другие задания смотри здесь…
2.5: Расположение электрона (модель оболочки)
Электронная оболочка — это внешняя часть атома вокруг атомного ядра. Это группа атомных орбиталей с одинаковым значением главного квантового числа \ (n \). Электронные оболочки имеют одну или несколько электронных подоболочек или подуровней. Название электронных оболочек происходит от модели Бора, в которой считалось, что группы электронов обращаются вокруг ядра на определенных расстояниях, так что их орбиты образуют «оболочки».
Введение
Что еще мы могли бы узнать о структуре атома? Мы знаем, что атомы содержат положительно и отрицательно заряженные частицы, и что количество этих зарядов в каждом атоме различно для каждого элемента.Мы также знаем, что положительные заряды сосредоточены в крошечном ядре, и что электроны движутся вокруг ядра в пространстве, которое намного больше ядра.
Однако некоторые из наиболее важных вопросов, которые мы задавали в предыдущем исследовании разработки концепции, все еще остаются без ответа. Помните, что мы видели, что углерод и азот имеют очень похожие атомные массы. Теперь мы можем добавить, что эти элементы имеют очень похожие атомные номера, поэтому их атомы имеют одинаковое количество протонов и электронов.Но углерод и азот в большинстве химических и физических аспектов очень разные. Точно так же некоторые элементы, такие как натрий и калий, имеют очень разные атомные номера, но имеют очень похожие химические и физические свойства. Кажется, что сравнение свойств двух разных атомов не очень легко понять, просто сравнивая количество протонов и электронов, содержащихся в атомах.
Чтобы и дальше понимать ответы на эти вопросы, нам нужны еще более подробные сведения о структуре каждого типа атомов.Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов. Эта концепция также полезна для описания химических связей, удерживающих атомы вместе.
Снаряды
Электронную оболочку можно представить как орбиту, по которой следуют электроны вокруг ядра атома. Поскольку каждая оболочка может содержать только фиксированное количество электронов, каждая оболочка связана с определенным диапазоном энергии электронов, и, таким образом, каждая оболочка должна полностью заполниться, прежде чем электроны могут быть добавлены к внешней оболочке.Электроны в самой внешней оболочке определяют химические свойства атома (см. Валентная оболочка). Для объяснения того, почему электроны существуют в этих оболочках, см. Конфигурацию электронов.
Рисунок \ (\ PageIndex {1} \) : Схема оболочки лития (слева) и натрия (справа)
Электронные оболочки обозначены буквами K, L, M, N, O, P и Q; или 1, 2, 3, 4, 5, 6 и 7; идет от самой внутренней оболочки наружу. Электроны во внешних оболочках имеют более высокую среднюю энергию и проходят дальше от ядра, чем электроны во внутренних оболочках.Это делает их более важными для определения того, как атом химически реагирует и ведет себя как проводник, потому что сила притяжения ядра атома на них слабее и легче разрушается. Таким образом, реакционная способность данного элемента сильно зависит от его электронной конфигурации.
Валентные электроны
Валентная оболочка — это самая внешняя оболочка атома в его несоединенном состоянии, которая содержит электроны, которые, скорее всего, объясняют природу любых реакций с участием атома и связывающих взаимодействий, которые он имеет с другими атомами.Валентные электроны — это электроны, которые связаны с атомом и могут участвовать в образовании химической связи; в одинарной ковалентной связи оба атома в связи вносят один валентный электрон для образования общей пары. Присутствие валентных электронов может определять химические свойства элемента и то, может ли он связываться с другими элементами: для элемента основной группы валентный электрон может находиться только во внешней электронной оболочке.
Атом с замкнутой оболочкой валентных электронов обычно химически инертен.Атом с одним или двумя валентными электронами больше, чем закрытая оболочка, очень реактивен, потому что лишние валентные электроны легко удаляются с образованием положительного иона. Атом с одним или двумя валентными электронами меньше, чем закрытая оболочка, также является высоко реактивным из-за тенденции либо получать недостающие валентные электроны (тем самым образуя отрицательный ион), либо делить валентные электроны (тем самым образуя ковалентную связь).
Подобно электрону во внутренней оболочке, валентный электрон обладает способностью поглощать или выделять энергию в виде фотона.Увеличение энергии может заставить электрон переместиться (прыгнуть) на внешнюю оболочку; это известно как атомное возбуждение. Или электрон может даже вырваться из валентной оболочки связанного с ним атома; это ионизация с образованием положительного иона. Когда электрон теряет энергию (тем самым вызывая излучение фотона), он может перемещаться во внутреннюю оболочку, которая не полностью занята.
Число валентных электронов элемента может быть определено группой периодической таблицы (вертикальный столбец), в которой этот элемент отнесен к категории.За исключением групп 3–12 (переходные металлы), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце.
* Общий метод подсчета валентных электронов обычно не подходит для переходных металлов.
** За исключением гелия, который имеет только два валентных электрона.
Авторы
- Соединения (Джон Хатчинсон)
- Википедия
Видео-вопрос: Определение структуры электронной оболочки атома кислорода
Стенограмма видео
На каком изображении показано расположение электронов в атоме кислорода?
Нам дали пять диаграммы электронных оболочек.В середине рисунок ядро, намного, намного больше по сравнению с атомом, чем оно было бы на самом деле жизнь. Красные кружки с p — протоны, а белые кружки с n — нейтроны. Черные кружки — электронные оболочки, в которых может поместиться ограниченное количество электронов. А синие точки — это электроны.
Вопрос в том, рисунок, который показывает расположение электронов в атоме кислорода.Кислород — это элемент, который мы можем найти в периодической таблице. Здесь мы видим, что атомный количество кислорода восемь. Это означает, что каждый атом или ион Кислорода в ядре восемь протонов. Атомы нейтральны, а это значит, что мы нужно равное количество электронов и протонов. Первое, что мы можем сделать, это проверить все наши диаграммы изображают восемь протонов и восемь электронов.
Все ядра выглядят одинаково, и у каждого из них по восемь протонов.Это означает, что мы имеем дело с ядра кислорода, и мы можем перейти к следующему испытанию. Самый простой способ отсчитать электроны должны определить электронную конфигурацию каждой диаграммы. Мы делаем это, считая электроны в каждой оболочке, начиная с первой оболочки.
На первой диаграмме два электронов в первой электронной оболочке, их двое во второй, и есть четыре в третьем.Это правильное количество электроны, но мы вернемся к этому чуть позже. На второй диаграмме конфигурация два, шесть. И третий Диаграмма имеет конфигурацию ноль, восемь. Помните, ноль по-прежнему имеет значение потому что это внутренняя оболочка. На четвертой диаграмме конфигурация восемь. И на последней диаграмме конфигурация четыре, четыре.
Каждая электронная оболочка имеет фиксированную максимальное количество электронов, которое может вместить.Вы можете поместить два электрона в первая электронная оболочка и до восьми во второй. Другой принцип, который мы собираемся Чтобы найти ответ, можно сказать, что электроны занимают наиболее стабильное пространство. Для электронных оболочечных диаграмм это означает самую низкую доступную оболочку.
Итак, на первой диаграмме мы можем видите, что есть два электрона в самой нижней доступной оболочке. Это хорошо. Однако есть четыре электрона в третьей оболочке, когда во второй еще есть место.Значит, это не тот диаграмма. На второй диаграмме есть снова два электрона в первой электронной оболочке. А оставшиеся шесть из восемь электронов заполняют вторую оболочку должным образом. Итак, это правильный диаграмма. Но давайте посмотрим на другие три так, на всякий случай.
На третьей диаграмме есть восемь электронов во второй оболочке, когда есть два свободных места в первый.Значит, это не тот конфигурация. Для четвертой диаграммы все электроны в первой электронной оболочке, что на шесть больше. И на последней диаграмме есть два слишком много электронов в первой электронной оболочке. Это означает, что изображение, которое показывает правильное расположение электронов в атоме кислорода — это тот, у которого восемь протонов в ядре, два электрона в первой оболочке и шесть во второй.
7 класс Вертикальные науки
Валентные электроны и химические свойства
Вы узнали, что атомы в целом не очень стабильны. Фактически, известно только шесть химически стабильных атомов: благородные газы. Атомы благородных газов химически стабильны из-за их электронной конфигурации. У каждого из них есть «полный» набор электронов во внешней оболочке.
Атом гелия (4He)
Неоновый атом (20Ne)
Атом аргона (40Ar)
Но подождите минутку.И атомы гелия, и неона имеют полные внешние электронные оболочки … атом гелия имеет два электрона в своей первой (внешней) оболочке, а атом неона имеет восемь электронов во второй (внешней) оболочке … но атом аргона имеет только восемь электронов в своей третья (внешняя) оболочка, когда третья оболочка может вместить до восемнадцати электронов. Как внешняя оболочка атома аргона хоть сколько-нибудь близка к полной?
девятнадцатый электрон в атоме калия (40K)
двадцатый электрон в атоме кальция (20Ca)
двадцать первый электрон в атоме скандия (45Sc)
Причина в том, что модель атома Бора, основанная на электронных оболочках, не точна.Электроны не занимают электронные оболочки; они занимают атомные орбитали. Следующим элементом после аргона является калий (K). У атома калия на один протон и на электрон больше, чем у атома аргона. Модель Бора предсказывает, что этот девятнадцатый электрон перейдет в третью электронную оболочку. Но на самом деле девятнадцатый электрон переходит на s-орбиталь в четвертой электронной оболочке, хотя третья оболочка еще не полностью заполнена. Остальные орбитали в третьей оболочке заполняются только после того, как s-орбиталь в четвертой оболочке будет заполнена первой.(Диаграммы Бора точны только до аргона.)
Хотя третья электронная оболочка может содержать 18 электронов, четвертая электронная оболочка может содержать 32 электрона, пятая электронная оболочка может содержать 50 электронов, а шестая электронная оболочка может содержать 72 электрона, после того как каждая из этих электронных оболочек заполнится 8 электронами. , следующие два электрона перейдут на следующую более высокую электронную оболочку. Это означает, что самая внешняя оболочка атома может иметь только от 1 до 8 электронов до того, как начнется новая внешняя оболочка, и эта оболочка вместо этого становится внутренней.Электроны на внешней оболочке атома называются валентными электронами.
Если у атома только один электрон, то все атомные орбитали электронной оболочки эквивалентны и имеют одинаковую энергию, и не имеет значения, какую атомную орбиталь заполняет электрон. Но когда у атома более одного электрона, геометрия атомных орбиталей и положения других электронов действительно влияют на энергию атомной орбитали и порядок, в котором они заполнены.
Первая электронная оболочка имеет одну атомную орбиталь: s-орбиталь. Все s-орбитали имеют форму сфер. Вторая электронная оболочка имеет четыре атомных орбитали: одну s-орбиталь и три p-орбитали. Р-орбитали имеют форму гантелей, чтобы максимально увеличить расстояние между электронами. Увеличение расстояния между электронами делает атом более стабильным, потому что электроны заряжены отрицательно и отталкиваются друг от друга.
Два электрона на рх-орбитали проводят большую часть своего времени в областях слева и справа от атомного ядра; два электрона на пи-орбитали проводят большую часть своего времени в областях выше и ниже атомного ядра; и два электрона на pz-орбитали проводят большую часть своего времени в областях перед атомным ядром и за ним.Геометрия этих орбиталей максимально разносит электроны, но все же есть некоторое перекрытие, которое снижает стабильность и немного увеличивает энергию p-орбиталей. Вот почему на самом деле s-орбиталь заполняется раньше p-орбиталей.
Третья электронная оболочка имеет девять атомных орбиталей: одну s-орбиталь, три p-орбитали и пять d-орбиталей. D-орбитали имеют еще более сложные и вытянутые формы, чтобы максимизировать расстояние между электронами, но перекрываются настолько сильно, что s-орбиталь в четвертой электронной оболочке фактически заполняется раньше, чем пять d-орбиталей в третьей. электронная оболочка начинает заполняться.
В этой таблице показан порядок заполнения атомных орбиталей. 1s — s-орбиталь в первой электронной оболочке. 2s — s-орбиталь во второй электронной оболочке. 2p — p-орбитали второй электронной оболочки.
Правило октетов и структуры Льюиса
Поскольку большинство атомов не очень стабильны, они имеют тенденцию химически связываться с другими атомами с образованием стабильных молекул.Способ, которым связываются многие атомы, можно предсказать с помощью правила октетов. Правило октета гласит, что атомы имеют тенденцию терять, принимать или делиться электронами до тех пор, пока у них не будет электронная конфигурация с «полной» внешней оболочкой (в данном случае полной, что означает два электрона, если самая внешняя оболочка является первой оболочкой, и восемь электронов. если самая внешняя оболочка является второй или более высокой оболочкой). Это та же электронная конфигурация, что и у атомов благородных газов, которые являются единственными химически стабильными атомами в периодической таблице. Правило октетов не всегда работает, поскольку существует очень много переменных, которые могут повлиять на стабильность атома.Обычно правило октетов не применяется к переходным или внутренним переходным металлам.
Как вы видели, диаграммы Бора могут вводить в заблуждение. Они также не очень полезны для предсказания химических свойств атомов. Химические свойства описывают, как атом или молекула реагирует в присутствии других атомов или молекул. Атомы реагируют, теряя, принимая или разделяя электроны, и это почти всегда касается внешних (валентных) электронов атома, а не электронов во внутренних оболочках.Структура Льюиса — это диаграмма, которая выделяет валентные электроны атома. Это может быть очень полезно для предсказания реакции атомов друг на друга.
Чтобы нарисовать структуру Льюиса атома, найдите символ и положение атома в периодической таблице.
Знак брома — Br. У него 35 протонов и 35 электронов, и он находится в четвертой строке и семнадцатом столбце периодической таблицы.
Начать заполнение валентных электронов брома.Поскольку бром находится в четвертой строке периодической таблицы, его валентные электроны будут находиться в четвертой электронной оболочке.
Начните с первого элемента четвертой строки периодической таблицы (K) и начните отсчет. Девятнадцатый электрон брома переходит на 4s-орбиталь. Нарисуйте одну точку справа от символа брома.
Двадцатый электрон также переходит на 4s-орбиталь.Нарисуйте вторую точку справа от символа брома.
4s-орбиталь теперь заполнена, и следующие десять электронов переходят на 3d-орбитали. Поскольку эти электроны входят в третью электронную оболочку, они являются внутренними электронами, а не валентными электронами. Не добавляйте точки к символу брома.
руб.
Тридцать первый электрон переходит на 4px-орбиталь.Нарисуйте одну точку над символом брома.
Тридцать второй электрон переходит на 4py-орбиталь. Нарисуйте одну точку слева от символа брома.
Тридцать третий электрон переходит на 4pz-орбиталь. Нарисуйте одну точку под символом брома. Каждая 4p-орбиталь теперь имеет по одному электрону.
Тридцать четвертый электрон переходит на 4px-орбиталь. Нарисуйте вторую точку над символом брома.Орбиталь в 4 пикселя теперь заполнена.
Тридцать пятый (и последний) электрон переходит на 4py-орбиталь. Нарисуйте вторую точку слева от символа брома. Теперь 4py-орбиталь заполнена.
Структура Льюиса атома брома завершена. На внешней оболочке у него семь валентных электронов. Поскольку внешняя оболочка не является «полной» (это короткий один электрон), атом брома не является химически стабильным и будет реагировать с другими атомами или молекулами до тех пор, пока его внешняя оболочка не заполнится.
Некоторые люди заполняют точки (валентные электроны) структуры Льюиса в разных порядках. Кажется, не существует единственного правильного способа сделать это, но я предпочитаю именно такой. Начните с заполнения s-орбитальных электронов справа от атомного символа, а затем заполните p-орбитальные электроны один за другим, двигаясь против часовой стрелки вокруг символа.
Группы элементов в периодической таблице
Если бы вы изобразили структуры Льюиса для всех элементов периодической таблицы, вы бы обнаружили интересный узор.Все элементы семнадцатого столбца периодической таблицы имеют одинаковую структуру Льюиса.
Эти элементы известны под общим названием галогены или группа фтора. Поскольку они имеют семь валентных электронов в одной электронной конфигурации, они обладают схожими химическими свойствами. Галогены обладают высокой реакционной способностью и будут связываться с другими атомами, принимая или разделяя один электрон, чтобы заполнить свои валентные оболочки.
На другом конце таблицы Менделеева находятся щелочные металлы или литиевая группа.Поскольку у них есть один валентный электрон в одной и той же электронной конфигурации, щелочные металлы также имеют схожие химические свойства. Они обладают высокой реакционной способностью и связываются с другими атомами, теряя один валентный электрон. Это делает следующую нижнюю (и полную) электронную оболочку самой внешней валентной оболочкой. Хотя водород технически входит в эту группу, он обладает некоторыми другими химическими свойствами. Это связано с тем, что, помимо потери электрона, атом водорода также может принимать или совместно использовать электрон, чтобы заполнить свою валентную оболочку.
электронная конфигурация | физика | Британника
электронная конфигурация , также называемая электронной структурой , расположение электронов на энергетических уровнях вокруг атомного ядра. Согласно более старой модели оболочечного атома, электроны занимают несколько уровней от первой оболочки, ближайшей к ядру, K, до седьмой оболочки, Q, самой дальней от ядра. С точки зрения более совершенной, квантово-механической модели, оболочки K — Q подразделяются на набор орбиталей ( см. Орбиталь ), каждая из которых может быть занята не более чем парой электронов.В таблице ниже указано количество орбиталей, доступных в каждой из первых четырех оболочек.
Электронная конфигурация атома в оболочечной модели атома может быть выражена указанием числа электронов в каждой оболочке, начиная с первого. Например, у натрия (атомный номер 11) 11 электронов распределены в первых трех оболочках следующим образом: оболочки K и L полностью заполнены 2 и 8 электронами соответственно, а оболочка M состоит только из частично заполнен одним электроном.
Британская викторина
Викторина «Все о физике»
Кто был первым ученым, проведшим эксперимент по управляемой цепной ядерной реакции? Какая единица измерения для циклов в секунду? Проверьте свою физическую хватку с помощью этой викторины.
Электронная конфигурация атома в квантово-механической модели указывается путем перечисления занятых орбиталей в порядке заполнения, причем количество электронов на каждой орбитали указывается верхним индексом.В этих обозначениях электронная конфигурация натрия будет иметь вид 1 с 2 2 с 2 2 p 6 3 с 1 , распределенных по орбиталям как 2-8-1 . Часто используется сокращенный метод, который перечисляет только те электроны, которые превышают конфигурацию благородного газа, непосредственно предшествующую атому в периодической таблице. Например, у натрия на 3 s электрона больше, чем у благородного газа неона (химический символ Ne, атомный номер 10), поэтому его сокращенное обозначение — [Ne] 3 s 1 .
Элементы одной группы в периодической таблице имеют схожую электронную конфигурацию. Например, элементы лития, натрия, калия, рубидия, цезия и франция (щелочные металлы группы I) имеют электронные конфигурации, показывающие, что один электрон находится на внешней (наиболее слабосвязанной) орбитали s . Этот так называемый валентный электрон отвечает за аналогичные химические свойства, присущие вышеупомянутым щелочным элементам в Группе I: яркий металлический блеск, высокая реакционная способность и хорошая теплопроводность.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчасРасшифровка: Химия в ее стихии: неон(Promo) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (конец акции) Крис Смит Здравствуйте! На этой неделе мы познакомимся с элементом, который сделал квартал красных фонарей тем, чем он является сегодня, ну вроде как; то, что вы обязательно увидите, — это пламя неоновых вывесок, а с историей о том, как они появились, — это Виктория Гилл. Victoria Gill Это может быть самый увлекательный элемент периодической таблицы Менделеева. Это газ, который может дать вам ваше имя или любое слово, которое вам нравится, на самом деле, в свете.Неоновый газ заполнил первые световые науки, которые были созданы почти столетие назад и с тех пор проникли в язык и культуру. Это слово вызывает в воображении образы красочных, а иногда и довольно захудалых, пылающих наук, многие из которых теперь не содержат самого газа. Только красное свечение является чистым неоном, почти все остальные цвета теперь производятся с использованием аргона, ртути и фосфора в различных пропорциях, что дает более 150 возможных цветов. Тем не менее, именно неон стал общим названием для всех светящихся трубок, которые позволяют рекламодателям и даже многим художникам рисовать и писать светом, и именно это свечение впервые выдало свое присутствие. До того, как он был изолирован, оставшееся место в периодической таблице было источником многих лет разочарования. Открыв аргон в 1894 году и выделив гелий в 1895 году, британский химик сэр Уильям Рамзи открыл первого и третьего членов группы инертных газов. Чтобы восполнить пробел, ему нужно было найти вторую. Наконец, в 1898 году в Университетском колледже в Лондоне Рамзи и его коллега Моррис Траверс изменили эксперимент, который они опробовали ранее, они позволили твердому аргону, окруженному жидким воздухом, медленно испаряться при пониженном давлении, и собрали газ, который выходил первым.Когда они поместили образец недавно открытого газа в атомный спектрометр, нагревая его, они были поражены его сияющим блеском. Траверс писал об этом открытии : «Вспышка малинового света из трубки рассказала свою собственную историю и была зрелищем, на котором стоит остановиться и никогда не забыть». Название неон происходит от греческого слова neos , что означает новый. На самом деле это был тринадцатилетний сын Рэмси, который предложил название для газа, сказав, что он хотел бы назвать его novum от латинского слова «новый».Его отцу идея понравилась, но он предпочел использовать греческий язык. Так новый элемент в названии и природе, наконец, занял свое место в таблице Менделеева. И изначально отсутствие реактивности означало, что у Neon не было очевидного применения. Это потребовало немного воображения от французского инженера, химика и изобретателя Жоржа Клода, который в начале -х годов века впервые применил электрический разряд к запечатанной трубке с неоновым газом. Создаваемое им красное свечение натолкнуло Клода на идею создания источника света совершенно новым способом.Он сделал стеклянные трубки из неона, которые можно было использовать как лампочки. Клод представил публике первую неоновую лампу 11 декабря -го года 1910 года на выставке в Париже. Его поразительный дисплей вскружил голову, но, к сожалению, неоновые лампы не продавались. Люди просто не хотели освещать свои дома красным светом; но Клода это не остановило. Он запатентовал свое изобретение в 1915 году и, пытаясь найти ему применение, обнаружил, что, сгибая трубки, он может создавать светящиеся буквы.Использование неоновых трубок для рекламных вывесок началось в 1923 году, когда его компания Claude Neon представила в США трубчатые вывески с газовым наполнением. Два он продал автосалону Packard в Лос-Анджелесе. Первые неоновые вывески были названы «жидким огнем», и люди останавливались на улице, чтобы смотреть на них, даже при дневном свете они заметно светятся. В наши дни неон извлекается из жидкого воздуха путем фракционной перегонки, и всего несколько тонн в год имеющегося в изобилии газа достаточно для удовлетворения любых коммерческих потребностей.И, конечно же, сейчас есть много источников световых вывесок, экранов и дисплеев, которые дают нам гораздо более впечатляющие прокручиваемые буквы и движущиеся картинки, которые мы ассоциируем с яркими красочными огнями, скажем, Таймс-сквер в Нью-Йорке. Итак, Неон мог потерять часть своего уникального блеска здесь, на Земле, но еще дальше он помог раскрыть некоторые секреты самого важного светящегося объекта для нашей планеты — Солнца. Солнечные частицы или солнечный ветер также содержат неон в соотношении двух изотопов неона в образцах лунных горных пород, горные породы, которые взрываются солнечным ветром в течение миллиардов лет, до недавнего времени ставили ученых в тупик.Это потому, что соотношение двух изотопов варьировалось в зависимости от глубины породы; с большим количеством неона-22, чем неона-20 на меньших глубинах. Значит ли это, что когда-то Солнце было значительно более активным, чем сегодня, выбрасывая частицы с более высокой энергией, которые могли проникать глубже в скалы? Наконец, на этот вопрос был дан ответ, когда ученые изучили кусок металлического стекла, который подвергался воздействию солнечного ветра всего два года на космическом корабле Genesis, который упал на Землю в 2004 году.Когда ученые измерили распределение неона в образцах стекла, подвергшихся воздействию солнечного ветра, они обнаружили, что верхний слой также содержал больше неона-20, чем нижележащий слой. Нижележащий слой был похож на лунную скалу. Поскольку активность Солнца вряд ли изменилась в течение двухлетней миссии, похоже, что несоответствие вызывало что-то вроде космической эрозии, микрометеороиды или частицы просто удалили часть исходного неона с верхней поверхности Луны. камень. Так что, может быть, вам стоит остановиться и остановиться на следующей неоновой вывеске, которую вы увидите, и просто оценить поистине уникальное свечение. Крис Смит Итак, элемент, который как дома в космосе, рекламирует торговую марку здесь, на Земле. Это была Виктория Гилл с историей неона. В следующий раз к химическому веществу, которое сглаживает морщины при производстве стали. Рон Каспи Когда сэр Генри Бессемер изобрел процесс производства стали в 1856 году, его сталь распалась при горячей прокатке или ковке; проблема была решена позже в том же году, когда Роберт Фостер Мушет, другой англичанин, обнаружил, что добавление небольшого количества марганца в расплавленное железо решает проблему.Поскольку марганец имеет большее сродство к сере, чем железо, он превращает легкоплавкий сульфид железа в стали в тугоплавкий сульфид марганца. Крис Смит Но как это сработало? Рон Каспи будет здесь на следующей неделе и расскажет о марганце, элементе, который делает возможным фотосинтез и дал нам альтернативу зеленому стеклу. Это на следующей неделе Chemistry в ее элементе; Надеюсь, вы сможете к нам присоединиться. Я Крис Смит, спасибо за внимание и до свидания! (Промо) (Окончание промо) |
Электронные оболочки — Атомный номер, массовое число и изотопы — Редакция GCSE Chemistry (Single Science) — Другое
Электроны расположены в различных оболочках вокруг ядра.Каждая последующая оболочка может содержать только определенное количество электронов.
Самая внутренняя оболочка заполняется первой. Эта оболочка может содержать максимум двух электронов. Вторая оболочка может содержать максимум восьми электронов. Когда он заполнен, электроны переходят в третью оболочку, которая также содержит максимум восьми электронов. Затем начинает наполняться четвертая оболочка.
| Энергетическая оболочка | Максимальное количество электронов |
|---|---|
| Первый | 2 |
| Второй | 8 |
| Третий | 9034 атом | 8 9030 , имеет три электрона.У него два в первой оболочке и одна во второй оболочке. У атома углерода шесть электронов. У него два в первом корпусе и четыре во втором корпусе. Электронное устройство лития Электронное устройство углерода Атом кальция состоит из 20 электронов. Два находятся в первом корпусе, восемь — во втором корпусе, восемь — в третьем корпусе и два — в четвертом корпусе. Атомная структураАтомная структураАтомная структура Вся материя состоит из основных строительных блоков, называемых атомами . Атомы состоят из еще более мелких частиц, называемых протонами , электрона и нейтрона . Протоны и нейтроны живут в ядре атома и практически идентичны по массе. Тем не мение, протоны имеют положительный заряд, тогда как нейтроны не имеют заряда. Электроны имеют отрицательный заряд и вращаются вокруг ядра в оболочках или электронах орбитали и намного менее массивны, чем другие частицы.С электроны в 1836 раз менее массивны, чем протоны или нейтроны, большая часть масса атома находится в ядре, которое составляет всего 1/100 000 размера атома. весь атом (!). Организация атома водорода показана ниже: Атом водорода Красная точка — это протон в ядре. Имеет положительный заряд +1 ед. Синяя точка — электрон. Имеет отрицательный заряд -1 ед. Для любого нормального атома количество электронов и протоны равны, что означает, что электрический заряд уравновешен.Там это только одна орбиталь для водорода. Давайте посмотрим на атом углерода большего размера. Атом углерода В ядре появилась новая частица — нейтрон. (представлен белыми точками). В ядре также 6 протонов, всего 12 частиц. Кроме того, теперь есть 6 электронов. вращается вокруг ядра по двум орбиталям. Причина, по которой атом углерода нуждается в вторая орбиталь сложна и выходит за рамки этого геологического класса. Но правила, управляющие атомами, гласят, что первая орбиталь может иметь только две электронов, на второй орбитали разрешено восемь электронов, на третьей — только восемь электронов и т. д. (См. стр. 27 вашего текста с номерами электронов на каждой орбитали для первых 20 элементов.) В природе 91 элемент. Атомы — это самые маленькие из возможных элементов, и на самом деле слово «атом» происходит от греческого слова «томос», что означает «не резать» — то есть вы не можете вырезать меньше, чем это.Мы обычно представляют элементы их атомным символом. Водород представлен буквой «H»; углерод буквой «C». Для атомов изменение числа протонов меняет вид элемент . Итак, если бы я бросил дополнительный протон в ядра атома углерода, проиллюстрированного выше, у меня больше не будет углерода — я будет азот. Точно так же, если бы я убрал протон из углерода атом, у меня был бы другой элемент, бор. Число протонов в ядро атома совпадает с атомным номером этого атом.Если сложить количество протонов и нейтронов, получится атомных массовое число этого конкретного атома. Quick quiz : Какой атомный номер показан атом водорода выше? Что это за атомное массовое число? Что такое атомный номер и массовое атомное число указанного выше атома углерода? Ответы : атомный номер водорода 1 (посчитайте протоны). Атомно-массовое число водорода тоже , одно (есть нет нейтронов!).Для углерода атомный номер 6 , а атомный номер массовое число 12 (6 протонов плюс 6 нейтронов). Посмотрите еще раз на изображение атома углерода. Что, если бы мы добавили нейтрон вместо протона? Будет ли у нас такой же элемент? да. Но атом был бы другим. A dding или вычитание нейтронов из ядра атома создает изотопы этого атома . Например, давайте добавим два нейтрона к атому углерода, обозначенному зеленым точки ниже: Изотоп углерода Добавление двух нейтронов меняет наш атом.Однако, поскольку количество протонов то же самое, это все еще углерод, но теперь это изотоп углерода. Мы представляем изотопы с помощью химического символа («C» для углерода) и число. Первый атом углерода только с 6 нейтроны будут называться 12 C или углерод-12. Новый с 8 нейтронов будет 14 C или углерод-14. Обратите внимание, что число «14» также является атомным массовым числом для этого изотопа. Химики работали над организацией элементов особым образом, называемым Периодическая таблица.Он упорядочен так, что элементы в каждом столбце имеют некоторые общие химические и физические свойства. Ниже приведено изображение Периодическая таблица: Каждый элемент имеет атомарный символ и атомарный символ. номер. Quick Quiz: Напомним, что атомный номер — это количество протонов в ядре. Сколько протонов в Атом натрия (Na)? Атом кислорода (O)? Атом урана (U)? Ответы: Натрий имеет 11 протонов , Кислород 8 протонов и урана 92 протонов. Продолжайте и узнайте об ионах. (Для получения дополнительной информации по основам химии и атомной структуре, посетите http://www. ➤
|

 Остальные работают в тетрадях и поднимают руки если есть ошибки. Учитель комментирует работу детей у доски.
Остальные работают в тетрадях и поднимают руки если есть ошибки. Учитель комментирует работу детей у доски. В данном случае это может быть как предложение, составленное учеником самостоятельно, так и крылатое выражение, пословица, поговорка, цитата, афоризм, обязательно в контексте раскрываемой темы.
В данном случае это может быть как предложение, составленное учеником самостоятельно, так и крылатое выражение, пословица, поговорка, цитата, афоризм, обязательно в контексте раскрываемой темы.