Тема 20. Кислоты. (Страницы 89,90,91,92,93,94,95)
Главная › 8 класс › Химия › Рабочая тетрадь по химии Габриелян Сладков 8 классЧасть I
1. Признаки кислот:- сложные вещества;
- состоят из атомов водорода и кислотного остатков;
- в растворе образуют простые ионы H+ и сложные или простые ионы кислотного остатка — Acd.
Общая формула кислот:
где n — заряд кислотного остатка.
2. Классификация кислот.
1) По числу атомов водорода
2) По наличию кислорода в кислотном остатке
3) По растворимости
4) По стабильности
1) Бескислородных.
НСl — хлороводородная кислота, h3S — сероводородная кислота.
2) Кислородсодержащих.
HNO2 — азотистая кислота, HNO3 – азотная кислота.
4.
5. Каждой кислоте соответствует свой оксид. Дополните таблицу «Кислоты и соответствующие им оксиды».
6. Кислоты изменяют окраску индикаторов. Дополните таблицу «Изменение окраски индикатора в кислой среде».
Часть II
Распределите все приведённые выше кислоты по группам. Запишите их названия.
2. Дайте характеристику фосфорной кислоты h4PO4 по всем признакам классификации.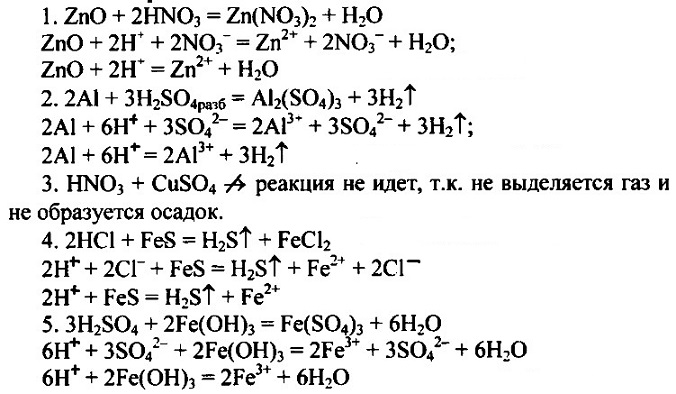
1) Кислородсодержащая
2) Трёхосновная
3) Средней силы
4) Стабильная.
4. Определите заряды ионов, степени окисления элементов в кислотах.
5. Установите соответствие между опасной ситуацией и необходимыми действиями по оказанию первой помощи во избежание химического ожога.
6. В пробирках А и Б находятся растворы гидроксида калия и соляной кислоты. Какие качественные реакции необходимо провести, чтобы определить содержимое каждой из пробирок?
7. Установите соответствие между свойством или применением кислоты и её формулой. Из букв, соответствующих правильным ответам, вы составите название кислоты, которая широко распространена в природе и легко удаляет с тканей пятна ржавчины:

8. Вычислите количество вещества, которое составляют 392 кг фосфорной кислоты. Сколько атомов водорода будет содержаться в этой порции кислоты?
Тема 19. Основания. — стр. 83-89Тема 21. Соли. — стр. 95-103
Сохраните или поделитесь с одноклассниками:
ГДЗ за 8 класс по Химии О.С. Габриелян
gdz-bot.ru НайтиНавигация по гдз
1 класс Русский язык Математика Английский язык Окружающий мир Литература Информатика Музыка Человек и мир 2 класс Русский язык Математика Английский язык Немецкий язык Окружающий мир Литература Информатика Музыка Технология Человек и мир 3 класс Русский язык Математика Английский язык Немецкий язык Окружающий мир Литература Информатика Музыка 4 класс Русский язык Математика Английский язык Немецкий язык Окружающий мир Литература Информатика Музыка Белорусский язык 5 класс Русский язык Математика Английский язык Немецкий язык История География Биология ОбществознаниеГДЗ по химии за 8 класс О. С. Габриелян онлайн
С. Габриелян онлайн
Издательство: Дрофа 2015
Тип: Учебник.
Материал по химии в 8 классе предусматривает изучение роли химии в жизни человека, умение наблюдать химические явления, учит проводить химические опыты, производить расчеты с помощью формул веществ, решать уравнения реакций. Изучение химии требует к себе особого внимания, так как ее знания необходимы в повседневной жизни. Ежедневно человек пользуется продуктами химического производства, но есть среди них и опасные, особенно это касается бытовой химии, поэтому знания техники безопасности в обращении с подобными веществами должен знать каждый цивилизованный человек.
Начальное изучение определенным образом сказывается на дальнейшем ее усвоение. Для того, чтобы усвоение было наиболее эффективным и качественным лучше всего воспользоваться ГДЗ по химии 8 класс авторы: Габриель О.С., Остроумов И.Г., Сладков С.А. Этот онлайн решебник поможет восьмикласснику наилучшим образом запомнить изучаемый материал. Готовые верные ответы, которые имеются в этом пособии, содержат точные и обстоятельные пояснения изучаемых тем и выполняемых заданий, способствующие лучшему запоминанию необходимой информации. Ничего страшного, если ученик будет обращаться к этому пособию за готовыми ответами, в конце концов он усвоит то, что ему необходимо знать по той или иной теме, которая дается ему с наибольшими трудностями.
ГДЗ к рабочей тетради по химии за 8 класс Габриелян О.С. можно скачать здесь.
ГДЗ к тетради для оценки качества знаний по химии за 8 класс Габриелян О.С. можно скачать здесь.
ГДЗ к контрольным и самостоятельным работам по химии за 8 класс Павлова Н.С. можно скачать здесь.
ГДЗ к тетради для лабораторных опытов и практических работ по химии за 8 класс Габриелян О.С. можно скачать здесь.
ГДЗ к контрольным работам по химии за 8 класс Габриелян О.С. можно скачать здесь.
ГДЗ к контрольным и проверочным работам по химии за 8 класс Габриелян О.С. можно скачать здесь.
ГДЗ к учебнику по химии за 8 класс Габриелян О.С. (Просвещение) можно скачать здесь.
ГДЗ по Химии 8 класс Габриелян, решебник
Навигация Видеорешения ГдзКлассы
7 8 9 10 11Все предметы
Математика Английский язык Русский язык Алгебра Геометрия Физика Химия Немецкий язык Белорусский язык Французский язык Биология История Информатика ОБЖ География Литература Обществознание Черчение Экология Технология Испанский язык Искусство Кубановедение Казахский язык Следите за намиРешебник (ГДЗ) по химии 8 класс Габриелян
Введение
§ 1 (1). Предмет химии. Вещества:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (н) 7 (н) 8 (н) 9 (н) 10 (н)
§ 2 (2). Превращения веществ. Роль химии в жизни человека:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 3 (3). Краткий очерк истории развития химии:
1 (1) 2 (2) 3 (3) 4 (н) 5 (4) 6 (5) 7 (6)
§ 4 (4). Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 5 (5). Химические формулы. Относительная атомная и молекулярная массы:
1 (с) 1 (3) 2 (4) 3 (н) 4 (5) 5 (2) 6 (н) 7 (н) 8 (н)
Глава 6 (с). Скорость химических реакций. Химическое равновесие
§ 29 (с). Скорость химических реакций:
1 (с) 2 (с) 3 (с) 4 (с) 5 (с)
§ 31 (с). Катализаторы:
1 (с) 2 (с) 3 (с) 4 (с) 5 (с) 6 (с)
§ 32 (с). Обратимые и необратимые реакции:
1 (с) 2 (с) 3 (с) 4 (с)
§ 33 (с). Химическое равновесие и способы его смещения:
1 (с) 2 (с) 3 (с) 4 (с) 5 (с) 6 (с)
_30(С)~1.ЗАВ:
1 (с) 2 (с) 3 (с) 4 (с) 5 (с) 6 (с) 7 (с)
Глава 1 (1). Атомы химических элементов
Решебник на обновлении.
§ 6 (6). Основные сведения о строении атомов:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 7 (7). Изменения в составе ядер атомов химических элементов. Изотопы:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
§ 8 (8). Строение электронных оболочек атомов:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6) 7 (7)
§ 9 (9). Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 10 (10). Взаимодействие атомов элементов-неметаллов между собой:
1 (1) 2 (2) 3 (3) 4 (4) 5 (н)
§ 11 (11). Ковалентная полярная химическая связь:
1 (1) 2 (2) 3 (3) 4 (4)
§ 12 (12). Металлическая химическая связь:
1 (1) 2 (2) 3 (3)
Глава 2 (2). Простые вещества
§ 13 (13). Простые вещества-металлы:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 14 (14). Простые вещества-неметаллы:
1(1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 15 (15). Количество вещества:
1(1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 16 (16). Молярный объем газов:
1(1) 2 (2) 3 (3) 4 (н) 5 (н)
Глава 3 (3). Соединения химических элементов
§ 17 (17). Степень окисления:
1(1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
§ 18 (18). Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения:
1(1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
§ 19 (19). Основания:
1(1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 20 (20). Кислоты:
1(1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 21 (21). Соли:
1(1) 2 (2) 3 (3)
§ 22 (22). Кристаллические решетки:
1(1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
§ 23 (23). Чистые вещества и смеси:
1(1) 2 (2) 3 (3) 4 (4)
§ 24 (24). Массовая и объемная доли компонентов смеси (раствора):
1(1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6) 7 (7)
Глава 4 (4). Изменения, происходящие с веществами
§ 29 (н). Реакции разложения: 1(н) 2 (н) 3 (н) 4 (н) 5 (н) 6 (н)
§ 30 (н). Реакции соединения:
1(н) 2 (н) 3 (н) 4 (н) 5 (н) 6 (н) 7 (н) 8 (н)
§ 31 (н). Реакции замещения:
1(н) 2 (н) 3 (н) 4 (н) 5 (н)
§ 32 (н). Реакции обмена:
1(н) 2 (н) 3 (н) 4 (н) 5 (н) 6 (н)
§ 33 (н). Типы химических реакций на примере свойств воды:
1(н) 2 (н) 3 (н) 4 (н) 5 (н)
§ 25 (25). Физические явления в химии:
1(1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
§ 26 (26). Химические реакции:
1(1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
§ 27 (27). Химические уравнения:
1(1) 2 (2) 3 (3) 4 (4)
§ 28 (28). Расчеты по химическим уравнениям:
1(1) 2 (2) 3 (3) 4 (4) 5 (5)
Глава 5 (5). Простейшие операции с веществом (химический практикум)
Практическая работа № 5 (c) «Получение водорода и определение его свойств:
1 2 3
Практическая работа № 6 (с). «Получение и свойства кислорода»:
1 2
Практическая работа № 2 (2). «Наблюдение за горящей свечой»:
1 2 3
Практическая работа № 3 (3). «Анализ почвы и воды»:
1 2 3 4
Практическая работа № 4 (4). «Признаки химических реакций»:
1 2 3 4
Практическая работа № 5 (7). «Приготовление раствора сахара…»:
Опыт
Глава 6 (7). Растворение. Растворы
§ 34 (34). Растворение. Растворимость веществ в воде:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6) 7 (7)
§ 35 (35). Электролитическая диссоциация:
1 (1) 2 (с) 2 (3) 3 (4) 4 (5) 5 (6)
§ 36 (36). Основные положения теории электролитической:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
§ 37 (37). Ионные уравнения:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 38 (38). Кислоты, их классификация и свойства:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
§ 39 (39). Основания, их классификация и свойства:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 40 (40). Оксиды, их классификация и свойства:
1 (1) 2 (2) 3 (3) 4 (с) 4 (н) 5 (5)
§ 41 (41). Соли, их классификация и свойства:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 42 (42). Генетическая связь между классами веществ:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
§ 43 (43). Окислительно-восстановительные реакции:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6) 7 (7) 8 (8)
Глава 6 (7). Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции
§ 42 (42). Генетическая связь между классами веществ:
§ 43 (43). Окислительно-восстановительные реакции:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6) 7 (7) 8 (8)
Глава 7 (8). Свойства электролитов (химический практикум)
Практическая работа № 6 (8). «Ионные реакции»:
1 2 3 4
Практическая работа № 7 (9). «Условия протекания химических реакций между растворами»:
1 2 3
Практическая работа № 8 (10). «Свойства кислот, оснований, оксидов и солей»:
1 2 3 4
Практическая работа № 9 (11). «Решение экспериментальных задач»:
1
Глава 8 (9). Портретная галерея великих химиков (Шеренга великих химиков)
Роберт Бойль:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
Парацельс:
1 (1) 2 (2) 3 (3) 4 (4)
М.В. Ломоносов:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6) 7 (7)
Ле Шателье (с):
1 (с) 2 (с) 3 (с) 4 (с)
К. Бертолле:
1 (1) 2 (2) 3 (3) 4 (4)
И.С. Каблуков:
1 (1) 2 (2) 3 (2) 4 (н) 5 (4)
Дж. Дальтон:
1 (1) 2 (2) 3 (3) 4 (4)
Д.И. Менделеев:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5)
А. Лавуазье:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
А. Авогадро:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
С. Аррениус:
1 (1) 2 (2) 3 (3) 4 (4) 5 (5) 6 (6)
Выберите страницу рабочей тетради7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125
ГДЗ по Химии за 8 класс О.С. Габриелян 2015
Решебники, ГДЗ
- 11 Класс
- Русский язык
- Английский язык
- Немецкий язык
- Математика
- Алгебра
- Геометрия
- Физика
- Химия
- Биология
- История
- География
- Обществознание
- Литература
- ОБЖ
- Информатика
- Белорусский язык
- Астрономия
- Мед. подготовка
- Испанский язык
- Казахский язык
- 10 Класс
- Русский язык
- Английский язык
- Немецкий язык
- Математика
- Алгебра
- Геометрия
- Физика
- Химия
- Биология
- История
- Географи
4.8: Кислотно-щелочная экстракция — Chemistry LibreTexts
Как они работают
Модификация экстракции, ранее обсуждавшаяся в этой главе, заключается в проведении химической реакции в делительной воронке для изменения полярности и, следовательно, разделения соединения на водный и органический слои. Распространенным методом является проведение кислотно-щелочной реакции, которая может преобразовать некоторые соединения из нейтральных в ионные формы (или наоборот).
Например, представьте, что смесь бензойной кислоты и циклогексана растворяется в органическом растворителе, таком как этилацетат, в делительной воронке.Для разделения компонентов можно попытаться удалить бензойную кислоту с помощью промывки водой, но бензойная кислота не особенно растворима в воде из-за ее неполярного ароматического кольца, и лишь небольшие количества могут быть экстрагированы в водный слой (рис. 4.54a).
Рис. 4.54: Промывка смеси бензойной кислоты и циклогексана: а) водой, б) водным \ (\ ce {NaOH} \).Однако возможно разделение смеси бензойной кислоты и циклогексана с использованием промывки основанием, таким как \ (\ ce {NaOH} \).+} \ right) \\ \ text {Бензойная кислота} & & & & & & \ text {Бензоат натрия} & & \ end {array} \]
Свойства растворимости карбоновых кислот существенно отличаются от их соответствующих карбоксилатных солей. Салицилат натрия примерно в 350 раз более растворим в воде, чем салициловая кислота, из-за его ионного характера (рис. 4.55), и он довольно нерастворим в органических растворителях, таких как диэтиловый эфир.
Рисунок 4.55: Данные о растворимости в воде салициловой кислоты и салицилата натрия (ссылка 4).Следовательно, промывка \ (\ ce {NaOH} \) превратит бензойную кислоту в ее ионную карбоксилатную форму, которая затем станет более растворимой в водном слое, что позволит бензоату натрия экстрагироваться в водный слой. Циклогексан останется в органическом слое, поскольку он не имеет сродства к водной фазе и не может каким-либо образом реагировать с \ (\ ce {NaOH} \). Таким образом можно разделить смесь бензойной кислоты и циклогексана (рис. 4.54b). Водный слой может быть позже подкислен \ (\ ce {HCl} \ left (aq \ right) \), если желательно преобразовать бензойную кислоту обратно в ее нейтральную форму.
Промывка бикарбонатом натрия
Кислотно-щелочная экстракция может использоваться для извлечения карбоновых кислот из органического слоя в водный слой. Как обсуждалось в предыдущем разделе, \ (\ ce {NaOH} \) можно использовать для преобразования карбоновой кислоты в ее более водорастворимую ионную карбоксилатную форму. Однако, если смесь содержит желаемое соединение, которое может реагировать с \ (\ ce {NaOH} \), следует использовать более мягкое основание, такое как бикарбонат натрия. Аналогичная реакция происходит:
\ [\ begin {array} {ccccccccccc} \ ce {PhCO_2H} \ left (aq \ right) & + & \ ce {NaHCO_3} \ left (aq \ right) & \ rightarrow & \ ce {PhCO_2Na} \ left ( aq \ right) & + & \ ce {H_2CO_3} \ left (aq \ right) & \ rightleftharpoons & \ ce {H_2O} \ left (l \ right) & + & \ ce {CO_2} \ left (g \ right) \\ \ text {Бензойная кислота} & & & & \ text {Бензоат натрия} & & & & & & \ end {array} \]
Одно отличие в использовании основания \ (\ ce {NaHCO_3} \) вместо \ (\ ce {NaOH} \) заключается в том, что побочный продукт углекислоты \ (\ left (\ ce {H_2CO_3} \ right) \) может разлагаться к воде и углекислому газу.При встряхивании кислого раствора с бикарбонатом натрия в делительной воронке необходимо осторожно вращать его, а выпускать воздух чаще, , чтобы сбросить давление из газа.
Примером реакции, в которой при обработке часто используется промывка бикарбонатом натрия, является реакция этерификации Фишера. Чтобы продемонстрировать, бензойную кислоту кипятили с обратным холодильником в этаноле вместе с концентрированной серной кислотой для образования этилбензоата (рис. 4.56a + b). Пластина ТСХ реакционной смеси при кипячении с обратным холодильником в течение 1 часа показала остаточную непрореагировавшую карбоновую кислоту (Фиг.4.56в), что нередко из-за энергетики реакции.
Рис. 4.56: a) Реагенты при кипячении с обратным холодильником, b) Схема реакции, c) ТСХ после 1 часа кипячения с обратным холодильником, где первая полоса (BA) представляет собой бензойную кислоту, вторая полоса (Co) является совместной точкой, а третья полоса (Pr ) представляет собой реакционную смесь (смесь гексаны: этилацетат 1: 1 и визуализация в УФ-свете).Остаточная карбоновая кислота может быть удалена из желаемого сложноэфирного продукта с использованием кислотно-щелочной экстракции в делительной воронке.Промывка бикарбонатом натрия превращает бензойную кислоту в ее более растворимую в воде форму бензоата натрия, извлекая ее в водный слой (рис. 4.57). Кроме того, бикарбонат натрия нейтрализует каталитическую кислоту в этой реакции.
Рис. 4.57: Промывка насыщенным бикарбонатом натрия для удаления остаточной карбоновой кислоты из реакционной смеси этерификации Фишера. Затем сложный эфир выделяют в органическом слое.В этом процессе бикарбонат натрия предпочтительнее \ (\ ce {NaOH} \), так как он является гораздо более слабым основанием; промывание \ (\ ce {NaOH} \) может вызвать гидролиз сложноэфирного продукта.
Смеси кислот и оснований
Как обсуждалось ранее, кислотно-основные свойства соединений можно использовать для селективного извлечения определенных соединений из смесей. Эту стратегию можно распространить на другие примеры
Базы извлечения
Основные соединения, такие как амины, можно экстрагировать из органических растворов путем встряхивания их с кислыми растворами, чтобы преобразовать их в более водорастворимые соли. +} \ right) \\ \ text {Карбоновая кислота} & & & & & & \ text {Карбоксилатная соль} & & \ end {array} \]
Аналогичная реакция происходит с фенолами \ (\ left (\ ce {PhOH} \ right) \), и их тоже можно экстрагировать в водный слой \ (\ ce {NaOH} \) (рис. 4.58а).
Однако фенолы значительно менее кислые, чем карбоновые кислоты, и недостаточно кислые, чтобы полностью реагировать с \ (\ ce {NaHCO_3} \), более слабым основанием. Следовательно, раствор бикарбоната можно использовать для разделения смесей фенолов и карбоновых кислот (рис. 4.58b).
Рисунок 4.58: a) Экстракция карбоновых кислот и фенолов в \ (5 \% \: \ ce {NaOH} \ left (aq \ right) \), b) Экстракция только карбоновых кислот в \ (5 \% \ : \ ce {NaHCO_3} \ left (aq \ right) \).Извлечение кислотных, основных и нейтральных соединений
Кислотно-основные свойства, обсуждавшиеся ранее, позволяют очищать смесь, содержащую кислотные (например, \ (\ ce {RCO_2H} \)), основные (например, \ (\ ce {RNH_2} \)) и нейтральные компоненты с помощью серии экстракций, как показано на Рисунке 4.59 (где используется менее плотный органический растворитель, чем вода).
Рисунок 4.59: Блок-схема разделения смеси, содержащей кислотные, основные и нейтральные компоненты.Предполагается, что читатели, проводящие этот тип экспериментов, знакомы с выполнением одиночного и множественного извлечения.В этом разделе описаны различия между общими процедурами экстракции и процессом, представленным на Рисунке 4.59.
- Выделение кислотного компонента:
- Когда кислотный компонент находится в водном слое в колбе Эрленмейера, он может быть преобразован обратно в нейтральный компонент путем добавления \ (2 \: \ text {M} \: \ ce {HCl} \ left (aq \ справа) \) до тех пор, пока pH раствора не станет равным 3-4 (по данным индикатора pH). Если присутствует большое количество кислоты, такое, что для подкисления потребуется слишком большой объем \ (2 \: \ text {M} \: \ ce {HCl} \ left (aq \ right) \), концентрированный \ (\ ce { HCl} \ left (aq \ right) \) можно вместо этого добавлять по каплям.Более низкие концентрации \ (\ ce {HCl} \ left (aq \ right) \) менее опасны, но увеличение объема водного слоя на большое количество повлияет на эффективность последующих этапов экстракции и фильтрации.
- После подкисления можно использовать два способа, в зависимости от того, является ли кислотный компонент твердым или жидким.
- Если при подкислении ионной соли образуется твердое вещество, его можно собрать с помощью вакуум-фильтрации. Этот метод следует использовать только в том случае, если видно большое количество кристаллов большого размера.Если образуются мелкие кристаллы (которые довольно часто встречаются), они забивают фильтровальную бумагу и мешают адекватному дренажу. Если будет видно только небольшое количество твердого вещества по сравнению с теоретическим количеством, вероятно, соединение хорошо растворимо в воде, и фильтрация приведет к низкому извлечению.
- Если при подкислении не образуется твердое вещество (или если мелкие кристаллы или небольшое количество твердых форм), извлеките кислотный компонент обратно в органический растворитель (\ (\ times 3 \)). Как правило, используйте для экстракции 1/3 количества растворителя по сравнению с исходным слоем (например.г. при использовании водного раствора \ (100 \: \ text {mL} \) экстрагируйте каждый раз органическим растворителем \ (33 \: \ text {mL} \)). Обязательно сначала охладите водный раствор на ледяной бане перед экстракцией, если при подкислении выделяется заметное тепло. Затем промойте рассолом (\ (\ times 1 \)), если используете диэтиловый эфир или этилацетат, высушите осушающим агентом и удалите растворитель с помощью роторного испарителя, чтобы оставить чистый кислотный компонент.
- Изоляция основного компонента:
- Используйте тот же процесс, что и для выделения кислотного компонента, за исключением того, что подщелачивайте раствор, используя \ (2 \: \ text {M} \: \ ce {NaOH} \ left (aq \ right) \), пока он не даст pH 9-10, как определено с помощью pH-бумаги.
- Изоляция нейтрального компонента:
- Нейтральный компонент будет «оставшимся» соединением в органическом слое. Чтобы выделить, промойте рассолом (\ (\ times 1 \)), если используете диэтиловый эфир или этилацетат, высушите осушающим агентом и удалите растворитель с помощью роторного испарителя, чтобы оставить чистый нейтральный компонент.
Автор
Лиза Николс (Общественный колледж Бьютта). Organic Chemistry Laboratory Techniques находится под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 Международная лицензия. Полный текст доступен онлайн.
RRB JE Exam: Chemistry (Acid & Base) Quiz
Q1. Значение pH щелочного раствораक्षारीय घोल का pH मान क्या है?
(а)
(б) 7
(c)> 7
(d) Нет / कोई नहीं
Показать ответ
Ans (c)
Sol. Чистая вода имеет нейтральный pH 7. Значения pH ниже 7 являются кислыми, а значения pH выше 7 — щелочными (основными).
2 кв. В чистой воде концентрация водородных ионов составляет
शुद्ध पानी में हाइड्रोजन सांद्रता कितनी होती है?
(а) 10-7
(б) 10-10
(в) 10-2
(г) 10-1
Показать ответ
Ans (a)
Sol. Чистая вода считается нейтральной, а концентрация ионов гидроксония составляет 1,0 x 10-7 моль / л, что равно концентрации гидроксид-иона.
3 кв. Шкала pH соответствует
pH स्केल किसके द्वारा दिया गया है?
(a) Аррениус /
(b) Bronsted /
(c) Сорнсен /
(d) Льюис /
Показать ответ
Ans (c)
Sol.Понятие pH было впервые введено датским химиком Сорнсеном Педером Лаурицем.
4 кв. Серная кислота —
एसिड ________ होता है
(a) Monobaisc / एकक्षारकी
(b) Diabasic / द्विक्षारकीय
(c) Tribasic /
(d) Tetrabasic / चतु: क्षारकी
Показать ответ
Ans (b)
Sol. Серная кислота является двухосновной кислотой, потому что она содержит два атома водорода, которые ионизируются в водном растворе, превращаясь в ионы 2H +.
Q5. Значение pH молока составляет
दूध का pH मान क्या है?
(а) 2,4
(б) 3,8
(в) 6,6
(г) 8,0
Показать ответ
Ans (c)
Sol. Свежее коровье молоко имеет pH от 6,7 до 6,5. Значения выше 6,7 обозначают маститное молоко, а значения pH ниже 6,5 указывают на наличие молозива или бактериального разложения. Поскольку молоко представляет собой буферный раствор, может произойти значительное кислотное образование до изменения pH.Это сделает его немного кислым.
Q6. Значение pH крови человека составляет
मानव रक्त का PH मान कितना होता है?
(а) 8,25- 8,35
(б) 7,35-7,45
(в) 4,0-4,5
(г) 6,45-6,55
Показать ответ
Ans (b)
Sol. Кровь обычно слегка щелочная, с нормальным диапазоном pH от 7,35 до 7,45.
Chem101: Лекция по общей химии 9 Кислоты и основания
Глава 14 — Кислоты и основания
Глава 14 — Кислоты и основания 14.1 Природа кислот и оснований А. Модель Аррениуса 1. Кислоты производят ионы водорода в водных растворах 2. Основания производят ионы гидроксида в водных растворах B. Bronsted-Lowry
Дополнительная информацияКислоты и основания: краткий обзор
Кислоты и: краткий обзор Кислоты: кислый вкус и вызывают изменение цвета красителей. : вкус горький и мыльный. Аррениус: кислоты увеличивают [H] основания увеличивают [OH] в растворе. Аррениус: кислотно-щелочная соленая вода.
Дополнительная информацияБЛОК (6) КИСЛОТЫ И ОСНОВАНИЯ
РАЗДЕЛ (6) КИСЛОТЫ И ОСНОВАНИЯ 6.1 Определение кислот и оснований по Аррениусу Определения кислот и оснований были предложены шведским химиком Саванте Аррениусом в 1884 году. Кислоты были определены как соединения, которые
Дополнительная информацияГлава 14: Кислоты и основания
Глава 14 Page 1 Глава 14: Кислоты и основания Свойства кислот Кислый вкус Взаимодействует с некоторыми металлами Делает синюю лакмусовую бумажку красной Взаимодействует с основаниями Некоторые обычные кислоты HCl, соляная кислота H 2 SO 4, серная кислота
Дополнительная информацияТема 8 Кислоты и основания 6 часов
Тема 8 Кислоты и основания 6 часов Ион гидроксония (h4O +) = более стабильная форма иона водорода (H +) H + + h3O h4O + 8.1 Теории кислот и оснований 2 часа 1. Аррениусовская H-X / M-OH КИСЛОТА вещество, диссоциирующее
Дополнительная информацияph: Измерение и использование
ph: Измерение и использование Одним из наиболее важных свойств водных растворов является концентрация иона водорода. Концентрация H + (или H 3 O +) влияет на растворимость неорганических и органических
Дополнительная информацияГлава 16 Кислотно-основное равновесие
Глава 16 Кислотно-основное равновесие Цели обучения и ключевые навыки: Понять природу гидратированного протона, представленного как H + (водн.) Или H 3 O + (водн.). Определить и идентифицировать кислоты и основания Арренюиса.
Дополнительная информацияГЛАВА 16: КИСЛОТЫ И ОСНОВАНИЯ
ГЛАВА 16: КИСЛОТЫ И ОСНОВАНИЯ Активное обучение: 4, 6, 14; Проблемы в конце главы: 2-25, 27-58, 66-68, 70, 75-77, 83, 90-91, 93-104 Глава 15 Проблемы в конце главы: 69-74, 125, 129 , 133 16,1 КИСЛОТ И
Дополнительная информацияТЕМА 11: Кислоты и основания
ТЕМА 11: Кислоты и основания ЭЛЕКТРОЛИТЫ — это вещества, которые при растворении в воде проводят электричество.Они проводят электричество, потому что распадутся на Ex. NaCl (ы)! Na + (водн.) + Cl — (водн.) И
Дополнительная информацияКислоты и основания HW PSI Chemistry
Кислоты и основания HW PSI Химия Название 1) Согласно концепции Аррениуса, кислота — это вещество, которое. A) способен отдавать один или несколько H + B) вызывает повышение концентрации H + в
Дополнительная информацияПредлагаемые проблемы: стр.625-627 # 58, 59, 65, 69, 74, 80, 85, 86, 90, 92, 93, 98, 99
Руководство по ускоренному изучению химии I. Глава 19 Кислоты, основания и соли ————————————- —————————————— К концу этого раздела навыки ты должен
Дополнительная информацияТема 5. Кислота и основания.
Тема 5 5-1 Кислота и основания Кислота и основания 5-2 В зависимости от того, что удобно использовать в конкретной ситуации, существует ряд определений для кислот и оснований: Аррениус и Оствальд: Теория электролита
Дополнительная информацияАвтоионизация воды
2H 2 O H 3 O + + OH Ион гидроксония гидроксид-ион В: Но как часто это происходит? Это фундаментальная концепция всей кислотно-щелочной химии. Сколько в чистой воде воды и сколько ионов?
Дополнительная информацияCHM1 Отзыв к экзамену 12
Темы Решения 1.Аррениусовы кислоты и основания a. Кислота увеличивает концентрацию H + в b. Основание увеличивает концентрацию ОН — в 2. Сильные кислоты и основания полностью диссоциируют 3. Слабые кислоты и
Дополнительная информацияКислоты и основания Бренстеда-Лоури
Кислоты и основания Бренстеда-Лоури 1 Согласно Бренстеду и Лоури, кислотно-основная реакция определяется с точки зрения переноса протона. Согласно этому определению реакция Cl в воде следующая: Cl (водн.) + Cl (водн.) +
Дополнительная информацияГлава 4 Химические реакции
Глава 4 Химические реакции I) Ионы в водном растворе. Многие реакции протекают в воде, образуют ионы в растворе водный раствор = растворенное вещество + растворенное вещество растворителя: вещество растворяется и присутствует в меньшем количестве Дополнительная информация
Кислотно-основное равновесие
AcidBaseEquil 1 Кислотно-основное равновесие См. Онлайн-заметки «Водные Ионы в химии» 1110 для обзора основ кислотно-основного состояния! Кислотно-основная реакция в водных растворах солей Напомним, что для обозначения концентрации
используйте []. Дополнительная информация4.Кислотно-основная химия
4. Кислотно-основной химический состав 4.1. Терминология: 4.1.1. Кислота Бренстеда / Лоури: «Кислота — это вещество, которое может отдавать ион водорода (H +) или протон, а основание — это вещество, которое принимает протон. B + HA
Дополнительная информацияНеобходимые материалы для чтения.
JF Chemistry 1101 2014-2015 Введение в физическую химию: кислотное основание и равновесие растворов.Школа химии профессора Майка Лайонса [email protected] Необходимые материалы для чтения. Коц, Трейхель и
Дополнительная информацияБлок второй: кислоты и основания
Раздел первый: теоретические материалы. Раздел второй: кислоты и основания. Концепция кислот и оснований существовала веками. Мы можем обсудить их двумя способами: операциональные определения и теоретические определения. 1.
Дополнительная информацияВодные ионы и реакции
Водные ионы и реакции (ионы, кислоты и основания) Demo NaCl (водн.) + AgNO 3 (водн.) AgCl (s) Два прозрачных и бесцветных раствора превращаются в мутно-белые при смешивании Demo Special Light lamp в воде, можно проверить на
Дополнительная информацияГлава 13 и 14 Практический экзамен
Имя: Класс: Дата: Глава 13 и 14 Практический экзамен Множественный выбор Определите вариант, который лучше всего завершает утверждение или отвечает на вопрос.1. Кислоты обычно выделяют газообразный H 2, когда они реагируют с a.
Дополнительная информацияСвойства кислот и оснований
Лабораторная работа 22 Свойства кислот и оснований TN Standard 4.2: Студент исследует характеристики кислот и оснований. Вы когда-нибудь чистили зубы, а затем выпивали стакан апельсинового сока? Что
Дополнительная информацияЭксперимент 16-кислоты, основания и ph
Определения кислота — ионное соединение, которое выделяет воду или вступает в реакцию с ней с образованием иона водорода (H +) в водном растворе.Они кислые на вкус и становятся красной лакмусовой бумажкой. Кислоты реагируют с некоторыми металлами, такими как цинк,
Дополнительная информация6 Реакции в водных растворах
6 Реакции в водных растворах. Вода — самая распространенная среда, в которой естественным образом протекают химические реакции. В этом нетрудно убедиться: 70% массы нашего тела состоит из воды и около 70% поверхности.
Дополнительная информацияГлава 15: Кислоты и основания
Глава 15: Кислоты и основания, кислоты и основы C h 1 5 Стр. 1 Домашнее задание: прочтите главу 15 Выполните примеры / практические упражнения в разделах, Дополнительные задачи: 39, 41, 49, 63, 67, 83, 91, 95 , 99, 107,
Дополнительная информацияКислоты и основания.Глава 16
Кислоты и основания Глава 16 Модель Аррениуса Кислота — это любое вещество, которое производит ионы водорода H + в водном растворе. Пример: когда газообразный хлористый водород растворяется в воде, следующие
Дополнительная информацияХИМИЯ II ЗАКЛЮЧИТЕЛЬНЫЙ ЭКЗАМЕН
Имя Период ХИМИЯ II ЗАКЛЮЧИТЕЛЬНЫЙ ЭКЗАМЕН Заключительный экзамен: приблизительно 75 вопросов с несколькими вариантами ответов. Раздел 12: Стехиометрия. Разделы 5 и 6: Электронные конфигурации и периодические свойства. Разделы 7 и 8: Связь. Раздел 14: Газ
. Дополнительная информация1.Прочтите P. 368-375, P. 382-387 и P. 429-436; С. 375 № 1-11 и стр. 389 № 1,7,9,12,15; С. 436 # 1, 7, 8, 11
SCh4U- РЕШЕНИЕ АКАДЕМИИ R.H.KING & РАБОЧАЯ ТАБЛИЦА КИСЛОТЫ / ОСНОВАНИЯ Название: Важность воды — УСТАНОВКА ПОДКЛЮЧЕНИЯ ЧТЕНИЕ 1. Прочтите стр. 368-375, стр. 382-387 и стр. 429-436; С. 375 № 1-11 и стр. 389 № 1,7,9,12,15; С. 436
Дополнительная информацияГлава 11: Кислоты и основания
188 Глава 11: Кислоты и основания Для наших целей кислота — это вещество, которое при растворении в воде производит ион водорода (H +).Основание — это вещество, которое при растворении образует гидроксид-ион (ОН -)
Дополнительная информацияПРИЛОЖЕНИЕ B: УПРАЖНЕНИЯ
ПРИЛОЖЕНИЕ B: УПРАЖНЕНИЯ Молекулярная масса, моль и массовый процент Относительная атомная и молекулярная масса Относительная атомная масса (A r) — это константа, которая выражает соотношение
Дополнительная информацияБанк вопросов Электролиз
Банк вопросов Электролиз 1.(а) Что вы понимаете под термином (i) электролиты (ii) неэлектролиты? (b) Составьте электролиты и неэлектролиты из следующих веществ (i) сахарный раствор
Дополнительная информацияВопросы по диагностике химии
Вопросы по диагностике химии Ответьте на эти 40 вопросов с несколькими вариантами ответов, а затем проверьте свои ответы, расположенные в конце этого документа. Если вы правильно ответили менее чем на 25 вопросов, вам необходимо
Дополнительная информацияМолекулярные модели в биологии
Молекулярные модели в биологии Цели: После этой лабораторной работы студент сможет: 1) Понимать свойства атомов, образующих связи.2) Понять, как и почему атомы образуют ионы. 3) Модель ковалентная,
Дополнительная информацияПримечания к кислотам и основаниям блока 4
Ионизация воды ДЕМОНСТРАЦИЯ ПРОВОДИМОСТИ ВОДЫ И ДИСТИЛЛИРОВАННОЙ ВОДЫ Чистая дистиллированная вода все же имеет небольшую проводимость. Почему? Присутствует несколько ионов. Почти вся чистая вода H
Дополнительная информацияОтвет в стиле кандидата
Кандидатский стиль Ответить по химии A Unit F321 Атомы, связи и группы Реакция с высокими полосами Этот буклет с вспомогательными материалами разработан вместе с OCR GCE Chemistry A Specimen Paper F321 для обучения
Дополнительная информацияPPT — Презентация PowerPoint по химическим кислотам и основаниям 11-го класса, скачать бесплатно
Назначение текстового набора Химические кислоты и основания 11-го класса Дэн Уилсон EDC 448 Осень 2012 г.
Руководящие вопросы • Что такое кислоты и основания? 2.Как кислоты и основания взаимодействуют друг с другом? 3. Каковы реальные приложения / примеры химии кислотных оснований?
Offline Texts
1. Merrill Chemistry Цитирование: Smoot, Robert C.., Richard G.. Смит, Джек Прайс и Том Руссо. Химия Меррилла: Студенческое издание. Нью-Йорк: Glencoe / McGraw-Hill, 1998. Печать. Количественный анализ. Этот учебник получил одиннадцать баллов по шкале Флеша-Кинкейда, что означает, что ученики одиннадцатых классов должны понимать его содержание.Это учебник химии для средней школы на 910 страницах. Хотя размер книги поначалу может показаться ошеломляющим, в ней есть глава о кислотах, основаниях и солях, которая начинается с определения повседневных предметов как кислот и оснований. В книге дается подробный, но понятный обзор химии кислотно-основных кислот. В книге есть четко обозначенные разделы, разъясняющие их цель. Хотя в учебнике используется научный жаргон, он четко определяет каждый незнакомый термин и содержит огромное количество изображений, таблиц, диаграмм и диаграмм, чтобы помочь читателям понять абстрактные концепции.
2. Карикатурный справочник по химии Цитирование: Гоник, Ларри и Крейг Криддл. Мультяшный справочник по химии. Нью-Йорк: Harper Resource, 2005. Печать. В этой книге есть глава, посвященная неформальному введению в кислоты и основания, краткому и смешному обзору кислотно-основных взаимодействий на атомном уровне и списку общих пар кислотно-основных конъюгатов. Иллюстрации в этой главе должны напоминать читателю комикс. Хотя они менее формальны, чем диаграммы, которые можно найти в учебнике, они все же очень информативны и относительно просты для понимания.В книге повседневные предметы называются кислотами и щелочами, что связано с предшествующей базой знаний читателя. Поскольку это не требует очень высокого уровня предварительных знаний, отрывки из этой книги будут хорошо работать в качестве случайного введения в тему кислот и оснований.
3. Weird Chemistry: Kitchen Creations Образец цитирования: Wetterschneider, Molly F. Weird Chemistry: Kitchen Creations. Чикаго: Группа Райт / Макгроу-Хилл, 2005. Печать. Этот учебник написан для младших классов, но на примерах дает определения кислот, оснований и нейтральных химикатов.Хотя начинающие читатели этого не заметят, в книге фактически представлены различные уровни шкалы pH, метод классификации химических веществ, который имеет отношение к кислотам и основаниям, но иногда бывает трудно понять. Хотя эту цель нелегко определить, знания, полученные из этого текста, послужат хорошей справочной информацией в будущем. В книге приводятся повседневные примеры кислот, оснований и нейтральных химикатов, которые известны читателям. Несмотря на то, что текст написан намного ниже школьного уровня и не содержит большого количества технической лексики, информация о кислотах и щелочах может послужить удобным введением в предмет, прежде чем читателей попросят понять гораздо более сложный учебник.Использование этой книги также принесет пользу членам класса с более низким уровнем чтения, чем их сверстники.
Онлайн-тексты
1. URI Chemistry Dept: Titration Video Цитата: Geldart, Sue. «Эксперимент 4: Проведение титрования». УНИИ кафедры химии. Университет Род-Айленда, без даты Интернет.
2. NSF / ACS ChemEd DL Образец цитирования: «Добро пожаловать! Изучите химию с ChemEd DL». Добро пожаловать в электронную библиотеку химического образования. Национальный научный фонд, Американское химическое общество и т. Д., 2012. Web.
3. Khan Academy: Кислотно-основное титрование В этом видео от Khan Academy зритель проходит через всю проблему кислотно-основного титрования, четко объясняя каждый этап и его причину. В видео используется техническая терминология, которая может показаться некоторым зрителям натянутой, но сделана это логично и таким образом, чтобы зрители могли легко следить за поиском решения проблемы. Хронологический порядок шагов, показанный в этом видео, служит отличным примером для студентов.Цель видео проясняется заранее, и рассказчик дает точное и информативное объяснение своих письменных шагов. Различение цветного текста делает объяснение шагов решения более легким для понимания, а ожидания фоновых знаний от видео являются разумными. Образец цитирования: «Титрование кислотной основы». Ханская академия. Хан Академия, 2012. Интернет.
4.The New York Times: Ocean Acidification Образец цитирования: Беддингтон, Джон и Джейн Любченко. «Кислотный тест на морскую жизнь». Нью-Йорк Таймс. The New York Times, 18 июня 2012 года. Интернет.
5. Кислотно-основное слайд-шоу Образец цитирования: «Кислотно-основная химия». Бриджуотерский государственный университет, 7 июня 2009 г.Интернет.
6. Университет Пердью: Руководство по проблемам титрования Образец цитирования: «Кислотно-основное титрование». Химическое образование Университета Пердью. Университет Пердью, 2011. Интернет.
Бойцовский клуб (1999) Образец цитирования: Бойцовский клуб. Реж. Дэвид Финчер. Perf. Брэд Питт и Эдвард Нортон. Fox 2000 Pictures, 1999. В этом фильме с Брэдом Питтом и Эдвардом Нортоном в главных ролях один персонаж перекладывает чрезвычайно опасную основу на руку другого. Основа, щелок, используется в процессах мыловарения, подобных тому, что обсуждается в фильме.Я бы не стал показывать весь фильм своему классу, но подумал бы о том, чтобы показать им этот клип. Мой школьный учитель химии показал его моему классу, и я помню, как он нашел отклик у нас как «крутой» пример для понимания химии. Тогда наш класс больше интересовался кислотами и основаниями; нас даже интересовала химия мыловарения. Показ такого отрывка из фильма — хороший способ связать текст с предметом культурно; многие старшеклассники уже видели этот фильм и признают его элементом популярной культуры.Если возможно, хорошо иметь некоторый уровень культурной связи между учениками и материалом, чтобы класс действительно мог принять участие.
Карточки для обзора экзамена по химии 11 класс
Через много экспериментов Джозеф Томсон сделал открытие, что водород на самом деле не самая маленькая единица материи, а эти частица или электроны как…
Нильс Бор учился у Эрнеста Резерфорда. Нильс Бор использовал комбинацию описания ядра Резерфорда и современной теории квантов, чтобы помочь …
Атом меди имеет атомный номер 29, что означает, что он также имеет 29 протонов и 29 электронов.Он расположен в блоке d периодической таблицы Менделеева, где …
Также добавляли тиосульфат натрия и соляную кислоту. Продукт собирают вакуумной фильтрацией и перекристаллизовывают из 96% этанола. ИК- и H- ЯМР-спектр …
IV.МЕТОДОЛОГИЯ ЗНАЧЕНИЕ САПОНИФИКАЦИИ Омыление — это метод, используемый для обработки нейтрального жира щелочью, разлагая его на глицерин и жирные кислоты. В …
Введение Давление пара — это давление пара (газа) в состоянии равновесия; равновесие возникает, когда нет чистого изменения между количеством жидкости и…
Освободившись, он вернулся в Англию, чтобы работать с Эрнестом Резерфордом в Кавендишской лаборатории в Кембридже. Вместе они были неудержимым дуэтом, …
Уксус для титрования гидроксидом натрия (NaOH) Введение Кислоты — это анионы, у которых есть по крайней мере один катион водорода, прикрепленный к их молекулярной формуле.Чт …
Хотя он добавил одно предположение относительно электронов. Бор предположил, что электроны могут вращаться вокруг ядра только по определенным орбитам или оболочкам с фиксированным …
Всего было 1.2, что означает, что соединение представляет собой полярную ионную связь из-за разницы в его электроотрицательности.

 С. Габриелян онлайн
С. Габриелян онлайн