Строение электронных оболочек атома
Быть может, эти электроны –
Миры, где пять материков,
Искусство, знания, войны, троны
И память сорока веков.
Вспомним, из чего состоит атом. Помните планетарную модель строения атома, согласно которой, в центре атома расположено положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны, подобно тому, как вращаются планеты вокруг Солнца.
Строение атома
Электроны, двигаясь вокруг ядра, в совокупности образуют электронную оболочку атома. Число электронов в атоме равно числу протонов в ядре и соответствует порядковому номеру элемента.
Электроны
двигаются в определённом порядке и различаются своей энергией.
Электроны с маленьким запасом энергии расположены ближе к ядру, они связаны
крепко с ядром и их тяжелее вырвать из электронной оболочки.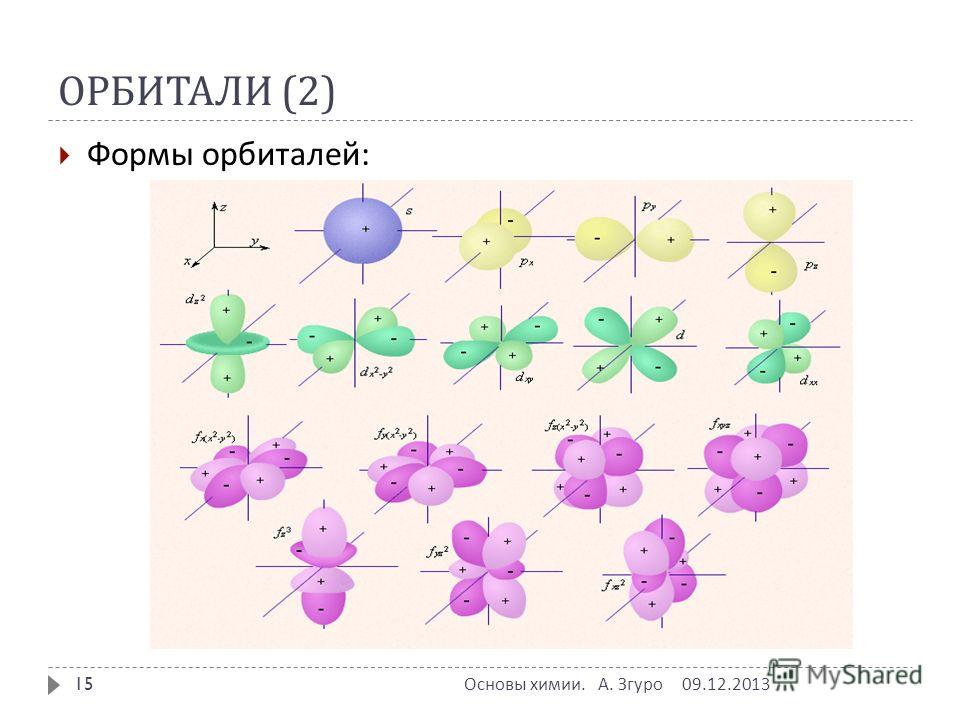
Несмотря на это, в атоме находятся электроны, которые имеют близкие значения энергии. Эти электроны образуют электронные слои, или энергетические уровни.
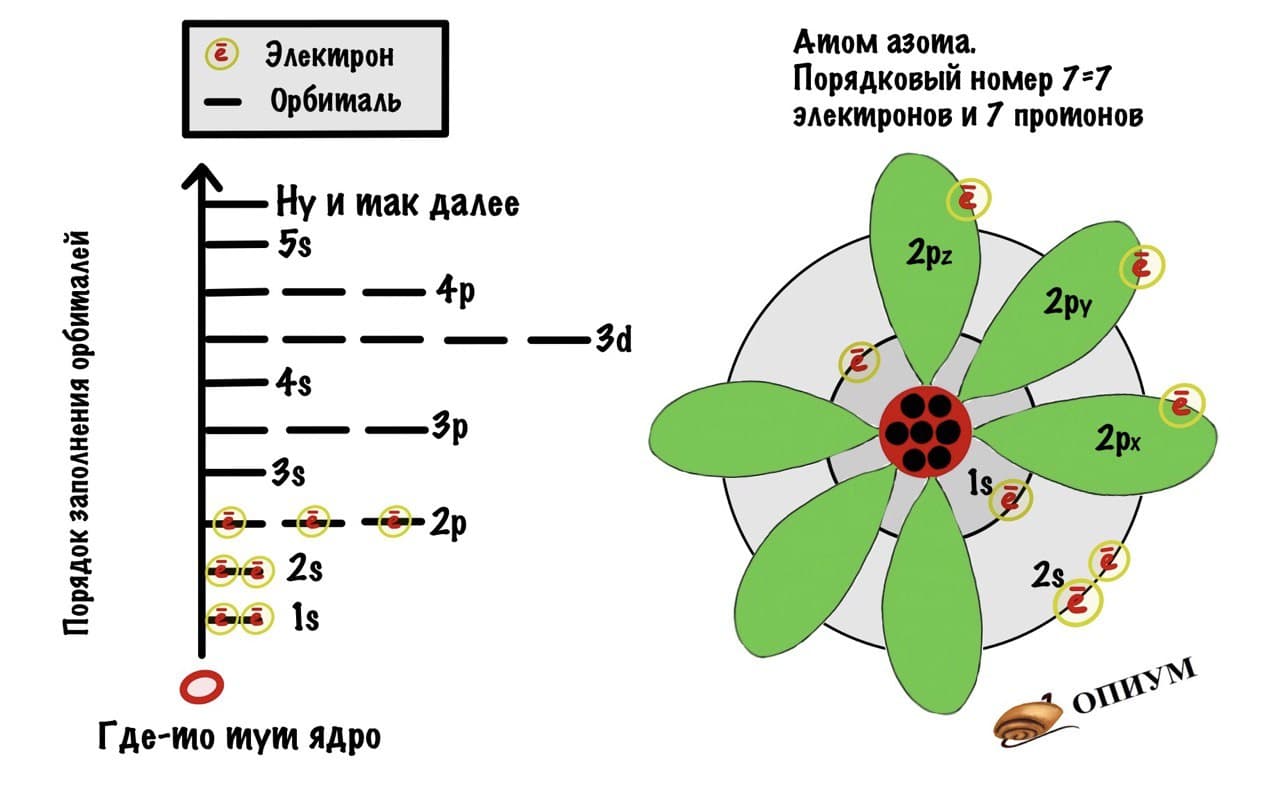
Чтобы определить число энергетических уровней, достаточно знать номер периода, в котором находится данный элемент. Например, у азота семь электронов в атоме, и два энергетических уровня. Теперь распределим эти семь электронов по уровням. Получается на первом их 2, а на втором – оставшиеся 5.
Максимальное число электронов на энергетическом уровне определяется по формуле: 2n2, где n – номер периода.
Если
подставить значения первых трех периодов, то получится, что максимально на
первом энергетическом уровне возможно только 2 электрона, на втором – 8, на
третьем – 18.
Число электронов на внешнем энергетическом уровне для элементов главных подгрупп равно номеру группы.
Рассмотрим это на примере атома натрия.
Ядро атома натрия имеет
И так, на первом уровне 2 электрона (это максимально), на втором – 8 (больше быть не может), а на третий остается один электрон. Вот этот электрон и будет электроном внешнего энергетического уровня. Натрий – элемент главной подгруппы I группы, поэтому число электронов на внешнем уровне равно номеру группы
Двигаясь,
электроны образуют своеобразный рисунок, так называемое электронное облако,
которое можно ещё назвать орбиталью. Электронное облако, или орбиталь, –
пространство вокруг ядра, где наиболее вероятно нахождение данного электрона.
Электронное облако, или орбиталь, –
пространство вокруг ядра, где наиболее вероятно нахождение данного электрона.
На всех энергетических уровнях есть s-орбитали, они сферической формы, и она только одна, на втором уровне уже появляются p-орбитали, которые имеют форму гантели, их всего три. На каждой орбитали максимально может находится не более двух электронов, следовательно, на s-орбитали – их два, на р-орбитали – шесть.
Для того, чтобы записать электронную формулу атома, для обозначения уровня используют арабские цифры, орбитали соответственно буквами s и р, а число электронов данной орбитали – арабской цифрой сверху справа над буквой орбитали.
Например, азот будет иметь электронную формулу 1s22s22p3.
Если
элементы имеют одинаковое число электронов на внешнем уровне, значит, у них
будут схожие свойства.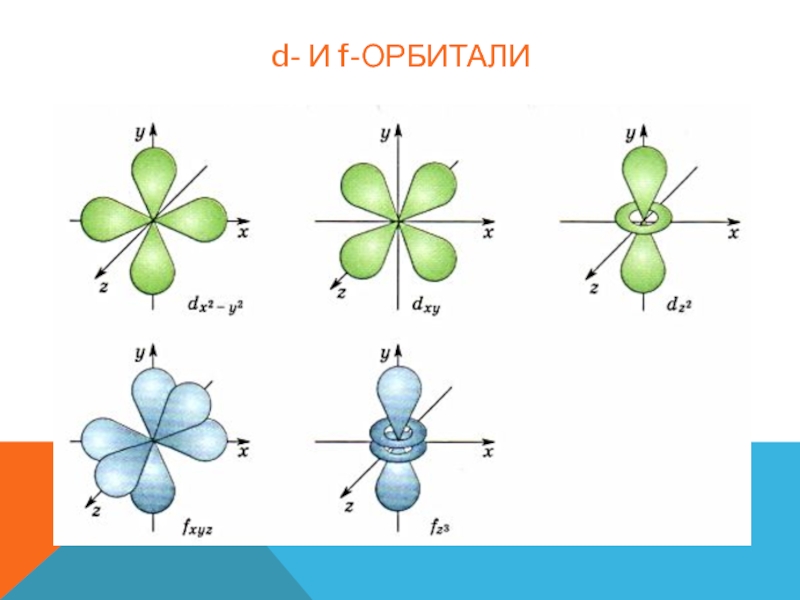
|
Презентация «Строение атома» 8 класс, химия
библиотека
материалов
Содержание слайдов
Основные сведения о строении атома. Автор: Пермякова Марфа Александровна. Преподаватель химии и биологии. ГБПОУ РС(Я) «Жатайский техникум»
Автор: Пермякова Марфа Александровна. Преподаватель химии и биологии. ГБПОУ РС(Я) «Жатайский техникум»
ядроатомэлектронынейтроныпротоны
Номер слайда 3
Электронная оболочка атома – совокупность всех электронов в атоме Электроны, обладающие близкими значениями энергии, образуют единый электронный слой(энергетический уровень)= номеру периода Электронное облако (атомная орбиталь, энергетический подуровень) — пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона валентные электроны – количество электронов, находящиеся на внешней (валентной) оболочке атома= номеру группы
Номер слайда 5
Число p+ равно порядковому номеру химического элемента, электрону, заряду ядра Число ē порядковому номеру химического элемента, протону, заряд ядра Число n° N = A – Z (массовое число минус порядковый номер химического элемента) p+=6№=6e=6 Z= 6e=14№=14p=14 Z= 14 N= 9-4=5
Номер слайда 6
Графически любая орбиталь изображается в виде клетки (квантовой ячейки):
Номер слайда 7
Номер слайда 8
Определите заряд ядра, атомную массу, количество электронов, протонов и нейтронов
Номер слайда 9
Номер слайда 10
3s12p62s21s2+11218sspspd1s22s23s12p6
Номер слайда 11
Неспаренные электроны. Валентные электроны
Валентные электроны
Строение электронных оболочек атомов — презентация онлайн
2. Строение электронных оболочек атомов
Задачи урока:1) Познакомиться со строением
электронных оболочек атомов
2) Научиться составлять схемы
строения электронных
оболочек
3. Соотнесите химические формулы и формы существования химических элементов
1) 2S
2) S8
3) 3h3O
4) Al2O3
5) 2Al
6) CuO
1
2
3
3
1
3
• 1) свободные
атомы
• 2) простые
вещества
• 3) сложные
вещества
4. Энергетический уровень (электронный слой) – это…
1+4
Be ) )
2 2
Be 2e, 2e
5. Число энергетических уровней = номеру периода
Максимальное число электронов науровне = 2 n2
1 уровень – 2 электрона
2 уровень – 8 электронов
Завершенный
уровень -…
3 уровень – 18 электронов
Максимальное число электронов на внешнем
уровне — 8
6.
 Запишите схемы строения электронных оболочек атомов: углерода, азота,кислорода, фтора. • Соотнесите число электронов на
Запишите схемы строения электронных оболочек атомов: углерода, азота,кислорода, фтора. • Соотнесите число электронов навнешнем уровне и номер группы
Число электронов на внешнем
уровне равно номеру группы
7. Повторение
1. Электроны в атомах располагаются …2. Электроны одного энергетического уровня
имеют примерно одинаковый …
3. Число уровней равно ….
4. Максимальное число электронов на уровне =
…
5. Уровень, содержащий максимальное
количество электронов называют …
6. Завершенный внешний уровень содержит
….. электронов
7. Число электронов на внешнем уровне = …
8. Электронная облако. Электронная орбиталь
+S — орбиталь
9. Электронная орбиталь
Р — орбиталь10. Электронная орбиталь
Р — орбитали11. На одной орбитали не может находится более 2 электронов
• Количество орбиталей на уровняхравно номеру уровня.
1 уровень – S — орбиталь
2 уровень – S, P — орбитали
12.
 Электронные формулы
Электронные формулы H )1
He )2
C )2 )4
O
F
Na
1S1
1S2
1S2 2S22P2
13. Повторение
1. Пространство вокруг ядра атома ,гденаиболее вероятно нахождение
электрона называют ….
2. S и P – орбитали различаются ….
3. Каждый уровень начинается …
орбиталью
4. На S – орбитали может находиться ….
электрона, на Р – орбиталях — ….
Электронов
5. Объясните, что обозначают цифры и
буквы в записи: 1S2 2S22P2
• По положению в Периодической
таблице определите: а) что лучший
окислитель — сера или фосфор? б) У
селена или у мышьяка лучше выражены
металлические свойства?
• Возрастают или уменьшаются
восстановительные свойства
элементов в ряду Li-Na-K-Rb-Cs?
Движение электронов в атоме. Электронные орбитали — Учебник по Химии. 8 класс. Григорович
Учебник по Химии. 8 класс. Григорович — Новая программа
Вспомните: как определить состав атомов и свойства субатомных частиц (§ 9).
Двойственность поведения электрона
Частицы с такими малыми размерами, как у электрона, обладают уникальными свойствами, отличающими их от обычных тел, с которыми мы сталкиваемся в повседневной жизни. В 1923 г. выдающийся французский физик Луи де Бройль установил, что электрон одновременно проявляет свойства и частицы и волны, т. е. имеет двойственную природу. Подобно другим частицам, электрон имеет определенную массу и заряд. Наряду с этим во время движения электрон проявляет волновые свойства. Волна отличается от частицы тем, что ее положение в пространстве в определенный момент времени нельзя точно определить.
В связи с этим для электрона невозможно одновременно определить скорость движения и направление. Если мы знаем направление движения электрона, то нельзя определить его скорость, и наоборот. Поэтому невозможно рассчитать траекторию движения электрона в атоме. Этот принцип впервые определил немецкий ученый В. Гейзенберг.
Таким образом, планетарная модель атома Резерфорда не в полной мере соответствует действительности в том, что электрон вращается вокруг ядра по определенной орбите. Для электрона понятие «траектория» применять вообще нельзя. Можно лишь утверждать, что в определенной точке пространства существует определенная вероятность пребывания электрона.
Для электрона понятие «траектория» применять вообще нельзя. Можно лишь утверждать, что в определенной точке пространства существует определенная вероятность пребывания электрона.
Понятие об орбиталях
Попробуйте ответить на вопрос: «Где во время футбольного матча находится вратарь?». Ответ «в воротах» не совсем соответствует действительности. Вратарь постоянно перемещается в пределах определенного пространства около ворот. Наиболее вероятное его место — непосредственно у ворот, с меньшей вероятностью его можно найти в середине поля и еще меньше вероятность, что он будет в воротах противника. И почти невероятно обнаружить вратаря на трибунах болельщиков во время матча. Таким образом, если следы от обуви вратаря обозначить на условной схеме, то получим изображение, как на рисунке 11.1. Можно сказать, что следы вратаря образуют «облако» вокруг ворот. Там, где плотность «облака» наибольшая, там вратарь находится чаще всего, а там, где он находится редко, — «облако» разрежено.
Рис. 11.1. Если точками отметить следы вратаря, то наибольшая вероятность его пребывания — орбиталь — будет около ворот
Так и электрон в атоме находится не в конкретной точке, а образует во время движения электронное облако, плотность которого (электронная плотность) показывает, в каких местах электрон находится чаще, а в каких — реже. Если бы у нас была возможность отмечать след электрона в пространстве, то для атома Гидрогена получили бы облако, как на рисунке 11.2. Ту часть электронного облака, в которой электрон находится больше всего, т. е. в которой электронная плотность большая, называют атомной орбиталью. Если продолжить аналогию с перемещением вратаря во время матча, то «орбиталь» вратаря — это место около ворот (рис. 11.1). Атомная орбиталь — это часть пространства, где вероятнее всего находится электрон.
Рис. 11.2. Электронное облако в атоме Гидрогена
Орбиталь — это часть пространства, где вероятность пребывания электрона выше 90 %.
Электронные облака, образованные отдельными электронами в атоме, вместе образуют общее электронное облако атома — электронную оболочку.
Разновидности электронных орбиталей
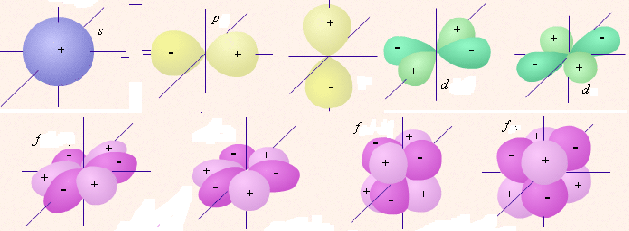
Обычно электронную оболочку атомов образует не один электрон. Их может быть до нескольких десятков и даже около сотни. Они не могут располагаться на одной орбитали. Поэтому в большинстве атомов электроны находятся на разных орбиталях, среди которых выделяют четыре типа. Каждый тип орбиталей характеризуется разными свойствами, в частности, они имеют разную форму.
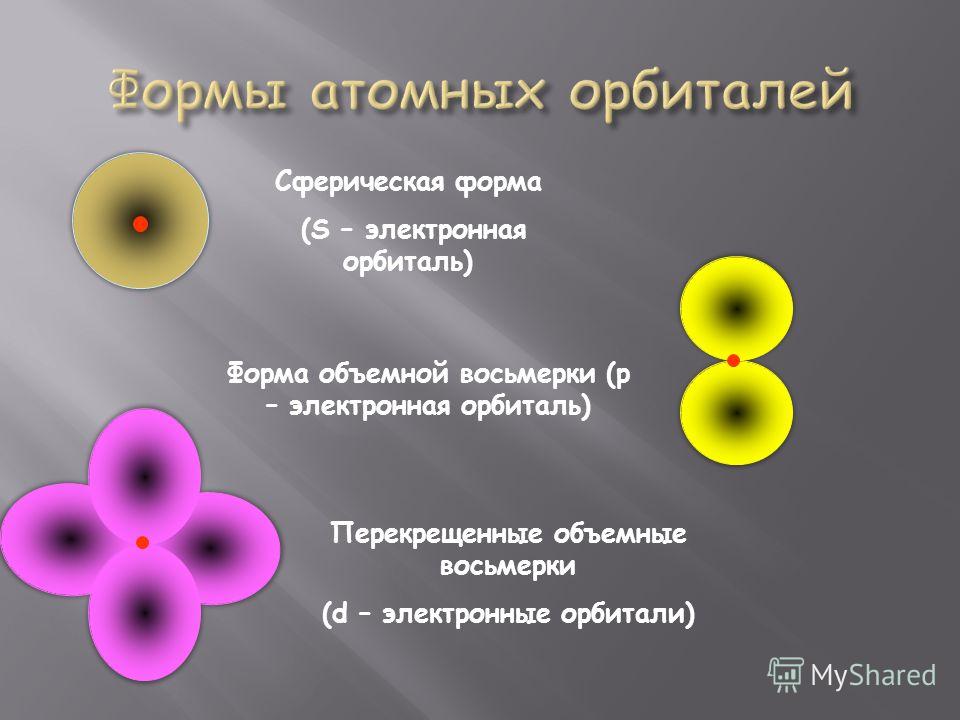
Орбитали разной формы обозначают разными буквами: s, р, d и f.
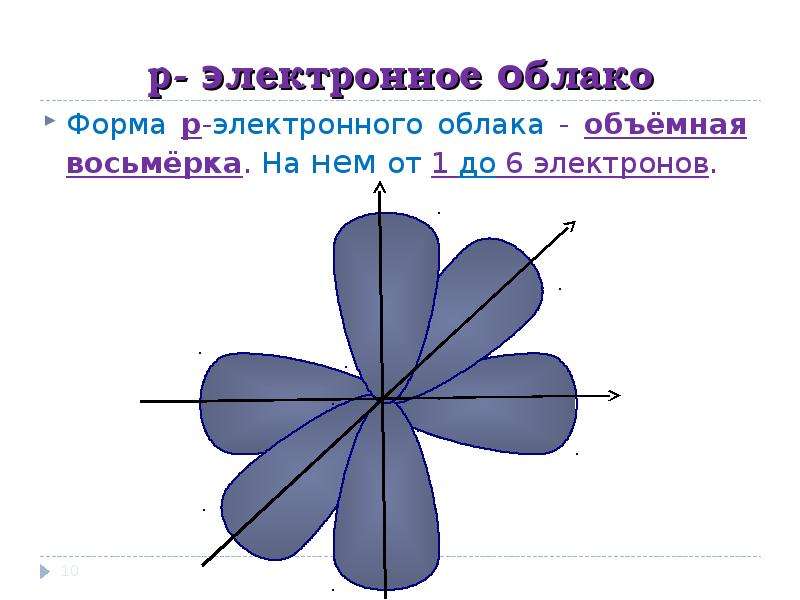
s-Орбитали имеют форму шара (рис. 11.3а, с. 58), иначе говоря, электрон, который находится на такой орбитали (его называют s-электроном), большую часть времени находится внутри сферы. р-Орбитали имеют форму объемной восьмерки (рис. 11.3б). Формы d- и f-орбиталей намного сложнее (рис. 11.3в-е).
Рис. 11.3. Атомные орбитали: а — s-орбиталь; б — р-орбиталь; в и г — разные виды d-орбиталей; д и е — разные виды f-орбиталей
Как узнали о формах орбиталей? Конечно, орбиталь увидеть невозможно ни невооруженным глазом, ни при помощи современных приборов. Орбиталь — это лишь часть пространства. А как можно увидеть пространство? Так же невозможно увидеть и электрон, который находится в пределах орбитали. О форме орбиталей мы знаем благодаря математическим методам моделирования движения частиц. В 1926 г. австрийский физик Эрвин Шредингер вывел фундаментальное уравнение (уравнение Шредингера), описывающее движение электрона в атоме, которое позволило определить вероятность пребывания электрона в той или иной части пространства, а следовательно, и определить форму орбиталей. Открытие Шредингера было одной из предпосылок возникновения квантовой химии, которая изучает строение электронных оболочек атомов и молекул.
Орбиталь — это лишь часть пространства. А как можно увидеть пространство? Так же невозможно увидеть и электрон, который находится в пределах орбитали. О форме орбиталей мы знаем благодаря математическим методам моделирования движения частиц. В 1926 г. австрийский физик Эрвин Шредингер вывел фундаментальное уравнение (уравнение Шредингера), описывающее движение электрона в атоме, которое позволило определить вероятность пребывания электрона в той или иной части пространства, а следовательно, и определить форму орбиталей. Открытие Шредингера было одной из предпосылок возникновения квантовой химии, которая изучает строение электронных оболочек атомов и молекул.
Эрвин Шредингер (1887-1961)
Австрийский физик, лауреат Нобелевской премии по физике 1933 г. Родился в Вене в семье фабриканта. Среднее образование получил дома, в 1906 г. поступил в Венский университет, а уже через четыре года защитил докторскую диссертацию. Свои исследования проводил в области общей теории относительности, статистической механики, теории цвета. Наибольший вклад внес в квантовую механику, сформулировав волновую функцию (уравнение Шредингера), которое описывает поведение микрочастиц — электронов, протонов, атомов и др. Это открытие стало мощным толчком в развитии теоретической физики и химии.
Наибольший вклад внес в квантовую механику, сформулировав волновую функцию (уравнение Шредингера), которое описывает поведение микрочастиц — электронов, протонов, атомов и др. Это открытие стало мощным толчком в развитии теоретической физики и химии.
Выводы
1. Электрон имеет двойственную природу: он одновременно проявляет свойства и частицы, и волны. Поэтому при определении положения электронов в атоме используют понятие об орбитали как части пространства, где пребывание электрона наиболее вероятно.
2. Различают четыре типа орбиталей: s, р, d и f.
Контрольные вопросы
1. Какое особое свойство электрона отличает его от обычных физических тел?
2. В чем заключается двойственная природа электрона?
3. Что называют: а) электронным облаком; б) атомной орбиталью?
4. Какую форму имеют s- и р-орбитали?
Задания для усвоения материала
1. Чем отличаются s-орбитали и р-орбитали?
2. Как вы считаете, благодаря каким взаимодействиям электроны притягиваются к ядру и отталкиваются друг от друга?
Как вы считаете, благодаря каким взаимодействиям электроны притягиваются к ядру и отталкиваются друг от друга?
3. Как вы считаете, почему у атомных орбиталей именно такая форма? Чем это обусловлено?
Электронная конфигурация атома — Электронный учебник K-tree
Электронная конфигурация атома — это формула, показывающая расположение электронов в атоме по уровням и подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали
одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему.
Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину.
Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо
изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Например, кислород рядом с водородом может превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину.
Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо
изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов — 16й элемент периодической системы. Золото имеет 79 протонов — 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин «орбиталь», орбиталь — это волновая функция электрона, грубо — это область, в которой электрон проводит 90% времени.
N — уровень
L — оболочка
Ml — номер орбитали
Ms — первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии, облако принимает четыре основных формы: шар, гантели и другие две, более сложные. В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой. На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f) орбиталей. Орбитальное квантовое число — это оболочка, на которой находятся орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно принимает значения 0,1,2 или 3.
На s-оболочке одна орбиталь (L=0) — два электрона
На p-оболочке три орбитали (L=1) — шесть электронов
На d-оболочке пять орбиталей (L=2) — десять электронов
На f-оболочке семь орбиталей (L=3) — четырнадцать электронов
Магнитное квантовое число m
l На p-оболочке находится три орбитали, они обозначаются цифрами
от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали «-1», «0» и «1». Магнитное квантовое число обозначается буквой ml.
Магнитное квантовое число обозначается буквой ml.
Внутри оболочки электронам легче располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять электронов заполняют оболочку принимая значения Ml=-2,Ml=-1,Ml=0, Ml=1,Ml=2.
Спиновое квантовое число m
sСпин — это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с противоположными спинами. Спиновое квантовое число обозначается ms
Главное квантовое число n
Главное квантовое число — это уровень энергии, на данный момент известны семь энергетических уровней,
каждый обозначается арабской цифрой: 1,2,3,. ..7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
..7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
Номер электрона
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0, магнитное квантовое число может принять только одно значение, Ml=0 и спин будет равен +1/2. Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут: N=2, L=1, M=-1, спин 1/2.
Энергетические уровни с подуровнями для наглядности изображены ниже, сверху вниз расположены уровни и цветом разделены подуровни:
Здесь, сверху-вниз показаны энергетические уровни (1-7), слева-направо разделены по группам электронные
подуровни (s,p,d,f), в каждой ячейке располагаются по два электрона в противоположных направлениях. Общий
принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного
и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то
сначала заполняется уровень с меньшим главным квантовым числом N.
Общий
принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного
и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то
сначала заполняется уровень с меньшим главным квантовым числом N.
У некоторых элементов имеются отклонения в формировании электронной конфигурации, а именно у 24Cr, 29Cu, 41Nb, 42Mo, 44Ru, 45Rh, 46Pd, 47Ag, 78Pt, 79Au
You need to enable JavaScript to run this app.Проверьте себя, составьте электронную конфигурацию для элементов #6, #9 и #22, затем проверьте себя по таблице ниже.
| № | Элемент | Название | Электронная конфигурация | Энергетических уровней |
|---|---|---|---|---|
| 1 | H | водород | 1s 1 | 1 |
| 2 | He | гелий | 1s 2 | 1 |
| 3 | Li | литий | 1s 22s 1 | 2 |
| 4 | Be | бериллий | 1s 22s 2 | 2 |
| 5 | B | бор | 1s 22s 22p 1 | 2 |
| 6 | C | углерод | 1s 22s 22p 2 | 2 |
| 7 | N | азот | 1s 22s 22p 3 | 2 |
| 8 | O | кислород | 1s 22s 22p 4 | 2 |
| 9 | F | фтор | 1s 22s 22p 5 | 2 |
| 10 | Ne | неон | 1s 22s 22p 6 | 2 |
| 11 | Na | натрий | 1s 22s 22p 63s 1 | 3 |
| 12 | Mg | магний | 1s 22s 22p 63s 2 | 3 |
| 13 | Al | алюминий | 1s 22s 22p 63s 23p1 | 3 |
| 14 | Si | кремний | 1s 22s 22p 63s 23p2 | 3 |
| 15 | P | фосфор | 1s 22s 22p 63s 23p3 | 3 |
| 16 | S | сера | 1s 22s 22p 63s 23p4 | 3 |
| 17 | Cl | хлор | 1s 22s 22p 63s 23p5 | 3 |
| 18 | Ar | аргон | 1s 22s 22p 63s 23p6 | 3 |
| 19 | K | калий | 1s 22s 22p 63s 23p64s 1 | 4 |
| 20 | Ca | кальций | 1s 22s 22p 63s 23p64s 2 | 4 |
| 21 | Sc | скандий | 1s 22s 22p 63s 23p64s 23d1 | 4 |
| 22 | Ti | титан | 1s 22s 22p 63s 23p64s 23d2 | 4 |
| 23 | V | ванадий | 1s 22s 22p 63s 23p64s 23d3 | 4 |
| 24 | Cr | хром | 1s 22s 22p 63s 23p64s 13d5 | 4 |
| 25 | Mn | марганец | 1s 22s 22p 63s 23p64s 23d5 | 4 |
| 26 | Fe | железо | 1s 22s 22p 63s 23p64s 23d6 | 4 |
| 27 | Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 | 4 |
| 28 | Ni | никель | 1s 22s 22p 63s 23p64s 23d8 | 4 |
| 29 | Cu | медь | 1s 22s 22p 63s 23p64s 13d10 | 4 |
| 30 | Zn | цинк | 1s 22s 22p 63s 23p64s 23d10 | 4 |
| 31 | Ga | галлий | 1s 22s 22p 63s 23p64s 23d104p1 | 4 |
| 32 | Ge | германий | 1s 22s 22p 63s 23p64s 23d104p2 | 4 |
| 33 | As | мышьяк | 1s 22s 22p 63s 23p64s 23d104p3 | 4 |
| 34 | Se | селен | 1s 22s 22p 63s 23p64s 23d104p4 | 4 |
| 35 | Br | бром | 1s 22s 22p 63s 23p64s 23d104p5 | 4 |
| 36 | Kr | криптон | 1s 22s 22p 63s 23p64s 23d104p6 | 4 |
| 37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 | 5 |
| 38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 | 5 |
| 39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 | 5 |
| 40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 | 5 |
| 41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 | 5 |
| 42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 | 5 |
| 43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 | 5 |
| 44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 | 5 |
| 45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 | 5 |
| 46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p64d10 | 5 |
| 47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 | 5 |
| 48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 | 5 |
| 49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 | 5 |
| 50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 | 5 |
| 51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s24d105p3 | 5 |
| 52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 | 5 |
| 53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 | 5 |
| 54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 | 5 |
| 55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 | 6 |
| 56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 | 6 |
| 57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 | 6 |
| 58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 | 6 |
| 59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 | 6 |
| 60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 | 6 |
| 61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 | 6 |
| 62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 | 6 |
| 63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 | 6 |
| 64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 | 6 |
| 65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 | 6 |
| 66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 | 6 |
| 67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 | 6 |
| 68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 | 6 |
| 68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 | 6 |
| 70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 | 6 |
| 71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 | 6 |
| 72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 | 6 |
| 73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 | 6 |
| 74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 | 6 |
| 75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 | 6 |
| 76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 | 6 |
| 77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 | 6 |
| 78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 | 6 |
| 79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 | 6 |
| 80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 | 6 |
| 81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 | 6 |
| 82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 | 6 |
| 83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 | 6 |
| 84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 | 6 |
| 85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 | 6 |
| 86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 | 6 |
| 87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 | 7 |
| 88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 | 7 |
| 89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 | 7 |
| 90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 | 7 |
| 91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 | 7 |
| 92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 | 7 |
| 93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 | 7 |
| 94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 | 7 |
| 95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 | 7 |
| 96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 | 7 |
| 97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 | 7 |
| 98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 | 7 |
| 99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 | 7 |
| 100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 | 7 |
| 101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 | 7 |
| 102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 | 7 |
| 103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 | 7 |
| 104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 | 7 |
| 105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 | 7 |
| 106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 | 7 |
| 107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 | 7 |
| 108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 | 7 |
| 109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 | 7 |
| 110 | Ds | дармштадтий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d8 | 7 |
| 111 | Rg | рентгений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d9 | 7 |
| 112 | Cn | коперниций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d10 | 7 |
| 113 | Nh | нихоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p1 | 7 |
| 114 | Fl | флеровий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p2 | 7 |
| 115 | Mc | московий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p3 | 7 |
| 116 | Lv | ливерморий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p4 | 7 |
| 117 | Ts | теннесcин | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p5 | 7 |
| 118 | Og | оганесон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p6 | 7 |
Таблица 2. Электронная конфигурация атомов Электронная конфигурация атомов | ||||
Если Вы хотите узнать, как составить электронную конфигурацию, обратитесь к статье «как написать электронную конфигурацию»
Квантовые числа электронов в атомахХимические элементы и вещества в свете электронной теории. Строение атомов и молекул 8 класс онлайн-подготовка на
Строение атомов и молекул
Атомы — это мельчайшие неделимые частицы, из которых состоит вещество.
Ядро атома состоит из частиц, которые он назвал протонами и нейтронами. Протоны и нейтроны имеют сложное строение и состоят из кварков. Они сосредоточены в ядре, чья масса составляет около 99,97% от массы атома. Радиус атома, как правило, составляет несколько ангстрем (1010 м), радиус ядра в 10 000 раз меньше радиуса самого атома.
Большую часть объема атома занимает пустое пространство между элементарными частицами. Отрицательно заряженные электроны удерживаются на своих энергетических уровнях силой притяжения к положительно заряженным протонам ядра.
Есть в атоме и другие элементарные частицы — электроны; они вращаются вокруг ядра.
Электрон — главная элементарная частица в химии, благодаря обмену электронами могут образовываться новые химические соединения.
Электрон имеет двойственную природу. С одной стороны, обладая малой массой, электрон проявляет свойства частицы.
С другой стороны, электрон движется с такой высокой скоростью, что фактически «размазан» по атому, он находится не в одной конкретной точке, а образует «электронное облако». В этой области пространства электронная плотность достаточно велика. Этим объясняются волновые свойства электрона.
Для потока электронов, как и для световых волн, характерны явления интерференции (наложения) и дифракции (огибание препятствия).
Электронное облако или атомная орбиталь — это область пространства, в которой вероятность нахождения электрона максимальна.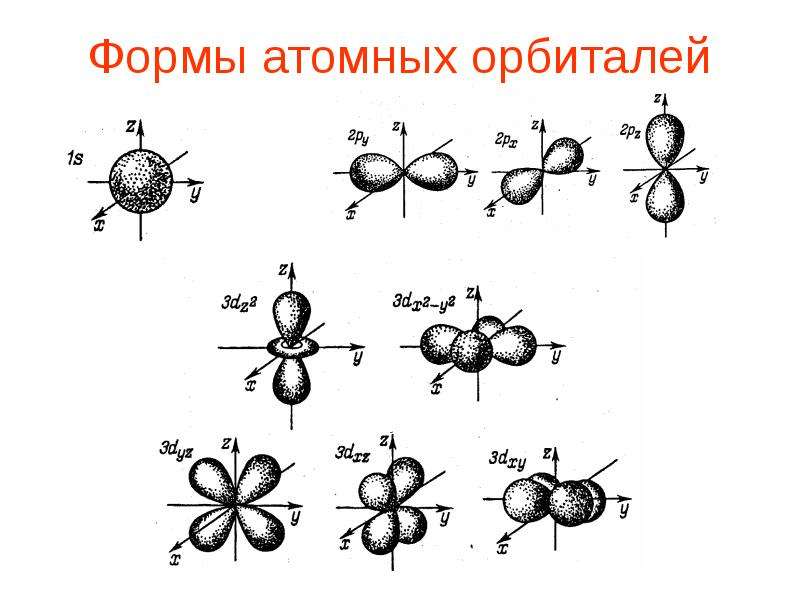
Электронные орбитали имеют определенную форму и энергию.
Правила при заполнении орбиталей электронами
● Принцип минимума энергии.
● Принцип Паули: на каждой орбитали может находиться не более двух электронов.
● Правило Хунда (Гунда): атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
У большинства элементов существуют изотопы (совокупность атомов одного химического элемента с различным массовым числом), атомы которых имеют несколько отличное строение. Количество протонов и электронов в атомах изотопов одного элемента всегда неизменно. Атомы изотопов различаются числом нейтронов в ядре. Следовательно, у всех изотопов одного элемента один и тот же атомный номер, но разная атомная масса.
Атомы редко встречаются и свободном состоянии. Как правило, они связываются друг с другом и образуют молекулы либо другие, более массивные структуры.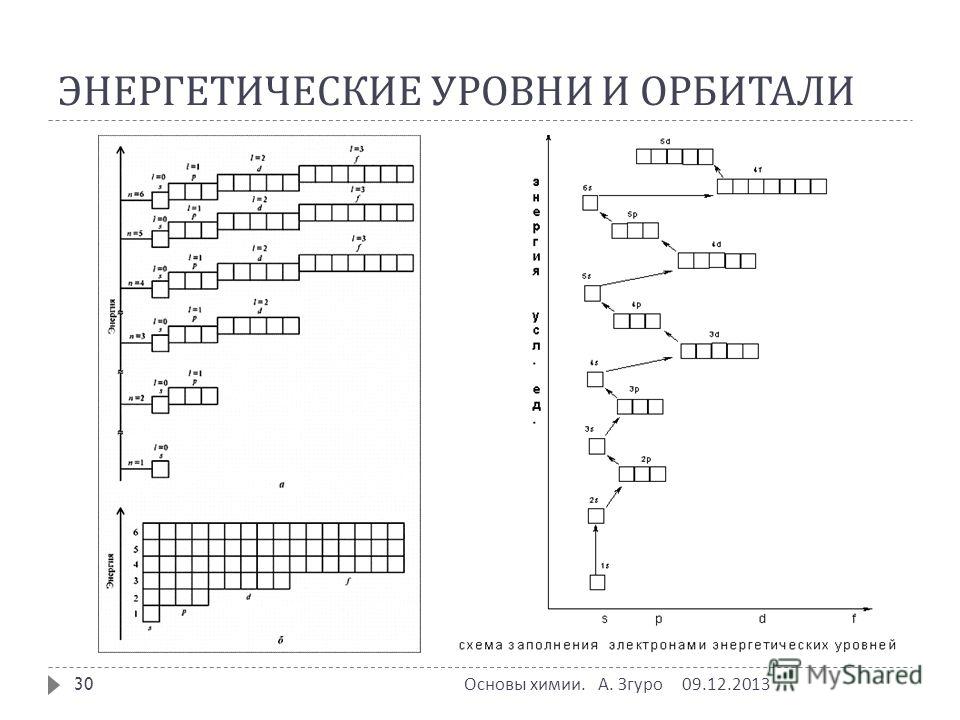
В современной химии молекула – мельчайшая частица какого-либо вещества. Даже одна молекула любого вещества обладает всеми свойствами, которые характерны для этого вещества. Если молекулу разделить на составные части, вещество, которое она составляла, уничтожается, распавшись на более простые элементы – атомы.
орбитальный | химия и физика
орбиталь , в химии и физике математическое выражение, называемое волновой функцией, которое описывает свойства, характерные не более чем для двух электронов вблизи ядра атома или системы ядер, как в молекуле . Орбиталь часто изображают как трехмерную область, в которой существует 95-процентная вероятность нахождения электрона ( см. Иллюстрацию ).
Понять концепцию различных форм и размеров орбит
Обзор различных форм и размеров орбит.
Encyclopædia Britannica, Inc. Посмотреть все видео для этой статьи Атомные орбитали обычно обозначаются комбинацией цифр и букв, которые представляют определенные свойства электронов, связанных с орбиталями, например, 1 s , 2 p , 3 д , 4 ж . Цифры, называемые основными квантовыми числами, указывают уровни энергии, а также относительное расстояние от ядра. Электрон 1 с занимает ближайший к ядру энергетический уровень.Электрон 2 s , связанный с меньшей прочностью, проводит большую часть времени дальше от ядра. Буквы s , p , d и f обозначают форму орбиты. (Форма является следствием величины углового момента электрона, возникающего в результате его углового движения.) Орбиталь s имеет сферическую форму с центром в ядре. Таким образом, электрон 1 s почти полностью ограничен сферической областью, близкой к ядру; электрон 2 с ограничен сферой несколько большего размера.Орбиталь p имеет приблизительную форму пары лопастей на противоположных сторонах ядра или несколько напоминающую форму гантели. Электрон на орбитали p имеет равную вероятность оказаться в любой из половин. Формы остальных орбиталей более сложные. Буквы s , p , d , f первоначально использовались для описательной классификации спектров на серии, называемые резкими, основными, диффузными и фундаментальными, до того, как была известна связь между спектрами и атомной электронной конфигурацией.
Цифры, называемые основными квантовыми числами, указывают уровни энергии, а также относительное расстояние от ядра. Электрон 1 с занимает ближайший к ядру энергетический уровень.Электрон 2 s , связанный с меньшей прочностью, проводит большую часть времени дальше от ядра. Буквы s , p , d и f обозначают форму орбиты. (Форма является следствием величины углового момента электрона, возникающего в результате его углового движения.) Орбиталь s имеет сферическую форму с центром в ядре. Таким образом, электрон 1 s почти полностью ограничен сферической областью, близкой к ядру; электрон 2 с ограничен сферой несколько большего размера.Орбиталь p имеет приблизительную форму пары лопастей на противоположных сторонах ядра или несколько напоминающую форму гантели. Электрон на орбитали p имеет равную вероятность оказаться в любой из половин. Формы остальных орбиталей более сложные. Буквы s , p , d , f первоначально использовались для описательной классификации спектров на серии, называемые резкими, основными, диффузными и фундаментальными, до того, как была известна связь между спектрами и атомной электронной конфигурацией.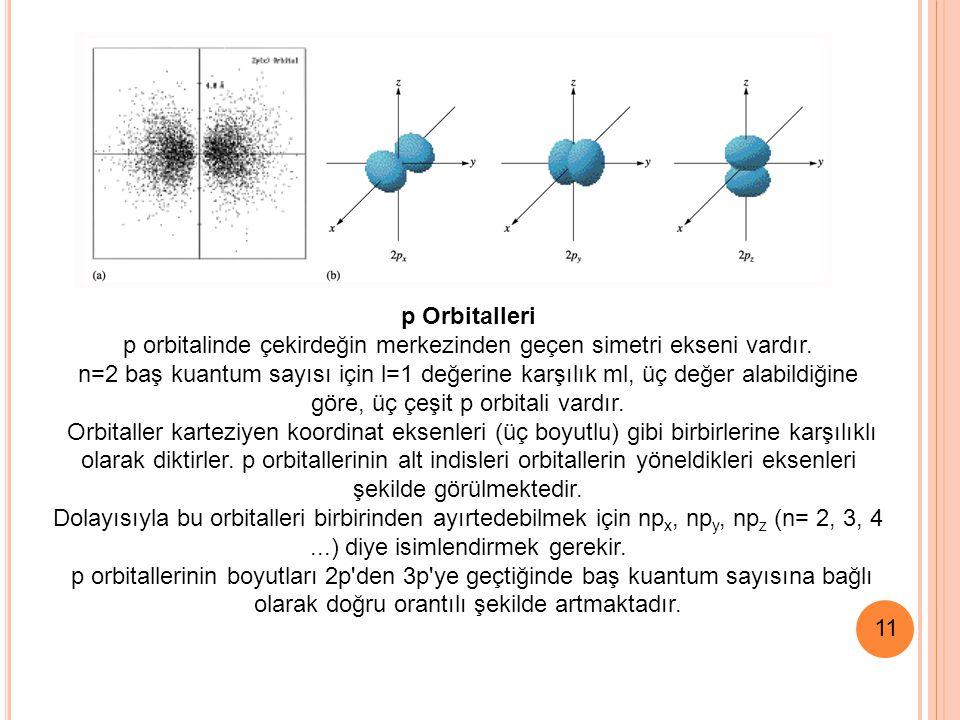
Подробнее по этой теме
переходный металл: атомные орбитали атома водорода
Как отмечалось ранее, электроны, связанные с атомным ядром, локализованы или сконцентрированы в различных конкретных областях пространства, называемых …
Узнайте об устройстве орбиталей электронов и уровнях энергии в атомах.
Обзор подуровней и оболочек на орбиталях.
Encyclopædia Britannica, Inc. Смотрите все видео для этой статьи № p орбиталей существуют на первом уровне энергии, но есть набор из трех на каждом из более высоких уровней. Эти тройки ориентированы в пространстве, как если бы они находились на трех осях под прямым углом друг к другу, и их можно различить нижними индексами, например, 2 p x , 2 p y , 2 п з . На всех уровнях, кроме первых двух основных уровней, имеется набор из пяти орбиталей d и на всех, кроме первых трех основных уровней, набор из семи орбиталей f , все со сложной ориентацией.
Только два электрона из-за их спина могут быть связаны с каждой орбиталью. Можно представить, что электрон вращается вокруг своей оси либо по часовой стрелке, либо против часовой стрелки, что делает каждый электрон крошечным магнитом. Электроны на полных орбиталях спарены с противоположными спинами или противоположными магнитными полярностями.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасГлава 2.5: Атомные орбитали и их энергия
Эффективные ядерные заряды
Для атома или иона с одним электроном мы можем вычислить потенциальную энергию, рассматривая только электростатическое притяжение между положительно заряженным ядром и отрицательно заряженным электроном.Однако, когда присутствует более одного электрона, полная энергия атома или иона зависит не только от притягивающих электрон-ядерных взаимодействий, но и от отталкивающих электрон-электронных взаимодействий. Когда есть два электрона, отталкивающие взаимодействия зависят от положений и электронов в данный момент, но поскольку мы не можем указать точные положения электронов, невозможно точно рассчитать отталкивающие взаимодействия.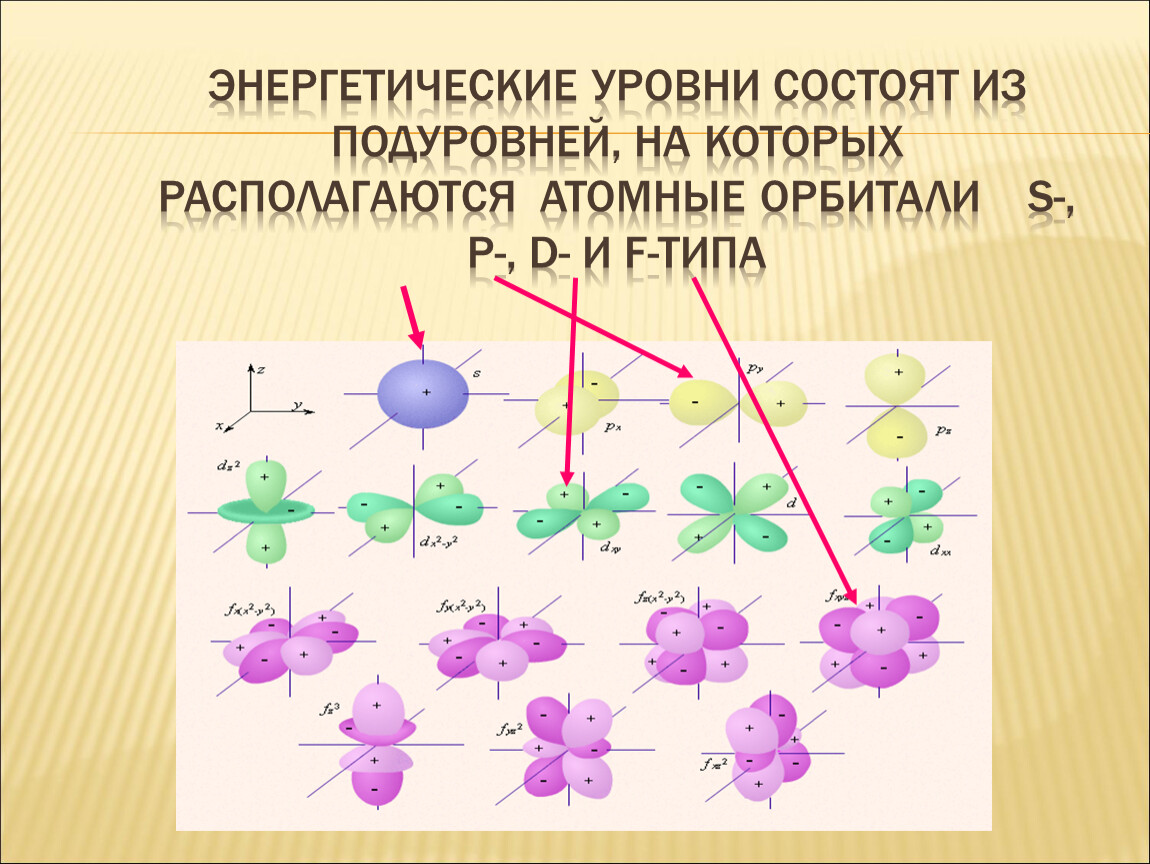 Следовательно, мы должны использовать приближенные методы, чтобы иметь дело с влиянием электрон-электронного отталкивания на орбитальные энергии.
Следовательно, мы должны использовать приближенные методы, чтобы иметь дело с влиянием электрон-электронного отталкивания на орбитальные энергии.
Если электрон находится далеко от ядра (то есть, если расстояние r между ядром и электроном велико), то в любой данный момент большинство других электронов будет находиться на между этим электроном и ядром. Следовательно, электроны нейтрализуют часть положительного заряда ядра и тем самым уменьшают притягивающее взаимодействие между ним и удаленным электроном. В результате удаленный электрон испытывает эффективный ядерный заряд ( Z eff ). Ядерный заряд, который электрон фактически испытывает из-за экранирования от других электронов, находящихся ближе к ядру.то есть на меньше , чем фактический ядерный заряд Z . Этот эффект называется защитой электронов. Эффект, при котором электроны, расположенные ближе к ядру, нейтрализуют часть положительного заряда ядра и тем самым уменьшают притягивающее взаимодействие между ядром и отцом электрона. По мере приближения расстояния между электроном и ядром. infinity, Z eff приближается к значению 1, потому что все остальные ( Z — 1) электроны в нейтральном атоме в среднем находятся между ним и ядром.Если, с другой стороны, электрон находится очень близко к ядру, то в любой данный момент большинство других электронов находятся дальше от ядра и не экранируют заряд ядра. При r ≈ 0 положительный заряд, испытываемый электроном, приблизительно равен полному заряду ядра, или Z eff ≈ Z . При промежуточных значениях r эффективный ядерный заряд находится где-то между 1 и Z : 1 ≤ Z eff ≤ Z .Таким образом, действительное значение Z eff , которое испытывает электрон на данной орбитали, зависит не только от пространственного распределения электрона на этой орбитали, но и от распределения всех других присутствующих электронов. Это приводит к большим различиям в Z eff для разных элементов, как показано на рисунке 2.
По мере приближения расстояния между электроном и ядром. infinity, Z eff приближается к значению 1, потому что все остальные ( Z — 1) электроны в нейтральном атоме в среднем находятся между ним и ядром.Если, с другой стороны, электрон находится очень близко к ядру, то в любой данный момент большинство других электронов находятся дальше от ядра и не экранируют заряд ядра. При r ≈ 0 положительный заряд, испытываемый электроном, приблизительно равен полному заряду ядра, или Z eff ≈ Z . При промежуточных значениях r эффективный ядерный заряд находится где-то между 1 и Z : 1 ≤ Z eff ≤ Z .Таким образом, действительное значение Z eff , которое испытывает электрон на данной орбитали, зависит не только от пространственного распределения электрона на этой орбитали, но и от распределения всех других присутствующих электронов. Это приводит к большим различиям в Z eff для разных элементов, как показано на рисунке 2. 5.9 для элементов первых трех строк периодической таблицы. Обратите внимание, что только для водорода Z eff = Z , и только для гелия Z eff и Z сопоставимы по величине.
5.9 для элементов первых трех строк периодической таблицы. Обратите внимание, что только для водорода Z eff = Z , и только для гелия Z eff и Z сопоставимы по величине.
Рисунок 2.5.9 Взаимосвязь между эффективным ядерным зарядом Z eff и атомным номером Z для внешних электронов элементов первых трех строк периодической системы Таблица За исключением для водорода , Z eff — всегда меньше Z , а Z eff увеличивается слева направо по мере прохождения строки.
Тенденция, которую вы видите на рисунке 2.5.9 для первых трех основных оболочек, соответствующих n = 1, 2 и 3, продолжается и в последующих оболочках. Атомный номер и, следовательно, заряд ядра увеличиваются линейно, но пилообразный узор для Z eff повторяется, сбрасываясь при изменении квантового числа n. Химическая связь и реакционная способность включают разделение или обмен электронами между атомами. Те электроны, которые могут участвовать, — это те, которые удерживаются атомом в наименьшей степени, внешние электроны, которые, независимо от атомного номера и заряда ядра, связаны со своим атомом примерно в том же диапазоне энергий из-за эффекта экранирования.
Химическая связь и реакционная способность включают разделение или обмен электронами между атомами. Те электроны, которые могут участвовать, — это те, которые удерживаются атомом в наименьшей степени, внешние электроны, которые, независимо от атомного номера и заряда ядра, связаны со своим атомом примерно в том же диапазоне энергий из-за эффекта экранирования.
В многоэлектронных атомах это сдвигает энергии различных орбиталей для типичного многоэлектронного атома, как показано на рисунке 2.5.10. В пределах данной главной оболочки многоэлектронного атома орбитальные энергии увеличиваются с увеличением l . Орбиталь нс всегда лежит ниже соответствующей орбиты np , которая, в свою очередь, лежит ниже орбитали ой . Эти энергетические различия вызваны эффектами экранирования и проникновения , степени, в которой данная орбиталь находится внутри других заполненных орбиталей.Как показано на рисунке 2.5.11, например, электрон на орбитали 2 s проникает внутрь заполненной орбитали 1 s больше, чем электрон на орбитали 2 p .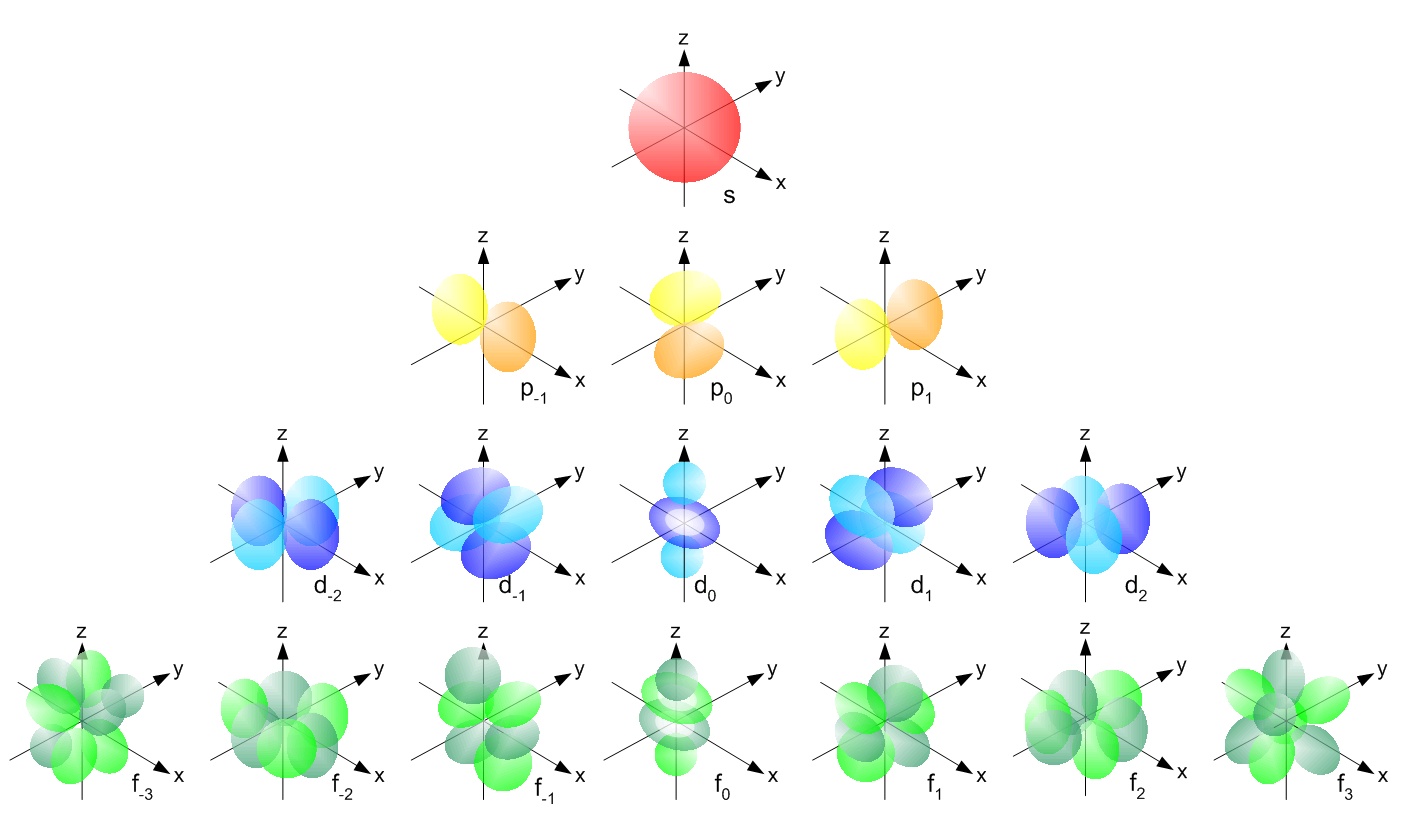 Следовательно, в атоме с заполненной орбиталью 1 s , Z eff , испытываемое электроном 2 s , больше, чем Z eff , которое испытывает электрон 2 p . Следовательно, электрон 2 s более тесно связан с ядром и имеет более низкую энергию, соответствующую порядку энергий, показанному на рисунке 2.5,10
Следовательно, в атоме с заполненной орбиталью 1 s , Z eff , испытываемое электроном 2 s , больше, чем Z eff , которое испытывает электрон 2 p . Следовательно, электрон 2 s более тесно связан с ядром и имеет более низкую энергию, соответствующую порядку энергий, показанному на рисунке 2.5,10
Обратите внимание на узор
Из-за защиты от электронов Z eff увеличивается быстрее по строке периодической таблицы, чем по столбцу.
Рисунок 2.5.10 Диаграмма уровней орбитальной энергии для типичного многоэлектронного атома
Из-за эффектов экранирования и различного радиального распределения орбиталей с одинаковым значением n , но разными значениями l , различные подоболочки не вырождены в многоэлектронном атоме.(Сравните это с рисунком 2.5.8.Для данного значения n , орбиталь ns всегда меньше по энергии, чем орбитали np , которые ниже по энергии, чем орбитали и , и так далее. В результате некоторые подоболочки с более высокими главными квантовыми числами на самом деле имеют меньшую энергию, чем подоболочки с меньшим значением n ; например, орбиталь 4 s имеет меньшую энергию, чем орбитали 3 d для большинства атомов.
В результате некоторые подоболочки с более высокими главными квантовыми числами на самом деле имеют меньшую энергию, чем подоболочки с меньшим значением n ; например, орбиталь 4 s имеет меньшую энергию, чем орбитали 3 d для большинства атомов.
Рисунок 2.5.11 Орбитальное проникновение Сравнение радиального распределения вероятностей орбиталей 2 s и 2 p для различных состояний атома водорода показывает, что орбиталь 2 s проникает внутрь орбитали 1 s больше, чем орбиталь s . 2 p орбитальный. Следовательно, когда электрон находится в малом внутреннем лепестке орбитали 2 s , он испытывает относительно большое значение Z eff , что приводит к тому, что энергия орбитали 2 s оказывается ниже энергии из 2 p орбитальных.
Обратите внимание на рис. 2.5.10, что разница в энергиях между подоболочками может быть настолько большой, что энергии орбиталей из разных основных оболочек могут стать приблизительно равными.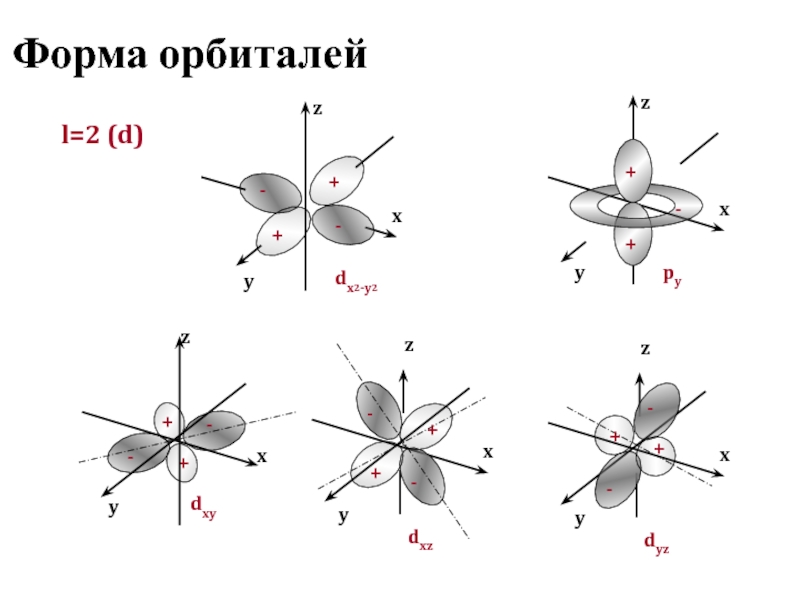 Например, энергия 3 d орбиталей в большинстве атомов фактически составляет между энергиями 4 s и 4 p орбиталей.
Например, энергия 3 d орбиталей в большинстве атомов фактически составляет между энергиями 4 s и 4 p орбиталей.
Ключевое уравнение
энергия водородоподобных орбиталей
Уравнение 2.{2}} \ mathcal {R} hc \)
Резюме
Из-за дуальности волна-частица ученым приходится иметь дело с вероятностью нахождения электрона в определенной точке пространства. Для этого требовалась разработка квантовой механики , которая использует волновых функций (Ψ) для описания математической связи между движением электронов в атомах и молекулах и их энергиями. Волновые функции обладают пятью важными свойствами: (1) волновая функция использует три переменные (декартовы оси x , y и z ) для описания положения электрона; (2) величина волновой функции пропорциональна интенсивности волны; (3) вероятность нахождения электрона в данной точке пропорциональна квадрату волновой функции в этой точке, что приводит к распределению вероятностей в пространстве, которое часто изображается как график электронной плотности ; (4) описание распределения электронов как стоячих волн естественным образом приводит к существованию наборов из квантовых чисел , характерных для каждой волновой функции; и (5) каждое пространственное распределение электрона, описываемое волновой функцией с заданным набором квантовых чисел, имеет определенную энергию.
Квантовые числа предоставляют важную информацию об энергии и пространственном распределении электрона. Главное квантовое число n может быть любым положительным целым числом; по мере увеличения n для атома среднее расстояние электрона от ядра также увеличивается. Все волновые функции с одинаковым значением n составляют основную оболочку , в которой электроны имеют одинаковые средние расстояния от ядра. Азимутальное квантовое число l может иметь целые значения от 0 до n — 1; он описывает форму распределения электронов.Волновые функции, которые имеют одинаковые значения как n , так и l , составляют подоболочку , соответствующую распределениям электронов, которые обычно различаются по ориентации, а не по форме или среднему расстоянию от ядра. Магнитное квантовое число m l может иметь 2 l + 1 интегральных значений в диапазоне от — l до + l и описывает ориентацию электронного распределения.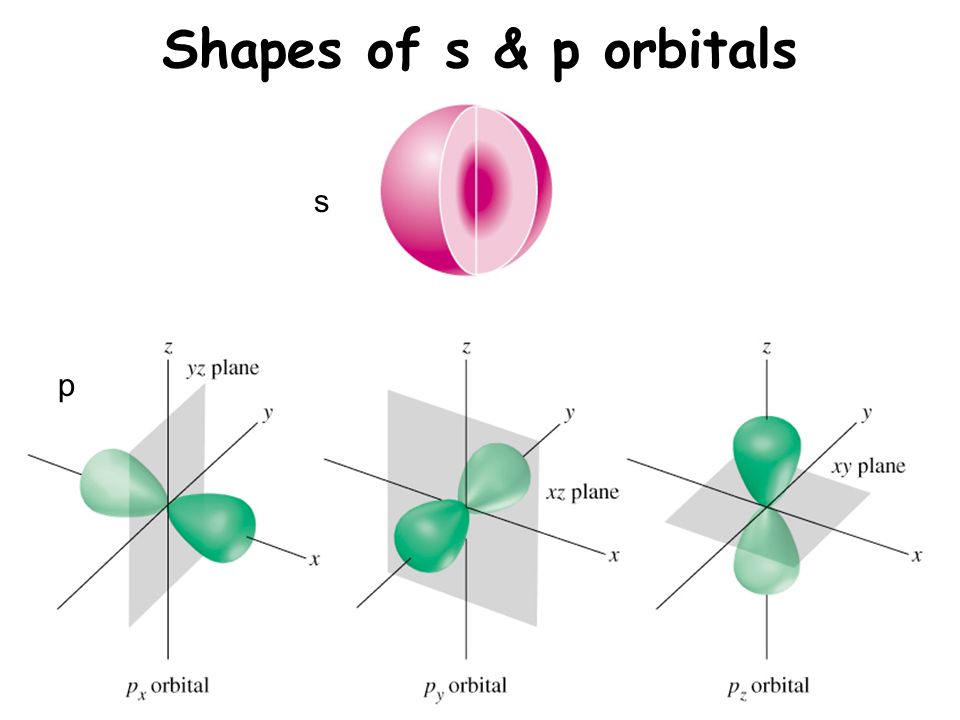 Каждая волновая функция с заданным набором значений n , l и m l описывает конкретное пространственное распределение электрона в атоме, атомной орбитали .
Каждая волновая функция с заданным набором значений n , l и m l описывает конкретное пространственное распределение электрона в атоме, атомной орбитали .
Четыре химически важных типа атомных орбиталей соответствуют значениям l = 0, 1, 2 и 3. Орбитали с l = 0 являются s орбиталями и сферически симметричны, с наибольшей вероятностью нахождения электрон, возникающий в ядре.Все орбитали со значениями n > 1 и l = 0 содержат один или несколько узлов. Орбитали с l = 1 являются p орбиталями и содержат узловую плоскость, которая включает ядро, что дает форму гантели. Орбитали с l = 2 являются орбиталями d и имеют более сложные формы, по крайней мере, с двумя узловыми поверхностями. Орбитали с l = 3 — это f орбитали, которые еще более сложны.
Поскольку его среднее расстояние от ядра определяет энергию электрона, каждая атомная орбиталь с заданным набором квантовых чисел имеет определенную энергию, связанную с ней, орбитальную энергию . В атомах или ионах с одним электроном все орбитали с одинаковым значением n имеют одинаковую энергию (они равны вырожденным ), а энергии основных оболочек плавно увеличиваются по мере увеличения n . Считается, что атом или ион с электроном (ами) на орбитали (ах) с наименьшей энергией находится в основном состоянии, тогда как атом или ион, в которых один или несколько электронов занимают орбитали с более высокой энергией, находятся в возбужденное состояние.
В атомах или ионах с одним электроном все орбитали с одинаковым значением n имеют одинаковую энергию (они равны вырожденным ), а энергии основных оболочек плавно увеличиваются по мере увеличения n . Считается, что атом или ион с электроном (ами) на орбитали (ах) с наименьшей энергией находится в основном состоянии, тогда как атом или ион, в которых один или несколько электронов занимают орбитали с более высокой энергией, находятся в возбужденное состояние.
Расчет орбитальных энергий в атомах или ионах с более чем одним электроном (многоэлектронные атомы или ионы) затруднен из-за отталкивающих взаимодействий между электронами.Концепция защиты электронов , в которой промежуточные электроны действуют, уменьшая положительный ядерный заряд, испытываемый электроном, позволяет использовать водородоподобные орбитали и эффективный ядерный заряд ( Z eff ) для описания электрона. распределения в более сложных атомах или ионах. Степень, в которой орбитали с разными значениями l и одинаковым значением n перекрываются или проникают через заполненные внутренние оболочки, приводит к немного разным энергиям для разных подоболочек в одной и той же основной оболочке у большинства атомов.
Степень, в которой орбитали с разными значениями l и одинаковым значением n перекрываются или проникают через заполненные внутренние оболочки, приводит к немного разным энергиям для разных подоболочек в одной и той же основной оболочке у большинства атомов.
Ключевые вынос
- Существует связь между движениями электронов в атомах и молекулах и их энергиями, которая описывается квантовой механикой.
Концептуальные проблемы
Почему электрон на орбитали с n = 1 в атоме водорода имеет меньшую энергию, чем свободный электрон ( n = ∞)?
Какие четыре переменные необходимы для полного описания положения любого объекта в пространстве? В квантовой механике одна из этих переменных явно не рассматривается.Какой и почему?
Химики обычно ссылаются на квадрат волновой функции, а не на саму волновую функцию.
 Почему?
Почему?Орбитальные энергии видов с одним электроном определяются только одним квантовым числом. Который из? У такого вида энергия орбитали с n = 2 больше, меньше или равна энергии орбитали с n = 4? Обосновать ответ.
В каждой паре подоболочек для атома водорода какая энергия выше? Укажите главное и азимутальное квантовое число для каждой пары.
- 1 с , 2 с
- 2 с , 2 с
- 2 с , 3 с
- 3 д , 4 с
Какова связь между энергией орбитали и ее средним радиусом? Если электрон совершил переход с орбитали со средним радиусом 846.В 4 часа дня до орбитали со средним радиусом 476,1 мкм будет ли получен спектр излучения или спектр поглощения? Почему?
При переходе с орбитали с главным квантовым числом 4 на орбиталь с главным квантовым числом 7 электрон атома водорода излучает или поглощает фотон энергии? Какой была бы энергия фотона? Какой области электромагнитного спектра соответствует эта энергия?
Какое квантовое число определяет каждое из следующего?
- общая форма орбиты
- Ориентация электрона относительно магнитного поля
- Ориентация орбиты в пространстве
- средняя энергия и расстояние электрона от ядра
Пытаясь объяснить свойства элементов, Нильс Бор первоначально предложил электронные структуры для нескольких элементов с орбитами, содержащими определенное количество электронов, некоторые из которых представлены в следующей таблице:
Элемент Число электронов электронов на орбитах с n = 4 3 2 1 H 1 1 He 2 2 Ne 10 8 2 Ар 18 8 8 2 Ли 3 1 2 Na 11 1 8 2 К 19 1 8 8 2 Be 4 2 2 - Изобразите электронную конфигурацию каждого атома, основываясь только на информации, приведенной в таблице.
 В чем разница между структурами, первоначально предложенными Бором, и принятыми сегодня?
В чем разница между структурами, первоначально предложенными Бором, и принятыми сегодня? - Используя модель Бора, каковы последствия для реакционной способности каждого элемента?
- Укажите фактическую электронную конфигурацию каждого элемента в таблице.
- Изобразите электронную конфигурацию каждого атома, основываясь только на информации, приведенной в таблице.
Что происходит с энергией данной орбитали, когда ядерный заряд Z какого-либо вида увеличивается? В многоэлектронном атоме и для данного заряда ядра величина Z eff , испытываемая электроном, зависит от его значения, равного l .Почему?
Электронная плотность отдельного атома делится на две основные области. Назовите эти две области и опишите, что каждая из них представляет.
По мере увеличения главного квантового числа разница энергий между последовательными уровнями энергии уменьшается. Почему? Что случилось бы с электронными конфигурациями переходных металлов, если бы этого уменьшения не произошло?
Опишите взаимосвязь между экранированием электронов и Z eff на самых удаленных электронах атома.
 Предскажите, как на химическую реактивность влияет снижение эффективного ядерного заряда.
Предскажите, как на химическую реактивность влияет снижение эффективного ядерного заряда.Если данный атом или ион имеет по одному электрону в каждой из следующих подоболочек, какой электрон легче удалить?
- 2 с , 3 с
- 3 п , 4 д
- 2 с , 1 с
- 3 д , 4 с
Числовые задачи
Сколько подоболочек возможно для n = 3? Кто они такие?
Сколько подоболочек возможно для n = 5? Кто они такие?
Какое значение l соответствует подоболочке d ? Сколько орбиталей в этой подоболочке?
Какое значение l соответствует подоболочке f ? Сколько орбиталей в этой подоболочке?
Укажите количество орбиталей и электронов, которые могут занимать каждую подоболочку.

- 2 с
- 3 п
- 4 д
- 6 из
Укажите количество орбиталей и электронов, которые могут занимать каждую подоболочку.
- 1 с
- 4 п
- 5 д
- 4 из
Сколько орбиталей и подоболочек находится в основной оболочке n = 6? Как эти орбитальные энергии соотносятся с таковыми для n = 4?
Сколько узлов, по вашему мнению, будет иметь орбиталь 4 p ? A 5 s орбитальный?
Орбиталь p имеет один узел в дополнение к узловой плоскости, которая разделяет лепестки пополам.Каким будет значение n , по вашему мнению? Если орбиталь с имеет два узла, каково значение n ?
Ответы
Три подоболочки, с l = 0 ( s ), l = 1 ( p ) и l = 2 ( d ).

Подоболочка d имеет l = 2 и содержит 5 орбиталей.
- 2 электрона; 1 орбитальный
- 6 электронов; 3 орбитали
- 10 электронов; 5 орбиталей
- 14 электронов; 7 орбиталей
Основная оболочка с n = 6 содержит шесть подоболочек с l = 0, 1, 2, 3, 4 и 5 соответственно. Эти подоболочки содержат 1, 3, 5, 7, 9 и 11 орбиталей соответственно, всего 36 орбиталей.Энергии орбиталей с n = 6 выше, чем у соответствующих орбиталей с таким же значением l для n = 4.
форм орбиталей | Что такое Орбиталь? Типы орбиталей
Что такое o rbital ? В химии орбиталь — это математическая функция, которая описывает волнообразное поведение электронной пары, электрона или нуклонов в квантовой механике и химии.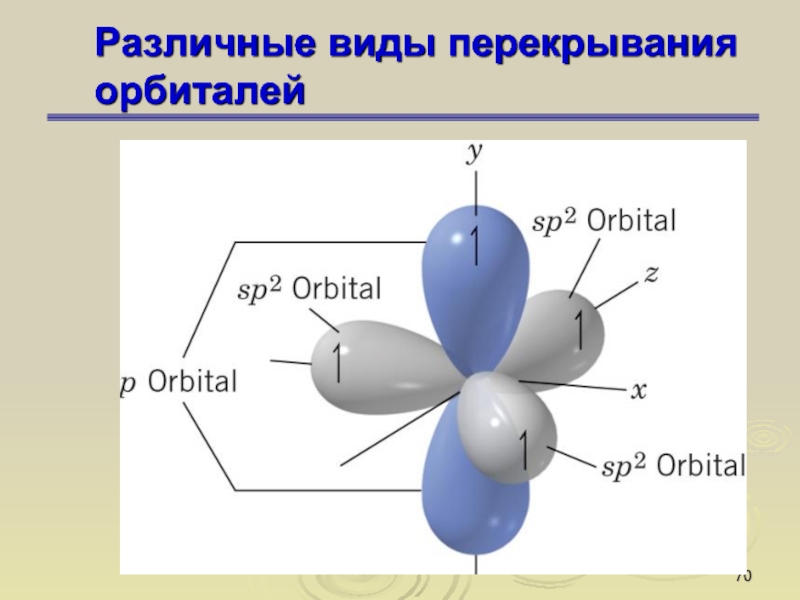 Орбитали также называют электронными или атомными орбиталями.
Орбитали также называют электронными или атомными орбиталями. Атомные орбитали — это трехмерные области пространства вокруг ядра атома. Атомные орбитали позволяют атомам образовывать ковалентные связи. s, p, d и f орбитали являются наиболее часто заполненными орбиталями. Согласно принципу исключения Паули, только два электрона можно найти в любом орбитальном пространстве.
Все электроны с одинаковым значением n, т.е. главным квантовым числом, будут находиться в одной оболочке. Когда электроны имеют одинаковые n, l и m, говорят, что они находятся на одной орбитали i.е. у них одинаковый энергетический уровень, и они различаются только квантовым числом спина.
Узел — это область, где вероятность нахождения электрона будет равна нулю. Узловая плоскость — это плоскость, которая проходит через ядро, на которой вероятность нахождения электрона равна нулю. В орбитали количество узловых плоскостей равно азимутальному квантовому числу. Есть два типа узлов: угловые и радиальные узлы.
 Угловые узлы обычно бывают плоскими под фиксированными углами.Радиальные узлы — это сферы с фиксированным радиусом, который возникает при увеличении главного квантового числа.
Угловые узлы обычно бывают плоскими под фиксированными углами.Радиальные узлы — это сферы с фиксированным радиусом, который возникает при увеличении главного квантового числа. Общее количество узлов орбитали представляет собой сумму угловых и радиальных узлов и выражается в квантовых числах n и l и приводится ниже:
N = n — l — 1
Типы орбиталей и их формы :
 Орбитали с l = 2 — это d-орбитали сложной формы с как минимум двумя узловыми поверхностями. Орбитали с l = 3 называются f-орбиталями, которые являются более сложными. Поскольку среднее расстояние от ядра будет определять энергию электрона, каждая атомная орбиталь с заданным набором квантовых чисел будет иметь определенную энергию, связанную с ней, которая называется орбитальной энергией.
Орбитали с l = 2 — это d-орбитали сложной формы с как минимум двумя узловыми поверхностями. Орбитали с l = 3 называются f-орбиталями, которые являются более сложными. Поскольку среднее расстояние от ядра будет определять энергию электрона, каждая атомная орбиталь с заданным набором квантовых чисел будет иметь определенную энергию, связанную с ней, которая называется орбитальной энергией.Распределение орбиталей в их внутреннем электронном ядре называется проникновением орбиталей.Пример: радиальная плотность 2-й орбиты распределена по кривой 1-й орбитали. Таким же образом, орбиталь 3s будет разделена на 1s орбитальную и 2s орбитальную. Из-за распространения электронов по 2s или 3s орбиталям он не будет полностью экранирован внутренними 1s-электронами ядра. От s
орбиталей к f орбиталям степень проникновения уменьшается.с> p> d> f
На приведенной выше диаграмме показано уменьшение проникновения от s к p-орбиталям, поскольку радиальное распределение близко к ядру для s больше по сравнению с p-орбиталями. Ион или атом с одним или несколькими электронами занимает орбитали с более высокой энергией и, как говорят, находится в возбужденном состоянии, тогда как ион или атом, в котором один или несколько электронов занимают орбитали с низкой энергией, находятся в основном состоянии. В атоме находится большое количество орбиталей. Если размер орбитали меньше, значит, больше шансов найти электрон рядом с ядром. Точно так же для формы больше возможностей найти электрон по одним направлениям, чем по другим. Форма орбиты 1с :
Ион или атом с одним или несколькими электронами занимает орбитали с более высокой энергией и, как говорят, находится в возбужденном состоянии, тогда как ион или атом, в котором один или несколько электронов занимают орбитали с низкой энергией, находятся в основном состоянии. В атоме находится большое количество орбиталей. Если размер орбитали меньше, значит, больше шансов найти электрон рядом с ядром. Точно так же для формы больше возможностей найти электрон по одним направлениям, чем по другим. Форма орбиты 1с : Значения квантовых чисел l и m равны 0 для s-орбиталей. Функции Φ и Θ не зависят от углов Φ и Θ для этих значений.
Каждая из вышеупомянутых двух функций равна постоянному члену, и для таких орбиталей уравнение будет иметь вид Угловой функции s-орбиталей: ΘΦ = (1 / 4π) 1/2 Для s-орбиталей l = 0 угловой волновая функция не зависит и постоянна от углов Φ и θ.2 Vs r ясно из приведенной выше диаграммы точечной населенности или граничной поверхности.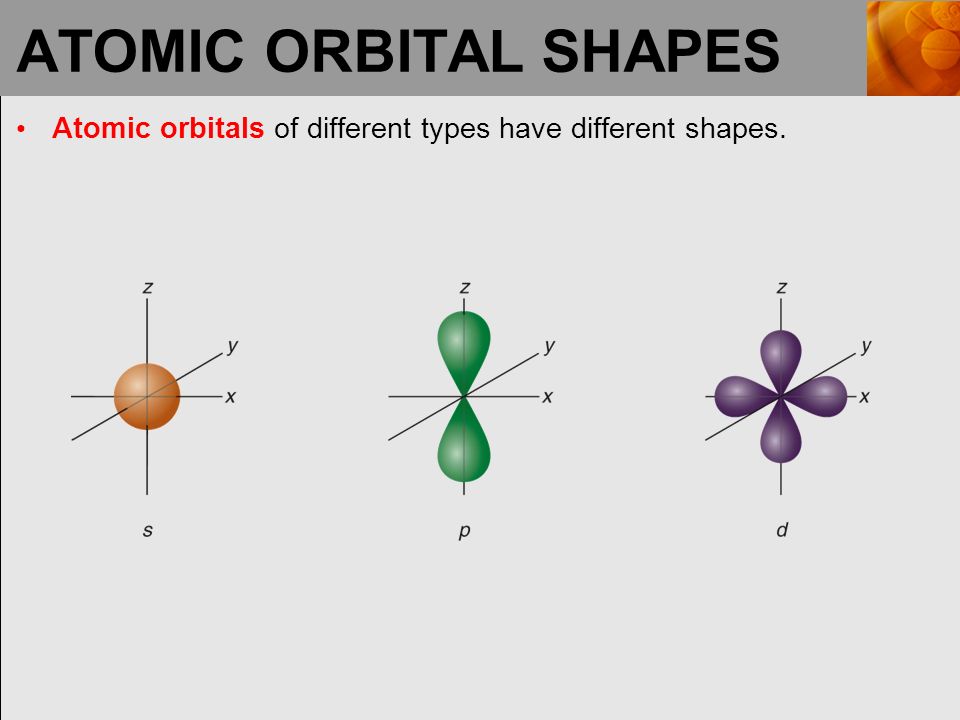 На приведенном выше изображении населенности точек значение относительной вероятности в данном месте показано точками плотности рядом с ним. Изображение населенности точек показывает фактическое описание среднего временного распределения электрона. На приведенной выше диаграмме четко показано изображение населенности точек R 2 / 1s Vs r. На контурах равной вероятности контуры могут быть нарисованы путем соединения точек с одинаковой вероятностью.Для любой s-орбитали вокруг ядра эти контуры сферически симметричны.
На приведенном выше изображении населенности точек значение относительной вероятности в данном месте показано точками плотности рядом с ним. Изображение населенности точек показывает фактическое описание среднего временного распределения электрона. На приведенной выше диаграмме четко показано изображение населенности точек R 2 / 1s Vs r. На контурах равной вероятности контуры могут быть нарисованы путем соединения точек с одинаковой вероятностью.Для любой s-орбитали вокруг ядра эти контуры сферически симметричны.Форма орбиты 2s :
Для орбиты 2s это будет
Ψ 2/2, 0, 0 α R 2/2, 0
 Один будет при r = 0, а другой примерно при 2 = 210 пм, между этими двумя максимумами вероятность станет нулем примерно при r = 105 пм. это называется узловой точкой. Размер орбитали 2s больше, чем размер орбитали 1s. Это связано с тем, что размер орбиты 2s находится дальше от ядра по сравнению с размером орбитали 1s.
Один будет при r = 0, а другой примерно при 2 = 210 пм, между этими двумя максимумами вероятность станет нулем примерно при r = 105 пм. это называется узловой точкой. Размер орбитали 2s больше, чем размер орбитали 1s. Это связано с тем, что размер орбиты 2s находится дальше от ядра по сравнению с размером орбитали 1s.Форма р-орбиты :
Здесь квантовое число m фиксирует направление углового момента.Квантовое число также фиксирует направление орбитали в пространстве. Пример: есть три орбитали p орбиталей (I = 1). Эти значения соответствуют трем значениям m (+1, 0, -1). Графики P0, P + 1 + P-1 и P + 1 — P-1 показывают орбитали в форме гантели. Они также перпендикулярны друг другу и указывают на оси x, y и z. По этой причине их называют орбиталями px, py, pz. Форма 2p-орбиталей :
Для всех трех 2p-орбиталей графики R2, 1 Vs r и R2 / 2 Vs r одинаковы.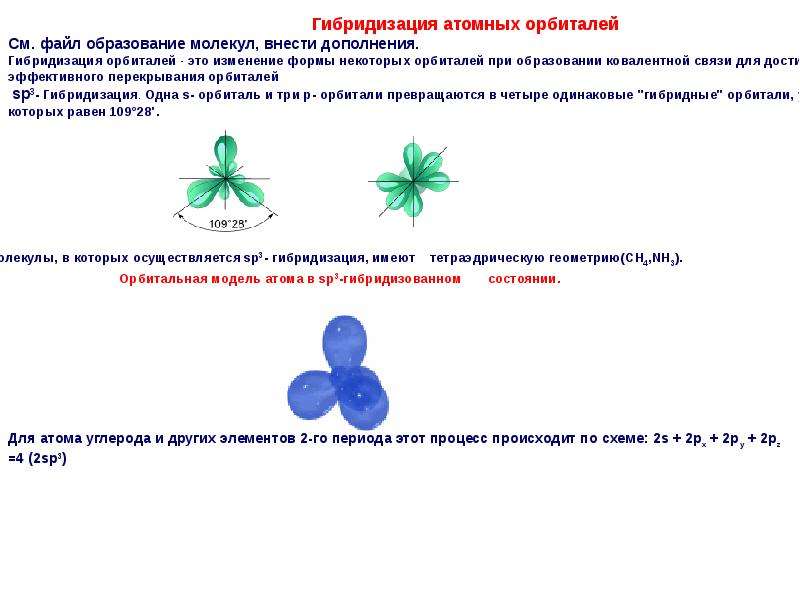 2.2 орбитали отличается от других.
2.2 орбитали отличается от других.
Форма трехмерных орбиталей :
Значение I = 2 для d орбиталей и для I = 2 допустимы пять значений m. Значения для орбиталей типа d равны +2, +1, 0, -1 и -2.
Необходимо знать трехмерные орбитали, поскольку это будет полезно при обсуждении химии многих элементов. Трехмерные орбитали можно разделить на 2 категории. Это следующие:
f-орбиталь :
f-орбиталь имеет вторичное квантовое число l = 3. Существует семь f-орбиталей с m l = -3, -2, -1, 0, +1, +2, +3, и эти орбитали не заняты в основном состоянии до 58-го элемента (церий). [Xe] 6s 2 4f5d — это электронная конфигурация для церия.
f-орбитали глубоко скрыты под валентной оболочкой даже для элементов, помимо церия.f-орбитали имеют три узловых плоскости и сложные формы с атомным ядром в центре.
Орбитальное совпадение 4f y3- 3x 2 y до l = 3, m l = -3 и n = 4.
Орбитальное совпадение 4f xyz до l = 3, m l = -2, и n = 4.
4f 5yz 2 — год 2 орбитальное совпадение до l = 3, m l = -1, и n = 4.
4f 5xz 2 — xr 2 орбитальное совпадение до l = 3, м l = +1 и n = 4.
4f zx 3 — xy 2 орбитальное совпадение до l = 3, m l = +2 и n = 4.
The 4f x 3 — 3 xy 2 орбитальное совпадают до l = 3, m l = +3 и n = 4.
4.6 Электронная конфигурация | Атом
4.
 6 Электронная конфигурация (ESABE)
6 Электронная конфигурация (ESABE)Энергия электронов (ЭСАБФ)
Все электроны атома имеют одинаковый заряд и одинаковую массу, но каждый электрон имеет разное количество. энергии . Электроны, которые имеют наименьшую энергию , находятся ближе всего к ядру (где сила притяжения положительно заряженного ядра наибольшая) и электроны с выше энергии (и способны преодолеть силу притяжения ядра) находятся дальше.
Электронная система (ESABG)
Мы начнем с очень простого представления о расположении или конфигурации электронов вокруг атома. Этот
Представление просто утверждает, что электроны расположены на энергетических уровнях (или оболочках) вокруг ядра атома. Эти
уровни энергии пронумерованы 1, 2, 3 и т. д. Электроны, которые находятся на первом уровне энергии (уровень энергии 1),
ближе всего к ядру и будет иметь наименьшую энергию. Электроны, находящиеся дальше от ядра, будут иметь
высшая энергия.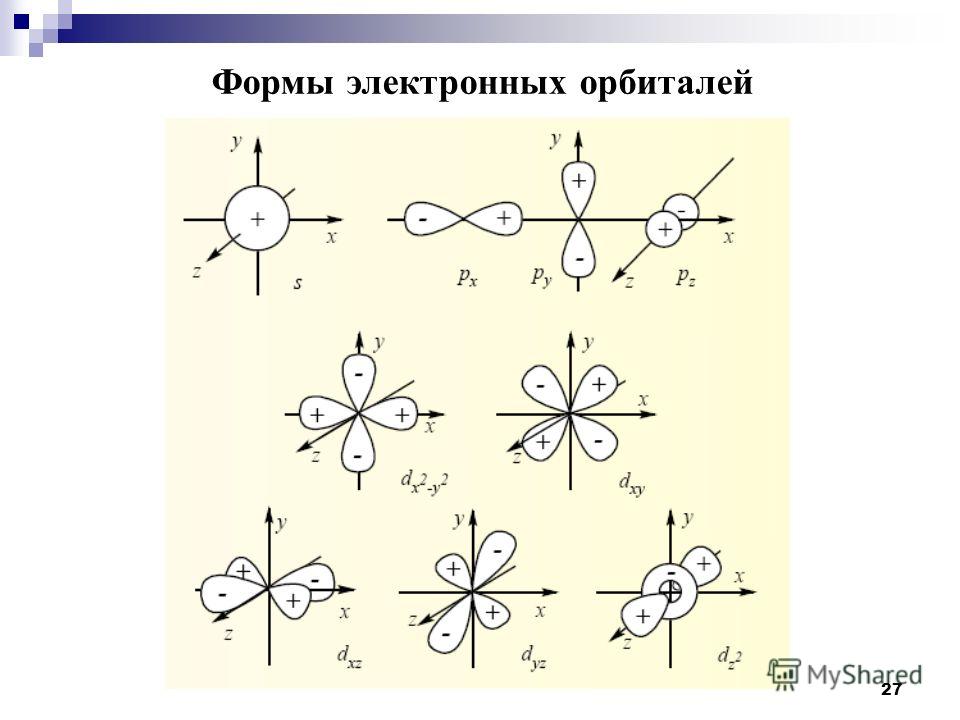
В следующих примерах уровни энергии показаны в виде концентрических кругов вокруг центрального ядра. В Для этих диаграмм важно знать, что первый энергетический уровень может содержать 2 электрона, второй энергетический уровень может содержать 8 электронов, а третий энергетический уровень может содержать 8 электронов.
Литий
Литий (\ (\ text {Li} \)) имеет атомный номер 3, что означает, что в нейтральном атоме количество электронов тоже будет 3.Первые два электрона находятся на первом энергетическом уровне, а третий электрон находится на первом уровне. находится на втором энергетическом уровне (рис. 4.7).
Рисунок 4.7: Электронное устройство атома лития.
Фтор
Фтор (\ (\ text {F} \)) имеет атомный номер 9, что означает, что нейтральный атом также имеет 9 электронов.
 В
первые 2 электрона находятся на первом уровне энергии, а остальные 7 — на втором уровне энергии.
уровень (рисунок 4.8).
В
первые 2 электрона находятся на первом уровне энергии, а остальные 7 — на втором уровне энергии.
уровень (рисунок 4.8).Рисунок 4.8: Электронное расположение атома фтора.
Неон
Неон (\ (\ text {Ne} \)) имеет атомный номер 10, что означает, что нейтральный атом также имеет 10 электронов. В первые 2 электрона находятся на первом энергетическом уровне, а последние 8 — на втором энергетическом уровне. (Рисунок 4.9).
Рис. 4.9: Электронное устройство атома неона.
Но ситуация несколько сложнее. В пределах каждого энергетического уровня электроны движутся в орбиталей . Орбиталь определяет пространства или области, в которых движутся электроны.
- Атомная орбиталь
Атомная орбиталь — это область, в которой электрон может находиться вокруг отдельного атома.

Первый энергетический уровень содержит только одну s-орбиталь, второй энергетический уровень содержит одну s-орбиталь и три p-орбитали. орбитали, а третий энергетический уровень содержит одну s-орбиталь и три p-орбитали (а также пять d-орбиталей).В пределах каждого энергетического уровня s-орбиталь имеет более низкую энергию, чем p-орбитали. Это расположение показано на Рисунок 4.10.
Рисунок 4.10: Положение первых десяти орбиталей атома на энергетической диаграмме.
Каждый блок на рисунке 4.10 может удерживать два электрона. Это означает, что s-орбиталь может содержать два электрона, а p-орбиталь может содержать в общей сложности шесть электронов, по два в каждом из трех блоков.
Эта диаграмма также помогает нам при разработке электронной конфигурации элемента. Электрон
Конфигурация элемента — это расположение электронов в оболочках и подоболочках.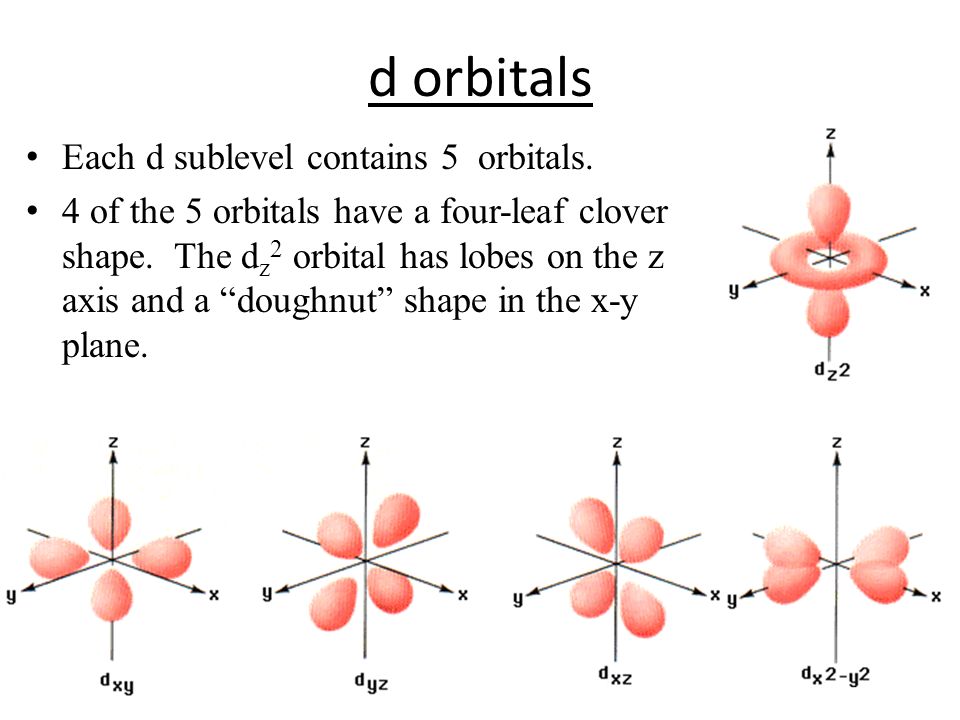 Есть несколько
рекомендации по разработке электронной конфигурации. Это:
Есть несколько
рекомендации по разработке электронной конфигурации. Это:
Каждая орбиталь может содержать только двух электронов . Электроны, которые встречаются вместе на орбитали, являются назвал электронную пару .
Электрон всегда будет пытаться войти на орбиталь с наименьшей возможной энергией.
Электрон будет занимать орбиталь самостоятельно, а не делить орбиталь с другим электроном. An электрон также предпочел бы занять более низкую энергетическую орбиталь с другим электроном, прежде чем занять орбиталь с более высокой энергией. Другими словами, в пределах одного энергетического уровня электроны заполнят s-орбиталь до того, как начинает заполнять p-орбитали.
Подоболочка может содержать 2 электрона
Подоболочка p может содержать 6 электронов
Способ расположения электронов в атоме называется его электронной конфигурацией .
Когда на орбитали два электрона, они называются электронной парой . Если орбиталь имеет только один электрон, этот электрон называется неспаренным электроном .Электрон пары показаны стрелками, указывающими в противоположных направлениях.
- Электронная конфигурация
Электронная конфигурация — это расположение электронов в атоме, молекуле или другой физической структуре.
Диаграммы Aufbau (ESABH)
Электронная конфигурация элемента может быть представлена с помощью диаграмм Ауфбау или уровней энергии. диаграммы.На диаграмме Ауфбау для обозначения электронов используются стрелки. Вы можете использовать следующие шаги, чтобы помочь вам нарисуйте диаграмму Ауфбау:
Определите количество электронов в атоме.
Заполните s-орбиталь на первом энергетическом уровне (1s-орбиталь) первыми двумя электронами.

Заполните s-орбиталь второго энергетического уровня (2s-орбиталь) двумя вторыми электронами.
Поместите по одному электрону в каждую из трех p-орбиталей второго энергетического уровня (2p-орбитали), а затем, если есть еще электроны, вернитесь и поместите второй электрон на каждую из 2p-орбиталей, чтобы заполните электронные пары.
Продолжайте таким образом через каждый из последовательных уровней энергии, пока не будут втянуты все электроны.
Вы можете думать о диаграммах Ауфбау как о людях, садящихся в автобус или поезд.Сначала люди сядут
на пустых местах с пустыми местами между ними и другими людьми (если они не знают людей, а затем они
сяду рядом с ними). Это самая низкая энергия. Когда все места так заполнены, больше людей, которые
получить будет вынужден сесть рядом с кем-то. Это выше по энергии. По мере того, как автобус или поезд заполняется еще больше,
люди должны стоять, чтобы соответствовать. Это высшая энергия.
Это выше по энергии. По мере того, как автобус или поезд заполняется еще больше,
люди должны стоять, чтобы соответствовать. Это высшая энергия.
Aufbau в переводе с немецкого означает «строить».Ученые использовали этот термин, поскольку именно он мы делаем, когда мы разрабатываем электронную конфигурацию, мы строим структуру атомов.
Правило Хунда и принцип Паули
Иногда люди ссылаются на правило Хунда для электронной конфигурации. Это правило просто говорит, что электроны будут скорее быть в подоболочке самостоятельно, чем совместно использовать подоболочку. Вот почему при заполнении подоболочек вы поместите один электрон в каждую подоболочку, а затем вернитесь и заполните подоболочку, прежде чем перейти к следующей энергии уровень.
Принцип исключения Паули просто гласит, что у электронов есть свойство, известное как спин, и что два электрона
в подоболочке не будет так же крутиться. {2} \).{6} \). Диаграмма Ауфбау:
{2} \).{6} \). Диаграмма Ауфбау:
Когда мы рисуем орбитали, мы рисуем фигуру с границей (т.е. замкнутую фигуру). Это представляет собой расстояние от ядра, в котором мы \ (\ text {95} \% \) уверены, что найдем электроны. В реальности электроны атома можно было найти на любом расстоянии от ядра.
Орбитальные формы (ESABJ)
Каждая из орбиталей имеет различную форму.Орбитали s сферические, а орбитали p — гантели. сформированный.
Рисунок 4.13: Орбитальные формы. Слева направо: s-орбиталь, p-орбиталь, три p-орбитали
.Остовные и валентные электроны (ЭСАБК)
Электроны на внешнем энергетическом уровне атома называются валентными электронами . Электроны
которые находятся в энергетических оболочках ближе к ядру, называются остовных электронов . Основные электроны
все электроны в атоме, за исключением валентных электронов. Элемент, имеющий валентный уровень энергии.
полный на более стабильный и с меньшей вероятностью реагируют , чем другие элементы с валентным уровнем энергии
это не полно.
Элемент, имеющий валентный уровень энергии.
полный на более стабильный и с меньшей вероятностью реагируют , чем другие элементы с валентным уровнем энергии
это не полно.
- Валентные электроны
Электроны на внешнем энергетическом уровне атома.
- Основные электроны
Все электроны в атоме, за исключением валентных электронов.
Остовные и валентные электроны
Учебное упражнение 4.4Заполните следующую таблицу:
Элемент или ион | Электронная конфигурация | Электроны ядра | Валентные электроны |
Калий (\ (\ text {K} \)) | |||
Гелий (\ (\ text {He} \)) | |||
Ион кислорода (\ (\ text {O} ^ {2 -} \)) | |||
Ион магния (\ (\ text {Mg} ^ {2 +} \)) |
Решение пока недоступно
Важность понимания электронной конфигурации (ESABL)
На этом этапе у вас может возникнуть вопрос, почему для вас важно понимать, как устроены электроны. вокруг ядра атома.Помните, что во время химических реакций, когда атомы вступают в контакт с одним
другой, это электронов этих атомов, которые будут взаимодействовать первыми. В частности, это валентных электронов атомов, которые будут определять, как они реагируют друг с другом.
вокруг ядра атома.Помните, что во время химических реакций, когда атомы вступают в контакт с одним
другой, это электронов этих атомов, которые будут взаимодействовать первыми. В частности, это валентных электронов атомов, которые будут определять, как они реагируют друг с другом.
Чтобы продвинуться дальше, атом наиболее стабилен (и, следовательно, нереактивен ), когда все его орбитали заполнены. С другой стороны, атом наименее стабилен (и, следовательно, наиболее реактивных ), когда его орбитали валентных электронов не полны.Это станет более понятным, если мы продолжим рассмотрение химической связи в более поздняя глава. Проще говоря, валентные электроны в значительной степени ответственны за химический состав элемента. поведение и элементы, которые имеют одинаковое количество валентных электронов, часто имеют схожие химические свойства.
Самые стабильные конфигурации — это те, которые имеют полный уровень энергии. Эти конфигурации встречаются в
благородные газы. Благородные газы — очень стабильные элементы, которые не реагируют легко (если вообще не реагируют) с какими-либо другими.
элементы.Это связано с полным уровнем энергии. Все элементы стремятся достичь наиболее стабильного электрона.
конфигурации, т.е. все элементы хотят быть благородными газами. Этот принцип устойчивости иногда называют
как правило октета. Октет — это набор из 8, а количество электронов на полном уровне энергии равно 8.
Эти конфигурации встречаются в
благородные газы. Благородные газы — очень стабильные элементы, которые не реагируют легко (если вообще не реагируют) с какими-либо другими.
элементы.Это связано с полным уровнем энергии. Все элементы стремятся достичь наиболее стабильного электрона.
конфигурации, т.е. все элементы хотят быть благородными газами. Этот принцип устойчивости иногда называют
как правило октета. Октет — это набор из 8, а количество электронов на полном уровне энергии равно 8.
Испытания на пламя
Цель
Чтобы определить, какого цвета катион металла вызывает пламя.
Аппарат
Стекло для часов
Горелка Бунзена
метанол
зубочистки (или палочки для шампуров)
солей металлов (например,грамм.
 \ (\ text {NaCl} \), \ (\ text {CuCl} _ {2} \), \ (\ text {CaCl} _ {2} \), \ (\ text {KCl} \) и т. д. )
\ (\ text {NaCl} \), \ (\ text {CuCl} _ {2} \), \ (\ text {CaCl} _ {2} \), \ (\ text {KCl} \) и т. д. )металлические порошки (например, медь, магний, цинк, железо и т. Д.)
Будьте осторожны при работе с горелками Бунзена, так как вы легко можете обжечься. Убедитесь, что все шарфы / свободные одежда надежно заправлена, а длинные волосы собраны назад. Убедитесь, что вы работаете в хорошо вентилируемом помещении. и что рядом с открытым пламенем нет ничего легковоспламеняющегося.
Метод
Для каждой соли или порошка выполните следующие действия:
Окуните чистую зубочистку в метанол
Окуните зубочистку в соль или порошок
Проведите зубочисткой сквозь пламя горелки Бунзена.
 Не держи зубочистку в пламени,
а лучше махайте им взад и вперед через пламя.
Не держи зубочистку в пламени,
а лучше махайте им взад и вперед через пламя.Посмотрите, что происходит
Результаты
Запишите результаты в таблицу, указав соль металла и цвет пламени.
Заключение
Вы должны были заметить разные цвета для каждой из солей и порошков металлов, которые вы тестировали.
Вышеупомянутый эксперимент по испытанию пламени относится к линейчатым спектрам излучения металлов.Эти линии излучения спектры являются прямым результатом расположения электронов в металлах. Каждая металлическая соль имеет уникальный цвет. пламя.
Энергетические диаграммы и электроны
Учебное упражнение 4.5Нарисуйте диаграммы Ауфбау, чтобы показать электронную конфигурацию каждого из следующих элементов:
- магний
- калий
- сера
- неон
- азот
Используя правила рисования диаграмм Ауфбау, получаем следующее.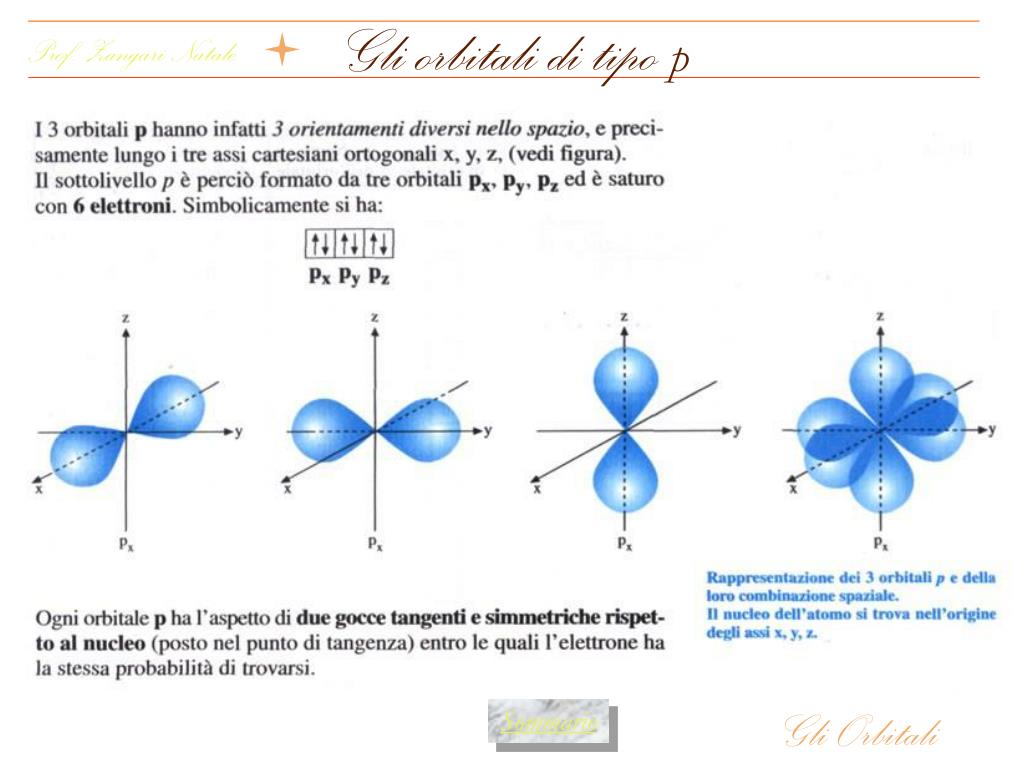
Магний имеет 12 электронов. Итак, мы начинаем с энергетического уровня 1 и помещаем в него 2 электрона. Затем мы переезжаем к энергетическому уровню два, который имеет 2s и 2p орбитали. Этот уровень может содержать 8 электронов. Сложения общее количество используемых электронов дает 10 электронов. Итак, мы должны разместить еще два электрона, и они уйдут. на третий уровень.
Калий имеет 19 электронов.Получаем:
Сера имеет 14 электронов, поэтому мы получаем:
Неон имеет 10 электронов, поэтому получаем:
Азот имеет 7 электронов, поэтому мы получаем:
Используйте нарисованные вами диаграммы Aufbau, чтобы заполнить следующую таблицу:
| Элемент | №уровней энергии с электронами | Кол-во электронов | Кол-во валентных электронов | Электронная конфигурация (стандартное обозначение) |
| \ (\ text {Mg} \) | ||||
| \ (\ text {K} \) | ||||
| \ (\ text {S} \) | ||||
| \ (\ text {Ne} \) | ||||
| \ (\ text {N} \) |
Уровни энергии указаны цифрами над полями, поэтому 1, 2, 3 и т. {3} \)
{3} \)
Расположите элементы, использованные выше, в порядке , увеличивая реактивность .Объясните причины заказа, который вы давать.
Решение пока недоступно.
Урок девятого класса Введение в электронные орбитальные уровни
После того, как я проштамповал разминку, я прошу учеников назвать один орбитальный подуровень. (Я ожидаю, что на этом этапе ученики будут выкрикивать ответы — мы разработали более разговорный стиль обсуждения в классе, когда я задаю вопросы, если я не предваряю вопрос словами «Не отвечайте вслух — я просто хочу, чтобы вы думали» об этом «студенты должны озвучивать свои ответы.)
Я ожидаю, что студенты ответят s, p, d или f в некотором порядке. Когда студенты называют орбитальные подуровни, я перечисляю их на доске. Некоторым учащимся может потребоваться некоторое время, чтобы соединить этот «орбитальный подуровень» с обозначениями s, p, d и f. Как только один ученик правильно озвучивает подуровень, я ожидаю, что остальная часть класса довольно быстро присоединится к остальным.
Как только один ученик правильно озвучивает подуровень, я ожидаю, что остальная часть класса довольно быстро присоединится к остальным.
Затем я раздаю первую часть сегодняшнего задания: подуровни электронных орбит в периодической таблице.
Я говорю студентам, что они могут использовать наборы маркеров, цветные карандаши, мелки или любые другие принадлежности, которые у них есть индивидуально, чтобы выбрать 4 цвета для цветового кодирования своих раздаточных материалов периодической таблицы с 4 различными подуровнями электронной орбиты.Я поднимаю рекламный проспект и спрашиваю класс, заметили ли они что-нибудь внизу страницы под Периодической таблицей. Я надеюсь, что студент ответит описанием предоставленного ключа цветовой кодировки. Я говорю студентам, что они могут использовать любые цвета, которые захотят, при условии, что мы можем сказать по их ключу, какой цвет принадлежит какому орбитальному подуровню.
Я напоминаю студентам, что во время перевернутого видео, которое они смотрели в качестве домашнего задания прошлой ночью, Хэнк показал, какие области Периодической таблицы соответствуют каждому орбитальному подуровню.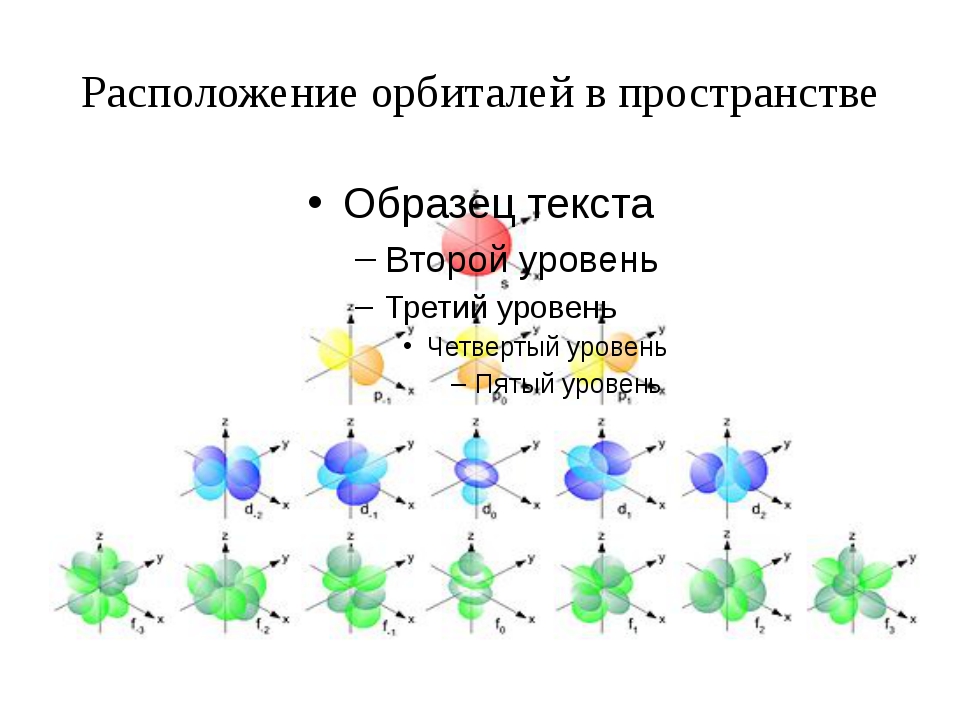 Если учащиеся не могут вспомнить, где находятся эти области, или они хотят дважды проверить перед раскрашиванием, я разрешаю им использовать любые ресурсы, доступные в классе: набор учебников, доступ в Интернет, доступ к YouTube через отдельные мобильные телефоны к перевернутому видео, партнеры по лаборатории и т. д. Студентам предлагается использовать меня в качестве последней проверки перед использованием другого источника.
Если учащиеся не могут вспомнить, где находятся эти области, или они хотят дважды проверить перед раскрашиванием, я разрешаю им использовать любые ресурсы, доступные в классе: набор учебников, доступ в Интернет, доступ к YouTube через отдельные мобильные телефоны к перевернутому видео, партнеры по лаборатории и т. д. Студентам предлагается использовать меня в качестве последней проверки перед использованием другого источника.
Я также говорю студентам, что у них есть только 10 минут на выполнение задания, и записываю на доске свое время в качестве напоминания.
Пока студенты работают, я хожу и наблюдаю. Я спрашиваю студентов, как они думают, что они знают, где находятся подуровни, что они думают о перевернутом видео, почему они выбрали цвета, которые они сделали, и как они думают, что эта информация может быть полезна при выполнении следующих заданий. Если ученик явно неправильно раскрашивает раздаточный материал, я могу задавать вопросы, чтобы понять, в чем заключается недоразумение.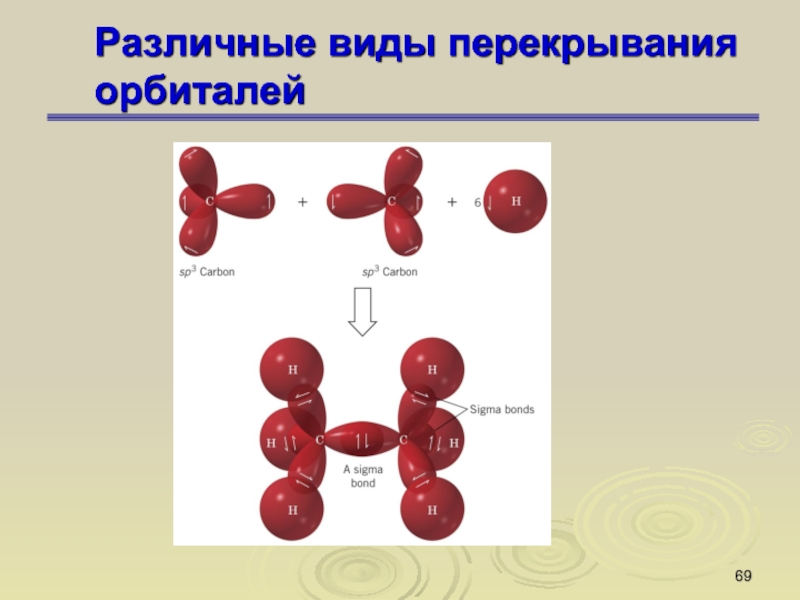 У студента просто переключены подуровни (например, окраска f-орбитальной области в цвет, обозначенный для d-орбиталей, и наоборот), что указывает на проблему с памятью, или же студент объединяет несколько орбиталей в одну, что указывает на понимание проблема? Если студенты действительно сбились с пути, я мог бы дать какие-то индивидуальные инструкции и исправить ошибки, но если у студентов есть незначительные ошибки (переключение орбиталей), я спрошу, уверены ли они в своих ответах, и затем позволю им понять выясните, неверно ли оно (и почему), посоветовавшись с другими студентами.
У студента просто переключены подуровни (например, окраска f-орбитальной области в цвет, обозначенный для d-орбиталей, и наоборот), что указывает на проблему с памятью, или же студент объединяет несколько орбиталей в одну, что указывает на понимание проблема? Если студенты действительно сбились с пути, я мог бы дать какие-то индивидуальные инструкции и исправить ошибки, но если у студентов есть незначительные ошибки (переключение орбиталей), я спрошу, уверены ли они в своих ответах, и затем позволю им понять выясните, неверно ли оно (и почему), посоветовавшись с другими студентами.
По истечении 10 минут или по окончании всего урока (в зависимости от того, что наступит раньше) я прошу студентов поделиться тем, что они раскрасили. Я делаю это с помощью документ-камеры и ЖК-проектора, чтобы мы могли проецировать работу учащегося на доске, и каждый мог просматривать раздаточный материал учащегося. Если нет добровольцев, я случайным образом выберу 3 и проецирую каждого (без указания имени). Мы исследуем его как класс, и если есть ошибки, мы обсуждаем их, и если это правильно, мы обсуждаем, как мы узнаем, что это правильно.Я ожидаю, что мои ученики сделают большую часть логических рассуждений в ходе обсуждения, не требуя от меня слишком много внимания.
Мы исследуем его как класс, и если есть ошибки, мы обсуждаем их, и если это правильно, мы обсуждаем, как мы узнаем, что это правильно.Я ожидаю, что мои ученики сделают большую часть логических рассуждений в ходе обсуждения, не требуя от меня слишком много внимания.
| Термин | Определение | Раздел книги |
|---|---|---|
| сокращенная электронная конфигурация | Электронная конфигурация, в которой один из благородных газов представляет сердцевину электронов вплоть до этого элемента. | Организация электронов в атомах |
| абсолютный ноль | Минимально возможная температура, обозначенная 0 K (ноль кельвинов) | Другие единицы: температура и плотность |
| кислота | Ионное соединение катиона H +, растворенное в воде | Кислоты |
| кислота | Соединение, увеличивающее количество ионов H + в водном растворе | Реакция нейтрализации |
| константа диссоциации кислоты ( K a ) | Константа равновесия диссоциации слабой кислоты на ионы | Некоторые особые типы равновесий |
| кислотная соль | Ионное соединение, водный раствор которого слабокислый | Сильные и слабые кислоты, основания и их соли |
| комплекс активированный | См. Состояние перехода Состояние перехода | Механизмы реакции |
| энергия активации (Ea) | Минимальное количество кинетической энергии, которым должны обладать молекулы для эффективного столкновения | Факторы, влияющие на скорость реакции |
| активный сайт | Область ферментативного действия, в которой реагируют молекулы субстрата | Катализ |
| серия действий | Список элементов, которые заменят элементы под ними в реакциях однократной замены | Типы химических реакций: реакции одинарного и двойного вытеснения |
| фактическая доходность | Количество, которое фактически образуется в химической реакции | Урожайность |
| реакция присоединения | Реакция, в которой атомы присоединяются по двойной или тройной связи | Углеводороды |
| адгезия | Тенденция вещества взаимодействовать с другими веществами под действием межмолекулярных сил | Свойства жидкостей |
| адсорб | Привязать к поверхности другое вещество | Катализ |
| спирт | Органическое соединение, содержащее функциональную группу ОН | Алкилгалогениды и спирты |
| альдегид | Соединение, которое имеет карбонильную функциональную группу на конце цепи из атомов C | Другие кислородсодержащие функциональные группы |
| углеводороды алифатические | Углеводород на основе цепочек атомов C | Углеводороды |
| щелочная батарея | Тип сухого элемента, содержащего щелочной (т. е.е., основная) влажная паста, а не кислая паста е.е., основная) влажная паста, а не кислая паста | Применение окислительно-восстановительных реакций: гальванические элементы |
| алкан | Алифатический углеводород только с одинарными ковалентными связями | Углеводороды |
| алкен | Алифатический углеводород, содержащий двойную связь C – C | Углеводороды |
| алкилгалогенид | Органическое соединение, содержащее атом галогена | Алкилгалогениды и спирты |
| алкин | Алифатический углеводород, содержащий тройную связь C – C | Углеводороды |
| альфа-частица | Тип радиоактивного излучения, эквивалентный ядру гелия | Радиоактивность |
| амидная группа | Функциональная группа, представляющая собой комбинацию аминных и карбонильных функциональных групп | Другие функциональные группы |
| амидная связь | Связь между атомом N и атомом C в амиде. | Другие функциональные группы |
| амин | Органическое производное аммиака | Другие функциональные группы |
| аморфное твердое тело | Твердое тело без длительной структуры и повторений | Твердые |
| амфипротический | Вещество, которое может действовать как донор протонов или акцептор протонов | Кислоты и основания Бренстеда-Лоури |
| аналит | Реагент неизвестной концентрации | Кислотно-основное титрование |
| Квантовое число углового момента (ℓ) | Индекс, влияющий на энергию и пространственное распределение электрона в атоме. | Квантовые числа для электронов |
| анион | Вид с общим отрицательным зарядом | Ионы и ионные соединения |
| анод | Половина ячейки, в которой протекает реакция окисления | Применение окислительно-восстановительных реакций: гальванические элементы |
| разрыхляющая молекулярная орбиталь | Молекулярная орбиталь с более высокой энергией, образованная деструктивным сочетанием атомных орбиталей | Молекулярные орбитали |
| ароматические углеводороды | Плоские кольцевые системы, которые содержат непрерывно перекрывающиеся p-орбитали, такие как бензол | Углеводороды |
| Аррениусовая кислота | Соединение, повышающее концентрацию ионов водорода в водном растворе | Аррениусовы кислоты и основания |
| Основание Аррениуса | Соединение, повышающее концентрацию гидроксид-иона в водном растворе | Аррениусовы кислоты и основания |
| атмосфера (атм) | Единица давления, равная среднему атмосферному давлению на уровне моря; определяется как ровно 760 мм рт. ст. ст. | Давление |
| атом | Наименьший кусок элемента, который сохраняет идентичность этого элемента | Атомная теория |
| атомная масса | Сумма количества протонов и нейтронов в ядре | Атомная теория |
| атомная масса | Средневзвешенное значение масс изотопов, составляющих элемент | Массы атомов и молекул |
| единица атомной массы | Одна двенадцатая массы атома углерода-12 | Массы атомов и молекул |
| атомный номер | Число протонов в атоме | Атомная теория |
| атомный радиус | Указание размера атома. | Периодические тренды |
| атомный символ | Одно- или двухбуквенное представление имени элемента | Атомная теория |
| атомная теория | Представление о том, что атомы играют фундаментальную роль в химии | Атомная теория |
| aufbau принцип | Способ, которым электроны первыми заполняют орбитали с самой низкой энергией. От немецкого «наращивать». От немецкого «наращивать». | Организация электронов в атомах |
| константа автоионизации воды ( K w ) | Произведение концентраций ионов водорода и гидроксид-иона | Автоионизация воды |
| автоионизация воды | Молекулы воды действуют друг с другом как кислоты (доноры протонов) и основания (акцепторы протонов) в незначительной степени во всех водных растворах | Автоионизация воды |
| Закон Авогадро | Газовый закон, который связывает количество частиц с объемом | Законы о других газах |
| вычисленное химическое уравнение | Состояние, при котором реагенты и продукты химического уравнения имеют одинаковое количество атомов всех присутствующих элементов | Химическое уравнение |
| основание | Соединение, увеличивающее количество ионов OH- в водном растворе | Реакция нейтрализации |
| соль основная | Ионное соединение, водный раствор которого является слабощелочным | Сильные и слабые кислоты, основания и их соли |
| беккерель (Бк) | Единица радиоактивности, равная 1 распаду в секунду | Единиц радиоактивности |
| бета-частица | Тип радиоактивного излучения, эквивалентный электрону | Радиоактивность |
| кипячение (или испарение) | Процесс превращения жидкости в газ | Фазовые переходы: плавление, кипение и сублимация |
| точка кипения | Характеристическая температура, при которой жидкость становится газом | Фазовые переходы: плавление, кипение и сублимация |
| превышение точки кипения | Повышение температуры кипения раствора из-за присутствия растворенного вещества | Коллигативные свойства растворов |
| константа повышения температуры кипения ( K b ) | Константа, связывающая молярную концентрацию раствора и изменение его температуры кипения | Коллигативные свойства растворов |
| энергия связи | Приблизительное количество энергии, необходимое для разрыва ковалентной связи | Другие аспекты ковалентного связывания |
| ордер на облигации | Метод оценки прочности сцепления | Молекулярные орбитали |
| связывающая электронная пара | Пара электронов, образующих ковалентную связь | Ковалентные облигации |
| связывающая молекулярная орбиталь | Молекулярная орбиталь с более низкой энергией, образованная конструктивным сочетанием атомных орбиталей | Молекулярные орбитали |
| Закон Бойля | Газовый закон, который связывает давление и объем при постоянной температуре и количестве | Закон о газе |
| углеводороды с разветвленной цепью | Соединение углерода с непрямой цепью, имеющее заместители, присоединенные к самой длинной цепи | Углеводороды с разветвленной цепью |
| Кислота Бренстеда-Лоури | Любые виды, которые могут отдавать протон другой молекуле | Кислоты и основания Бренстеда-Лоури |
| База Бренстеда-Лоури | Любые виды, которые могут принимать протон от другой молекулы | Кислоты и основания Бренстеда-Лоури |
| буфер | Раствор, устойчивый к резким изменениям pH | Буферы |
| буферная емкость | Количество сильной кислоты или основания, которому буфер может противодействовать | Буферы |
| бюретка или бюретка | Точно откалиброванная объемная подающая трубка | Кислотно-основное титрование |
| калорий | Единица измерения энергии, первоначально определяемая как нагрев определенного количества воды. 1 кал = 4,184 Дж 1 кал = 4,184 Дж | Энергия |
| калориметр | Контейнер, используемый для измерения теплоты химической реакции. | Энтальпия и химические реакции |
| калориметрия | Процесс измерения изменения энтальпии химических реакций. | Энтальпия и химические реакции |
| капиллярное действие | Поведение жидкости на узких поверхностях из-за различий в адгезии и когезии | Свойства жидкостей |
| карбонильная группа | Функциональная группа, в которой атом O и атом C соединены двойной связью | Другие кислородсодержащие функциональные группы |
| карбоксильная группа | Функциональная группа, состоящая из карбонильной группы и группы ОН | Другие кислородсодержащие функциональные группы |
| карбоксилат-ион | Отрицательно заряженный ион карбоновой кислоты | Другие кислородсодержащие функциональные группы |
| карбоновая кислота | Молекула с карбоксильной группой | Другие кислородсодержащие функциональные группы |
| катализатор | Вещество, увеличивающее скорость реакции | Сдвиг равновесия: принцип Ле Шателье |
| катализатор | Вещество, которое ускоряет реакцию, участвуя в ней, но не потребляется | Факторы, влияющие на скорость реакции |
| катализатор | Вещество, которое снижает энергию активации определенной реакции, обеспечивая альтернативный путь реакции | Катализ |
| катод | Половина ячейки, содержащая реакцию восстановления | Применение окислительно-восстановительных реакций: гальванические элементы |
| катион | Вид с общим положительным зарядом | Ионы и ионные соединения |
| центральный атом | Атом в центре молекулы | Ковалентные облигации |
| Закон Чарльза | Газовый закон, который связывает объем и температуру при постоянном давлении и количестве | Закон о газе |
| химическая связь | Связь между двумя атомами в молекуле | Молекулы и химическая номенклатура |
| химическое изменение | Процесс демонстрации химического свойства | Некоторые основные определения |
| химическое уравнение | Краткий способ представления химической реакции | Химическое уравнение |
| химическое равновесие | Точка, в которой прямые и обратные химические реакции уравновешивают друг друга | Химическое равновесие |
| химическая номенклатура | Очень специфическая система наименования соединений, в которой уникальные вещества получают уникальные имена | Молекулы и химическая номенклатура |
| химическое свойство | Характеристика, описывающая изменение формы материи в присутствии другой материи | Некоторые основные определения |
| химия | Изучение взаимодействия материи с другой материей и с энергией | Введение |
| коэффициент | Часть числа в экспоненциальном представлении, умноженная на степень 10 | .Выражение чисел |
| коэффициент | Число в химическом уравнении, обозначающее более одной молекулы вещества | Химическое уравнение |
| сцепление | Тенденция вещества взаимодействовать с самим собой | Свойства жидкостей |
| коллигативная собственность | Свойство растворов, связанное с долей растворенных частиц в растворе, а не их идентичностью | Коллигативные свойства растворов |
| теория столкновений | Теория, согласно которой реакции происходят, когда молекулы реагентов «эффективно сталкиваются» | Факторы, влияющие на скорость реакции |
| Закон о комбинированном газе | Газовый закон, сочетающий давление, объем и температуру | Законы о других газах |
| реакция горения | Химическая реакция, в которой реагент соединяется с кислородом с образованием оксидов всех других элементов в виде продуктов | Реакции состава, разложения и горения |
| полное ионное уравнение | Химическое уравнение, в котором растворенные ионные соединения записываются как отдельные ионы | Ионные уравнения: более внимательный взгляд |
| состав реакция | Химическая реакция, в которой одно вещество образуется из нескольких реагентов | Реакции состава, разложения и горения |
| соединение | Комбинация более чем одного элемента | Некоторые основные определения |
| коэффициент сжимаемости | Мера отклонения от характеристик идеального газа.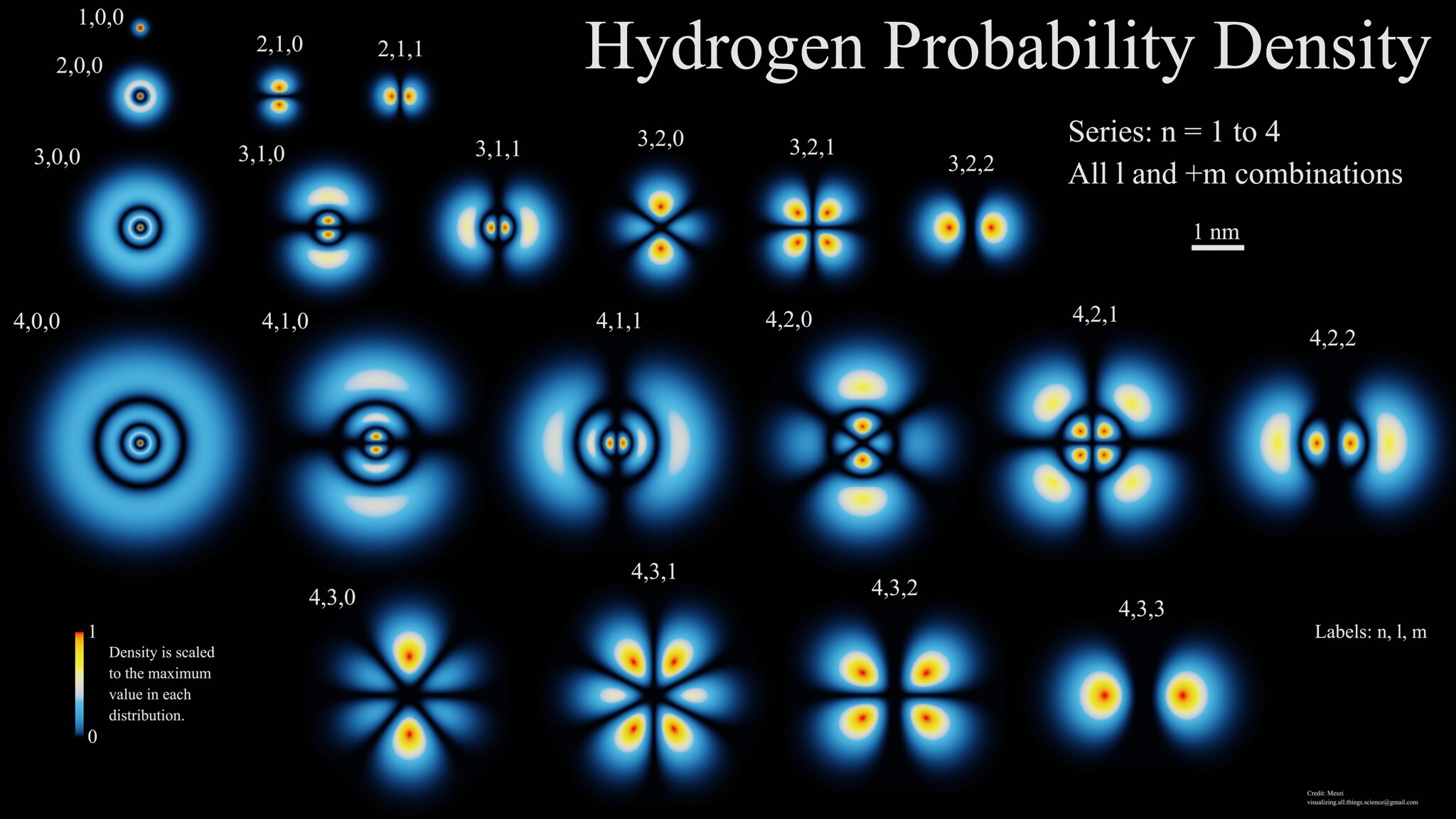 | Реальные газы |
| концентрированный раствор | Раствор с большим количеством растворенных веществ | Некоторые определения |
| концентрация | Сколько растворенного вещества растворено в данном количестве растворителя | Некоторые определения |
| концентрация (глагол) | Удаление растворителя, увеличивающее концентрацию растворенного вещества в растворе | Разведения и концентрации |
| конденсация | Процесс превращения газа в жидкость | Фазовые переходы: плавление, кипение и сублимация |
| конденсированная структура | Список атомов, связанных с каждым атомом C в цепи | Углеводороды |
| сопряженная кислотно-основная пара | Два вида, формулы которых различаются только ионом водорода | Кислоты и основания Бренстеда-Лоури |
| непрерывный спектр | Изображение, содержащее все цвета света. | Квантовые числа для электронов |
| коэффициент преобразования | Дробь, которую можно использовать для перевода количества из одной единицы в другую | Преобразователи |
| ковалентная связь | Химическая связь, образованная двумя атомами, разделяющими электроны. | Ковалентные облигации |
| твердые тела с ковалентной сеткой | Кристаллическое твердое вещество, состоящее из атомов одного или нескольких элементов, ковалентно связанных друг с другом, казалось бы, бесконечным образом | Твердые |
| критическая точка | Точка наивысшей температуры и давления, при которой жидкости и газы остаются различимыми | Свойства жидкостей |
| твердое кристаллическое | Твердое тело с правильной повторяющейся трехмерной структурой | Твердые |
| кюри | Единица радиоактивности, равная 3.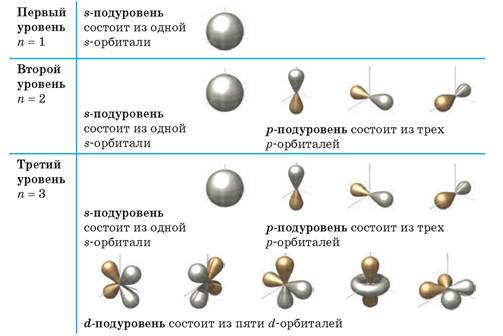 7 × 1010 распадов / с 7 × 1010 распадов / с | Единиц радиоактивности |
| d блок | Столбцы периодической таблицы, в которых занято d подоболочек. | Электронная структура и периодическая таблица |
| Закон парциальных давлений Дальтона | Общее давление газовой смеси Ptot равно сумме парциальных давлений компонентов Pi | Смеси газовые |
| дочерний изотоп | Продукт, оставшийся от исходного изотопа в ядерном уравнении | Радиоактивность |
| реакция разложения | Химическая реакция, в которой одно вещество превращается в несколько веществ | Реакции состава, разложения и горения |
| градусов | Блок температурных шкал | Другие единицы: температура и плотность |
| плотность | Физическое свойство, определяемое как масса вещества, деленная на его объем | Другие единицы: температура и плотность |
| осаждение | Процесс превращения газа в твердое вещество | Фазовые переходы: плавление, кипение и сублимация |
| производная единица | Единица, являющаяся произведением или частным от основной единицы | Блоки экспрессии |
| двухатомная молекула | Молекула, состоящая всего из двух атомов | Молекулы и химическая номенклатура |
| диффузор | Движение молекул газа через один или несколько дополнительных типов газа посредством случайного молекулярного движения | Молекулярная диффузия и диффузия |
| разбавленный | Раствор с очень низким содержанием растворенных веществ | Некоторые определения |
| разведение | Добавление растворителя, уменьшающее концентрацию растворенного вещества в растворе | Разведения и концентрации |
| уравнение разбавления | Математическая формула для расчета новых концентраций или объемов при разбавлении или концентрировании раствора | Разведения и концентрации |
| диполь-дипольные взаимодействия | Межмолекулярная сила, вызванная молекулами с постоянным диполем | Межмолекулярные силы |
| дисперсионная сила (или лондонская дисперсионная сила) | Межмолекулярная сила, вызванная мгновенным положением электрона в молекуле | Межмолекулярные силы |
| диссоциация | Процесс разделения ионного соединения на ионы при растворении | Ионные уравнения: более внимательный взгляд |
| двойная связь | Ковалентная связь, состоящая из двух пар связывающих электронов | Ковалентные облигации |
| реакция двойной замены | Химическая реакция, в которой части двух ионных соединений меняются | Типы химических реакций: реакции одинарного и двойного вытеснения |
| сухая камера | Современный аккумулятор, не содержащий большого количества водного раствора | Применение окислительно-восстановительных реакций: гальванические элементы |
| динамическое равновесие | Когда процесс все еще происходит, но противоположный процесс также происходит с той же скоростью, поэтому в системе нет чистых изменений. | Свойства жидкостей |
| эффективный заряд ядра (Zeff) | Чистый заряд ядра, ощущаемый валентными электронами. | Периодические тренды |
| излияние | Перемещение молекул газа из одного контейнера в другой через крошечное отверстие | Молекулярная диффузия и диффузия |
| электродов | Катод или анод гальванического элемента | Применение окислительно-восстановительных реакций: гальванические элементы |
| электролиз | Процесс возникновения неспонтанной окислительно-восстановительной реакции путем подачи электричества в ячейку | Электролиз |
| электролизер | Ячейка, в которой электричество вынуждает вызвать несамопроизвольную реакцию | Электролиз |
| электромагнитный спектр | Полный диапазон возможных длин волн, частот и энергий света. | Свет |
| электрон | Крошечная субатомная частица с отрицательным зарядом | Атомная теория |
| сродство к электрону (EA) | Изменение энергии, когда атом в газовой фазе принимает электрон.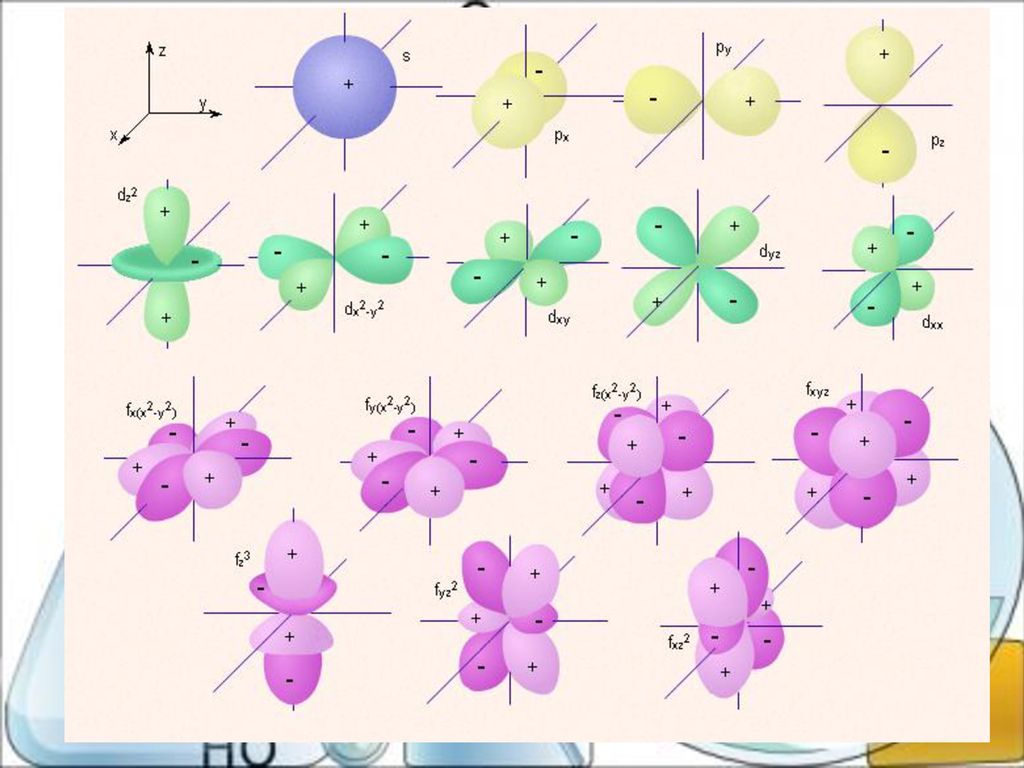 | Периодические тренды |
| электронная конфигурация | Список меток оболочки и подоболочки. | Организация электронов в атомах |
| электронодефицитные молекулы | Молекула с менее чем восемью электронами в валентной оболочке атома | Нарушения правила октета |
| геометрия группы электронов | как устроены электронные группы (связи и несвязывающие электронные пары) | Молекулярные формы и полярность |
| электронных групп | Ковалентная связь любого типа или неподеленная электронная пара | Молекулярные формы и полярность |
| электронная оболочка | Термин, используемый для описания электронов с одним и тем же главным квантовым числом. | Квантовые числа для электронов |
| электроотрицательность | Шкала для оценки того, насколько атомы любого элемента притягивают электроны | Другие аспекты ковалентного связывания |
| гальваника | Нанесение тонкого слоя металла на объект в защитных или декоративных целях | Электролиз |
| элемент | Вещество, которое не может быть расщеплено на более простые химические вещества обычными химическими средствами | Некоторые основные определения |
| элементарный шаг | Каждое событие, происходящее в химической реакции в результате эффективного столкновения | Механизмы реакции |
| реакция элиминирования | Удаление функциональной группы (X или OH) и атома H из соседнего углерода | Алкилгалогениды и спирты |
| эндотермический | Химическая реакция с положительным изменением энтальпии. | Энтальпия и химические реакции |
| энергия | Умение делать работу. | Энергия |
| изменение энтальпии | Теплота процесса при постоянном давлении. Обозначается как Δ H . | Энтальпия и химические реакции |
| энтальпия образования | Изменение энтальпии для реакции образования; обозначается как ΔHf. | Реакции образования |
| энтальпия плавления | Количество энергии, необходимое для перехода из твердого состояния в жидкое или из жидкого в твердое | Фазовые переходы: плавление, кипение и сублимация |
| энтальпия сублимации | Количество энергии, необходимое для перехода от твердого тела к газу или от газа к твердому телу | Фазовые переходы: плавление, кипение и сублимация |
| энтальпия испарения | Количество энергии, необходимое для перехода от жидкости к газу или от газа к жидкости | Фазовые переходы: плавление, кипение и сублимация |
| энтропия | Уровень случайности (или беспорядка) системы или мера распределения энергии молекул в системе | Энтропия и второй закон термодинамики |
| фермент | Белковые молекулы, катализирующие биохимические реакции | Катализ |
| фермент-субстратный комплекс | Связывание субстрата с ферментативным активным центром | Катализ |
| константа равновесия (Keq) | Числовое значение, относящееся к соотношению продуктов и реагентов при равновесии | Константа равновесия |
| точка эквивалентности | Точка реакции, когда весь аналит прореагировал с титрантом | Кислотно-основное титрование |
| эфирная группа | Функциональная группа, образованная соединением карбоновой кислоты со спиртом | Другие кислородсодержащие функциональные группы |
| эфирная группа | Функциональная группа, которая имеет атом O, присоединенный к двум органическим группам | Другие кислородсодержащие функциональные группы |
| испарение | Образование газовой фазы из жидкости при температуре ниже точки кипения | Свойства жидкостей |
| точное число | Число из определенного отношения, которое технически имеет бесконечное количество значащих цифр | Преобразователи |
| экзотермический | Химическая реакция с отрицательным изменением энтальпии.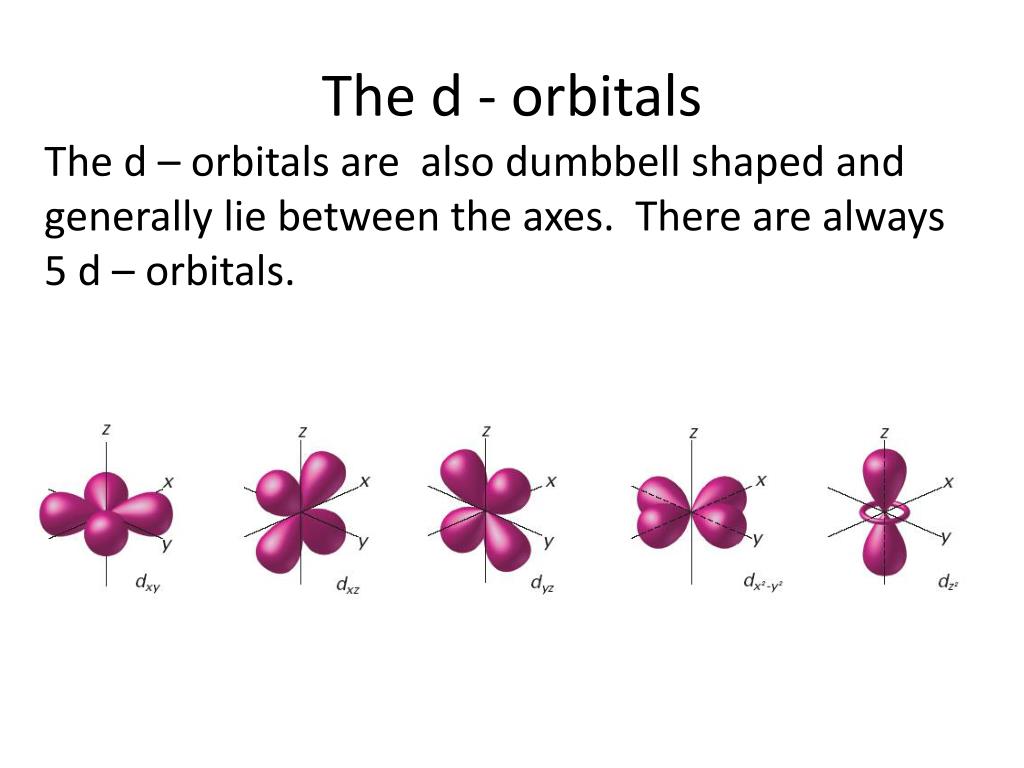 | Энтальпия и химические реакции |
| молекулы расширенной валентной оболочки | Молекула с более чем восемью электронами в валентной оболочке атома | Нарушения правила октета |
| опыт | Тест естественной вселенной, чтобы проверить, верна ли догадка (гипотеза) | Химия как наука |
| показатель | Число с выпуклостью справа от 10, указывающее количество множителей 10 в исходном числе | Выражение чисел |
| f блок | Столбцы таблицы Менделеева, в которых занято f подоболочек. | Электронная структура и периодическая таблица |
| деление | Распад атомного ядра на более мелкие ядра | Радиоактивность |
| реакция образования | Химическая реакция, при которой образуется один моль вещества из составляющих его элементов в их стандартном состоянии. | Реакции образования |
| Депрессия точки замерзания | Снижение точки замерзания раствора из-за присутствия растворенного вещества | Коллигативные свойства растворов |
| Константа депрессии точки замерзания (Kf) | Константа, связывающая молярную концентрацию раствора и изменение его точки замерзания | Коллигативные свойства растворов |
| частота | Количество световых циклов, проходящих через заданную точку за одну секунду.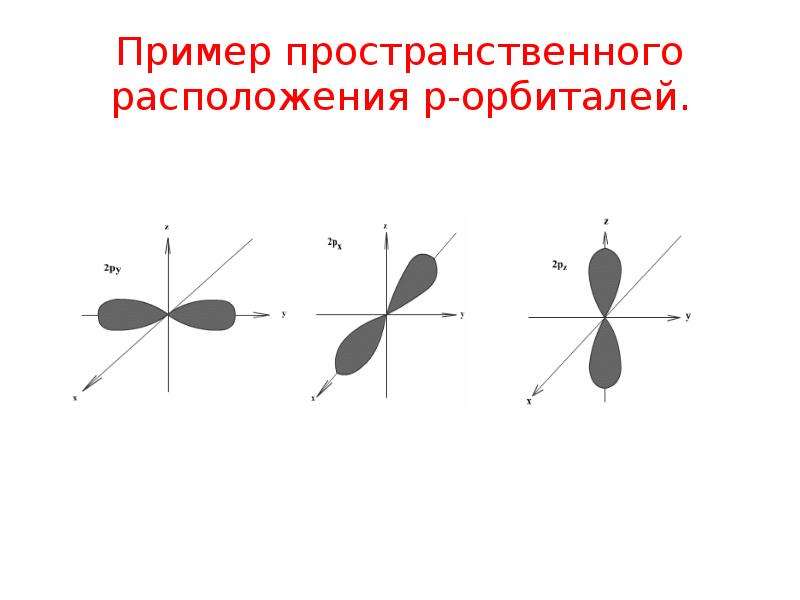 | Свет |
| коэффициент частоты ( A ) | Фактор, учитывающий частоту реакций и вероятность правильной ориентации молекул | Энергия активации и уравнение Аррениуса |
| граничные молекулярные орбитали | Термин, относящийся к HOMO и LUMO, орбиталям, наиболее вероятным для участия в химических реакциях или процессах | Молекулярные орбитали |
| функциональная группа | Набор атомов или связей с определенными характерными реакциями | Алкилгалогениды и спирты |
| основные элементы | Одна из семи основных единиц СИ, используемых в науке | Блоки экспрессии |
| гамма-луч | Тип радиоактивного излучения, представляющий собой очень мощную форму электромагнитного излучения | Радиоактивность |
| газовый закон | Простая математическая формула, позволяющая моделировать или предсказывать поведение газа | Закон о газе |
| Закон Гей-Люссака | Газовый закон, связывающий давление с абсолютной температурой | Законы о других газах |
| Счетчик Гейгера | Электрическое устройство, обнаруживающее радиоактивность | Единиц радиоактивности |
| Свободная энергия Гиббса ( G ) | Мера спонтанности, которая включает энтальпию и энтропию | Свободная энергия Гиббса |
| Закон излияния Грэма | Закон, связывающий скорость истечения газа с величиной, обратной квадратному корню из его молярной массы. | Молекулярная диффузия и диффузия |
| серый (Gy) | Единица радиоактивного облучения равная 100 рад | Единиц радиоактивности |
| полуэлемент | Часть гальванического элемента, содержащая половину реакции | Применение окислительно-восстановительных реакций: гальванические элементы |
| полуреакция | Индивидуальная реакция окисления или восстановления окислительно-восстановительной реакции | Балансировка окислительно-восстановительных реакций |
| метод полуреакции | Метод уравновешивания окислительно-восстановительных реакций путем записи и уравновешивания индивидуальных полуреакций | Балансировка окислительно-восстановительных реакций |
| период полураспада | Время, необходимое для распада половины радиоактивного изотопа | Период полураспада |
| период полураспада | Время, необходимое для того, чтобы концентрация реагента упала до половины его начальной концентрации | Взаимосвязь концентрации и времени: законы о комплексной ставке |
| тепло | Передача энергии от одного тела к другому из-за разницы температур. | Работа и тепло |
| кривая нагрева | График зависимости температуры от количества добавленного тепла | Фазовые переходы: плавление, кипение и сублимация |
| Закон Гесса | Когда химические уравнения объединяются алгебраически, их энтальпии могут быть объединены точно так же. | Закон Гесса |
| гетерогенный катализатор | Катализатор, который находится в фазе, отличной от фазы одного или нескольких реагентов | Катализ |
| гетерогенное равновесие | Равновесие, в котором присутствует более одной фазы реагентов или продуктов | Константа равновесия |
| гетерогенная смесь | Неоднородное сочетание более чем одного вещества | Некоторые основные определения |
| HOMO | Самая высокая занятая молекулярная орбиталь | Молекулярные орбитали |
| гомогенный катализатор | Катализатор, находящийся в той же фазе, что и молекулы реагента | Катализ |
| гомогенная смесь | Однородная смесь более чем одного вещества, которая ведет себя как одно вещество | Некоторые основные определения |
| Правило Хунда | Один электрон помещается на каждую вырожденную орбиталь перед спариванием электронов на одной орбитали. | Организация электронов в атомах |
| гибридизация | Математическое смешение атомных орбиталей | Теория валентной связи и гибридные орбитали |
| углеводороды | Органическое соединение, состоящее из углерода и водорода | Углеводороды |
| водородная связь | Очень сильное взаимодействие между молекулами из-за того, что атомы H связаны с атомами N, O или F | Межмолекулярные силы |
| реакция гидрирования | Реакция водорода через двойную или тройную связь C – C, обычно в присутствии катализатора | Углеводороды |
| ион гидроксония | Фактическое химическое соединение, представляющее ион водорода в водном растворе | Аррениусовы кислоты и основания |
| гипотеза | Обоснованное предположение о том, как устроена естественная вселенная | Химия как наука |
| гидролиз | Реакция с водой | Кислоты и основания Бренстеда-Лоури |
| График ICE | Таблица, используемая для расчета значений равновесия, содержащая строки начальной, измененной и эквивалентной концентрации | Расчет значений констант равновесия |
| идеальный газ | Газ, который точно соответствует принципам кинетической молекулярной теории. | Реальные газы |
| Закон идеального газа | Газовый закон, связывающий все четыре независимых физических свойства газа при любых условиях | Закон об идеальном газе и некоторые приложения |
| индикатор | Вещество, изменение цвета которого указывает на точку эквивалентности титрования | Кислотно-основное титрование |
| начальная ставка | Мгновенная скорость в начале реакции | Скорость реакции |
| метод начальных ставок | Метод определения закона скорости по мгновенной скорости реакции при смешивании реагентов | Тарифные законы |
| мгновенная скорость реакции | Скорость реакции в один момент времени | Скорость реакции |
| средний | Химическое соединение не появляется в общем сбалансированном уравнении и генерируется на одном элементарном этапе, но используется на следующем этапе | Механизмы реакции |
| ион | Вид с общим электрическим зарядом | Ионы и ионные соединения |
| ионное соединение | Соединение, образованное положительными и отрицательными ионами | Ионы и ионные соединения |
| ионная формула | Химическая формула ионного соединения | Ионы и ионные соединения |
| ионное твердое вещество | Кристаллическое твердое вещество, состоящее из ионов | Твердые |
| энергия ионизации (IE) | Количество энергии, необходимое для удаления электрона от атома в газовой фазе.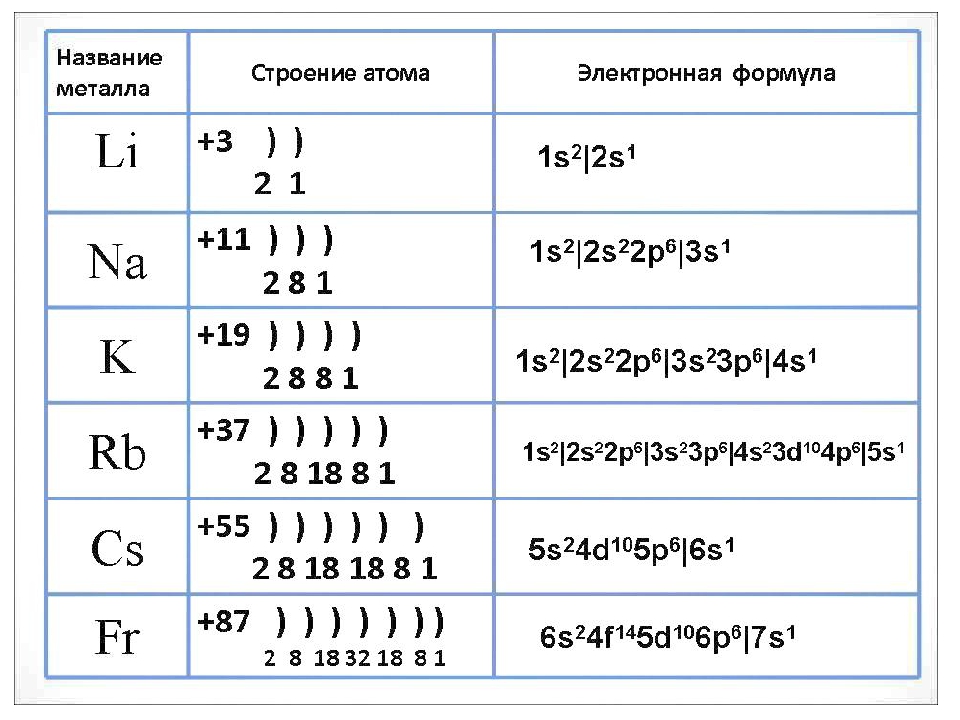 | Периодические тренды |
| изолированная система | Система, которая не позволяет перенос энергии или материи внутрь или наружу. | Энергия |
| изомер | Молекула с той же молекулярной формулой, что и другая молекула, но другой структуры | Углеводороды |
| изотермический | Процесс, не изменяющий температуру | Фазовые переходы: плавление, кипение и сублимация |
| изотопов | Атомы одного элемента с разным числом нейтронов | Атомная теория |
| джоуль | Единица измерения энергии в системе СИ. | Энергия |
| кельвин | Основная единица измерения температуры в SI | Другие единицы: температура и плотность |
| кетон | Соединение, в котором карбонильный углерод присоединен к двум углеродным цепям | Другие кислородсодержащие функциональные группы |
| кинетическая энергия | Энергия движения | Кинетико-молекулярная теория газов |
| кинетическая молекулярная теория газов | Модель, которая помогает нам понять газы на молекулярном уровне и их физические свойства | Кинетико-молекулярная теория газов |
| кинетика | Исследование скорости реакции и факторов, которые могут влиять на скорость реакции | Введение в кинетику |
| закон сохранения энергии | Закон физики, который гласит, что полная энергия изолированной системы не увеличивается и не уменьшается. | Энергия |
| закон масс | Соотношение количеств реагентов и продуктов при равновесии | Константа равновесия |
| Принцип Ле Шателье | Если равновесие нарушено, реакция смещается, чтобы уменьшить напряжение | Сдвиг равновесия: принцип Ле Шателье |
| Диаграмма Льюиса | Изображение валентных электронов атома с использованием точек вокруг символа элемента. | Электронно-точечные диаграммы Льюиса |
| ограничивающий реагент | Реагент, который выходит первым в данной химической реакции | Ограничивающие реагенты |
| линейчатый спектр | Изображение, содержащее только определенные цвета света | Квантовые числа для электронов |
| локант | Числовое положение заместителя | Углеводороды с разветвленной цепью |
| замок и ключ модель | Простая модель, используемая для описания активности ферментов, где субстраты должны соответствовать активным центрам соответствующей формы | Катализ |
| неподеленные электронные пары | Пара электронов, не образующих ковалентной связи | Ковалентные облигации |
| LUMO | Самая низкая незанятая молекулярная орбиталь | Молекулярные орбитали |
| магнитное квантовое число (мℓ) | Индекс, определяющий ориентацию пространственного распределения электрона. | Квантовые числа для электронов |
| массово-массовый расчет | Расчет, в котором вы начинаете с заданной массы вещества и вычисляете массу другого вещества, участвующего в химическом уравнении | Расчет молекулярной массы и массы-массы |
| материя | Все, что имеет массу и занимает место. | Некоторые основные определения |
| длина свободного пробега | Среднее расстояние, пройденное молекулой между столкновениями. | Молекулярная диффузия и диффузия |
| плавка | Процесс превращения твердого тела в жидкость | Фазовые переходы: плавление, кипение и сублимация |
| точка плавления | Характеристическая температура, при которой твердое вещество становится жидкостью | Фазовые переходы: плавление, кипение и сублимация |
| мениск | Изогнутая поверхность, которую создает жидкость при приближении к твердой преграде | Свойства жидкостей |
| металл | Элемент, который хорошо проводит электричество и тепло, блестящий, серебристый, твердый, пластичный и податливый | Некоторые основные определения |
| металлический цельный | Твердое тело с характерными свойствами металла | Твердые |
| микросостояние ( Вт ) | Термин, используемый для описания различных возможных расположений молекул и кинетической энергии в определенном термодинамическом состоянии | Энтропия и второй закон термодинамики |
| миллиметры ртутного столба (мм рт. Ст.) | Величина давления, оказываемого столбом ртути высотой ровно 1 мм | Давление |
| смесь | Физическая комбинация более чем одного вещества | Некоторые основные определения |
| моляльность (м) | Количество молей растворенного вещества на килограмм растворителя | Количественные единицы концентрации |
| молярная масса | Масса 1 моля вещества в граммах | Крот |
| молярный объем | Объем ровно 1 моль газа; равно 22.4 л на СТП. | Закон об идеальном газе и некоторые приложения |
| молярность (M) | Число молей растворенного вещества, деленное на количество литров раствора | Количественные единицы концентрации |
| моль | Число элементов, равное числу атомов ровно в 12 г углерода-12; равно 6.022 × 1023 штуки | Крот |
| мольная доля | Отношение количества молей компонента в смеси к общему количеству молей в образце | Смеси газовые |
| мольная доля | Отношение количества молей компонента к общему количеству молей в системе | Коллигативные свойства растворов |
| молекулярная формула | Формальный список того, что и сколько атомов находится в молекуле | Молекулы и химическая номенклатура |
| геометрия молекулы | как расположены атомы в молекуле | Молекулярные формы и полярность |
| молекулярная масса | Сумма масс атомов в молекуле | Массы атомов и молекул |
| теория молекулярных орбиталей (теория МО) | Более сложная модель химической связи, в которой новые молекулярные орбитали генерируются с помощью математического процесса, называемого линейной комбинацией атомных орбиталей (LCAO) | Молекулярные орбитали |
| молекулярная полярность | Векторная сумма диполей отдельных связей | Молекулярные формы и полярность |
| молекулярное твердое вещество | Кристаллическое твердое вещество, компоненты которого представляют собой ковалентно связанные молекулы | Твердые |
| Молекулярность | Общее количество молекул, участвующих в эффективном столкновении элементарной ступени | Механизмы реакции |
| молекула | Наименьшая часть вещества, имеющая физические и химические свойства этого вещества | Молекулы и химическая номенклатура |
| расчет молярной массы | Расчет, в котором вы начинаете с заданного количества молей вещества и вычисляете массу другого вещества, участвующего в химическом уравнении, или наоборот | Расчет молекулярной массы и массы-массы |
| моль-моль в расчете | Расчет стехиометрии, когда начинают с молей одного вещества и переводят в моли другого вещества с помощью сбалансированного химического уравнения | Моль в химических реакциях |
| мономер | Повторяющийся блок полимера | Полимеры |
| чистое ионное уравнение | Химическое уравнение с удаленными ионами-наблюдателями | Ионные уравнения: более внимательный взгляд |
| соль нейтральная | Ионное соединение, не влияющее на кислотность его водного раствора | Сильные и слабые кислоты, основания и их соли |
| реакция нейтрализации | Реакция кислоты и основания с образованием воды и соли | Реакция нейтрализации |
| нейтрон | Субатомная частица без заряда | Атомная теория |
| узел (узловая плоскость) | Область нулевой электронной плотности | Молекулярные орбитали |
| номенклатура | Правила наименования в органической химии | Углеводороды с разветвленной цепью |
| неметалл | Элемент, который существует в различных цветах и фазах, является хрупким и плохо проводит электричество или тепло | Некоторые основные определения |
| неполярная ковалентная связь | Равное разделение электронов ковалентной связью | Другие аспекты ковалентного связывания |
| нормальная точка кипения | Характеристическая температура, при которой жидкость становится газом, когда окружающее давление составляет ровно 1 атм | Фазовые переходы: плавление, кипение и сублимация |
| атомная энергия | Управляемый сбор энергии из реакций деления | Ядерная энергия |
| ядерное уравнение | Химическое уравнение, подчеркивающее изменения в атомных ядрах | Радиоактивность |
| ядерная модель | Модель атома с протонами и нейтронами в центральном ядре с электронами на орбите вокруг ядра | Атомная теория |
| ядро | Центр атома, содержащий протоны и нейтроны | Атомная теория |
| молекул с нечетными электронами | Молекула с нечетным числом электронов в валентной оболочке атома | Нарушения правила октета |
| орбитальный | Определенный набор главных, углового момента и магнитных квантовых чисел для электрона. | Квантовые числа для электронов |
| осмос | Тенденция молекул растворителя проходить через полупроницаемую мембрану из-за разницы концентраций | Коллигативные свойства растворов |
| осмотическое давление | Тенденция раствора пропускать растворитель через полупроницаемую мембрану из-за разницы концентраций | Коллигативные свойства растворов |
| окисление | Потеря одного или нескольких электронов атомом; увеличение степени окисления | Реакции окисления-восстановления |
| степень окисления | Номер, присвоенный атому, который помогает отслеживать количество электронов на атоме | Реакции окисления-восстановления |
| окислительно-восстановительные (окислительно-восстановительные) реакции | Химическая реакция с переносом электронов | Реакции окисления-восстановления |
| п блок | Столбцы периодической таблицы, в которых занято p подоболочек. | Электронная структура и периодическая таблица |
| родительский изотоп | Реагент в ядерном уравнении | Радиоактивность |
| частей на миллиард (ppb) | Отношение массы растворенного вещества к общей массе образца, умноженное на 1 000 000 000 | Количественные единицы концентрации |
| частей на миллион (ppm) | Отношение массы растворенного вещества к общей массе образца, умноженное на 1000000 | Количественные единицы концентрации |
| частей на тысячу (ppth) | Отношение массы растворенного вещества к общей массе пробы, умноженной на 1000 | Количественные единицы концентрации |
| Принцип исключения Паули | Никакие два электрона в атоме не могут иметь одинаковый набор из четырех квантовых чисел. | Организация электронов в атомах |
| процентная доходность | Фактическая доходность, деленная на теоретическую доходность, умноженную на 100%, дает процентное значение от 0% до 100% | Урожайность |
| процентный состав по массе (или массовый процент,% м / м) | Отношение массы растворенного вещества к общей массе образца, умноженное на 100 | Количественные единицы концентрации |
| таблица Менделеева | Схема всех элементов | Атомная теория |
| периодические тенденции | Изменение свойств в зависимости от положения в периодической таблице. | Периодические тренды |
| pH | Отрицательный логарифм концентрации ионов водорода | Шкала pH |
| Шкала pH | Диапазон значений от 0 до 14, который описывает кислотность или основность раствора | Шкала pH |
| фаза | Важное физическое свойство, которое определяет, является ли вещество твердым, жидким, газовым или сверхкритическим флюидом | Некоторые основные определения |
| фазовая диаграмма | Графическое изображение равновесных соотношений, существующих между фазами вещества при определенных давлениях и температурах | Свойства жидкостей |
| фотон | Имя дискретной единицы света, действующей как частица. | Свет |
| физическое изменение | Изменение, которое происходит, когда образец вещества меняет одно или несколько своих физических свойств | Некоторые основные определения |
| физическая собственность | Характеристика, описывающая материю в том виде, в котором она существует | Некоторые основные определения |
| пи связь (пи связь) | Боковое перекрытие p-орбиталей, размещение электронной плотности по разные стороны от межъядерной оси — двойная или тройная связь | Теория валентной связи и гибридные орбитали |
| Постоянная Планка | Константа пропорциональности между частотой и энергией света: 6.626 × 10 в степени −34 Дж · с. | Свет |
| pOH | Отрицательный логарифм концентрации гидроксид-иона | Шкала pH |
| полярная ковалентная связь | Ковалентная связь между разными атомами, которая в разной степени притягивает общие электроны и вызывает дисбаланс электронного распределения | Другие аспекты ковалентного связывания |
| полярность | Мера неравномерного распределения электронов, которое привело к дипольному моменту | Другие аспекты ковалентного связывания |
| многоатомные ионы | Ион, содержащий более одного атома | Ионы и ионные соединения |
| полимер | Длинная молекула, состоящая из множества повторяющихся звеньев | Полимеры |
| полимеризация | Процесс изготовления полимера | Полимеры |
| полипротонная кислота | Кислота, способная отдавать более одного иона H + | Некоторые особые типы равновесий |
| осадок | Твердое вещество, выпадающее из раствора в результате реакции осаждения | Типы химических реакций: реакции одинарного и двойного вытеснения |
| реакция осаждения | Химическая реакция, при которой два ионных соединения растворяются в воде и образуют новое ионное соединение, которое не растворяется | Типы химических реакций: реакции одинарного и двойного вытеснения |
| префикс | Префикс, используемый с единицей, которая относится к кратной или дробной части основной единицы, чтобы сделать единицу более удобного размера для определенного количества | Блоки экспрессии |
| давление | Сила на единицу площади | Давление |
| первичная батарея | Аккумулятор, который нельзя перезарядить | Применение окислительно-восстановительных реакций: гальванические элементы |
| главное квантовое число (n) | Индекс, который в значительной степени определяет энергию электрона в атоме. | Квантовые числа для электронов |
| товар | Конечное вещество в химическом уравнении | Химическое уравнение |
| протон | Субатомная частица с положительным зарядом | Атомная теория |
| качественный | Описание качества объекта | Химия как наука |
| количественный | Описание определенного количества чего-либо | Химия как наука |
| квантование | Когда количество ограничено определенными значениями. | Квантовые числа для электронов |
| квантовая механика | Теория электронов, которая рассматривает их как волны. | Квантовые числа для электронов |
| квантовое число | Индекс, соответствующий такому свойству электрона, как его энергия. | Квантовые числа для электронов |
| рад | Единица радиоактивного облучения, равная 0,01 Дж / г ткани | Единиц радиоактивности |
| радиоактивный распад | Самопроизвольное изменение ядра от одного элемента к другому | Радиоактивность |
| радиоактивность | Излучение частиц и излучение атомных ядер | Радиоактивность |
| Закон Рауля | Математическая формула для расчета давления пара раствора | Коллигативные свойства растворов |
| константа скорости ( k ) | Константа пропорциональности, специфичная для каждой реакции при определенной температуре | Тарифные законы |
| этап определения скорости | Самый медленный шаг в многоступенчатом механизме | Механизмы реакции |
| тарифный закон | Математическая зависимость между скоростью реакции и концентрацией реагентов | Тарифные законы |
| реагент | Исходное вещество в химическом уравнении | Химическое уравнение |
| механизм реакции | Этапы образования и разрыва связи, которые происходят на молекулярном уровне во время химической реакции | Механизмы реакции |
| заказ реакции | Сумма показателей степени концентрации в уравнении скоростного закона | Тарифные законы |
| скорость реакции | Скорость химической реакции | Введение в кинетику |
| реальный газ | Газ, поведение которого отличается от идеального. | Реальные газы |
| окислительно-восстановительная реакция | Химическая реакция с переносом электронов | Реакции окисления-восстановления |
| редуктор | Захват одного или нескольких электронов атомом; снижение степени окисления | Реакции окисления-восстановления |
| рем | Единица радиоактивного облучения, включающая коэффициент для учета типа радиоактивности | Единиц радиоактивности |
| рибозим | Молекулы рибонуклеиновой кислоты (РНК), способные катализировать определенные химические реакции | Катализ |
| Среднеквадратичная (rms) скорость (urms) | Скорость молекул, имеющих точно такую же кинетическую энергию, что и средняя кинетическая энергия образца | Кинетико-молекулярная теория газов |
| блок | Столбцы таблицы Менделеева, в которых заняты s подоболочки | Электронная структура и периодическая таблица |
| соль | Любое ионное соединение, которое образуется в результате реакции между кислотой и основанием | Реакция нейтрализации |
| соль | Любое ионное соединение, которое образуется в результате реакции между кислотой и основанием | Аррениусовы кислоты и основания |
| соляной мостик | Часть гальванического элемента, содержащая раствор некоторого ионного соединения, ионы которого мигрируют в обе стороны от гальванического элемента для поддержания баланса заряда | Применение окислительно-восстановительных реакций: гальванические элементы |
| углеводороды насыщенные | Соединение углерода с максимально возможным числом атомов H в формуле | Углеводороды |
| насыщенный раствор | Раствор с максимальным количеством растворенных в нем растворенных веществ | Некоторые определения |
| наука | Процесс познания естественной Вселенной посредством наблюдений и экспериментов | Химия как наука |
| научное право | Конкретное утверждение, которое, как считается, никогда не нарушается всей естественной вселенной | Химия как наука |
| научное обозначение | Выражение числа в степени 10 | Выражение чисел |
| грохочение | Отталкивание валентных электронов электронами остова | Периодические тренды |
| второй закон термодинамики | Спонтанный процесс увеличит энтропию Вселенной | Энтропия и второй закон термодинамики |
| аккумулятор | Аккумулятор с возможностью подзарядки | Применение окислительно-восстановительных реакций: гальванические элементы |
| полуметалл | Элемент, обладающий свойствами как металлов, так и неметаллов | Некоторые основные определения |
| полупроницаемая мембрана | Тонкая мембрана, которая пропускает одни небольшие молекулы, но не пропускает другие | Коллигативные свойства растворов |
| Единица СИ | Международная система единиц, используемая всеми учеными, дословно переводится с «le Système International d’unités.” | Блоки экспрессии |
| Зиверт (Св) | Зиверт (Зв) является связанной единицей и определяется как 100 бэр | Единиц радиоактивности |
| сигма-связь (σ-связь) | Орбитальное перекрытие с образованием связи, имеющей цилиндрическую симметрию — одинарной связи | Теория валентной связи и гибридные орбитали |
| значащие цифры | Предел количества мест измерения может быть правильно выражен с помощью | Значимые цифры |
| силиконы | Полимер на основе кремния и кислорода | Полимеры |
| одинарная связь | Ковалентная связь, состоящая из одной пары электронов | Ковалентные облигации |
| реакция однократного замещения | Химическая реакция, в которой один элемент замещается другим элементом в соединении | Типы химических реакций: реакции одинарного и двойного вытеснения |
| затвердевание | Процесс превращения жидкости в твердое тело | Фазовые переходы: плавление, кипение и сублимация |
| растворимость | Максимальное количество растворенного вещества, которое может быть растворено в данном количестве растворителя | Некоторые определения |
| правила растворимости | Общие положения, предсказывающие, какие ионные соединения растворяются, а какие нет | Типы химических реакций: реакции одинарного и двойного вытеснения |
| растворенное вещество | Второстепенный компонент раствора | Некоторые определения |
| раствор | См. Однородную смесь | Некоторые основные определения |
| растворитель | Главный компонент решения. | Некоторые определения |
| удельная теплоемкость | Константа пропорциональности между теплом, массой и изменением температуры; также называется удельной теплоемкостью. | Работа и тепло |
| спектатор ион | Ион, который ничего не делает в ходе химической реакции | Ионные уравнения: более внимательный взгляд |
| спиновое квантовое число (м_с) | Индекс, указывающий одно из двух спиновых состояний электрона. | Квантовые числа для электронов |
| самопроизвольный процесс | Процесс, который происходит без влияния внешних сил или изменений, приводящих систему к равновесию | Спонтанное изменение |
| стандартная мольная энтропия (So) | Энтропия 1 моля вещества в стандартном состоянии при давлении 1 атм. | Измерение энтропии и изменений энтропии |
| стандартное обозначение | Простое выражение числа | Выражение чисел |
| стандартные температура и давление (STP) | Набор исходных условий, используемых для сравнения других свойств газов: 100 кПа для давления и 273 K для температуры | Закон об идеальном газе и некоторые приложения |
| стехиометрия | Связь одного химического вещества с другим с помощью сбалансированной химической реакции | Стехиометрия |
| сильная кислота | Любая кислота, которая на 100% диссоциирует на ионы в водном растворе | Сильные и слабые кислоты, основания и их соли |
| сильное основание | Любое основание, которое на 100% диссоциирует на ионы в водном растворе | Сильные и слабые кислоты, основания и их соли |
| сублимация | Процесс превращения твердого вещества в газ | Фазовые переходы: плавление, кипение и сублимация |
| подоболочка | Термин, используемый для описания электронов в оболочке с одинаковым квантовым числом углового момента. | Квантовые числа для электронов |
| вещество | Вещество с одинаковыми физическими и химическими свойствами. | Некоторые основные определения |
| заместитель | Ответвление основной цепи в углеводороде | Углеводороды с разветвленной цепью |
| подложка | Реагенты, специфичные для биологического катализатора | Катализ |
| сверхкритическая жидкость | Фаза за пределами критической точки, где жидкая и газовая фазы больше не разделены | Свойства жидкостей |
| перенасыщенный раствор | Нестабильный раствор с количеством растворенного вещества больше, чем обычно, | Некоторые определения |
| поверхностное натяжение | Эффект, вызванный дисбалансом сил на атомах на поверхности жидкости | Свойства жидкостей |
| окружающие атомы | Атом, образующий ковалентные связи с центральным атомом (атомами) | Ковалентные облигации |
| система | Часть вселенной, которая изучается. | Энергия |
| температура | Мера среднего количества кинетической энергии, которую содержит система | Другие единицы: температура и плотность |
| теоретический выход | Теоретически произведенное количество, рассчитанное с использованием сбалансированной химической реакции | Урожайность |
| теория | Общее утверждение, объясняющее большое количество наблюдений | Химия как наука |
| термохимическое уравнение | Химическое уравнение, которое включает изменение энтальпии. | Энтальпия и химические реакции |
| тиол | Серный аналог спирта | Другие функциональные группы |
| третий закон термодинамики | При абсолютном нуле энтропия чистого идеального кристалла равна нулю | Измерение энтропии и изменений энтропии |
| титрант | Реагент известной концентрации | Кислотно-основное титрование |
| титрование | Химическая реакция, проводимая количественно для определения точного количества реагента | Кислотно-основное титрование |
| торр | Другое название миллиметра ртутного столба | Давление |
| трассировщик | Вещество, которое можно использовать, чтобы проследить путь этого вещества через структуру | Использование радиоактивных изотопов |
| переходное состояние | Наивысшая точка перехода энергии на элементарной стадии | Механизмы реакции |
| тройная связь | Ковалентная связь, состоящая из трех пар связывающих электронов | Ковалентные облигации |
| непредельные углеводороды | Соединение углерода с числом атомов H меньше максимально возможного в его формуле | Углеводороды |
| ненасыщенный раствор | Раствор с количеством растворенных веществ меньше максимального | Некоторые определения |
| валентный электрон | Электрон в оболочке с наивысшим номером или в последней незаполненной подоболочке.Валентные электроны — это те электроны, которые, скорее всего, будут участвовать в химических реакциях. | Электронная структура и периодическая таблица |
| валентная оболочка | Оболочка атома с самым высоким номером, содержащая электроны. | Электронная структура и периодическая таблица |
| теория отталкивания электронных пар валентных оболочек (VSEPR) | Общая концепция, оценивающая форму простой молекулы: пары электронов отталкиваются друг от друга, чтобы уйти друг от друга как можно дальше | Молекулярные формы и полярность |
| уравнение Ван-дер-Ваальса | Уравнение, которое компенсирует отклонения от поведения идеального газа, корректируя межмолекулярные силы и объем молекул газа. | Реальные газы |
| Фактор Вант-Гоффа (i) | Количество частиц, на которые распадается каждая формула растворенного вещества при растворении | Коллигативные свойства ионных растворенных веществ |
| пар | Материал в газовой фазе за счет испарения | Свойства жидкостей |
| Давление паров | Парциальное давление, вызываемое испарением жидкости | Смеси газовые |
| Понижение давления пара | Снижение давления пара раствора из-за присутствия растворенного вещества | Коллигативные свойства растворов |
| количество векторов | Величина, имеющая как величину, так и направление | Молекулярные формы и полярность |
| гальванический (гальванический) элемент | Аппарат, позволяющий извлекать полезную электрическую работу из окислительно-восстановительной реакции. | Применение окислительно-восстановительных реакций: гальванические элементы |
| длина волны | Расстояние между соответствующими точками в двух соседних световых циклах. | Свет |
| слабая кислота | Любая кислота, диссоциированная менее чем на 100% на ионы в водном растворе | Сильные и слабые кислоты, основания и их соли |
| слабое основание | Любое основание, диссоциированное на ионы менее чем на 100% в водном растворе | Сильные и слабые кислоты, основания и их соли |
Орбитальные диаграммы — Концепция — Видео по химии от Brightstorm
Хорошо, поговорим об орбитальных диаграммах.Орбитальные диаграммы — это наглядное описание электронов в атоме. Чтобы выяснить, куда идут электроны в атоме, мы должны следовать трем основным правилам. Первым из них является принцип Ауф Бау, принцип Ауф Бау утверждает, что каждый электрон занимает орбиталь с наименьшей доступной энергией. Затем мы должны хорошо подумать о подуровнях, я имею в виду орбитали, как они падают с точки зрения одинаковой энергии, которая ниже по энергии, а какая выше по энергии. Итак, давайте посмотрим на диаграмму Auf Bau, которая на самом деле показывает это для нас, хорошо, так что здесь у нас есть орбиталь 1s, но черточка 1 указывает, что есть 1 орбиталь внутри подуровня 1s, что имеет смысл, что она является самой низкой по энергии, это ее уровень энергии первого принципа.Вы немного подпрыгиваете в энергии, и мы получаем орбиталь 2s, которая делает ее подуровнем 2p. Обратите внимание, что на подуровне 2p есть 3 орбитали, о которых мы узнали раньше, и это имеет смысл. Хорошо, когда мы поднимаемся вверх и прыгаем на орбиталь 3s, затем на орбитали 3p, затем здесь становится все смешно, как будто все вещи, все подуровни и все орбитали становятся неуклюжими с точки зрения того, что вы предсказываете. Так как же нам вспомнить, какой из них по энергии ниже, чем другие? Вместо того, чтобы носить это с собой и возвращаться к этой реальной диаграмме, есть простой способ запомнить, в какую сторону, как электроны падают на орбитали и на подуровни.
Хорошо, мы собираемся сделать эту диаграмму, которая может показаться знакомой из класса, первый уровень энергии — орбиталь 1 с, затем мы собираемся сделать 2 с и 2 точки, затем 3, 3, 3, хорошо, затем 4 с. , 4p, 4d, 4f и так далее и так далее. Я не собираюсь рисовать все, но вы понимаете, как это получается. Затем мы скажем: «Хорошо, электроны сначала упадут на 1-ю орбиталь с наименьшей энергией, как описано на диаграмме Ауф Бау». Хорошо, попадание на орбиталь 1s, затем они попадут на орбиталь 2s, после этого, хорошо, отлично, тогда они упадут на орбиталь 2p, а затем на орбиталь 3s, образующую нашу диагональ.Затем они упадут на орбиту 3p, а затем на орбиту 4s. Мы пропустили 3-ю. Затем они собираются искать 4-х, затем они упадут в 3-е, а затем в 4-е и просто продолжат нажимать стрелки вниз, если у вас есть больше основных уровней энергии, и так далее, и вперед. Хорошо, я на самом деле запустил это в игру и через секунду.
Второе правило, о котором мы собираемся поговорить, — это принцип исключения Паули, который в основном гласит, что на орбитали приходится максимум 2 электрона.Таким образом, орбиталь может содержать только 2 электрона, и этого больше нет. Он может содержать 1, но не более 2. Наконец, Правило рук гласит, что они должны занимать все орбитали с равной энергией, прежде чем объединяться в пары. Так же, как электроны оба отрицательны, они все отрицательно заряжены, они не захотят быть очень близко друг к другу, поэтому они находятся в равной энергии, они сначала займут все энергетические уровни той же энергии, прежде чем они объединяются в пары, потому что им обычно не нравится быть рядом друг с другом.Давайте применим все эти вещи, как все это сложится. Хорошо, давайте сделаем орбитальную диаграмму для железа, железо, которое, как мы знаем, находится в основном состоянии в 26 электронов, поэтому мы знаем, что первые электроны собираются перейти на орбиталь 1s, и мы сказали, что 2 электрона могут попасть на орбиталь 1s. После того, как орбиталь 1s станет 2s, туда также войдут 2 электрона, тогда у вас будет 2p, и не забудьте, что у p-подуровней 3 орбитали, поэтому мы нарисуем 3 черточки, обозначающие подуровень 3p и электроны сначала войдут во все из них, прежде чем объединятся в пары, так что сейчас у нас в общей сложности 10 электронов, это подуровень 2p.После подуровня 2p мы перейдем в 3s, 2 электрона упадут туда, а 12 через 3s мы перейдем в 3p, мы собираемся нарисовать 3 черточки 1, 2, 3, 4, 5, 6, значит, 12, 14, 16, 18 электронов. После 3p мы собираемся перейти в 4s нет, мы не собираемся переходить в 3d, мы переходим прямо в 4s, что равно 1, так что у вас там 2 электрона, так что у вас есть 2, 4, 6, 8. , 10, 12, 14, 16, 18, 20, у нас осталось 6 электронов. Следующий — ad, d — это 5 орбиталей, все те же энергии, которые мы собираемся нарисовать 5 штрихов 2, 3, 4, 5, все — 3d, поэтому мы собираемся нарисовать мне нужно еще 6, поэтому 1, 2, 3, 4, 5, 6, и вот как вы рисуете орбитальные диаграммы.

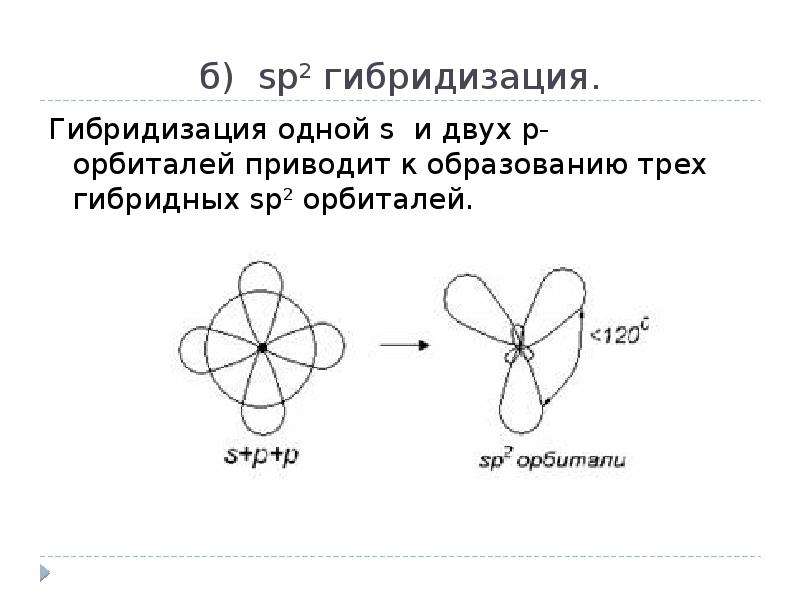
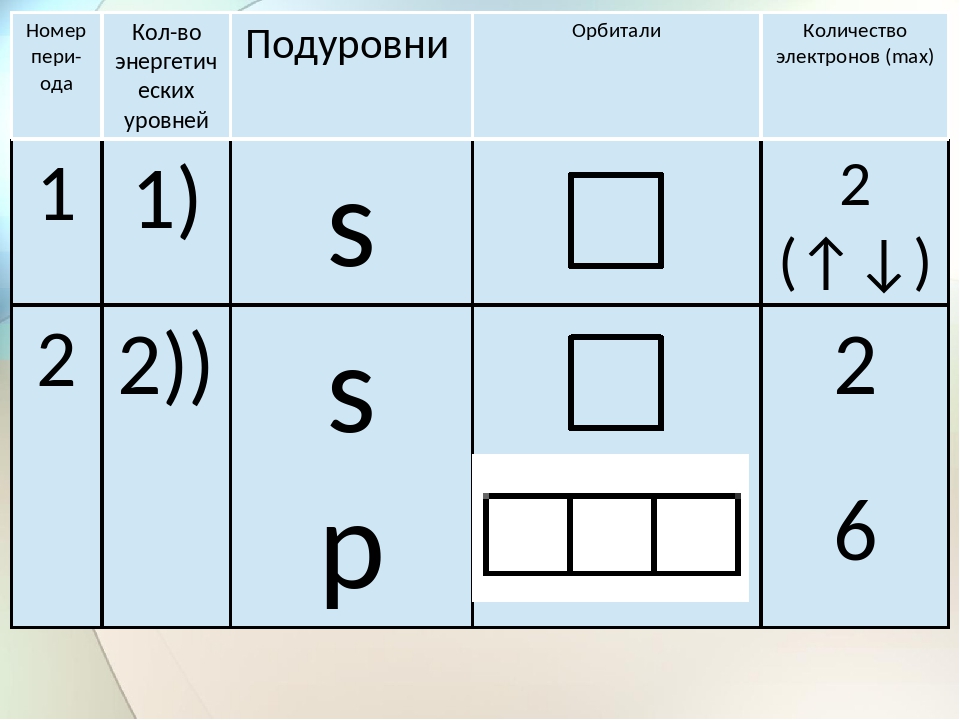 Почему?
Почему?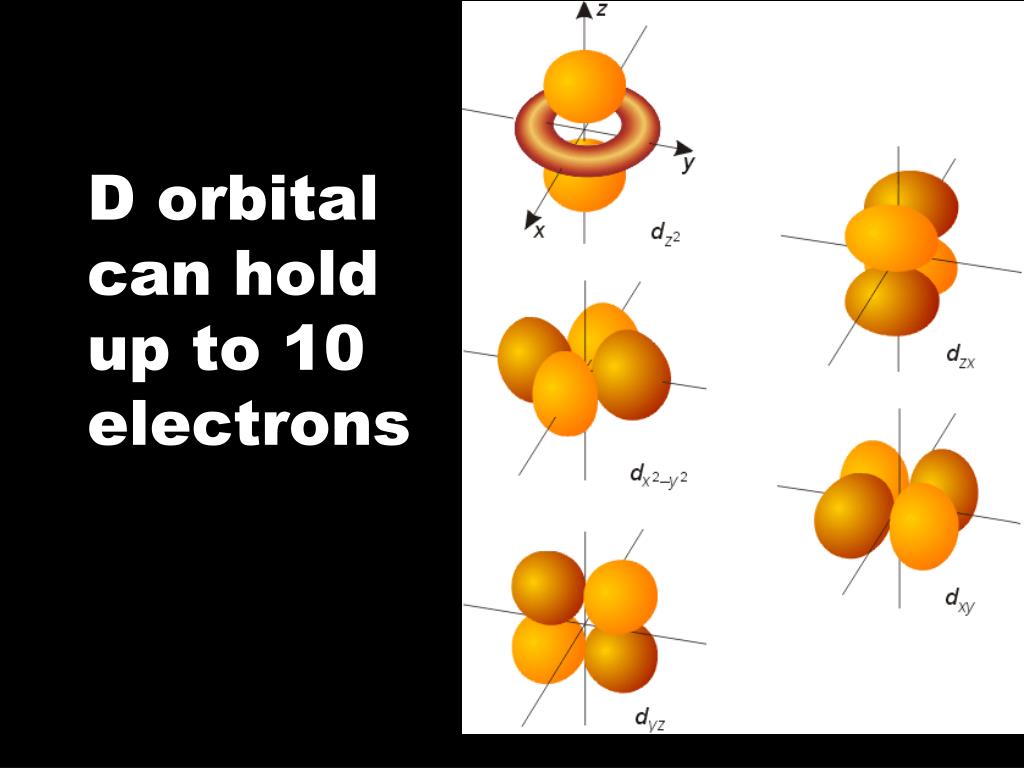 В чем разница между структурами, первоначально предложенными Бором, и принятыми сегодня?
В чем разница между структурами, первоначально предложенными Бором, и принятыми сегодня? Предскажите, как на химическую реактивность влияет снижение эффективного ядерного заряда.
Предскажите, как на химическую реактивность влияет снижение эффективного ядерного заряда.
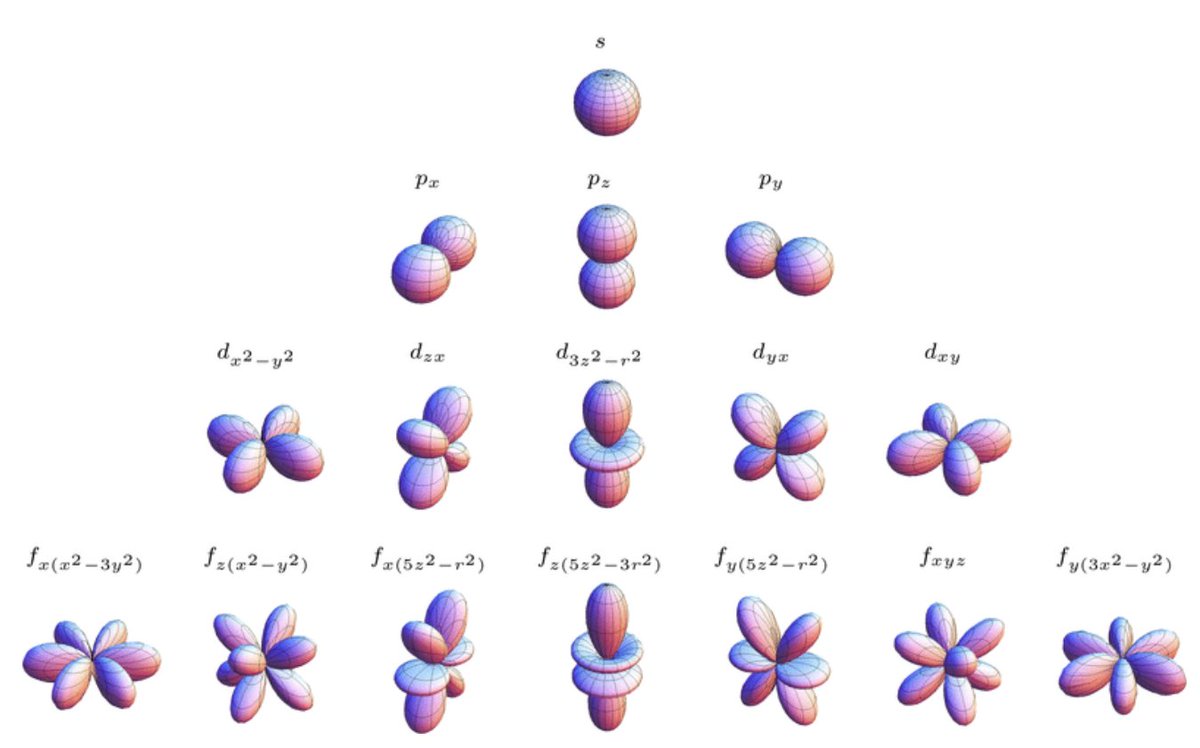
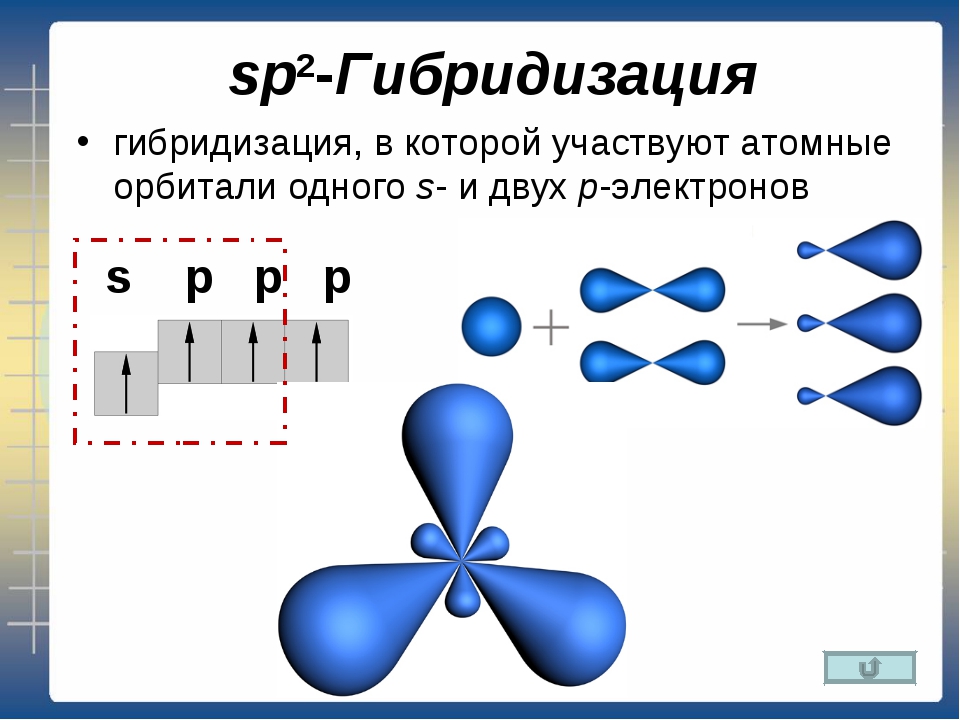 В
первые 2 электрона находятся на первом уровне энергии, а остальные 7 — на втором уровне энергии.
уровень (рисунок 4.8).
В
первые 2 электрона находятся на первом уровне энергии, а остальные 7 — на втором уровне энергии.
уровень (рисунок 4.8).

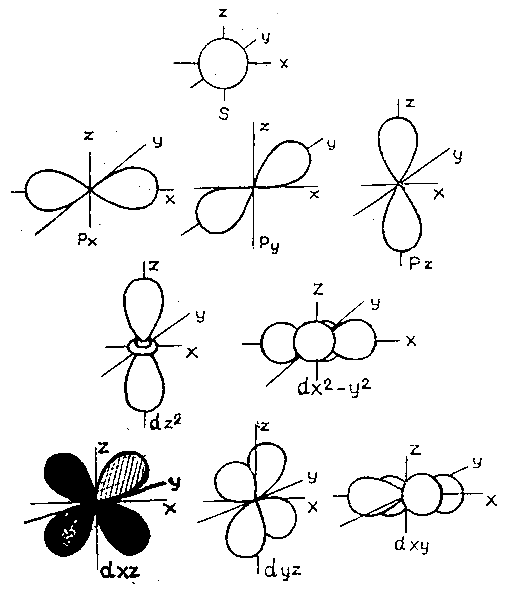 \ (\ text {NaCl} \), \ (\ text {CuCl} _ {2} \), \ (\ text {CaCl} _ {2} \), \ (\ text {KCl} \) и т. д. )
\ (\ text {NaCl} \), \ (\ text {CuCl} _ {2} \), \ (\ text {CaCl} _ {2} \), \ (\ text {KCl} \) и т. д. ) Не держи зубочистку в пламени,
а лучше махайте им взад и вперед через пламя.
Не держи зубочистку в пламени,
а лучше махайте им взад и вперед через пламя.