Онлайн уроки по химии за 8 класс
Ярко и красиво! Мы начинаем изучать Химию- одну из самых увлекательных наук!
Сегодня вы узнаете основные понятия, без которых невозможно представить себе химию как науку!
На этом уроке мы поговорим о атомно- молекулярном учении
Сейчас мы рассмотрим основной закон в химии- Периодический
На этой странице мы поговорим о базовых химических понятиях, без которых дальнейшее изучение химии бесполезно
Что такое чистота вещества? Здравый смысл подсказывает, что это количество примесей в смеси.
Одно из самых увлекательных занятий в химии это Химическая реакция!
Продолжим изучение химической реакции как одной из основ химической науки!
В повседневной жизни нам приходится решать множество задач, так или иначе связанных с химией – выбрать подходящий клей, правильно разбавить уксус, подобрать пятновыводитель
Сейчас мы поговорим о газах и о их роли в природе
Кислород – самый распространенный на Земле химический элемент!
Ты уже неоднократно встречался с различными типами соединений.
На этом уроке мы приведём эти знания в единую систему
Из них состоит все!
После подробного изучения строения атома и состояния электронных оболочек можно приступать к вопросу о том, каким же образом происходит соединение атомов в молекулы.
Когда мы видим ржавчину на железе или темный налет на серебре, мы часто можем услышать фразу – «металл окислился».
Разберём подробнее, что значит это выражение с точки зрения химии
На этом уроке мы поговорим о водороде – химическом элементе и простом веществе. Ты узнаешь о его роли в космосе и в нашей жизни, почему люди отказались использовать водород в дирижаблях, можно ли бензобак заменить на водородобак и другие интересные факты
В этом уроке мы познакомимся с немногочисленной, но очень важной группой химических элементов
Согласись, полезно знать как быстро будут проходить твои опыты!
В этом уроке вы узнаете про серу, чем она вредна и чем полезна, как между собой связано Чёрное море и тухлые яйца, как правильно разбавлять электролит для аккумулятора и ещё много полезного и интересного
«Азот» в переводе с греческого – «безжизненный». Однако в наше время всем и каждому хорошо известно, что это далеко не так. На этом уроке мы по полочкам разложим всё самое интересное и полезное про этот элемент с самым, пожалуй, противоречивым названием.
Однако в наше время всем и каждому хорошо известно, что это далеко не так. На этом уроке мы по полочкам разложим всё самое интересное и полезное про этот элемент с самым, пожалуй, противоречивым названием.
Азот образует оксиды, в которых проявляет степени окисления от +1 до +5.
Фосфор- один из самых распространенных и жизненно важных химических элементов
Углерод – химический элемент IVгруппы периодической системы химических элементов
Кремний – химический элемент IV группы периодической системы.
Это самый распространённый после кислорода элемент в земной коре (26 % по массе).
Из всех химических элементов металлы представляют абсолютное большинство – ученые выделяют 94 металла
Алюминий – химический элемент III группы периодической системы элементов.
Без этого металла прогресс человечества был бы невозможен!
Поговорим о сплавах железа и каким химическим воздействиям оно подвергается в природе. Роль железа в живых организмах и у человека
Роль железа в живых организмах и у человека
Онлайн-уроки включают в себя основополагающие сведения о химии как науке, предмете и методах ее изучения. Кроме того, школьнику предстоит изучить свойства атомов и молекул, валентность вещества, основные химические реакции, элементы из таблицы Менделеева.
3 причины изучать уроки с Лэйдл
- Четкая структура занятий.
В нашей команде работают исключительно профессиональные педагоги, которые структурировали школьную программу и постарались сделать уроки максимально полезными и интересными. Ребенок больше не будет путаться в терминологии или искать дополнительную информацию в Интернете. - Наглядные материалы.
Чтобы материал усваивался легко, мы снабдили каждый урок мультимедийными файлами (фото или видео), задачами и упражнениями. Так что школьнику предстоит не только читать о свойствах химических веществ, но и учиться применять полученные знания на практике. - Доступность.
Здесь речь идет не только о демократичной стоимости онлайн-уроков, но и простоте их получения. Вам достаточно пройти регистрацию – и весь курс химии за 8 класс окажется под рукой.
Начните изучение химии прямо сейчас – пройдите пробный урок и оформите подписку на Лэйдл!
8 класс Контрольня №1 ФиР «Основы химии»
Контрольная
работа по химии за 8 класс.
«Основы химии»
Вариант I
Задание 1
Определите, какие явления относятся к физическим, а какие – к химическим.
А) свечение нити в лампе накаливания;
Б) гниение пищевых продуктов;
В) образование тумана;
Г) процесс фотосинтеза.
Задание 2
Из следующих высказываний выберите те, в которых говорится о химическом элементе, и те, в которых говорится о простом веществе.
А) молекулы водорода;
Б) кислород, растворённый в воде;
В) натрий в составе поваренной соли.
Задание 3
Выпишите символы и названия элементов, находящихся в периодической таблице:
— в 2-ом периоде, III группе;
— в 3-ем периоде, VI группе;
— в 4-ом периоде, V группе, основной подгруппе;
— в 5-ом периоде, IV группе, побочной подгруппе;
Задание 4
Запишите формулы молекул, состоящих из:
— двух атомов натрия и одного атома кислорода;
— одного атома германия и двух атомов кислорода;
— трёх атомов водорода, одного
атома бора и трёх атомов кислорода.
Задание 5
Определите валентности элементов в следующих соединениях:
NaH, CaS, AlCl3, Li3N
Задание 6
Определите формулы соединений, состоящие из следующих элементов:
— магний и кислород;
— алюминий и хлор с валентностью I;
— железо с валентностью III и сера с валентностью II.
Задание 7
Рассчитайте массовую долю натрия в соединении с формулой Na2SO4.
Контрольная работа по химии за 8 класс.
«Основы химии.»
Вариант II
Задание 1
Определите, какие явления относятся к физическим, а какие – к химическим.
А) горение природного газа;
Б) кипение воды;
В) ржавление железа;
Г) диффузия.
Задание 2
Из следующих высказываний выберите те, в которых говорится о химическом элементе, и те, в которых говорится о простом веществе.
А) плавление железа;
Б) кислород, в составе воды;
В) жидкий азот.
Задание 3
Выпишите символы и названия элементов, находящихся в периодической таблице:
— в 2-ом периоде, IV группе;
— в 3-ем периоде, III группе;
— в 4-ом периоде, VI группе, основной подгруппе;
— в 5-ом периоде, V группе, побочной подгруппе;
Задание 4
Запишите формулы молекул, состоящих из:
— трёх атомов натрия и одного атома азота;
— двух атомов галлия и трёх атомов кислорода;
— двух атомов водорода, одного атома серы и четырёх атомов кислорода.
Задание 5
Определите валентности элементов в следующих соединениях:
CaO, KCl, SeO3, CH4,
Задание 6
Определите формулы соединений, состоящие из следующих элементов:
— алюминий и водород;
— железо с валентностью III и кислород;
— медь с валентностью I
и сера с валентностью II.
Задание 7
Рассчитайте массовую долю кислорода соединении с формулой CaCO3.
Контрольная работа по химии за 8 класс.
«Основы химии.»
Вариант III
Задание 1
Определите, какие явления относятся к физическим, а какие – к химическим.
А) образование росы;
Б) плавление стали;
В) образование кариеса;
Г) брожение дрожжей.
Задание 2
Из следующих высказываний выберите те, в которых говорится о химическом элементе, и те, в которых говорится о простом веществе.
А) кровь содержит соединения железа;
Б) оловянный солдатик;
В) сухой лёд – это замороженный углекислый газ.
Задание 3
Выпишите символы и названия элементов, находящихся в периодической таблице:
— в 2-ом периоде, II группе;
— в 3-ем периоде, VII группе;
— в 4-ом периоде, III группе, основной подгруппе;
— в 5-ом периоде, I группе, побочной подгруппе;
Задание 4
Запишите формулы молекул, состоящих из:
— одного атома углерода и двух атомов серы;
— четырёх атомов алюминия и трёх атомов углерода;
— одного атома водорода,
одного атома хлора и четырёх атомов кислорода.
Задание 5
Определите валентности элементов в следующих соединениях:
Ca3N2, SeO2, Al2S3, Na2O
Задание 6
Определите формулы соединений, состоящие из следующих элементов:
— алюминий и кислород;
— медь с валентностью I и кислород;
— фосфор с валентностью V и хлор с валентностью I.
Задание 7
Рассчитайте массовую долю кислорода в соединении с формулой KNO3.
Контрольная работа по химии за 8 класс.
«Основы химии.»
Вариант IV
Задание 1
Определите, какие явления относятся к физическим, а какие – к химическим.
А) запасание энергии в виде питательных веществ;
Б) почернение серебряной посуды;
В) протекание электрического тока по проводам;
Г) замерзание
спирта.
Задание 2
Из следующих высказываний выберите те, в которых говорится о химическом элементе, и те, в которых говорится о простом веществе.
А) амальгамы – растворы различных металлов в ртути;
Б) магний в составе хлорофилла;
В) алюминиевая кастрюля.
Задание 3
Выпишите символы и названия элементов, находящихся в периодической таблице:
— в 2-ом периоде, VI группе;
— в 3-ем периоде, II группе;
— в 4-ом периоде, VII группе, основной подгруппе;
— в 5-ом периоде, III группе, побочной подгруппе;
Задание 4
Запишите формулы молекул, состоящих из:
— одного атома кислорода и двух атомов фтора;
— четырёх атомов лития и одного атома кремния;
— двух атомов водорода, одного
атома углерода и трёх атомов кислорода.
Задание 5
Определите валентности элементов в следующих соединениях:
FeO, P2O3, SiCl4, BN
Задание 6
Определите формулы соединений, состоящие из следующих элементов:
— бор и кислород;
— азот с валентностью III и водород;
— сера с валентностью VI и фтор с валентностью I.
Задание 7
Рассчитайте массовую долю лития в соединении с формулой Li3PO4.
Страница не найдена
Новости
3 ноя
Роспотребнадзор продлил действие санитарных правил по работе образовательных организаций в условиях распространения коронавирусной инфекции COVID-19.
1 ноя
У жительницы подмосковного Сергиева Посада сотрудники опеки увезли 14-летнюю дочь из школы в детский дом. Поводом для изъятия ребёнка из семьи послужила безобидная фотография. Девочка сделала селфи в ванной, полностью укутавшись в полотенце, а затем отправила фото однокласснику. Тот выложил его в соцсеть. По словам матери, классная руководительница посчитала фотографию слишком откровенной и сообщила о ней социальным службам. Через неделю, после вмешательства общественников и запроса RT в органы опеки, ребёнка вернули. Мать считает, что лица, ответственные за изъятие дочери, должны понести наказание.
31 окт
По меньшей мере четыре человека пострадали в результате вооружённого нападения на школу в столице Гаити Порт-о-Пренсе. Об этом сообщает агентство EFE.
Об этом сообщает агентство EFE.
30 окт
Выпускные экзамены в России в 2022 году пройдут в режиме, который действовал до 2020 года, если позволит эпидемиологическая ситуация, рассказали «Парламентской газете» в Рособрнадзоре и профильных комитетах обеих палат парламента.
30 окт
Выпускные экзамены в России в 2022 году пройдут в режиме, который действовал до 2020 года, если позволит эпидемиологическая ситуация, рассказали «Парламентской газете» в Рособрнадзоре и профильных комитетах обеих палат парламента.
29 окт
В Самаре бывшая учительница физкультуры, 24-летняя Анна Шмелёва (имя изменено. — RT), обвиняется в сексуальной связи с несовершеннолетней ученицей. В июне этого года мать школьницы (девочке сейчас 15 лет) написала заявление в Следственный комитет о том, что педагог якобы домогалась её дочери. СК возбудил уголовное дело по ч. 2 ст. 134 УК РФ («Мужеложство или лесбиянство с лицом, не достигшим шестнадцатилетнего возраста, совершённые лицом, достигшим восемнадцатилетнего возраста»). Адвокат Шмелёвой и её близкие считают, что родственники ученицы могли подать заявление в СК из мести: Шмелёва обращалась в опеку, чтобы семью взяли на контроль. В деталях громкого дела разбирался RT.
28 окт
Губернатор Московской области Андрей Воробьёв исключил перевод школ на удалёнку после каникул.
Основы химии — Викиверситет
<Викиверситет: Школа химии
Основы химии — это введение в Периодическую таблицу, стехиометрию, химические состояния, химическое равновесие, кислоту и основание, реакции окисления и восстановления, химическую кинетику, неорганическую номенклатуру и химические связи.
Определение [править | править источник]
Химические элементы — это фундаментальные ингредиенты всей существующей материи, которые могут быть объединены в реакцию, чтобы создать химическое вещество.Каждый химический элемент во Вселенной обладает уникальными свойствами, которые отличают его от всех других химических элементов. Они не могут быть химически преобразованы друг в друга или расщеплены на более простые вещества и являются основными составляющими вещества.
Химические элементы обычно обозначаются символом
- Z M E
Где,
- E — имя элемента
- Z атомный номер
- M масса элемента
Например, водород обозначается как
- 1 1 H
Периодическая таблица элементов [править | править источник]
В периодической таблице элементы группируются по свойствам. Для его истории см. Историю Периодической таблицы Википедии. Периодическая таблица доступна здесь: Periodic Table на Wikimedia Commons, и пояснения будут основаны на этой таблице. Распечатайте или закажите печатную копию периодической таблицы Менделеева для легкого доступа и справки.
Для его истории см. Историю Периодической таблицы Википедии. Периодическая таблица доступна здесь: Periodic Table на Wikimedia Commons, и пояснения будут основаны на этой таблице. Распечатайте или закажите печатную копию периодической таблицы Менделеева для легкого доступа и справки.
В таблице каждое поле содержит один элемент и дополнительную информацию. Для водорода цифра «1» в верхнем углу — это атомный номер, который определяет количество протонов или положительных зарядов в атоме. Буква «H» обозначает водород.Все элементы получают одно или двухбуквенное обозначение (есть несколько исключений с необъявленными элементами). Число внизу — это атомный вес или атомная масса. 1,00794 представляет, сколько граммов содержится в каждом моль (6,022 × 10 23 единиц) водорода. Атомная масса — очень важная часть химии, имеющая множество применений.
Элементы организованы в строки и столбцы. В периодической таблице есть восемнадцать групп (или семей или столбцов). Каждый из них представляет, сколько электронов прикреплено к элементам, и соотносится с количеством валентных электронов.
Каждый из них представляет, сколько электронов прикреплено к элементам, и соотносится с количеством валентных электронов.
Первые две группы (1A и 2A), а также шесть справа (3A-8A). Они называются репрезентативными элементами . Группа 1A — это щелочных металлов (кроме водорода, который является неметаллом), а Группа 2A — это щелочноземельных металлов. Группы 3A — 8A имеют смешанные свойства, но есть определенные шаблоны.
Электроны — это отрицательно заряженные субатомные частицы, которые «вращаются» вокруг ядра элемента. Валентные электроны — это электроны, которые находятся за пределами атома. Есть семь периодов (или горизонтальных рядов), которые описывают электронные оболочки.
Химические соединения — это чистые вещества, состоящие только из одного типа молекул (два или более атомов, удерживаемых вместе в фиксированном соотношении химическими связями). Химическое соединение обычно имеет свойства, отличные от свойств составляющих его элементов. Название химического соединения обычно идентично названию молекулы, составляющей соединение (например, двуокиси углерода), но некоторые соединения также имеют «общие названия», под которыми эти вещества известны вне научных дискуссий.Например, бикарбонат натрия широко известен как «пищевая сода».
Название химического соединения обычно идентично названию молекулы, составляющей соединение (например, двуокиси углерода), но некоторые соединения также имеют «общие названия», под которыми эти вещества известны вне научных дискуссий.Например, бикарбонат натрия широко известен как «пищевая сода».
[править | править источник]
См. Также Далтон. Основные положения атомной теории Дальтона:
- Элементы состоят из очень маленьких частиц, называемых атомами.
- Атомы данного элемента идентичны по размеру, массе и другим свойствам; атомы разных элементов различаются по размеру, массе и другим свойствам.
- Атомы нельзя разделить, создать или уничтожить.
- Атомы различных элементов объединяются в простых целочисленных отношениях с образованием химических соединений.
- В химических реакциях атомы объединяются, разделяются или перегруппировываются.
Примеры [править | править источник]
Например, соединение хлорид натрия (NaCl) состоит из одного иона хлора, связанного с одним ионом натрия. Натрий в его естественной форме представляет собой твердый металлический элемент, который обладает высокой реакционной способностью и при взаимодействии с водой вызывает сильное вспенивание.
Натрий в его естественной форме представляет собой твердый металлический элемент, который обладает высокой реакционной способностью и при взаимодействии с водой вызывает сильное вспенивание.
- NaCl {\ displaystyle NaCl}
Хлор в его естественной форме представляет собой неметаллический элемент, который состоит из множества двухатомных молекул Cl 2 и существует в виде бледно-зеленого газа, который токсичен при вдыхании. большие суммы. Однако составной хлорид натрия — это не что иное, как простая поваренная соль, применяемая в пищевых продуктах. Причина появления этих новых свойств кроется в типе склеивания и элементах, составляющих соединение. Это будет обсуждаться более подробно в следующих разделах.
- Cl2 {\ displaystyle Cl_ {2}}
Химические формулы [редактировать | править источник]
Химическая формула используется для обозначения химического соединения. Например
- Вода — h3O {\ displaystyle H_ {2} O}
- Озон — это O3 {\ displaystyle O_ {3}}
- Соль представляет собой NaCl {\ displaystyle NaCl}
Химическая связь [править | править источник]
Химическая связь — это длительное притяжение между атомами, которое позволяет образовывать химические соединения.
Например, соединение хлорид натрия (NaCl) состоит из одного иона хлора, связанного с одним ионом натрия.Натрий в его естественной форме представляет собой твердый металлический элемент, который обладает высокой реакционной способностью и при взаимодействии с водой вызывает сильное вспенивание.
- Na + Cl {\ displaystyle Na + Cl} → NaCl {\ displaystyle NaCl}
Хлор в его естественной форме является неметаллическим элементом, который состоит из множества двухатомных молекул Cl 2 и существует как бледно-зеленый газ, токсичный при вдыхании в больших количествах. Однако составной хлорид натрия — это не что иное, как простая поваренная соль, применяемая в пищевых продуктах.Причина появления этих новых свойств кроется в типе склеивания и элементах, составляющих соединение. Это будет обсуждаться более подробно в следующих разделах.
- Cl + Cl {\ displaystyle Cl + Cl} → Cl2 {\ displaystyle Cl_ {2}}
Типы химических связей [править | править источник]
Химическая реакция — это взаимодействие между химическими веществами с образованием новых веществ. Например, окисление металла или раскисление окисленного металла.{+2}}
Например, окисление металла или раскисление окисленного металла.{+2}}
Химические уравнения — это способ выразить химическую реакцию. Они представляют химические частицы с химическими символами элементов, из которых они состоят, и индексами, которые представляют фактическое количество частиц этого элемента, будь то атомы или ионы, составляющие соединение. Например, рассмотрим реакцию, показанную ниже:
2h3 (g) + O2 (g) → 2h3O (ℓ) {\ displaystyle {\ ce {2H_ {2} (g) + O_ {2} (g) \ rightarrow 2H_ {2} O (\ ell)}}}
Слева от стрелки вы видите два изображенных соединения.Это реагентов , химические соединения, которые перегруппировываются, давая продукт , химические соединения, представленные в правой части стрелки. Первый реагент, H 2 , представляет собой молекулу водорода. Нижний индекс «2» показывает, что есть два атома водорода, которые химически объединяются, чтобы произвести молекулу. Следовательно, каждая молекула H 2 содержит два атома водорода, химически связанных друг с другом. Та же концепция применима к реагирующей молекуле O 2 справа от нее.
Та же концепция применима к реагирующей молекуле O 2 справа от нее.
(g) и (l) или государственные символы обозначают физическое состояние химических веществ во время реакции. (g) означает, что химические соединения O 2 и H 2 существуют в виде газов до того, как они вступят в реакцию, а нижний индекс (l) означает, что химические соединения H 2 O существуют в виде жидкости, когда они образованы Реакция.
Коэффициенты перед молекулами, такими как H 2 O и H 2 , представляют собой простейшее целочисленное отношение количества вещества в реакционной смеси.Например, приведенное выше уравнение показывает, что каждая молекула O 2 реагирует с двумя молекулами H 2 с образованием двух молекул H 2 O.
Размерный анализ [править | править источник]
В качестве более сложного примера концентрацию оксидов азота (например, NOx {\ displaystyle \ color {Blue} {\ ce {NO}} _ {x}}) в дымовых газах промышленной печи можно преобразовать в массовый расход, выраженный в граммах в час (т. е. г / ч) NOx {\ displaystyle {\ ce {NO}} _ {x}}, используя следующую информацию, как показано ниже:
е. г / ч) NOx {\ displaystyle {\ ce {NO}} _ {x}}, используя следующую информацию, как показано ниже:
- Концентрация NOx
- = 10 частей на миллион по объему = 10 частей на миллион по объему = 10 объемов / 10 6 объемов
- NOx молярная масса
- = 46 кг / кгмоль (иногда также выражается как 46 кг / кмоль)
- Расход дымовых газов
- = 20 кубометров в минуту = 20 м³ / мин
- Дымовой газ выходит из печи при температуре 0 ° C и температуре 101 ° C.{3} \ {\ ce {NO}} _ {x}}}}} \ times {\ frac {46 \ {\ cancel {\ mathrm {kg}}} {\ ce {NO}} _ {x}} {1 \ {\ cancel {\ mathrm {kg \ cdot mol \ NO} _ {x}}}}} \ times {\ frac {1000 \ mathrm {g}} {1 {\ cancel {\ mathrm {kg}} }}} = 24,63 \ {\ frac {\ mathrm {g \ NO} _ {x}} {\ text {hour}}}}
Стехиометрия [править | править источник]
Стехиометрия используется для анализа количественных измерений в отношении реагентов и продуктов химического уравнения. Химическое уравнение — это символическое представление химической реакции. Реагенты химического уравнения выровнены слева, что дает ссылку на его определение, вещество, используемое или потребляемое в химической реакции. Продукты химического уравнения обосновываются справа и определяются как вещество, которое образуется или образуется в результате химической реакции. Чтобы полностью понять стехиометрические отношения, необходимо рассмотреть закон сохранения массы, закон определенных пропорций и закон множественных пропорций. Помните, что масса или материя не создаются и не уничтожаются.
Реагенты химического уравнения выровнены слева, что дает ссылку на его определение, вещество, используемое или потребляемое в химической реакции. Продукты химического уравнения обосновываются справа и определяются как вещество, которое образуется или образуется в результате химической реакции. Чтобы полностью понять стехиометрические отношения, необходимо рассмотреть закон сохранения массы, закон определенных пропорций и закон множественных пропорций. Помните, что масса или материя не создаются и не уничтожаются.
Среди свойств элементов есть состояния. Существует 3 основных состояния элемента: твердое, жидкое и газообразное. Они обозначаются нижним индексом (s), (l) и (g) соответственно, и им присваивается соответствующее соединение или элемент в химическом уравнении. Вещество, растворенное в воде, обозначено (водн.). Также может существовать плазма, которая представляет собой ионизированный газ с особыми свойствами.
Стехиометрия позволяет химикам количественно анализировать относительные отношения между веществами в химическом уравнении.
Уравновешивание химических уравнений [править | править источник]
Этин (C 2 H 2 ) добавляют к газообразному кислороду (O 2 ) с получением диоксида углерода (CO 2 ) и воды (H 2 O). Эту реакцию можно было бы записать так:
- Несбалансированное уравнение
- C2h3 (г) + O2 (г) → CO2 (г) + h3O (л) {\ Displaystyle C_ {2} H_ {2} (г) + O_ {2} (г) \ к CO_ {2} (г ) + H_ {2} O (l)}
Однако приведенное выше уравнение не сбалансировано.
- Слева расположены два атома углерода (C), два атома водорода (H) и два атома кислорода в сумме.
- Справа один атом углерода, три атома кислорода и два атома водорода.
Обратите внимание, что для правильного подсчета атомов в уравнении необходимо отметить, что подсчет атомов производится с учетом коэффициента и индексов. Особое внимание следует уделять соединениям и многоатомным ионам, поскольку они сгруппированы по отношению друг к другу.
Чтобы сбалансировать уравнение правильно, число, известное как коэффициент, должно быть добавлено перед каждым представлением в химическом уравнении.
- Правильно вычисленное уравнение
- 2C2h3 (g) + 5O2 (g) → 4CO2 (g) + 2h3O (l) {\ displaystyle 2C_ {2} H_ {2} (g) + 5O_ {2} (g) \ to 4CO_ {2} (g ) + 2H_ {2} O (l)}
Как видно, нижние индексы не были затронуты, только целые числа были добавлены в начало всех формул по мере необходимости. Коэффициенты могут быть дробными, которые обычно используются в термохимии, но для всех целей и целей обычно используются целые числа.
Было бы неправильно балансировать, изменяя номера нижних индексов.
- Неправильно сбалансированное уравнение
- C2h3 (g) + O3 (g) → C2O2 (g) + h3O (l) {\ displaystyle C_ {2} H_ {2} (g) + {\ color {Red} O_ {3} (g)} \ \ to {\ color {Красный} C_ {2} O_ {2} (g)} + H_ {2} O (l)}
Изменяя индексы, вы меняете химические вещества, участвующие в реакции. В приведенном выше примере O3 {\ displaystyle O_ {3}} — это озон, а не обычный кислород, а C2O2 {\ displaystyle C_ {2} O_ {2}} — нестабильное соединение.Небольшое изменение индексов и состава отдельного соединения дает совершенно другой набор свойств.
В приведенном выше примере O3 {\ displaystyle O_ {3}} — это озон, а не обычный кислород, а C2O2 {\ displaystyle C_ {2} O_ {2}} — нестабильное соединение.Небольшое изменение индексов и состава отдельного соединения дает совершенно другой набор свойств.
Обычно мы узнаем, что существует четыре основных состояния материи:
- Плазма
- Газ
- Жидкость
- Solid
Тем не менее, физические исследования предполагают и другие состояния вещества (например, конденсат Бозе-Эйнштейна), но это обычно считается грубой отправной точкой.
Газы состоят из атомов и / или молекул, которые свободно движутся и поэтому не имеют определенной формы.Они равномерно трансформируются в форму контейнера, в котором находятся. Если контейнер не запечатан, газ может выйти. Следовательно, объем газа зависит от температуры и / или давления в газе или окружающей среде. Это наблюдается с помощью законов идеального газа, которые обсуждаются позже.
Важно знать, что такое водный раствор. {-}]}
{-}]}
Их сумма составляет
pH + pOH = 14 {\ displaystyle pH + pOH = 14}
Кислоты [править | править источник]
Характеристики кислот:
- Водные кислоты могут превращать синюю лакмусовую бумажку в красную.
- Реагирует с основаниями и некоторыми металлами с образованием солей.
- Определение кислоты Аррениуса: при растворении в воде выделяет ионы водорода.
- Определение кислоты по Льюису: может принимать пару электронов с образованием ковалентной связи.
- Определение кислоты Бренстеда-Лоури: разновидность, которая может терять или «отдавать» ион водорода
- Может иметь кислый вкус.
- Может давать один или несколько протонов (или просто H + )
- Электролиты, но обычно не ионные соединения
Основания [править | править источник]
Характеристики баз:
- Водные основания (щелочи) могут превращать красную лакмусовую бумажку в синий.

- Реагирует с кислотами с образованием солей.
- Определение основания Аррехениуса: при растворении в воде производят ионы OH — .
- Определение основания Льюиса: может отдавать пару электронов для образования ковалентной связи с кислотой
- Определение основания Бренстеда-Лоури: Вид, который может получать или «принимать» ион водорода
- Может иметь горький вкус.
- Может принимать один или несколько протонов (или проще H + )
- Проводить электричество
Разница между основаниями и щелочами заключается в том, что щелочи растворяются в воде и считаются основными солями щелочных металлов.Примером основания, не являющегося щелочью, является аммиак (NH 3 ).
Номенклатура неорганической химии [редактировать | редактировать источник]
- Флауэрс, Пол, Клаус Теопольд, Ричард Лэнгли, Уильям Р. Робинсон, Марк Блазер, Саймон Ботт, Дональд Карпенетти, Эндрю Эклунд, Эмад Эль-Джиар, Дон Франц, Пол Хукер, Джордж Камински, Дженнифер Лук, Кэрол Мартинес, Трой Милликен, Вики Моравек, Джейсон Д.
 Пауэлл, Томас Соренсен и Эллисон Сульт. Химия. Нп .: н.п., 2015. Химия.Колледж OpenStax, март 2015 г. Web.
Пауэлл, Томас Соренсен и Эллисон Сульт. Химия. Нп .: н.п., 2015. Химия.Колледж OpenStax, март 2015 г. Web.
PC: CHEM100 — Основы химии
1. Химический мир 1.1 Soda Pop Fizz1.2 Химические вещества составляют обычные предметы
1.3 Все вещи состоят из атомов и молекул
1.4 Научный метод: как думают химики
1.5 Начинающий химик: как добиться успеха
2. Измерение и решение проблем
2.1 Измерение глобальной температуры
2.2 Научная нотация: запись больших и малых чисел
2.3 значимые числа: запись чисел для отражения точности
2.4 Значимые числа в расчетах
2.5 Основные единицы измерения
2.6 Решение проблем и преобразование единиц
2.7 Решение задач многоступенчатого преобразования
2,8 Единицы, возведенные в степень
2,9 Плотность
2.10 Числовая задача- Стратегии решения и карта решения
3. Материя и энергия
3.1 В вашей комнате
3.2 Что такое материя?
3. 3 Классификация материи по ее состоянию: твердое, жидкое и газообразное
3 Классификация материи по ее состоянию: твердое, жидкое и газообразное
3.4 Классификация материи по ее составу: элементы, соединения и смеси
3.5 Различия в материи: физические и химические свойства
3.6 Изменения материи: физические и химические изменения
3.7 Сохранение массы: новой материи нет
3.8 Энергия
3.9 Энергетические, химические и физические изменения
3.10 Температура: случайное движение молекул и атомов
3.11 Температурные изменения: теплоемкость
3.12 Расчет энергии и теплоемкости
4.Атомы и элементы
4.1 Испытание атомов на Тибуроне
4.2 Неделимость: атомная теория
4.3 Ядерный атом
4.4 Свойства протонов, нейтронов и электронов
4.5 Элементы: определяются их числом протонов
4.6 Поиск закономерностей: Периодический закон и периодическая таблица
4.7 Ионы: теряющие и приобретающие электроны
4.8 Изотопы: когда количество нейтронов меняется
4.9 Атомная масса: средняя масса атомов элемента
5. Молекулы и соединения
Молекулы и соединения
5.1 Сахар и соль
5.2 Соединения отображают постоянный состав
5.3 Химические формулы: как представлять соединения
5.4 Молекулярное представление элементов и соединений
5.5 Составление формул для ионных соединений
5.6 Номенклатура: присвоение имен соединениям
5.7 Присвоение имен ионным Соединения
5.8 Обозначение молекулярных соединений
5.9 Обозначение кислот
5.10 Краткое описание номенклатуры
5.11 Формула массы: масса молекулы или единицы формулы
6.Химический состав
6,1 Сколько натрия?
6.2 Подсчет гвоздей по фунтам
6.3 Подсчет атомов по грамму
6.4 Подсчет молекул по грамму
6.5 Химические формулы как коэффициенты пересчета
6.6 Массовый процентный состав соединений
6.7 Массовый процентный состав по химической формуле
6.8 Расчет эмпирических формул для Соединения
6.9 Расчет молекулярных формул для соединений
7. Химические реакции
7. Вулканы, автомобили и средства для стирки 1-го класса
Вулканы, автомобили и средства для стирки 1-го класса
7.2 Свидетельства химической реакции
7.3 Химическое уравнение
7.4 Как писать сбалансированные химические уравнения
7.5 Водные растворы и растворимость: соединения, растворенные в воде
7.6 Реакции осаждения: реакции в водном растворе Которые образуют твердое тело
7.7 Написание химических уравнений для реакций в растворе: молекулярные, полные ионные и чистые ионные уравнения
7.8 Кислотно-основные реакции и реакции выделения газа
7.9 Реакции окисления-восстановления
7.10 Классификация химических реакций
8. Количества в химических реакциях
8.1 Изменение климата: слишком много диоксида углерода
8.2 Приготовление блинов: взаимосвязь между ингредиентами
8.3 Изготовление молекул: молярное преобразование
8.4 Изготовление молекул: преобразование массы в массу
8.5 Еще блины: ограничение реагента, теоретический выход и процентный выход
8.6 Ограничение реагента, теоретический выход и процентный выход от исходных масс реагентов
8. 7 Энтальпия: мера тепла, выделяемого или поглощаемого в реакции
7 Энтальпия: мера тепла, выделяемого или поглощаемого в реакции
9. Электроны в атомах и периодическая таблица
9.1 Дирижабли, воздушные шары и модели атома
9.2 Свет: электромагнитное излучение
9.3 Электромагнитный спектр
9.4 Модель Бора: атомы с орбитами
9.5 Квантово-механическая модель: атомы с орбиталями
9.6 Квантово-механические орбитали и электронные конфигурации
9.7 Электронные конфигурации и периодическая таблица
9.8 Объясняющая сила квантово-механической модели
9.9 Периодические тенденции: размер атома, энергия ионизации и металлический характер
10. Химическая связь
10.1 Модели связи и лекарства от СПИДа
10.2 Представление валентных электронов точками
10.3 Структуры Льюиса ионных соединений: переносимые электроны
10.4 Ковалентные структуры Льюиса: общие электроны
10.5 Запись структур Льюиса для ковалентных соединений
10.6 Резонанс: эквивалентные структуры Льюиса для одной и той же молекулы
10. 7 Прогнозирование форм молекул
7 Прогнозирование форм молекул
10.8 Электроотрицательность и полярность: почему масло и вода не смешиваются
11. Газы
11.1 Сверхдлинные соломинки
11.2 Кинетическая молекулярная теория: модель для газов
11.3 Давление: результат Постоянные молекулярные столкновения
11.4 Закон Бойля: давление и объем
11.5 Закон Чарльза: объем и температура
11.6 Закон комбинированного газа: давление, объем и температура
11.7 Закон Авогадро: объем и моль
11.8 Закон идеального газа: давление, объем, температура и моли
11.9 Смеси газов: почему дайверы дышат смесью гелия и кислорода
11.10 Газы в химических реакциях
12. Жидкости, твердые вещества и межмолекулярные силы
12.1 Взаимодействие между молекулами
12.2 Свойства жидкостей и твердых тел
12.3 Межмолекулярные силы в действии: поверхностное натяжение и вязкость
12.4 Испарение и конденсация
12.5 Плавление, замораживание и сублимация
12. 6 типов межмолекулярных сил: дисперсия, диполь-диполь, водородная связь и ион-диполь
6 типов межмолекулярных сил: дисперсия, диполь-диполь, водородная связь и ион-диполь
12.7 Типы кристаллических твердых тел: молекулярные, ионные и атомные
12.8 Вода: замечательная молекула
13. Решения
13.1 Трагедия в Камерун
13.2 Растворы: гомогенные смеси
13.3 Растворы твердых веществ, растворенных в воде: как приготовить леденцы
13.4 Растворы газов в воде: как газированная вода получает газ
13.5 Определение концентрации раствора: массовый процент
13.6 Определение концентрации раствора: молярность
13.7 Разведение раствора
13.8 Стехиометрия раствора
13.9 Понижение точки замерзания и повышение температуры кипения: повышение температуры замерзания воды и повышение температуры кипения
13.10 Осмос: почему питьевая соленая вода вызывает обезвоживание
14. Кислоты и основания
14.1 Sour Patch Kids и международные шпионские фильмы
14.2 Кислоты: свойства и примеры
14.3 Основания: свойства и примеры
14. 4 Молекулярные определения кислот и оснований
4 Молекулярные определения кислот и оснований
14.5 Реакции кислот и оснований
14.6 Кислотно-основное титрование: способ количественного определения количества кислоты или основания в растворе
14.7 Сильные и слабые кислоты и основания
14,8 Вода: кислота и основание в одном
14,9 Шкалы pH и pOH : Способы выражения кислотности и щелочности
14.10 Буферы: растворы, устойчивые к изменению pH
15. Химическое равновесие
15.1 Жизнь: контролируемое неравновесие
15.2 Скорость химической реакции
15.3 Идея динамического химического равновесия
15.4 Константа равновесия: мера того, насколько далеко заходит реакция
15.5 Гетерогенные равновесия: выражение равновесия для реакций с участием твердого тела или жидкости
15.6 Расчет и использование констант равновесия
15.7 Нарушение реакции в состоянии равновесия: принцип Ле Шателье
15,8 Влияние изменения концентрации на равновесие
15.9 Влияние изменения объема на равновесие
15. 10 Влияние изменения температуры на равновесие
10 Влияние изменения температуры на равновесие
15.11 Константа произведения растворимости
15.12 Путь реакции и влияние катализатора
16. Окисление и восстановление
16.1 Конец двигателя внутреннего сгорания?
16.2 Окисление и восстановление: некоторые определения
16.3 Состояния окисления: электронный учет
16.4 Уравновешивание окислительно-восстановительных уравнений
16.5 Серии действий: прогнозирование спонтанных окислительно-восстановительных реакций
16.6 Батареи: использование химии для выработки электроэнергии
16.7 Электролиз: использование электричества для получения химии
.8 Коррозия: нежелательные окислительно-восстановительные реакции
17. Радиоактивность и ядерная химия
17.1 Диагностика аппендицита
17.2 Обнаружение радиоактивности
17.3 Типы радиоактивности: альфа-, бета- и гамма-распад
17.4 Обнаружение радиоактивности
17.5- Естественная радиоактивность Жизнь
17. 6 Радиоуглеродное датирование: использование радиоактивности для измерения возраста окаменелостей и других артефактов
6 Радиоуглеродное датирование: использование радиоактивности для измерения возраста окаменелостей и других артефактов
17.7 Открытие деления и атомная бомба
17.8 Ядерная энергия: использование деления для выработки электроэнергии
17.9 Ядерный синтез: сила Солнца
17.10 Влияние радиации на жизнь
17.11 Радиоактивность в медицине — см. Дополнительную информацию по адресу: http://www.pearsonhighered.com/educa .. ..pzwssdaT.dpuf
Эта текстовая карта представляет собой вводный текст по химии, предназначенный для начала одного семестра или четверти опыта в области химии. В этой текстовой карте рассматриваются некоторые основные темы химии, и она должна дать студентам достаточно знаний, чтобы оценить влияние химии в повседневной жизни и, при необходимости, подготовить студентов к дополнительным занятиям по химии.
Открытые учебники | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7A
Марка 7Б
7 класс (A и B вместе)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 8A
Сорт 8Б
Оценка 8 (вместе A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
9 класс (A и B вместе)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4A
Класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5A
Марка 5Б
Оценка 5 (вместе A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 6А
Марка 6Б
6 класс (A и B вместе)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий.Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без бренда)
Эти небрендовые версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, изменять или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Ресурсы для учителей Home-Waldorf
Миссия и видение
Миссия этого сайта - предоставить учителям Waldorf возможность поделиться друг с другом тем, что сработало.Это место, где мы можем поделиться своими идеями по учебной программе, основными страницами уроков, музыкой, ресурсами и, прежде всего, своим вдохновением и опытом.
Этот сайт посвящен тому, чтобы сделать обучение в Вальдорфе устойчивым. Ежегодная подготовка к новой учебной программе - это грандиозная задача. Этот сайт предоставляется в качестве ресурса для идей и материалов, чтобы мы могли проводить больше времени с нашими семьями и заботиться о себе, что, в конечном итоге, делает нас лучшими учителями.Как это работает
Вы найдете материалы, упорядоченные по классам и блокам уроков, каждый из которых имеет вкладку «Самоцветы»."На этой вкладке находятся отдельные сообщения, содержащие идеи учебной программы и материалы, которые хорошо зарекомендовали себя в классе. К каждому сообщению могут быть прикреплены основные работы урока или полезные материалы. Учителя могут" отвечать "на сообщение, чтобы добавить дополнительные материалы или отзывы. Учителя также могут добавлять свои собственные сообщения с новыми идеями. Щелкните следующую ссылку, чтобы ознакомиться с процедурой публикации и инструкциями.
Для рассмотрения
В качестве предостережения, ничто не может заменить нашу внутреннюю работу. Любое обучение, основанное только на методах и материалах, не является в живых.Задача вальдорфского учителя - учить художественно. Мы учим художественно, когда связаны с духовным миром, поскольку именно здесь все истинное искусство находит свой источник. Искусство - это результат жизненной силы, которая течет через нас из этого источника, и отражается в том, как мы готовим и проводим урок. Это отражается в том, как мы настраиваемся на потребности детей в классе и реагируем на них. Хотя материалы на этом сайте обеспечивают в основном физическую поддержку, мы надеемся, что можно будет передать каплю духа и вдохновения, которые были вложены в их привлечение в класс.Все это легко потерять при переводе и эффективности документации. Пожалуйста, не забудьте спросить: «Почему я беру этот урок? Как этот урок удовлетворяет интеллектуальные, эмоциональные и / или физические потребности детей? Какие способности он помогает развить?»
Это совершенно бесплатно?
Этот сайт предоставляется учителям и школам совершенно бесплатно. Если вы сочтете это ценным, пожертвование поможет покрыть расходы на содержание веб-сайта.
Почему требуется регистрация для определенных функций веб-сайта
Регистрация гарантирует, что вы человек с реальным адресом электронной почты.Это помогает предотвратить рассылку спама на страницах учебных программ. Это также помогает сохранить доступ к этим страницам для целевой аудитории. Те, кто понимает ценность, приложат дополнительные усилия для регистрации.
Макет сайта
На каждой странице учебной программы имеется до трех вкладок.
GEMS - это сердце веб-сайта. Он содержит сообщения с элементами учебной программы (идеи, материалы урока, основные страницы урока, музыка и т. Д.). Как следует из названия, в идеале он содержит «то, что сработало» в классе, или драгоценные камни для обучения.Вы можете размещать свои собственные работы на этих страницах.
ГАЛЕРЕЯ содержит все изображения для страницы, содержащейся в ее сообщениях. РЕСУРСЫ содержит все ссылки для страницы, содержащиеся в ее сообщениях, а также иногда другие полезные ссылки. Поиск позволяет быстро находить темы по включенным словам. Верхний поиск будет выполнять глобальный поиск, возвращая результаты из любой точки сайта. Нижний поиск возвращает результаты в рамках текущей темы или фильтрует результаты дальше.Что впереди ...
В июне 2013 года я закончил восьмой класс. После годичного перерыва я начал заново с новым классом. Я активно занимаюсь наполнением этого сайта материалами, полученными за годы преподавания в классах, а также размещением материалов, которые другие учителя щедро предоставили в распоряжение. Этот сайт открыт для всех учителей, которые могут загружать свои материалы и публиковать свои идеи. Добавление моего материала - это медленный процесс, и в ближайшие годы я буду преподавать в новом классе, прежде чем я опубликую полную учебную программу.Ты можешь помочь. Пожалуйста, внесите свой вклад и сделайте это живым ресурсом.
Регулярно проверяйте и нажимайте кнопку «Что нового» в строке меню, чтобы получать обновления о ходе работы сайта.
Элементы и (первые) принципы в химии
Теперь, когда мы проследили APE через историю химии, мы можем обсудить его эпистемический статус. Это правда, согласно современной химии? Если это то, что можно узнать сейчас, когда это стало известно? Когда стало известно, были ли основания априори или апостериори? Современная химия однозначно подтверждает APE: элементы выживают в своих соединениях, потому что ядерный заряд, элементарное свойство, благодаря которому химия индивидуализировала элементы с 1923 года, сохраняется при химических изменениях (см. Обсуждение в Hendry 2006). Footnote 5 Поскольку факты, подтверждающие истинность APE, были открыты только в двадцатом веке, это должно считаться эмпирическим открытием.
Если APE истинно, то в принципе это может быть известно, но очень трудно сказать, что Лавуазье мог знать, что APE истинен. Трудно даже сказать, что он этому верил. Его теории, его методы (включая гравиметрию) и его способы описания химических изменений могут включать в себя презумпцию их истинности, но это не означает, что он утверждал бы это, если бы на него настаивали.Нельзя также сказать, что у него было бы какое-либо оправдание для утверждения его истинности, если бы оно подтверждалось фактами, которые стали известны только в двадцатом веке. Поэтому можно было бы сказать, что APE был доступен Лавуазье как негласное рабочее предположение о том, как должна работать теория композиции, но это не то же самое, что сказать, что он знал, что это правда. Такое предположение было бы «оправданным» только в том смысле, что его допустимо было делать при выполнении его программы исследования композиции.Это не то же самое, что оправдание в более традиционном эпистемологическом смысле (достаточное основание для веры). В поисках такого обоснования рабочего предположения в исследовательской программе до того, как эта программа запущена, телега ставится впереди лошади. Какое бы там ни было оправдание, оно появилось бы благодаря эмпирическому успеху программы.
APE — это, безусловно, естественный способ понять химический состав и изменения. Это может быть даже психологически естественным допущением — так же, как это естественно для младенцев после определенного этапа их когнитивного развития, — структурировать свой мир на основе постоянства объекта.Все это не означает, что APE может быть известен априори. Если предположить, что APE — это только психологическая тенденция, то дальнейшие размышления могут позволить ему противостоять. Я думаю, что дальнейшие размышления действительно показывают, что APE можно сопротивляться: учение Аристотеля о химической комбинации отрицает APE, но при этом совершенно логично.
Согласно Аристотелю, элементы потенциально присутствуют только при объединении в микс. Footnote 6 Аристотель развил свою точку зрения в противоположность атомизму, согласно которой основные компоненты вещей сохраняются неизменными в более сложных телах, а различия между вещами объясняются их различным расположением.Аристотель утверждал, что если элементы объединяются для образования новой субстанции, а не просто сопоставляются, продукт должен быть однородным. Однако, если предполагается, что атомы неизменны, тогда (он утверждал) атомизм может допускать только сопоставление, и поэтому не может распознавать различие между простым сопоставлением и подлинной комбинацией (Needham 2009). Положительное контрпредложение Аристотеля состоит в том, чтобы создавать элементы из противоположных пар свойств: горячего и холодного, влажного и сухого. Элементы соответствуют максимальным степеням совместимости пар этих свойств: воздух — это горячее и влажное, вода — это холодное и влажное, огонь — горячее и сухое, а земля — холодное и сухое.В сочетании основные свойства элементов смешиваются, так что смесь будет иметь субмаксимальные степени тепла или холода, влажности или сухости. Поскольку смесь однородна, элементы фактически не присутствуют в смеси, потому что никакая часть смеси не обладает существенными свойствами любого из элементов. Что сохраняется? Нидхэм интерпретирует точку зрения Аристотеля как принимающую непрерывные изменения как части материи, обладающие свойствами вещества, включая способность снова проявлять элементарные свойства (2009).Только в этом смысле — потенциальности — можно сказать, что элементы находятся «в смеси».
Если APE является конституирующим принципом, который может быть известен априори, то что же он является конститутивным? Понятие элемента? Разборчивость (для нас) объяснения композиции Аристотеля является (опровержимым) свидетельством того, что это представление связно. Если объяснение Аристотеля логично, то оно не нарушает никаких рациональных ограничений на применение концепции элемента. В этом случае APE можно согласованно отрицать, и он не является составляющей нашей концепции элемента.Теперь вместо этого можно было бы увидеть применимость концепции элемента в зависимости от непрерывности химических изменений: химические реакции включают изменение, но последовательное изменение требует непрерывности, что серия химических изменений имеет постоянный субъект , с которым это происходит. Это тоже было бы недостаточным оправданием для APE. Согласно Нидхему, у Аристотеля материя является продолжением: химические изменения — это вещи, которые происходят с частями материи. Следовательно, даже если непрерывность химических изменений является требованием для надлежащей применимости концепции химического элемента, ее можно удовлетворить, не предполагая, что элементы выживают в своих соединениях. Footnote 7
Этот аргумент можно было бы оспорить, указав, что концепции элементов радикально изменились на протяжении истории науки. Даже если рассказ Аристотеля понятен современному философу или ученому, возможно, он не был для Лавуазье. Мне не известно о положительном текстуальном обосновании этого утверждения в собственной работе Лавуазье. Рассмотрим по аналогии предположение Лавуазье о том, что кислотность обеспечивается присутствием кислорода. Должны ли мы сказать, что это предположение ложно или что это часть концепции кислотности Лавуазье? Если мы можем считать, что Лавуазье способен рассуждать о кислотах, то мы можем считать, что он ошибался в отношении природы кислот (я думаю, что можем).Тогда мы можем сказать, что предположение Лавуазье о кислотности оказалось ложным, как и все последующие теории, согласно которым свойство кислотности обеспечивается присутствием определенного элемента (см. Hendry 2005, 2010). Теперь Лавуазье рассуждает об элементах и их роли в химических изменениях способами, которые хорошо известны современной науке. APE ограничивало его рассуждения, но оно могло оказаться ложным, поэтому более правдоподобно рассматривать его как фактическое предположение даже в системе Лавуазье.Это не нокдаун-аргумент, поскольку он основан на предшествующей позиции: исторические философы и ученые могут (иногда) рассуждать о том же самом мире, в котором мы находимся, и могут ошибаться в этом. Эта позиция может быть оспорена конкретными текстовыми доказательствами: что Лавуазье рассматривал кислород как концептуально (а не материально) составляющую кислотности, или что он рассматривал APE как концептуально составляющую элемент. Такие доказательства (насколько мне известно) полностью отсутствуют.
Вместо априорного регулирующего принципа я бы сказал, что APE следует рассматривать как метафизический принцип, который, тем не менее, мог играть важную регулирующую и эвристическую роль в развитии теорий химического состава и структуры с восемнадцатого века. века и позже. Под «метафизическим» я подразумеваю «относящийся к существованию или реальности или относящийся к ним». Метафизический принцип — это общее или абстрактное утверждение о том, как обстоят дела, а не условность или необходимое предварительное условие для знания в какой-либо конкретной области.«Метафизичность» в этом смысле не означает непроверяемости или непроверяемости. Метафизические принципы может быть трудно проверить или проверить, и может быть даже невозможно проверить или проверить самостоятельно, но то же самое верно и для многих научных теорий. Метафизичность не исключает возможности быть неотъемлемой частью науки. Действительно, метафизические принципы часто четко формулируются учеными (рассмотрим, например, приверженность Ньютона абсолютному времени и пространству), но часто они не сформулированы, даже если они регулируют выводы ученого о категориях, которыми они управляют.Достоинство понимания APE как метафизического принципа состоит именно в том, что его можно непрерывно проследить на протяжении истории химии, от того времени, когда он не был сформулирован (в работе Лавуазье), до того времени, когда он был явно признан (в работе Менделеева). ).
Начиная с 1950-х годов философы Лондонской школы экономики разработали противоположные мнения о том, как это могло бы работать. Можно сказать, что проект определения роли метафизики в науке сам по себе был исследовательской программой в рамках широко реалистической философии науки, поддерживаемой (и сам по себе поддерживающей) широким взглядом на то, что единицы оценки в науке должны быть исследовательскими программами (т. Е. , серии теорий, а не отдельных теорий, разработанных в рамках таких программ).Поэтому в оставшейся части этого раздела я буду критически исследовать, примерно в хронологическом порядке, предложения Карла Поппера, Дж. У. Н. Уоткинса, Имре Лакатоса и Эли Захара.
Чтобы быть достойным своего имени, реалистическое описание роли метафизики в науке должно основываться на следующих общих принципах. Во-первых, метафизические теории или принципы должны рассматриваться как фактические утверждения: они (или, по крайней мере, некоторая их абстрактная часть) должны интерпретироваться реалистично, чтобы семантически соответствовать другим теоретическим утверждениям в науке, и их предполагаемые роль в науке должна зависеть от этой интерпретации.Во-вторых, роль метафизических теорий или принципов не должна сводиться к просто психологической роли в приведении конкретной проверяемой теории в сознание конкретного ученого. Утверждается, что наблюдение за падением яблока в его доме в Вулсторпе сыграло определенную роль в возникновении закона всемирного тяготения Ньютона. Footnote 8 Дремал перед огнем Августу Кекуле якобы было видение змеи, которая схватила свою собственную сказку, приняв форму кольца, которое, как он сказал позже, подсказало ему его знаменитую шестиугольную формулу. для бензола (см. Rocke 2010, глава 7).Согласно реалистической концепции, роль метафизических теорий не должна быть просто наводящей на размышления, как яблоко и змея для Ньютона и Кекуле. Чтобы поддержать реалистический вывод, эвристическая и регулирующая роль должна зависеть от содержания метафизического принципа, истолкованного в буквальном смысле. В-третьих, если такие теории или принципы семантически наравне с проверяемыми научными утверждениями, и они могут играть роль в развитии теорий, которая не просто наводит на размышления, то в принципе должна быть возможна оценка этой роли. конкретных метафизических теорий или принципов в конкретных научных разработках, во многом так же, как абстрактным, но все же научным принципам в физике приписывается эмпирический успех в теоретических разработках, в которых они играют важную роль.
Это предполагает взгляд на роль метафизики в науке, близкий по духу научному реализму, но требующий большего. Не каждый научный реалист может захотеть дать реалистическое описание роли метафизики в науке. Можно быть реалистом в отношении науки, но думать, что метафизика оказывает на нее только вредное воздействие. Или можно допустить, что метафизические принципы могут (иногда) играть роль, но никогда так, чтобы обосновать аргумент в пользу их истинности. Я думаю, что метафизические принципы могут играть роль в эмпирической науке, что действительно позволяет им получить положительную поддержку.Осталось описать, как это вообще возможно.
В коротком, но хорошо известном отрывке в постскриптуме к Логике научных открытий Поппер попытался сформулировать роль метафизики в науке, но название раздела ясно дает понять, что эта роль ограничена и не соответствует два из наших трех критериев реалистической концепции роли метафизики в науке: «Почему даже псевдонауки могут иметь смысл». Метафизические программы для науки »(1983, стр.189–93). Его обсуждение начинается с повторения его фальсификационистского критерия демаркации, который «выделяет те теории, которые могут быть серьезно обсуждены с точки зрения опыта» (1983, с. 189). Но ученый рискует пренебречь изучением псевдонаучных и метафизических теорий, которые не соответствуют этому критерию, из которого можно извлечь «что-то действительно интересное». Он утверждал, что пренебрежение к астрологии, например, может скрыть от ученого астрономические возможности, такие как влияние Луны на приливы и отливы, и признал, что Кеплер «принадлежал к астрологической традиции», хотя он «никогда не уставал выдвигать свои гипотезы. к остроумным и очень критическим тестам »(1983, с.190). Центральным примером «чрезвычайно важной метафизической теории» Поппера (1983, стр. 191) является атомизм:
Метафизический характер «корпускулярной теории», во всяком случае до Авогадро, ясен. Не было возможности опровергнуть это. Неспособность обнаружить тельца или какие-либо доказательства их существования всегда можно объяснить, указав на то, что они слишком малы, чтобы их можно было обнаружить. Только теория, которая привела к оценке размера молекул, была более или менее заблокирована, так что опровержение стало в принципе возможным.(Поппер, 1983, с. 191)
Согласно Попперу, атомизм является метафизической теорией не только потому, что он не поддается проверке, но и потому, что он «задумал мир в терминах обширного обобщения в высочайшем масштабе» (1983, p. 191), и « объяснил. известное в терминах неизвестного : оно сконструировало неизвестный и невидимый мир за нашим известным миром »(1983, p. 192). Для Поппера ее ценность для науки заключалась в том, что ее можно было дополнить дальнейшими предположениями, чтобы ее можно было проверить (1983, с.191). Следовательно, было бы «грубым заблуждением называть это бессмысленным; и очень рискованно отвергать его сразу, как это сделал Мах »(1983, с. 191). Конечно, став поддающимся проверке, атомизм стал научной теорией, но даже непроверяемая теория может« указать направление наших поисков, и своего рода объяснение, которое могло бы нас удовлетворить ». (1983, стр. 193). Таким образом, неопровержимое экзистенциальное утверждение «существует философский камень» (1983, стр. 193) «оказалось многообещающим и даже плодотворным в истории науки» (предположительно, благодаря его влиянию на алхимию), несмотря на то, что что это «никогда не проверялось и теперь никто не верит» (1983, с.193).
Из обсуждения Поппера стоит отметить три вещи. Во-первых, он никогда не отличает метафизику от лженауки. Оба они неопровержимы, и термины, в которых он характеризует метафизику (большая общность, объясняющая известное в терминах неизвестного или невидимого), несколько расплывчаты и едва ли отличаются от метафизики. Как признает Поппер, эти черты разделяют и многие научные теории. Во-вторых, ненаучная теория может иметь ценность для науки двумя способами.Атомизм стал поддающимся проверке, когда он был расширен, чтобы стать проверяемым. Поступив так, она перестала быть метафизической, но другие теории остались непроверяемыми и, тем не менее, наводили на мысль об эмпирической работе. Поппер не указывает, сделали ли они это, предлагая проверяемые гипотезы, но даже если бы они это сделали, эта роль позволила бы отнести их к (психологическому) контексту открытия. Об отношении Кеплера к астрологии он отмечает: «Здесь, как часто… важные гипотезы могут происходить из поистине фантастических идей: происхождение не имеет значения, пока гипотеза поддается проверке.'(1983, с. 191). В-третьих, если метафизические теории могут стать научными теориями, когда они дополнены дополнительными предположениями, то, похоже, статус теории как метафизической ей не присущ. Это кажется особенно верным, если, как в случае атомизма, дополнительные требования являются относительно низкими, например, оценка размера молекулы. Теперь Поппер фактически неверно определяет, как атомизм стал частью науки: проверяемые оценки физических свойств атомов стали доступны только в двадцатом веке в результате процесса триангуляции, задуманного Жаном Перреном (см. Nye 1972).Это произошло через много лет после того, как атомизм стал частью науки: широко атомистические теории молекулярной структуры можно было проверить, по крайней мере косвенно, химическими средствами с 1860-х годов, с помощью процесса, который Алан Рок назвал «подсчетом изомеров» (см. Rocke 2010, глава 7). ). Как и многие философы науки двадцатого века, Поппер имел тенденцию игнорировать химию.
По основному логическому пункту, что метафизическое (потому что непроверяемое) может стать научным (потому что проверяемым) , просто будучи соединенным с другими утверждениями , Поппер явно прав.Более того, в двадцатом веке нужно было указать на это. Но следствием признания этой важной истины является то, что различие между научными и метафизическими теориями немедленно становится контекстуальным и, следовательно, исторически случайным, а не вневременной чертой их содержания или логической формы, потому что это зависит от того, была ли предложена конкретная теория. наряду с другими утверждениями, вместе с которыми это подразумевает некоторые эмпирически проверяемые последствия.Фактически, кажется, что различие между метафизикой и наукой полностью исчезает. Footnote 9 Другие теории, которые Поппер считал однозначно научными, такие как механика Ньютона, также не поддавались проверке в отдельности, требуя дополнения вспомогательными предположениями, и он явно охарактеризовал теорию эволюции Дарвина, которая для большинства других философов является частью науки, как «программа метафизических исследований» (1974, стр. 133–143).
Поппер справедливо отверг значение как аспект, по которому наука должна отличаться от ненаучной.Более того, идея о том, что метафизическая теория может стать проверяемой (и, следовательно, научной) путем дополнения, поддерживает наше первое условие: семантический паритет метафизики и науки. Трудно понять, как добавление дополнительных посылок может волшебным образом превратить метафизику в науку, если эти две вещи существенно различаются по природе своего содержания или их логической форме. Однако для Поппера метафизическая теория, которая остается непроверяемой, не может быть частью науки. Даже если можно назвать его «важным», трудно понять, чем его суггестивная роль отличается от роли яблока Ньютона или змеи Кекуле, поскольку, как мы видели, он также считал, что происхождение проверяемой теории «никогда имеет значение’.Эта странная и несколько противоречивая позиция относительно роли метафизики в науке навязана Попперу из-за того, что он придерживался фальсификационистского критерия демаркации. Метафизические принципы не могут быть полностью частью науки, потому что они не поддаются проверке.
Уоткинс использовал игрушечный пример — «доктрины призрачной вселенной» (1958, стр. 344) — для описания роли метафизики в науке, которая все еще в целом попперовская, но более тонкая, чем собственная точка зрения Поппера. Рассмотрим замок, который считается населенным привидениями.Поскольку оно включает экзистенциальное утверждение (« что-то есть » (стр. 344)), это убеждение неопровержимо, хотя оно также может быть «драматично, хотя и не окончательно подтверждено жутким опытом» (стр. 344). Некоторые метафизические теории являются или влекут за собой утверждения о тесно связанной форме, утверждает Уоткинс: те, которые «утверждают о завуалированном существовании чего-то во вселенной, о чем мы можем уловить подтверждающие проблески» (стр. 344). Поскольку они неопровержимо подтверждаемы, но неопровержимы, они «пользуются особой привилегией в борьбе идей за существование» (стр.344). Они являются «вненаучными», но могут влиять на развитие научных теорий.
Логическая форма типичной «доктрины вселенной с привидениями» включает в себя как универсальную, так и экзистенциальную количественную оценку (1958, стр. 346), относительно низкоуровневый пример из химии, заключающийся в том, что «для любого металла существует кислота, которая растворяет его». (1958, с. 346). Детерминизм часто понимается как утверждение, что «каждое событие имеет причину» (1958, стр. 348). Исходя из предположения, что причинное утверждение, такое как «X вызывает Y», требует наличия закона природы, который включает взаимосвязь между ними, детерминизм предписывает ученым искать законы природы (1958, стр.356). Точно так же механизм, понимаемый как утверждение, что «или каждое физическое изменение существуют смежные и одновременные факторы, вызывающие это изменение» (1958, стр. 350), предписывает ученым никогда не принимать «оккультные качества, действие на расстоянии, мгновенную передачу». или любые другие отклонения от принципа действия путем контакта »(1958, стр. 356).
Теперь может случиться так, что каждая метафизическая доктрина может быть выражена в этой форме или влечет за собой утверждение, которое может быть выражено в этой форме.Утверждение, что все метафизические утверждения в науке могут быть истолкованы как имеющие эту форму (то есть доктрины призрачной вселенной), могло бы быть вполне тривиальным, если бы не было никаких ограничений в отношении того, какие классы сущностей могут быть введены для кванторов. Интересно, что это более сильное утверждение само по себе имеет ту же логическую форму, что и доктрины вселенной с привидениями, хотя и с кванторами второго порядка: для каждой метафизической теории существует класс сущностей, которые при количественной оценке позволяют сформулировать эквивалентное утверждение: форма вселенной с привидениями.Однако Уоткинс совершенно разумно никогда не предлагает, чтобы все метафизические утверждения могли быть выражены таким образом, делая лишь более слабое утверждение, что «эта структура является общей для ряда вненаучных идей, которые серьезно повлияли на развитие науки» (1958). , с. 344).
Ядро композиционной программы в химии можно переформулировать в соответствии с предложением Уоткинса: для каждого составного вещества есть элементарные вещества, из которых оно (материально) состоит.Это утверждение, однако, является следствием более логически более сильного утверждения, которое химики после Лавуазье также поддержали бы: существуют элементарные вещества, из которых (материально) состоит каждое химическое вещество. По отдельности эти утверждения неопровержимы, но подтверждаемы, и работы химиков с 1790-х годов, заполнившие таблицу простых веществ Лавуазье, подтвердили их конкретными примерами. Попутно некоторые из простых веществ, придуманных Лавуазье, были удалены (калорийность, легкость), а требования к индивидуальному составу были пересмотрены (было принято, что кислота морской соли не содержала кислорода).Более того, как указывает Захар (2007, с. 139), метафизический характер доктрин вселенной Уоткинса проистекает не из содержащихся в них концепций или ненаблюдаемой природы сущностей, которые они количественно оценивают, а из их логической формы: «ибо каждая субстанция есть некоторая субстанция, в которой она растворяется » включает наблюдаемое отношение » x растворяет y », и тем не менее является столь же явно метафизическим (потому что не поддающимся анализу), как ‘каждое событие имеет причину’. Идея доктрины вселенной с привидениями кажется искренней чтобы осветить композиционную программу в химии и метафизический характер ее основных утверждений: экзистенциальное утверждение мотивирует поиск своего творца истины, которым может быть призрак, растворитель или несколько химических элементов.
Однако принятие Уоткинсом фальсификационистского критерия разграничения науки и ненаучности означает, что его точка зрения сталкивается с той же фатальной трудностью, что и точка зрения Поппера. Метафизика остается чем-то иным, чем наука: «между царством аналитических истин и царством эмпирических утверждений находится ничейная земля доктрин вселенной с привидениями» (1958, стр. 359). Это жесткое разделение влечет за собой, что даже там, где доктрина вселенной с привидениями играет важную роль в науке, это не может служить простым аргументом в пользу ее истинности, потому что (i) разные части науки могут поддерживать разные метафизические теории; (ii) эмпирические теории, поддерживающие метафизические теории, позволили бы им препятствовать конкуренции (1958, стр.363–365). Нельзя не думать, что если метафизические теории просто принять как часть науки, эти трудности исчезнут или, по крайней мере, представляют собой не больше трудностей, чем логические столкновения между успешными научными теориями.
Поппер рассматривал методологию программ научных исследований Лакатоса как развитие его идеи программы метафизических исследований. Footnote 10 Это несправедливо во многих отношениях, но для нашего настоящего обсуждения есть одно действительно важное различие между ними.В обзоре собранных статей Лакатоса Ян Хакинг отметил, что Лакатос совершил «отход от демаркационной проблемы Поппера» (1979, стр. 384):
Поппер пришел к неявному разделению на науку, метафизику и гадость. Метафизика — это серьезное предположение, которое когда-нибудь может привести к положительной науке. У логических позитивистов была наука и метафизика — гадость, но Поппер имел в виду лучший набор различий, проиллюстрированный тем фактом, что гадость теперь организовалась как нечто, отличное от умозрительной метафизики.Лакатос теперь готов объединить метафизику, которая становится наукой, с самой наукой, потому что это часть более широкого роста знания, которое его беспокоит. Таким образом, наука-метафизика противостоит гадости. (Взлом, 1979, стр. 384–385)
Здесь стоит сделать два комментария. Во-первых, идея о том, что «наука-метафизика противостоит гадости», вызывает не более фиксированную метафизику, чем фиксированную науку. Лакатос был убежденным фаллибилистом. Изменения возможны в любой области науки, включая метафизику.Исследовательская программа со связанной метафизикой может быть заменена в любое время более успешной исследовательской программой с совершенно иной метафизикой. Наука как наука не имеет метафизических основ. Во-вторых, даже фраза «метафизика — наука противостоит дерьму» предполагает слишком большой контраст между наукой и метафизикой. Комментируя попперовцев Джозефа Агасси и Джона Уоткинса, Лакатос замечает
Я пошел намного дальше, чем они, в стирании разграничения между [Поппером] «наукой» и [Поппером] «метафизикой»: я даже больше не использую термин «метафизический».Я говорю только о научных исследовательских программах, твердое ядро которых неопровержимо не обязательно из-за синтаксиса, но, возможно, из-за методологических причин, не имеющих ничего общего с логической формой. (1970, стр. 184) Сноска 11
По мнению Лакатоса и Захара, метафизические допущения следует искать в самом сердце науки, в твердом ядре исследовательской программы (Захар 1989, с. 21; 2007, с. 138). В этом смысле они выше эмпирической схватки, но в то же время способны играть эвристическую и регулирующую роль в развитии конкретных научных теорий за счет их «предписывающего значения» структуры физических законов и объяснений (1989, с.21). Таким образом, согласно Захару, «Специальная теория относительности основана на метафизическом утверждении, что не существует привилегированной инерциальной системы отсчета. Это приводит к предписанию, согласно которому все теории должны принимать одну и ту же форму во всех инерциальных системах отсчета »(1989, с. 21). Поскольку исследовательская программа определяется ее твердым ядром, а исследовательские программы можно оценивать эмпирически, эмпирический успех исследовательской программы действительно должен отражаться на ее твердом ядре. Это отвечает на один важный вопрос, который, по словам Захара, «Поппер не задавал должным образом, не говоря уже о том, чтобы удовлетворительно ответить» (2007, стр.141): «Поддерживает ли эксперимент, подтверждающий теорию, принадлежащую программе, метафизику, лежащую в основе программы?» Отвечая на этот вопрос положительно, отчет Захара отвечает всем трем условиям реалистической концепции роли метафизики в науке.
Фундаментальная концепция, обучающая модель или эпистемологическое препятствие?
Атом в учебной программе по химии
Нерсесян, Нэнси (1992) Конструирование и обучение: роль «методов абстракции
» в создании и изучении физики, глава 2 Duschl, R.&
Гамильтон Р. (ред.), Философия науки, когнитивная психология и
Образовательная теория и практика, Олбани, Нью-Йорк: SUNY Press, стр. 48-68.
Новак, Джозеф Д. и Мусонда, Дисмас (1991). Двенадцатилетнее лонгитюдное исследование
научного концептуального обучения, American Educational Research Journal, 28 (1),
Spring 1991, pp.117-153.
Нуссбаум, Джозеф и Новик, Шимшон (1982) Альтернативные рамки, концептуальные
Конфликт и приспособление: к принципиальной стратегии обучения,
Учебная наука, 11, стр.183-200.
Оксфордская научная программа (1993) Материалы и модели, Оксфорд: Оксфордский университет
Press.
Петри Дж. И Ниддерер Х. (1998). Путь обучения квантовой физике средней школы
, атомная физика, International Journal of Science Education, 20, 1075-1088.
Полани, Майкл (1962) Личные знания: к посткритической философии,
Чикаго: University of Chicago Press, исправленная версия (первоначально опубликовано,
1958).
Поппер, Карл Р., Объективное знание: эволюционный подход (пересмотренное издание),
Oxford: Oxford University Press, 1979 (оригинальное издание, 1972).
Познер, Джордж Дж., Страйк, Кеннет А., Хьюсон, Питер У. и Герцог, Уильям А.
(1982) Приспособление научной концепции: к теории
концептуальных изменений, Science Education, 66 (2), стр 211-227.
Ренстрём, Лена, Андерссон, Бьёрн и Мартон, Ференс (1990) Концепции студентов
материи, Журнал педагогической психологии, 82 (3), стр.555-569.
Sackheim, George I. & Lehman, Dennis D. (1994) Chemistry for the Health Sciences,
7th Edition, New York: Macmillan.
Скерри, Эрик Р. (1991) Модель электронной конфигурации, квантовая механика и редукция
, Британский журнал философии науки, 42, стр. 309-325.
Скерри, Эрик Р. (1997) Была ли успешно аксиоматизирована таблица Менделеева?
Erkenntnis, 47, стр. 229-243.
Скерри, Эрик (1999) О природе химии, Educación Quimica, 10 (2), стр.74-78.
Шмидт, Ханс-Юрген (1991) Ярлык как скрытый убедитель: нейтрализация химиков
Концепция, Международный журнал естественнонаучного образования, 13 (4), стр.459-471.
Schmidt, Hans-Jürgen (1998) Относится ли периодическая таблица к химическим элементам,
School Science Review 80 (290), стр.71-74.
Schmidt, Hans-Jürgen — подано
Shayer, M. & Adey, P. (1981) На пути к преподаванию естественных наук: когнитивное развитие
и потребность в учебной программе, Oxford: Heinemann Educational Books.
Смит, Джон П., ДиСесса, Андреа А. и Рошелль, Джереми (1993) Заблуждения
переосмыслено: конструктивистский анализ знания в переходный период, Журнал
the Learning Sciences 3 (2), стр. 115-163 . Соломон, Джоан (1992) Как добраться до
Знать об энергии — в школе и обществе, Лондон: Falmer Press.
Сук, Жан-Паскаль, Историческая эпистемология Гастона Башлара и ее значение
для естественнонаучного образования, Мышление: Философский журнал для
детей, 6 (4), 1988, стр.8-13.
Ставриду, Хелени и Соломониду, Кристина (1998) Концептуальная реорганизация и
построение концепции химической реакции во время среднего образования,
International Journal of Science Education, 20 (2), pp.205-221.
Страйк, Кеннет А. и Познер, Джордж Дж. (1985) Концептуальный взгляд на изменение обучения
и понимание, Глава 13 Веста, Лео Х.Т. и Пайнс, А. Леон (ред.),
Законов химического сочетания: обзор и объяснение — видео и стенограмма урока
Закон сохранения массы
В химических реакциях чистые элементы или комбинации элементов, называемые соединениями, перестраиваются.В ядерных реакциях ядра атомов меняются. В обоих случаях масса сохраняется даже при создании новых веществ. Представьте себе пустую комнату с одной дверью, в которую входят пять человек. В конце концов пять человек должны покинуть комнату. То, что входит, должно выходить наружу. Закон сохранения массы гласит, что масса до реакции должна быть равна массе после реакции. Итак, давайте рассмотрим химическую и ядерную реакцию, чтобы показать, как масса до реакции равна массе после реакции.
Химическая реакция
Давайте быстро посмотрим, как твердый кальций реагирует с бромистоводородной кислотой:
Ca + HBr → CaBr2 + h3
Обратите внимание, что в левой части реакции есть только один бром и водород, тогда как есть два атомы каждого на стороне продуктов реакции. Это невозможно, потому что один атом водорода и брома не может быть произведен ниоткуда. Чтобы показать, что происходит на самом деле, мы должны сбалансировать уравнение с коэффициентами, которые представляют собой числа перед соединениями или элементами в реакции.Давайте уравновесим это уравнение:
Ca + 2HBr → CaBr2 + h3
Коэффициент перед HBr делает уравнение сбалансированным для массы. Теперь посмотрим на ядерную реакцию.
Ядерная реакция
В ядерной реакции ядро атома каким-то образом изменяется. Протон может превратиться в нейтрон или наоборот. Ядро также может потерять четыре единицы массы и две единицы заряда из-за выброса альфа-частицы. Давайте посмотрим, как полоний-214 превращается в свинец-210.Эта диаграмма показывает эту трансмутацию:
Значения вверху — это значения массы, а значения внизу — это электрический заряд. Обратите внимание, что ни масса, ни заряд не сохраняются, что также невозможно. Чтобы показать, что происходит на самом деле, мы должны добавить альфа-частицу, которая является ядром гелия, к стороне продуктов. Следующая диаграмма показывает полную ядерную реакцию:
Добавляя массы на стороне продуктов уравнения, мы получаем 214, что равно массе на стороне реагентов уравнения.Заряды по обе стороны от знака доходности равны. Теперь перейдем к закону постоянных пропорций.
Закон постоянных пропорций
Закон постоянных пропорций гласит, что соотношение масс одного и того же соединения является постоянным. Другими словами, он говорит нам, что соединения одного типа всегда имеют одинаковое соотношение элементов. Например, углекислый газ всегда имеет отношение ОДИН атом углерода к двум атомам кислорода, что дает формулу СО2. Соотношение масс также постоянно: 12 г углерода к 32 г кислорода, что является округленным числом в таблице Менделеева.Далее следует закон множественных пропорций.
Закон множественных пропорций
Закон множественных пропорций объясняет, как несколько элементов могут сочетаться друг с другом в множестве соотношений. Подумайте о соотношении мужчин и женщин в вашей семье. В некоторых семьях есть одна мать, один отец и одна дочь, в результате чего соотношение женщин и мужчин составляет 2: 1. В соседней семье может быть одна мать, один отец и два сына, в результате чего соотношение женщин и мужчин составляет 1: 3. Та же идея применима к элементам и соединениям.Например, водород и кислород объединяют несколько способов с образованием нескольких соединений.
Отношение одного кислорода к одному водороду — это гидроксид-ион. Один атом кислорода к двум атомам водорода — это вода (h3 O). Два атома кислорода на два атома водорода — это перекись водорода, имеющая формулу h3 O2. Несмотря на то, что эти три вещества содержат только водород и кислород, разные соотношения каждого из них приводят к соединениям с разными свойствами. Последний закон, с которым мы будем иметь дело, — это закон взаимных пропорций.
Закон взаимных пропорций
Поскольку все виды элементов объединяются, образуя соединения, между соединениями, образованными с этими элементами, должна быть какая-то связь. Эта связь объясняется законом обратных пропорций.
Закон взаимных пропорций объясняет, как два элемента могут сочетаться с другим общим элементом, и соотношение масс двух исходных элементов должно быть кратным соотношению масс этих элементов из исходного соединения.Давайте посмотрим на пример:
Сера образует соединения с водородом и кислородом, и сера является общим звеном в этих соединениях. h3 S и SO2 — два соединения с общим элементом сера. Определим массовое соотношение элементов в каждом соединении.
h3 S составляет 2 H: 16 S от округленных молярных масс по периодической таблице. Это соотношение уменьшается до 1 H: 8 S.
Мы собираемся переписать SO2 как O2 S, чтобы сера оставалась вторым элементом. Это дает нам соотношение масс 32 O: 32 S, которое сокращается до 1 O: 1 S.Теперь мы извлекаем серу из каждого соотношения, чтобы получить отношение водорода к кислороду, которое составляет 1 H: 1 O.
Давайте посмотрим на соединение, образованное между водородом и кислородом, которое представляет собой h3 O2. Массовое отношение кислорода к водороду в этом соединении должно составлять 1 O: 1 H или 1 H: 1 O. Массовое отношение h3 O2 составляет 2 H: 32 O, которое сокращается до 1 H: 16 O, которое кратно исходному соотношению 1 H: 1 O.
Резюме урока
Давайте сделаем пару минут, чтобы повторить то, что мы узнали о законах химического соединения.
Существует четыре основных основы химии с точки зрения химических и ядерных реакций:
- Закон сохранения массы , согласно которому масса до реакции должна быть равна массе после реакции
- Закон постоянных пропорций , в котором соотношение масс для одного и того же соединения постоянно
- Закон нескольких пропорций , в котором несколько элементов могут сочетаться друг с другом в нескольких соотношениях; и наконец
- Закон взаимных пропорций , в котором два элемента могут объединяться с другим общим элементом, а соотношение масс двух исходных элементов должно быть кратным соотношению масс этих элементов из исходного соединения
Теперь вы должны понять законы химического сочетания, которые должны значительно упростить наблюдение и изучение соединений в лаборатории!
.
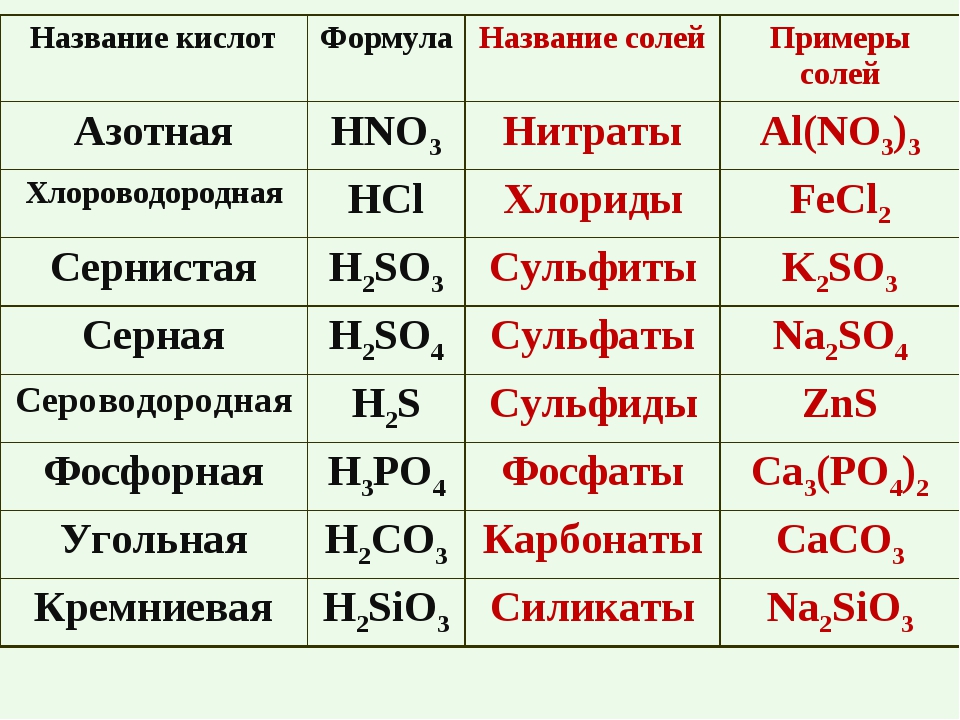
 Пауэлл, Томас Соренсен и Эллисон Сульт. Химия. Нп .: н.п., 2015. Химия.Колледж OpenStax, март 2015 г. Web.
Пауэлл, Томас Соренсен и Эллисон Сульт. Химия. Нп .: н.п., 2015. Химия.Колледж OpenStax, март 2015 г. Web.