ГДЗ 8 класс / тема 1 / работа 4 1 химия 8‐9 класс дидактический материал Радецкий
Решение есть!- 1 класс
- Математика
- Английский язык
- Русский язык
- Литература
- Окружающий мир
- 2 класс
- Математика
- Английский язык
- Русский язык
- Информатика
- Музыка
- Окружающий мир
- Технология
- 3 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Музыка
- Литература
- Казахский язык
- 4 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- 5 класс
- Математика
- Английский язык
- Русский язык
Решебник по химии за 8 класс к дидактическому материалу А. М.РадецкийВсе главы
М.РадецкийВсе главы
Тема I. Первоначальные химические понятия. Работа 1. Химические элементы. Простые и сложные вещества
Тема I. Первоначальные химические понятия. Работа 2. Химические формулы. Относительная молекулярная масса
Тема I. Первоначальные химические понятия. Работа 3. Валентность
Тема I. Первоначальные химические понятия. Работа 4. Химические уравнения
Тема I. Первоначальные химические понятия. Работа 5. Типы химических реакций
Тема I. Первоначальные химические понятия. Работа 6. Количество вещества. Моль. Молекулярная масса
Тема I. Первоначальные химические понятия. Работа 7. Итоговая по теме I
Тема II. Кислород. Оксиды. Горение. Работа 1. Получение и свойства кислорода
Тема II. Кислород. Оксиды. Горение. Работа 2. Состав воздуха. Горение веществ в воздухе
Тема II. Кислород. Оксиды. Горение. Итоговая работа по теме II
Тема II. Кислород. Оксиды. Горение. Работа 3. Итоговая по теме II
Тема III. Водород. Кислоты. Соли. Работа 1. Получение и свойства водорода
Водород. Кислоты. Соли. Работа 1. Получение и свойства водорода
Тема III. Водород. Кислоты. Соли. Работа 2. Свойства кислот. Соли
Тема III. Водород. Кислоты. Соли. Работа 3. Итоговая по теме III
Тема IV. Вода. Растворы. Основания. Работа 1. Вычисление массовой доли и массы вещества в растворе
Тема IV. Вода. Растворы. Основания. Работа 2. Химические свойства воды. Основания
Тема IV. Вода. Растворы. Основания. Работа 3. Итоговая по теме IV
Тема V. Важнейшие классы неорганических соединений. Работа 1. Классификация неорганических соединений
Тема V. Важнейшие классы неорганических соединений. Работа 2. Взаимосвязь между оксидами, основаниями, кислотами и солями
Тема V. Важнейшие классы неорганических соединений. Работа 3. Взаимодействие между отдельными классами неорганических соединений
Тема V. Важнейшие классы неорганических соединений. Работа 4. Итоговая по теме V
Тема VI. Периодический закон и периодическая система химических элементов Д. И.Менделеева. Строение атома. Работа 1. Периоды, группы, подгруппы периодической системы химических элементов
И.Менделеева. Строение атома. Работа 1. Периоды, группы, подгруппы периодической системы химических элементов
Тема VI. Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. Работа 2. Строение атома
Тема VI. Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома. Работа 3. Итоговая по теме VI
Тема VII. Химическая связь. Строение веществ. Работа 1. Химическая связь. Кристаллические решетки
Тема VII. Химическая связь. Строение веществ. Работа 2. Элекроотрицательность и степень окисления
Тема VII. Химическая связь. Строение веществ. Работа 3. Окислительно-восстановительные реакции
Тема VII. Химическая связь. Строение веществ. Работа 4. Итоговая по теме VII
Тема VIII. Молекулярный объем газов. Работа 1. Расчетные задачи по теме: «Молекулярный объем газов»
Тема IX. Галогены. Работа 1. Хлор. Хлорводород. Соляная кислота
Тема IX. Галогены. Работа 2. Фтор. Бром. Иод
Фтор. Бром. Иод
Тема IX. Галогены. Работа 3. Расчетные задачи по теме Галогены
Тема IX. Галогены. Работа 4. Итоговая по теме VIII
Тема IX. Галогены. Итоговая работа по теме IX
8 класс тема 1 работа 1
- 1 Класс
- Математика
- Русский язык
- Английский язык
- Информатика
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- Технология
- 2 Класс
- Математика
- Русский язык
- Белорусский язык
- Английский язык
- Информатика
- Украинский язык
- Французский язык
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- Технология
- Испанский язык
- 3 Класс
- Математика
- Русский язык
- Белорусский язык
- Английский язык
- Информатика
- Украинский язык
- Французский язык
- Немецкий язык
- Литература
- Человек и мир
- Музыка
Учебник Химия Дидактический материал 8-9 класс Радецкий
Учебник Химия Дидактический материал 8-9 класс Радецкий — 2014-2015-2016-2017 год:Читать онлайн (cкачать в формате PDF) — Щелкни!
<Вернуться> | <Пояснение: Как скачать?> Пояснение: Для скачивания книги (с Гугл Диска), нажми сверху справа — СТРЕЛКА В ПРЯМОУГОЛЬНИКЕ .
 Затем в новом окне сверху справа — СТРЕЛКА ВНИЗ . Для чтения — просто листай колесиком страницы вверх и вниз.
Затем в новом окне сверху справа — СТРЕЛКА ВНИЗ . Для чтения — просто листай колесиком страницы вверх и вниз.Текст из книги:
A.M. Радецкий
химия
Дидактический
материал
8-9
классы
ПОСОБИЕ ДЛЯ УЧИТЕЛЕЙ ОБЩЕОБРАЗОВАТЕЛЬНЫХ УЧРЕЖДЕНИЙ
3-е издание
Москва
«Просвещение»
2011
УДК 372.8:54 ББК 74.262.4 Р15
Радецкий А. М.
Р15 Химия. Дидактический материал. 8—9 классы : пособие для учителей общеобразоват. учреждений / А. М. Радецкий. — 3-е изд. — М. : Просвещение, 2011. — 127 с. — ISBN 978-5-09-023985-1.
Пособие известного автора переработано и включено в линию учебно-методических комплектов по химии Г. Е. Рудзитиса и Ф. Г. Фельдмана. Сборник может также использоваться с любыми учебниками химии для основной школы.
УДК 372.8:54 ББК 74.262.4
ISBN 978-5-09-023985-1
Издательство «Просвещение», 2009 Художественное оформление. Издательство «Просвещение», 2009 Все права защищены
Предисловие
Цель данного пособия — помочь учителю проверить степень усвоения программного материала учащимися в процессе изучения химии в 8—9 классах.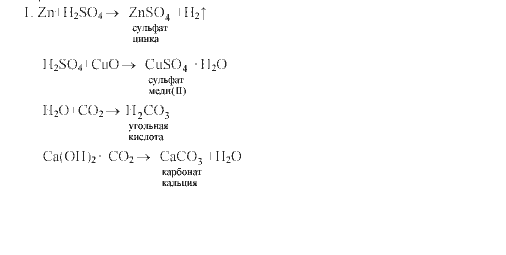 По всем темам курса автор предлагает несколько работ, каждая из которых дает учителю возможность проверить знания учащихся по отдельному фрагменту данной темы. Все работы содержат четыре варианта заданий. Отличаются задания по своим дидактическим целям: одни из них требуют простого воспроизведения материала, другие заставляют сравнивать и анализировать, третьи требуют творческого осмысления и применения знаний в новых ситуациях. Использование таких заданий во фронтальной работе позволяет организовать одновременную работу всех учащихся класса и обеспечить условия для работы каждого в отдельности. Каждую тему завершает итоговая работа, позволяющая проверить знания учащихся по всей теме.
Разнообразные дополнительные задания предоставляют учителю возможность индивидуализировать обучение. Их можно использовать при повторении и закреплении изученного материала, для организации самостоятельной работы учащихся на уроке или дома, а также для составления дополнительных вариантов работ.
s
Тема I.
По всем темам курса автор предлагает несколько работ, каждая из которых дает учителю возможность проверить знания учащихся по отдельному фрагменту данной темы. Все работы содержат четыре варианта заданий. Отличаются задания по своим дидактическим целям: одни из них требуют простого воспроизведения материала, другие заставляют сравнивать и анализировать, третьи требуют творческого осмысления и применения знаний в новых ситуациях. Использование таких заданий во фронтальной работе позволяет организовать одновременную работу всех учащихся класса и обеспечить условия для работы каждого в отдельности. Каждую тему завершает итоговая работа, позволяющая проверить знания учащихся по всей теме.
Разнообразные дополнительные задания предоставляют учителю возможность индивидуализировать обучение. Их можно использовать при повторении и закреплении изученного материала, для организации самостоятельной работы учащихся на уроке или дома, а также для составления дополнительных вариантов работ.
s
Тема I. Первоначальные химнчесние понятия
Работа 1
Физические и химические явления. Химические элементы. Простые и сложные вещества
Вариант 1
1. Какие из перечисленных явлений относят к химическим и почему?
а) Замерзание воды;
б) плавление свинца;
в) горение газа;
г) поднятие дрожжевого теста;
д) помутнение микстуры при длительном хранении.
2. Укажите, в каких предложениях речь идет о простом веществе, а в каких — о химическом элементе.
а) Все живые существа на Земле дыщат кислородом.
б) В состав ржавчины входят железо и кислород.
в) На долю кислорода в воде приходится 89%.
г) Железо притягивается магнитом.
3. Укажите, какие из перечисленных веществ являются простыми, а какие — сложными. Поясните свой выбор.
а) Вода Н2О; в) иод I2;
б) алюминий AI; г) мел СаСОз.
Вариант 2
1. Какие из перечисленных явлений относят к физическим и почему?
а) Таяние льда;
б) ржавление железного гвоздя;
в) плавление алюминия;
г) кипение воды;
д) прогоркание масла при длительном хранении;
е) плавление воска.
2. Укажите, в каких предложениях речь идет о простом веществе, а в каких — о химическом элементе.
Первоначальные химнчесние понятия
Работа 1
Физические и химические явления. Химические элементы. Простые и сложные вещества
Вариант 1
1. Какие из перечисленных явлений относят к химическим и почему?
а) Замерзание воды;
б) плавление свинца;
в) горение газа;
г) поднятие дрожжевого теста;
д) помутнение микстуры при длительном хранении.
2. Укажите, в каких предложениях речь идет о простом веществе, а в каких — о химическом элементе.
а) Все живые существа на Земле дыщат кислородом.
б) В состав ржавчины входят железо и кислород.
в) На долю кислорода в воде приходится 89%.
г) Железо притягивается магнитом.
3. Укажите, какие из перечисленных веществ являются простыми, а какие — сложными. Поясните свой выбор.
а) Вода Н2О; в) иод I2;
б) алюминий AI; г) мел СаСОз.
Вариант 2
1. Какие из перечисленных явлений относят к физическим и почему?
а) Таяние льда;
б) ржавление железного гвоздя;
в) плавление алюминия;
г) кипение воды;
д) прогоркание масла при длительном хранении;
е) плавление воска.
2. Укажите, в каких предложениях речь идет о простом веществе, а в каких — о химическом элементе. а) Водород входит в состав ядовитого газа сероводорода.
Первоначальные химические понятия
б) Водород — самый легкий газ.
в) На долю водорода в воде приходится 11%.
г) Рыбы дышат кислородом, растворенным в воде.
3. Укажите, какие из перечисленных веществ являются простыми, а какие — сложными. Поясните свой выбор.
а) Серебро Ag; в) поваренная соль NaCl;
б) углекислый газ СО2; г) кислород О2.
Вариант 3
1. Какие из перечисленных явлений относят к химическим и почему?
а) Таяние снега;
б) прокисание молока;
в) ржавление железа;
г) плавление меди;
д) позеленение бронзового памятника;
е) воспламенение спички.
2. Укажите, в каких предложениях речь идет о простом веществе, а в каких — о химическом элементе.
а) В воздухе содержится 78% азота (по объему).
б) Азот входит в состав аммиака.
в) При фотосинтезе зеленые растения выделяют кислород.
г) Кислород малорастворим в воде.
3. Укажите, какие из перечисленных веществ являются простыми, а какие — сложными. Поясните свой выбор.
а) Сода Na2C03; б) метан СН4; в) медь Си; г) водород Н2.
а) Водород входит в состав ядовитого газа сероводорода.
Первоначальные химические понятия
б) Водород — самый легкий газ.
в) На долю водорода в воде приходится 11%.
г) Рыбы дышат кислородом, растворенным в воде.
3. Укажите, какие из перечисленных веществ являются простыми, а какие — сложными. Поясните свой выбор.
а) Серебро Ag; в) поваренная соль NaCl;
б) углекислый газ СО2; г) кислород О2.
Вариант 3
1. Какие из перечисленных явлений относят к химическим и почему?
а) Таяние снега;
б) прокисание молока;
в) ржавление железа;
г) плавление меди;
д) позеленение бронзового памятника;
е) воспламенение спички.
2. Укажите, в каких предложениях речь идет о простом веществе, а в каких — о химическом элементе.
а) В воздухе содержится 78% азота (по объему).
б) Азот входит в состав аммиака.
в) При фотосинтезе зеленые растения выделяют кислород.
г) Кислород малорастворим в воде.
3. Укажите, какие из перечисленных веществ являются простыми, а какие — сложными. Поясните свой выбор.
а) Сода Na2C03; б) метан СН4; в) медь Си; г) водород Н2. y’
2. Перепишите формулы и обозначьте римскими цифрами валентность элементов в соединениях с кислородом, зная, что в данных соединениях он двухвалентен:
N2O, Р2О5, N2O3, СаО, СО2, SO3, NO.
3. Сера образует с водородом соединение h3S. Составьте формулы соединений серы с натрием, кальцием и алюминием, в которых сера проявляет такое же значение валентности, как в указанном соединении с водородом.
Вариант 2
1. Составьте формулы сложных веществ, образованных элементом кислородом и следующими элементами:
Mn(VII), Cr(VI), Sb(V), Sn(IV), Cr(III), N(II), Hg(I).
2. Перепишите формулы и обозначьте римскими цифрами валентность элементов в соединениях с хлором, зная, что в данных соединениях он одновалентен:
КС1, CaCl2, РеС1з, PCI5, ZnCl2, СгС1з, SiCl4.
3. Медь образует с кислородом два оксида — CU2O и СиО. Составьте формулы соединений меди с серой, в которых сера проявляет такие же значения валентности, как в указанных соединениях с кислородом.
Вариант 3
1. Составьте формулы следующих соединений:
III I I
Mg^Si^, Са^Р^, Si^O^,, Al^Cl^,, C^Cl^,.
y’
2. Перепишите формулы и обозначьте римскими цифрами валентность элементов в соединениях с кислородом, зная, что в данных соединениях он двухвалентен:
N2O, Р2О5, N2O3, СаО, СО2, SO3, NO.
3. Сера образует с водородом соединение h3S. Составьте формулы соединений серы с натрием, кальцием и алюминием, в которых сера проявляет такое же значение валентности, как в указанном соединении с водородом.
Вариант 2
1. Составьте формулы сложных веществ, образованных элементом кислородом и следующими элементами:
Mn(VII), Cr(VI), Sb(V), Sn(IV), Cr(III), N(II), Hg(I).
2. Перепишите формулы и обозначьте римскими цифрами валентность элементов в соединениях с хлором, зная, что в данных соединениях он одновалентен:
КС1, CaCl2, РеС1з, PCI5, ZnCl2, СгС1з, SiCl4.
3. Медь образует с кислородом два оксида — CU2O и СиО. Составьте формулы соединений меди с серой, в которых сера проявляет такие же значения валентности, как в указанных соединениях с кислородом.
Вариант 3
1. Составьте формулы следующих соединений:
III I I
Mg^Si^, Са^Р^, Si^O^,, Al^Cl^,, C^Cl^,. 2. Перепишите формулы и обозначьте римскими цифрами валентность элементов в соединениях с серой, зная, что в данных соединениях она двухвалентна:
AI2S3, Na2S, MgS, CS2, PbS, Ag2S, ZnS.
3. Бром образует с водородом соединение НВг. Сос
2. Перепишите формулы и обозначьте римскими цифрами валентность элементов в соединениях с серой, зная, что в данных соединениях она двухвалентна:
AI2S3, Na2S, MgS, CS2, PbS, Ag2S, ZnS.
3. Бром образует с водородом соединение НВг. Сос
ГДЗ по Химии за 8‐9 класс дидактический материал А.М. Радецкий 2016
Решебники, ГДЗ
- 11 Класс
- Русский язык
- Английский язык
- Немецкий язык
- Математика
- Алгебра
- Геометрия
- Физика
- Химия
- Биология
- История
- География
- Обществознание
- Литература
- ОБЖ
- Информатика
- Белорусский язык
- Астрономия
- Мед.
 подготовка
подготовка - Испанский язык
- Казахский язык
- 10 Класс
- Русский язык
- Английский язык
- Немецкий язык
- Математика
- Алгебра
Дидактический материал по химии — химия, тесты
Химия 8 класс
Химия – это наука
а) о явлениях в природе
б) об организмах и их свойствах
в) о веществах, их свойствах и превращениях
г) об охране окружающей среды
2. Какое прилагательное НЕ характеризует вещество
Какое прилагательное НЕ характеризует вещество
а) твердое
б) растворимое
в) вогнутое
г) прозрачное
3. Формула простого вещества
а) O2
б) H2O
в) CO2
г) NaCl
4. Какой химический знак соответствует элементу железо
а) F
б) Fr
в) Fe
г) Te
5. Порядковый номер 3 в таблице Д.И. Менделеева соответствует элементу
а) калий
б) азот
в) литий
г) фтор
6. В 3 периоде периодической системы химических элементов находится элемент
а) Al
б) Li
в) B
г) Sc
7. Распределение электронов 2 8 1 соответствует химическому элементу
а) Mg
б) Cl
в) S
г) Na
8. Семь протонов в ядре атома
а) Ar
б) Ne
в) Cl
г) N
9. Десять нейтронов в ядре
а) Ne
б) Na
в) F
г) P
10. Относительная атомная масса 35,5 соответствует
Относительная атомная масса 35,5 соответствует
а) хлору
б) сере
в) кальцию
г) аргону
11. Установите соответствие «знак химического элемента – его произношение»:
а) Mg | 1) феррум |
б) Fe | 2) купрум |
в) Si | 3) силициум |
г) Cu | 4) эн |
д) N | 5) магний |
12. Установите соответствие « атом – распределение электронов на энергетических уровнях»
а) Сa | 1) 2 5 | ||||
б) Li | 2) 2 8 8 2 | ||||
в) F | 3) 2 7 | ||||
г) Al | 4) 2 8 3 | ||||
д) N | 5) 2 1 | ||||
а | б | в | г | д | |
2 | 5 | 3 | 4 | 1 | |
13. Покажите строение изотопов К40 и К39
Покажите строение изотопов К40 и К39
ОТВЕТ
К40 – заряд ядра +19, электронов – 19, протонов – 19, нейтронов – 21
К39 – заряд ядра +19, электронов – 19, протонов – 19, нейтронов — 20
14. Рассчитайте относительную молекулярную массу NaOH
ОТВЕТ
Mr(NaOH) = 23+16+1=40
15. Определите положение в таблице Д.И. Менделеева атомов K, S, Cl.
ОТВЕТ
К – 4 период, 1 группа главная подгруппа, порядковый номер 19, Ar=39
S — 3 период, 6 группа главная подгруппа, порядковый номер 16, Ar=32
Cl — 3 период, 7 группа главная подгруппа, порядковый номер 17, Ar=35,5
Химия 9 класс
Какой элемент 3 периода образует летучее водородное соединение
а) Na
б) S
в) Al
г) Ar
2. Полная электронная формула 1s22s22p3 соответствует
Полная электронная формула 1s22s22p3 соответствует
а) Ar
б) Ne
в) Cl
г) N
3. Металлические свойства атомов в периоде слева направо
а) усиливаются
б) ослабевают
в) вначале ослабевают, потом усиливаются
г) не изменяются
4. Неметаллические свойства в группе сверху вниз
а) не изменяются
б) ослабевают
в) усиливаются
г) вначале усиливаются, потом ослабевают
5. Элементу с порядковым номером 3 в таблице Д.И. Менделеева НЕ соответствует характеристика
а) металл
б) окислитель
в) 1 электрон на внешнем уровне
г) восстановитель
6. В 3 периоде периодической системы химических элементов справа налево находится элементы в порядке
а) усиления металлических свойств
б) уменьшения восстановительных свойств
в) увеличения электроотрицательности
г) уменьшения атомного радиуса
7. Распределение электронов на внешнем уровне 3s1 соответствует химическому элементу
Распределение электронов на внешнем уровне 3s1 соответствует химическому элементу
а) Mg
б) Cl
в) S
г) Na
8. Восстановительные свойства ярче выражены у:
а) Na
б) Mg
в) Fe
г) Cu
9. Высшая степень окисления у азота проявляется в оксиде:
а) NO
б) N2O3
в) N2O5
г) N2O
10. Основный оксид образует
а) хлор
б) сера
в) кальций
г) аргон
11. Установите соответствие :
а) MgO | 1) амфотерный оксид |
б) ZnO | 2) основный |
в) SO3 | 3) кислотный |
г) SO2 | |
д) Na2O |
12. Установите соответствие между соединением серы и значением ее степени окисления в этом соединении
Установите соответствие между соединением серы и значением ее степени окисления в этом соединении
а) H2SO4 | 1) +6 | ||||
б) CaSO3 | 2) -2 | ||||
в) Al2S3 | 3) +4 | ||||
г) SO3 д) H2S | |||||
а | б | в | г | д | |
1 | 3 | 2 | 1 | 2 | |
13. Как осуществить превращения:
Mg→Mg(OH)2→Mg(NO3)2
ОТВЕТ
Mg+2H2O→Mg(OH)2+H2
Mg(OH)2+2HNO3→Mg(NO3)2+2H2O
14. Решите уравнение реакции ионного обмена между карбонатом натрия и азотной кислотой
ОТВЕТ
Na2CO3+2HNO3→2NaNO3+H2O+CO2
2Na++CO3-2+2H++2NO3—→2Na++2NO3—+H2O+CO2
2H++ CO3-2→ H2O+CO2
15. Составьте характеристику атома S по положению в Периодической таблице по плану:
1. Полная электронная формула
2. Семейство элементов (s,p,d,f)
3. Период, группа, номер в таблице, Ar
4. Металл (неметалл)
5. Формула высшего оксида
ОТВЕТ
1s22s22p63s23p4
p-элемент
S — 3 период, 6 группа главная подгруппа, порядковый номер 16, Ar=32
Неметалл
SO3
Химия 10 класс
Какое вещество является органическим
а) карбонат натрия
б) угольная кислота
в) ацетат натрия
г) нитрид калия
2. К алканам НЕ относится
а) С2Н2
б) С3Н8
в) С2Н6
г) С10Н22
3. Гомологами являются
а) бутан и пентан
б) пентан и пентен
в) этанол и бензол
г) бутен и бутадиен
4. Валентность углерода в органических соединениях имеет значение
а) +4
б) -4
в) IV
г) II
5. Возбужденному состоянию углерода соответствует запись
а) 1s22s22p4
б) 1s22s22p2
в) 1s22s12p3
г) 1s22s22p3
6. Какова гибридизация атомов углерода в СН3-СН=СН-СН3
а) sp3, sp2
б) sp, sp2
в) sp, sp3
г) sp3
7. Какое вещество НЕ является изомером бутена-1?
а) бутен-2
б) циклобутан
в) 2-метилпропан
г) бутан
8. Тип связи в молекулах предельных углеводородов
а) ковалентная полярная
б) ковалентная неполярная
в) ионная
г) металлическая
9. В каком веществе валентность и степень окисления атома углерода различны по величине?
а) СН4
б) CCl4
в) CO2
г) CHCl3
10. Ученый, предложивший термин «органические вещества»:
а) Берцелиус
б) Менделеев
в) Бутлеров
г) Либих
11. Установите соответствие «формула вещества – класс углеводородов»:
а) С2Н4 | 1) алканы |
б) С5Н8 | 2) алкены |
в) С2Н6 | 3) алкины |
г) С7Н14 | |
д) С3Н4 |
1 2 3 4 5
12. Для вещества, имеющего формулу СН≡С-СН=СН-СН3 , соотнесите:
Номер атома С тип гибридизации
а) 1 | 1) sp3 | ||||
б) 2 | 2) sp2 | ||||
в) 3 | 3) sp | ||||
г) 4 | |||||
д) 5 | |||||
а | б | в | г | д | |
3 | 3 | 2 | 2 | 1 | |
13. Покажите строение изомеров бутина-2 (СН3-С≡С-СН3) и дайте им название
ОТВЕТ
СН2=СН-СН=СН2 бутадиен-1,3
СН2=С=СН-СН3 бутадиен-1,2
СН = СН
ǀ ǀ циклобутен
СН2— СН2
14. Рассчитайте массовые доли углерода, водорода и кислорода в метиловом спирте СН3ОН
ОТВЕТ
ω(С)=37,5%, ω(Н)=12,5%, ω(О)=50%
15. Напишите уравнения реакций в цепочке превращений СН4→СН3Br→CH3NH2→CH3OH
ОТВЕТ
CH4+Br2→HBr+CH3Br
CH3Br+2NH3→CH3NH2+NH4Br
CH3NH2+HNO2→CH3OH+N2+H2
Химия 11 класс
Число нейтронов в атоме Se79
а) 79
б) 45
в) 34
г) 44
2. Максимальное число электронов на d-подуровне
а) 2
б) 10
в) 8
г) 14
3. Элемент, образующий высший оксид Э2О7 в основном состоянии имеет электронную конфигурацию валентных электронов
а) 4s23d5
б) 3s23p7
в) 2s22p7
г) 3d7
4. В порядке усиления металлических свойств расположены элементы
а) Sr, Ca, K
б) Na, Mg, Al
в) Ca, Sr,Rb
г) Ba, Sr,Ca
5. Порядковый номер элемента, у которого валентные электроны атома имеют конфигурацию 3s23p3 , равен
а) 12
б) 15
в) 10
г) 17
6. Иону Са+2 соответствует электронная формула:
а) 1s2s2s22p63s23p64s2
б) 1s2s2s22p63s23p6
в) 1s2s2s22p63s23p64s1
г) 1s2s2s22p63s23p4
7. В атоме железа число полностью заполненных энергетических уровней равно:
а) 3
б) 2
в) 4
г) 1
8. Наибольший радиус имеет атом
а) железо
б) калий
в) галлий
г) натрий
9. Формула высшего оксида элемента с электронной конфигурацией атома 1s2s2s22p63s23p64s23d104p3
а) ЭО
б) Э2О3
в) Э2О5
г) ЭО2
10. Кислотные свойства наиболее ярко выражены у вещества, формула которого:
а) HF
б) H2S
в) H2N
г) HCl
11. Установите соответствие «соединение хлора – степень окисления хлора в соединении»:
а) NCl3 | 1) -1 |
б) Cl2O7 | 2) +7 |
в) HCl | 3) +1 |
г) Cl2O | |
д) NaClO7 |
12. Установите соответствие:
Изменение свойств в ряду | Ряд элементов | ||||
а) убывают окислительные свойства | 1) P→S→Cl | ||||
б) увеличиваются металлические свойства | 2) Na→K→Rb | ||||
в) уменьшается радиус атома | 3) O→S→Se | ||||
г) увеличиваются неметаллические свойства | 4) Al→Mg→Na | ||||
д) уменьшается атомная масса | |||||
а | б | в | г | д | |
3 | 2 | 1 | 1 | 4 | |
13. Установите соответствие:
Электронная формула | Состав ядра | ||||
а) 4s1 | 1) 35p,45n | ||||
б) 4s2 | 2) 19p,20n | ||||
в) 3s23p2 | 3) 14p,14n | ||||
г) 4s24p5 | 4) 20p,20n | ||||
д) 2s22p2 | 5) 6p, 6n | ||||
а | б | в | г | д | |
2 | 4 | 3 | 1 | 5 | |
14. Запишите электронные конфигурации атомов элементов, имеющих порядковые номера 12,17,21 в Периодической таблице д.И. Менделеева. Определите электронные семейства, к которым они относятся.
ОТВЕТ
Mg -1s2s2s22p63s2 , s-семейство
Cl — 1s2s2s22p63s23p5, p-семейство
Sc — 1s2s2s22p63s23p64s23d, d- семейство
15. Некоторое количество сульфида цинка разделили на две части. Одну из них обработали соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причем выделился бурый газ. Напишите уравнения четырех описанных реакций.
ОТВЕТ
ZnS+2HCl→ZnCl2+H2S↑
2ZnS+3O2→2ZnO+2SO2↑
2H2S+SO2→3S↓+2H2O
S+6HNO3→H2SO4+6NO2+2H2O
Восьмой класс (8 класс) Вопросы по органической химии для тестов и рабочих листов
Вы можете создавать печатные тесты и рабочие листы из этих 8 класс по органической химии вопроса! Выберите один или несколько вопросов, установив флажки над каждым вопросом. Затем нажмите кнопку добавить выбранные вопросы к тесту перед переходом на другую страницу.
Выбрать все вопросы Четыре класса органической химии, необходимые живым существам:- углеводы, белки, витамины и липиды.
- углеводы, белки, нуклеиновые кислоты и витамины.
- углеводы, белки, нуклеиновые кислоты и липиды.
- углеводы, витамины, нуклеиновые кислоты и липиды.
EDEXCEL INTERNATIONAL GCSE CHEMISTRY СЕРТИФИКАТ EDEXCEL ПО ХИМИИ ОТВЕТЫ НА РАЗДЕЛ E
Раздел 6 Концепция крота
Химическая форма 3 Page 62 Ms.Р. Буттигиг Раздел 6 Концепция родинки См. Раздел «Химия для вас», глава 28 стр. 352-363 См. Главу 5 по химии GCSE, стр. 70-79 6.1 Относительная атомная масса. Относительная атомная масса
ПодробнееIB Химия. Обзор химии DP
DP Chemistry Review Тема 1: Количественная химия 1.1 Концепция молей и константа Авогадро Заявление об оценке Примените концепцию молей к веществам.Определите количество частиц и количество
ПодробнееОписание концепции крота:
Описание концепции крота: Предположим, вас отправили в магазин купить 36 яиц. Когда вы их подберете, вы получите 3 коробки, в каждой по 12 яиц. Вы только что использовали математический аппарат под названием
. ПодробнееПРИЛОЖЕНИЕ B: УПРАЖНЕНИЯ
ПРИЛОЖЕНИЕ B: УПРАЖНЕНИЯ Молекулярная масса, моль и массовый процент Относительная атомная и молекулярная масса Относительная атомная масса (A r) — это константа, которая выражает соотношение
ПодробнееГлава 3: Стехиометрия
Глава 3: Стехиометрия Ключевые навыки: Уравновешивание химических уравнений Предсказание продуктов простого сочетания, реакций разложения и горения.Расчет веса формулы Преобразование граммов в моль и
ПодробнееУчебное пособие к главе 7
Имя: Класс: Дата: ID: Учебное пособие по главе 7 «Множественный выбор». Определите вариант, который лучше всего завершает утверждение или отвечает на вопрос. 1. Число атомов в моль любого чистого вещества
Подробнеенейтроны присутствуют?
Лист заданий AP Chem Summer # 1 Атомная структура 1.а) Для иона 39 K + укажите, сколько электронов, сколько протонов и сколько 19 нейтронов присутствует? б) Какая из этих частиц имеет наименьшее
ПодробнееБлок 10A Примечания по стехиометрии
Блок 10А. Примечания по стехиометрии Стехиометрия — это громкое слово для процесса, который химики используют для расчета количеств в реакциях. Он использует коэффициент, установленный уравнениями сбалансированной реакции
ПодробнееW1 МАСТЕРСКАЯ ПО СТОХИОМЕТРИИ
ВВЕДЕНИЕ W1 СЕМИНАР ПО СТОХИОМЕТРИИ Эти заметки и упражнения разработаны, чтобы познакомить вас с основными понятиями, необходимыми для понимания химической формулы или уравнения.Относительные атомные массы
ПодробнееХимия: химические уравнения
Химия: химические уравнения Напишите сбалансированное химическое уравнение для каждого словесного уравнения. Включите в уравнение фазу каждого вещества. Классифицировать реакцию как синтез, разложение, однократное замещение,
ПодробнееРАСЧЕТ МОЛЕЙ И МОЛЕЙ
35 МОЛЕЙ И МОЛЕВОЙ КЛКУЛЬЦИИ ВВЕДЕНИЕ Цель этого раздела — представить некоторые методы расчета количества каждого реагента, используемого в химической реакции, и количества каждого продукта
ПодробнееАТОМЫ.Вопросы с множественным выбором
Глава 3 АТОМЫ И МОЛЕКУЛЫ Вопросы с множественным выбором 1. Что из следующего правильно соответствует 360 г воды? (i) 2 моля H 2 0 (ii) 20 моль воды (iii) 6,022 10 23 молекулы воды (iv)
ПодробнееФормулы, уравнения и родинки
Глава 3 Формулы, уравнения и моли. Интерпретация химических уравнений. Вы можете интерпретировать сбалансированное химическое уравнение разными способами.На микроскопическом уровне две молекулы H 2 реагируют с одной молекулой
ПодробнееХимические пропорции в соединениях
Глава 6 Химические пропорции в соединениях. Решение практических задач. Учебник для учащихся, стр. 201 1. Задача. Анализируется образец соединения и обнаруживается, что он содержит 0,90 г кальция и 1,60 г
. ПодробнееЗаключительное руководство по химии
Имя: Класс: Дата: Заключительное руководство по химии. Множественный выбор. Определите вариант, который лучше всего завершает утверждение или отвечает на вопрос.1. Электроны, участвующие в образовании ковалентной связи
ПодробнееГлава 3 Стехиометрия
Глава 3 Стехиометрия 3-1 Глава 3 Стехиометрия В этой главе Как вы узнали из предыдущих глав, большая часть химии включает использование макроскопических измерений для определения того, что происходит между атомами
ПодробнееРаздел 2: Количества в химии
Масса, моль и молярная масса Относительные количества изотопов в природном элементе (%) E.г. Углерод имеет 2 изотопа С-12 и С-13. Из двух изотопов углерода 98,9% С-12 и 11,1% С-13. Найдите
ПодробнееОбзор стехиометрии
Обзор стехиометрии В этом обзоре 20 задач. Ответы, включая постановку задачи, можно найти во второй половине этого документа. 1. N 2 (г) + 3H 2 (г) ———> 2NH 3 (г) а. азот
ПодробнееХИМИЯ II ЗАКЛЮЧИТЕЛЬНЫЙ ЭКЗАМЕН
Имя Период ХИМИЯ II ЗАКЛЮЧИТЕЛЬНЫЙ ЭКЗАМЕН Заключительный экзамен: приблизительно 75 вопросов с несколькими вариантами ответов. Раздел 12: Стехиометрия. Разделы 5 и 6: Электронные конфигурации и периодические свойства. Разделы 7 и 8: Связь. Раздел 14: Газ
. ПодробнееМОЛЕКУЛЯРНАЯ МАССА И ФОРМУЛЬНАЯ МАССА
1 МОЛЕКУЛЯРНАЯ МАССА И МАССА ФОРМУЛЫ Молекулярная масса = сумма атомных масс всех атомов в молекуле.Формульная масса = сумма атомных масс всех атомов в формульной единице. 2 МОЛЕКУЛЯРНАЯ МАССА И
ПодробнееОтвет в стиле кандидата
Кандидатский стиль Ответить по химии A Unit F321 Атомы, связи и группы Реакция с высокими полосами Этот буклет с вспомогательными материалами разработан вместе с OCR GCE Chemistry A Specimen Paper F321 для обучения
ПодробнееНАПИСАНИЕ ХИМИЧЕСКОЙ ФОРМУЛЫ
НАПИСАНИЕ ХИМИЧЕСКОЙ ФОРМУЛЫ Для ионных соединений должна быть разработана химическая формула.У вас больше не будет списка ионов на экзамене (как на GCSE). Вместо этого вы должны выучить одни и отработать другие.
ПодробнееЭмпирическая формула соединения
Эмпирическая формула лаборатории соединений № 5 Введение Взгляд на массовые отношения в химии обнаруживает мало порядка или смысла. Отношение масс элементов в соединении, пока постоянное,
ПодробнееКлюч с ответами на листе молярной массы
Таблица с ответами на молярную массу Рассчитайте молярные массы следующих химикатов: 1) Cl 2 71 г / моль 2) KOH 56.1 г / моль 3) BeCl 2 80 г / моль 4) FeCl 3 162,3 г / моль 5) BF 3 67,8 г / моль 6) CCl 2 F 2 121 г / моль
ПодробнееЭлектрохимия — ОТВЕТЫ
Электрохимия — ОТВЕТЫ 1. Используя таблицу стандартных электродных потенциалов, предскажите, будут ли следующие реакции происходить спонтанно, как написано. а) Al 3+ + Ni Ni 2+ + Al Al 3+ + 3e — Al E = -1,68
ПодробнееГлава 6 Примечания Наука 10 Название:
6.1 Типы химических реакций a) Синтез (A + B AB) Реакции синтеза также известны как реакции. Когда это происходит, два или более реагента (обычно элементы) соединяются, образуя a. A + B AB, где A и
ПодробнееСтехиометрия. Схема объекта
3 Схема стехиометрии 3.1 Молярная и молярная масса 3.2 Стехиометрия и формулы соединений 3.3 Стехиометрия и химические реакции 3.4 Стехиометрия и предельные реагенты 3.5 Химический анализ
ПодробнееРодинка и молярная масса
Моль и молярная масса 1 Молярная масса — это масса одного моля вещества. Молярная масса численно равна атомной массе, молекулярной массе или формульной массе. Однако единицы молярной массы — г / моль.
ПодробнееРедокс и электрохимия
Название: четверг, 8 мая 2008 г. Редокс и электрохимия 1.Схема химической ячейки и уравнение показаны ниже. Когда переключатель замкнут, электроны будут перемещаться от 1. Pb (s) к Cu (s) 2+
Подробнее20.2 Химические уравнения
Все химические изменения, которые вы наблюдали в последнем расследовании, были результатом химических реакций. Химическая реакция включает перегруппировку атомов в одном или нескольких реагентах с образованием одного или нескольких
Подробнее1332 ГЛАВА 18 Примеры вопросов
1332 ГЛАВА 18 Примеры вопросов Пара E 0 Пара E 0 Br 2 (l) + 2e 2Br (aq) +1.06 В AuCl 4 + 3e Au + 4Cl +1,00 В Ag + + e Ag +0,80 В Hg 2+ 2 + 2e 2 Hg +0,79 В Fe 3+ (водн.) + E Fe 2+ (водн.) +0,77 В Cu 2 +
ПодробнееБлок 9 Соединения, молекулы
Раздел 9 Соединения Молекулы ВВЕДЕНИЕ Соединения — это результат сочетания элементов. Эти новые вещества обладают уникальными свойствами по сравнению с элементами, из которых они состоят. Составы на сегодняшний день
Подробнеешагов научного метода
Убедитесь, что в вашем браузере включен JavaScript.Если вы оставите отключенным JavaScript, вы получите доступ только к части предоставляемого нами контента. Вот как.Что такое научный метод?
Научный метод — это процесс экспериментирования, который используется для изучения наблюдений и ответов на вопросы. Означает ли это, что все ученые точно следуют этому процессу? Нет. Некоторые области науки легче проверить, чем другие. Например, ученые, изучающие, как звезды меняются с возрастом или как динозавры переваривают пищу, не могут ускорить жизнь звезды на миллион лет или провести медицинские осмотры кормления динозавров, чтобы проверить свои гипотезы.Когда прямые эксперименты невозможны, ученые изменяют научный метод. На самом деле, версий научного метода, вероятно, столько же, сколько ученых! Но даже после модификации цель остается той же: выявить причинно-следственные связи, задавая вопросы, тщательно собирая и исследуя доказательства и проверяя, можно ли объединить всю доступную информацию в логический ответ.
Несмотря на то, что мы показываем научный метод как серию шагов, имейте в виду, что новая информация или мышление могут побудить ученого сделать резервную копию и повторить шаги в любой момент в течение процесса.Такой процесс, как научный метод, который включает такое резервное копирование и повторение, называется итеративным процессом.
Выполняете ли вы научный проект, проводите ли вы научную деятельность в классе, независимое исследование или любое другое практическое научное исследование, понимание этапов научного метода поможет вам сосредоточить свой научный вопрос и проработать свои наблюдения и данные, чтобы ответить на вопрос как можно лучше.
Схема научного метода.Научный метод начинается с вопросов, и проводится предварительное исследование, чтобы попытаться ответить на этот вопрос. Если вы хотите найти доказательства ответа или самого ответа, вы строите гипотезу и проверяете ее в эксперименте. Если эксперимент работает и данные проанализированы, вы можете либо подтвердить, либо опровергнуть свою гипотезу. Если ваша гипотеза опровергнута, вы можете вернуться к полученной новой информации и создать новую гипотезу, чтобы заново начать научный процесс.
Попробуйте наши планы уроков:
Назначьте студенческий тест с помощью Google Класса:
Шаги научного метода
1. Задайте вопрос
Научный метод начинается с того, что вы задаете вопрос о том, что наблюдаете: как, что, когда, кто, что, почему или где?
Для проекта научной ярмарки некоторые учителя требуют, чтобы вопрос был чем-то, что можно измерить, желательно с помощью числа.
Для получения подробной справки по этому шагу используйте следующие ресурсы:2. Проведите предварительное исследование
Вместо того, чтобы начинать с нуля при составлении плана ответа на ваш вопрос, вы хотите быть сообразительным ученым, использующим библиотеки и Интернет-исследования, чтобы помочь вам найти лучший способ делать что-то и убедиться, что вы не повторяете ошибок прошлого. .
Для получения подробной справки по этому шагу используйте следующие ресурсы:3.Построить гипотезу
Гипотеза — это обоснованное предположение о том, как все работает. Это попытка ответить на ваш вопрос объяснением, которое можно проверить. Хорошая гипотеза позволяет вам сделать прогноз:
«Если _____ [я делаю это] _____, то _____ [это] _____ произойдет».
Укажите свою гипотезу и полученный прогноз, который вы будете проверять. Прогнозы должны быть легко измеряемыми.
Для получения подробной справки по этому шагу используйте следующие ресурсы:4.Проверьте свою гипотезу, проведя эксперимент
Ваш эксперимент проверяет, является ли ваш прогноз точным и, следовательно, ваша гипотеза подтверждается или нет. Важно, чтобы ваш эксперимент прошел честно. Вы проводите честный тест, убеждаясь, что вы изменяете только один фактор за раз, сохраняя при этом все остальные условия.
Также следует повторить эксперименты несколько раз, чтобы убедиться, что первые результаты не были случайностью.
Для получения подробной справки по этому шагу используйте следующие ресурсы:5.Проанализируйте свои данные и сделайте вывод
По завершении эксперимента вы собираете свои измерения и анализируете их, чтобы увидеть, подтверждают они вашу гипотезу или нет.
Ученые часто обнаруживают, что их прогнозы не были точными, а их гипотеза не подтверждалась, и в таких случаях они сообщают результаты своего эксперимента, а затем возвращаются и строят новую гипотезу и прогноз на основе информации, которую они узнали в ходе эксперимента.Это снова запускает большую часть процесса научного метода. Даже если они обнаружат, что их гипотеза подтверждается, они могут захотеть проверить ее еще раз по-новому.
Для получения подробной справки по этому шагу используйте следующие ресурсы:6. Сообщите свои результаты
Чтобы завершить свой проект научной ярмарки, вы поделитесь своими результатами с другими в итоговом отчете и / или на доске объявлений. Профессиональные ученые делают почти то же самое, публикуя свой итоговый отчет в научном журнале или представляя свои результаты на плакате или во время выступления на научном собрании.На научной ярмарке судьи интересуются вашими выводами независимо от того, подтверждают ли они вашу первоначальную гипотезу.
Для получения подробной справки по этому шагу используйте следующие ресурсы:Видео о нашей науке
Роликовые горки для бумаги — увлекательное занятие STEM! | Сделать водомерку — STEM Activity | Как сделать щетину |

 М.РадецкийВсе главы
М.РадецкийВсе главы Водород. Кислоты. Соли. Работа 1. Получение и свойства водорода
Водород. Кислоты. Соли. Работа 1. Получение и свойства водорода И.Менделеева. Строение атома. Работа 1. Периоды, группы, подгруппы периодической системы химических элементов
И.Менделеева. Строение атома. Работа 1. Периоды, группы, подгруппы периодической системы химических элементов Фтор. Бром. Иод
Фтор. Бром. Иод подготовка
подготовка