Периодическая таблица химических элементов Менделеева: группы, периоды, металлы и неметаллы в ПСХЭ
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Первый вариант Периодической таблицы элементов, составленной Д.И. Менделеевым.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
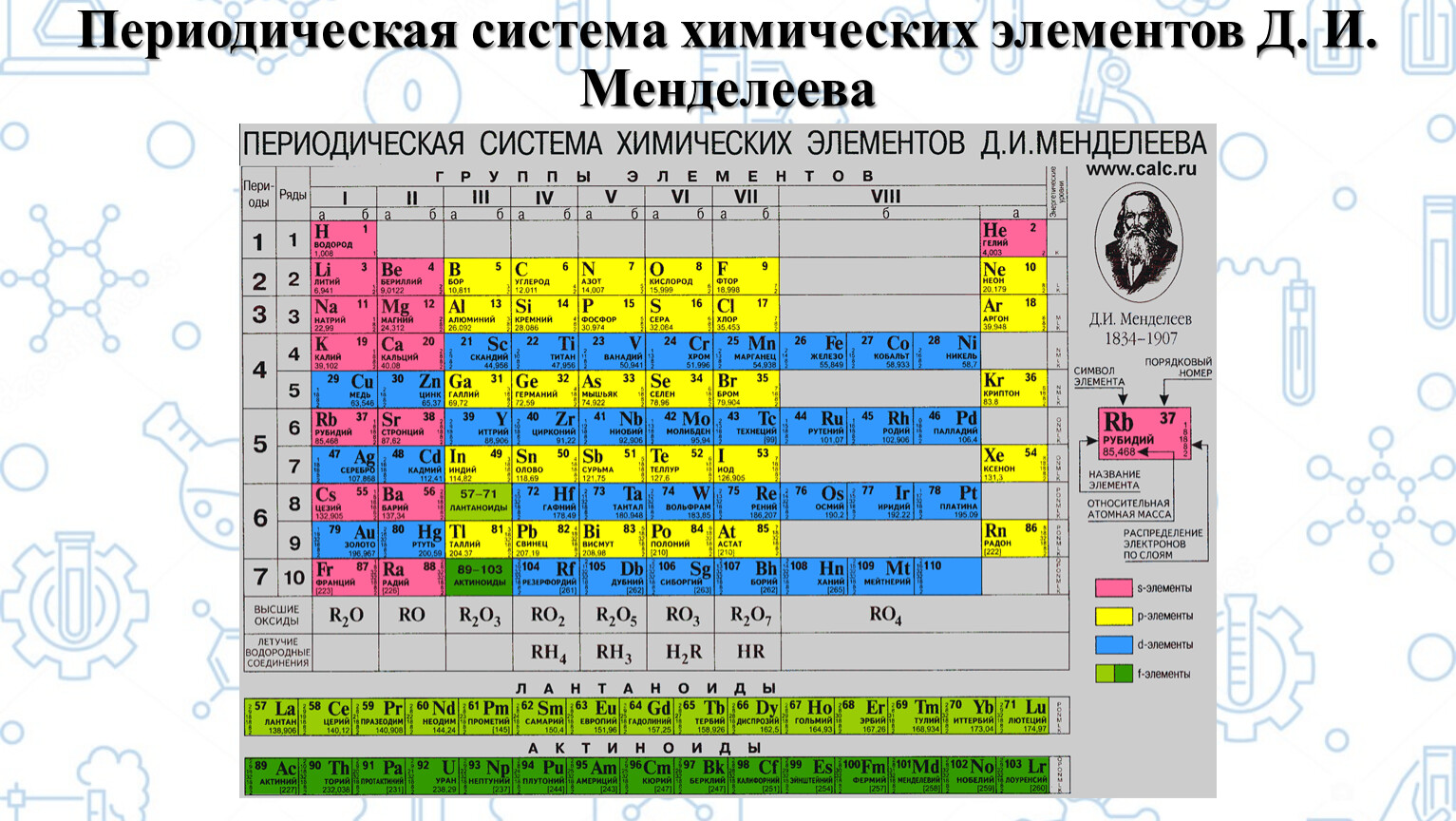
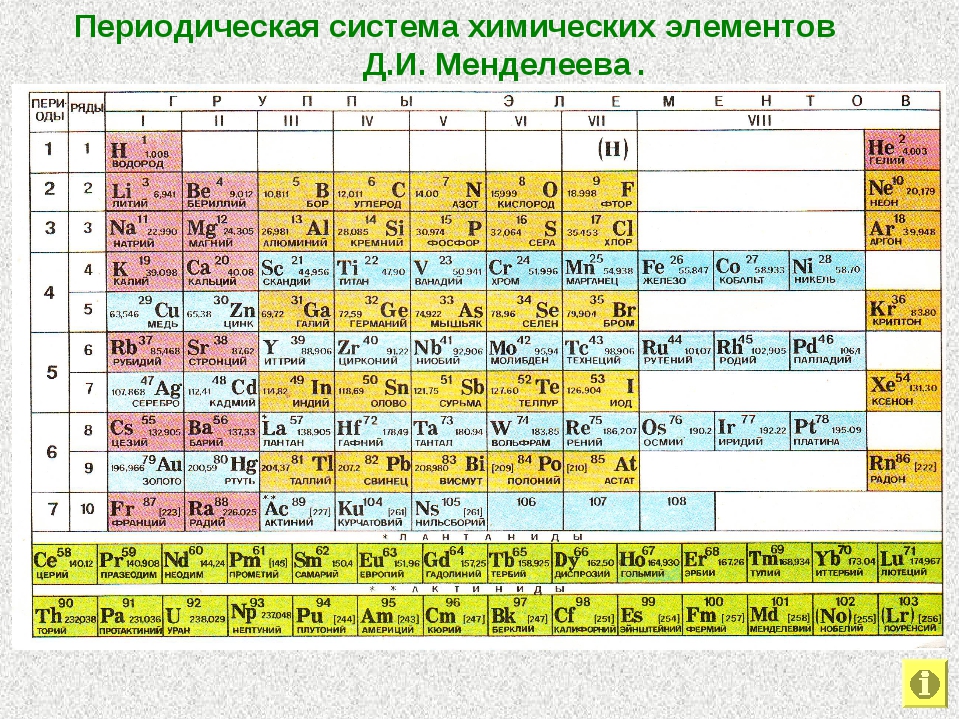
Периодическая таблица химических элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп.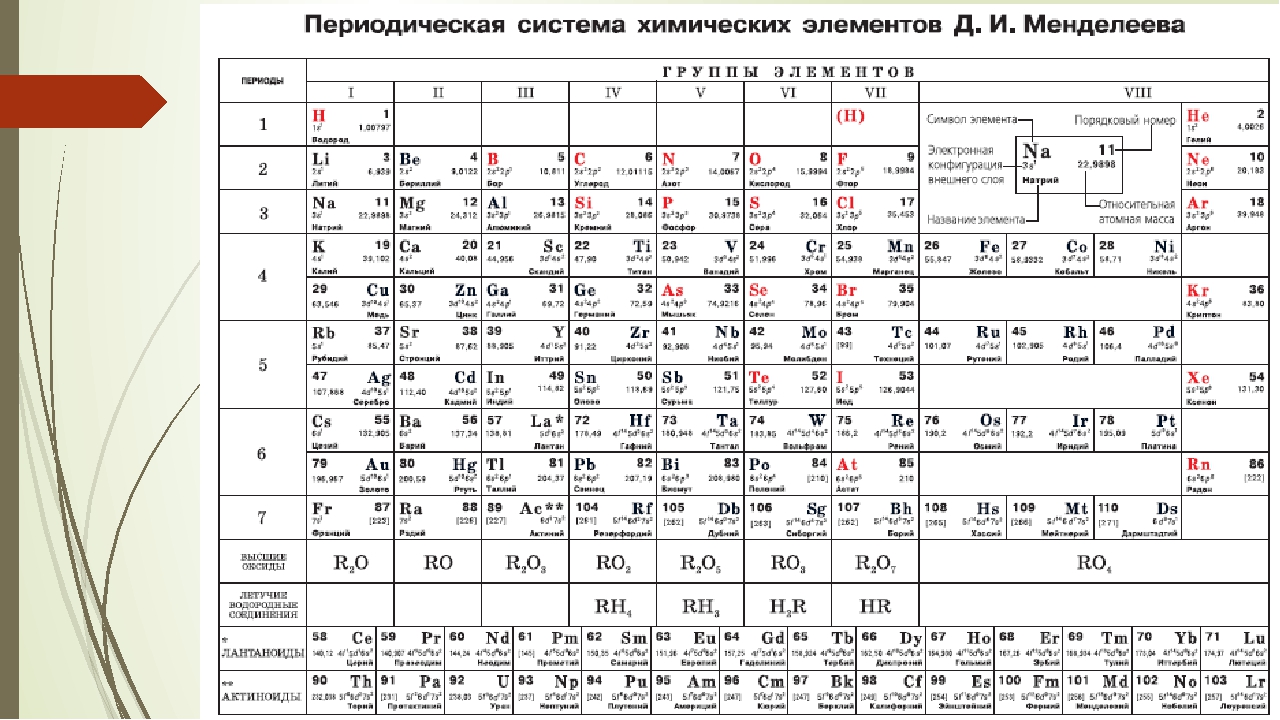 Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.

- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду
CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.Щелочноземельные металлы
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.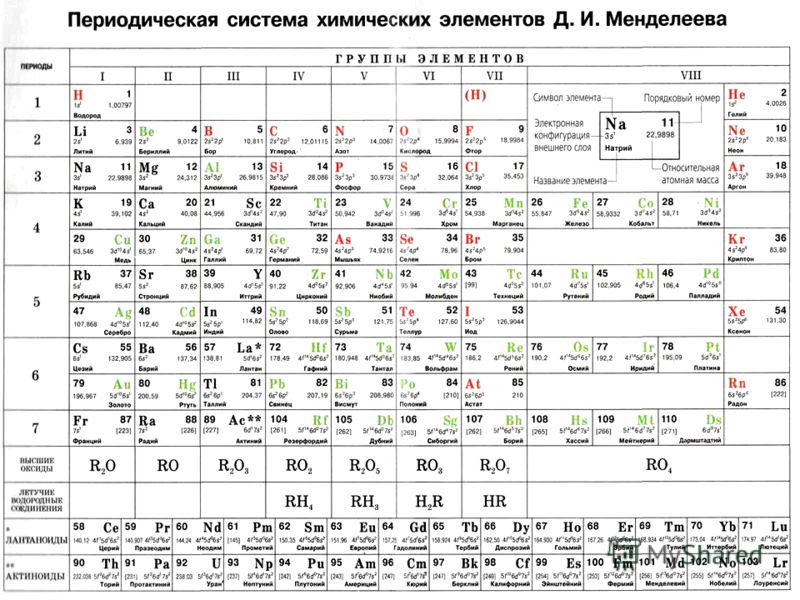 Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).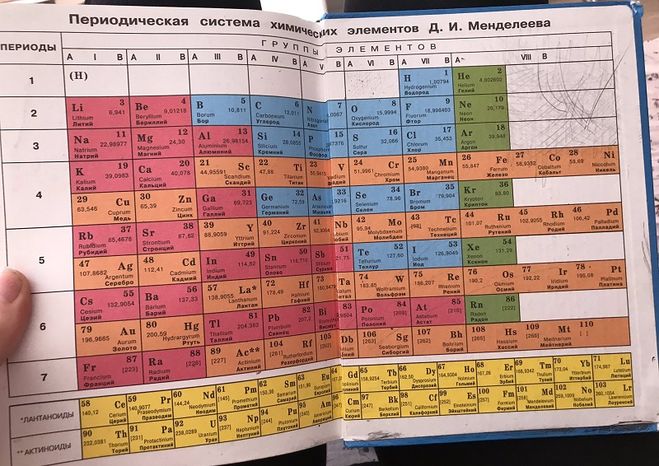 Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.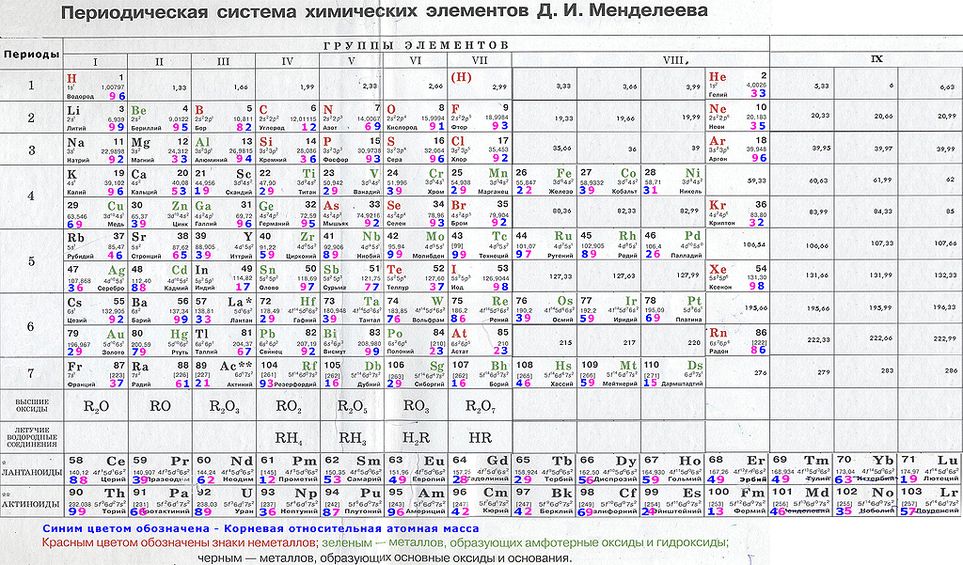
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей.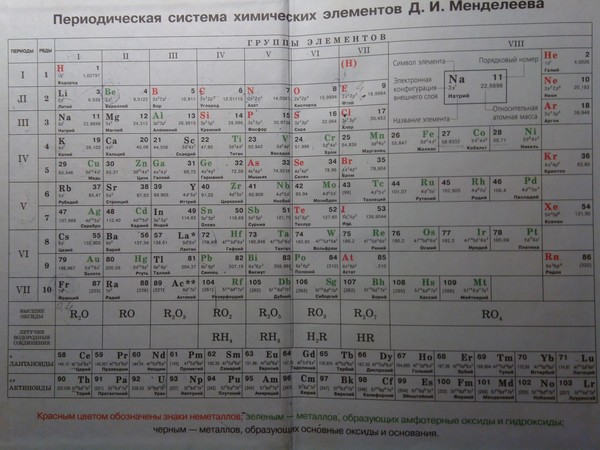 Например, хлор входит в состав обычной поваренной соли.
Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
План-конспект урока » Периодическая система химических элементов»
Тема урока: Периодическая система химических элементов.
Цель урока: рассмотреть периодическую систему химических элементов.
Задачи урока:
1) дать понятие о структуре периодической системы;
2) помочь учащимся выяснить сходство и различие в характере изменения свойств атомов элементов больших и малых периодов, особенности групп А и групп В.
3) обучать умению обобщать полученные сведения.
Тип урока: урок изучения нового материала
Методы: словесные, словесно-наглядные.
Формируемые понятия: периодическая система, главная группа, побочная группа, период.
Развиваемые понятия: периодический
закон, периодичность, систематизация.
Литература для учителя: учебник 8 класса,
Сечко, О. И. Химия: 7 – 8 классы: дидактические материалы: пособие для учителей общеобразоват. учреждений / О. И. Сечко, И. И. Окова. – Минск: Аверсэв, 2009. – 128 с.
Литература для учащихся: учебник 8 класса
Ход урока
1) Организация начала занятия
Здравствуйте! Присаживайтесь. Кто дежурный? Кто сегодня отсутствует? У всех есть всё необходимое на партах? Приступим к занятию.
2) Проверка выполнения домашнего задания
2 ученика вызываются к доске для выполнения письменного задания (задания на карточках).
1.
Составить
уравнения реакций полной нейтрализации между кислотами (серная, фосфорная) и
основаниями (гидроксид натрия и гидроксид магния). Назвать все образующиеся
соединения.
Решение.
H2SO4 + 2 NaOH →Na2SO4 + 2H2O (сульфат натрия)
H2SO4 + Mg(OH)2 → MgSO4 + 2H2O (сульфат магния)
H3PO4 + 3NaOH → Na3PO4 + 3H2O (фосфат натрия)
2H3PO4 + 3Mg(OH)2 → Mg3(PO4)2 + 6H
2. Составьте уравнения реакций, при помощи которых можно осуществить превращения согласно приведенной схеме:
Mg→MgO→ Mg(OH)2 →MgCl2
Решение.
2Mg + O2 → 2MgO
MgO + H2O → Mg(OH)2
Mg(OH)2 + 2HCl → MgCl2+ 2H2O
В это время остальной класс занят фронтальным опросом.
Вопросы:
1.
Какие
характеристики химических элементов взял Д. И. Менделеев за основу своей систематизации?
(атомная масса).
3. Сформулируйте периодический закон.(отвечает несколько человек).
4. В каком году был открыт периодический закон? (1869).
5. Как изменяются металлические свойства простых веществ в периодах с возрастанием относительных атомных масс элементов, которые образуют эти вещества? (уменьшаются).
6. Как изменяются неметаллические свойства простых веществ в периодах с возрастанием относительных атомных масс элементов, которые образуют эти вещества? (увеличиваются).
7.
Как
изменяются свойства высших оксидов и соответствующих им гидроксидов (оснований
и кислот) с возрастанием относительных атомных масс? (от основных к кислотным).
Учитель проходит по классу и проверяет наличие домашнего задания в тетрадях.
Зачитывается сообщение «Интересные факты из жизни Д. И. Менделеева».
3) Подготовка к основному этапу занятия
На предыдущем уроке мы рассмотрели периодический закон Д. И. Менделеева. Опираясь на периодический закон, Менделеев построил естественную классификацию химических элементов – периодическую систему химических элементов. Ее графическим изображением является таблица, которая так и называется – периодическая система химических элементов. Запишите в тетради тему урока.
4) Усвоение новых знаний и способов действий.
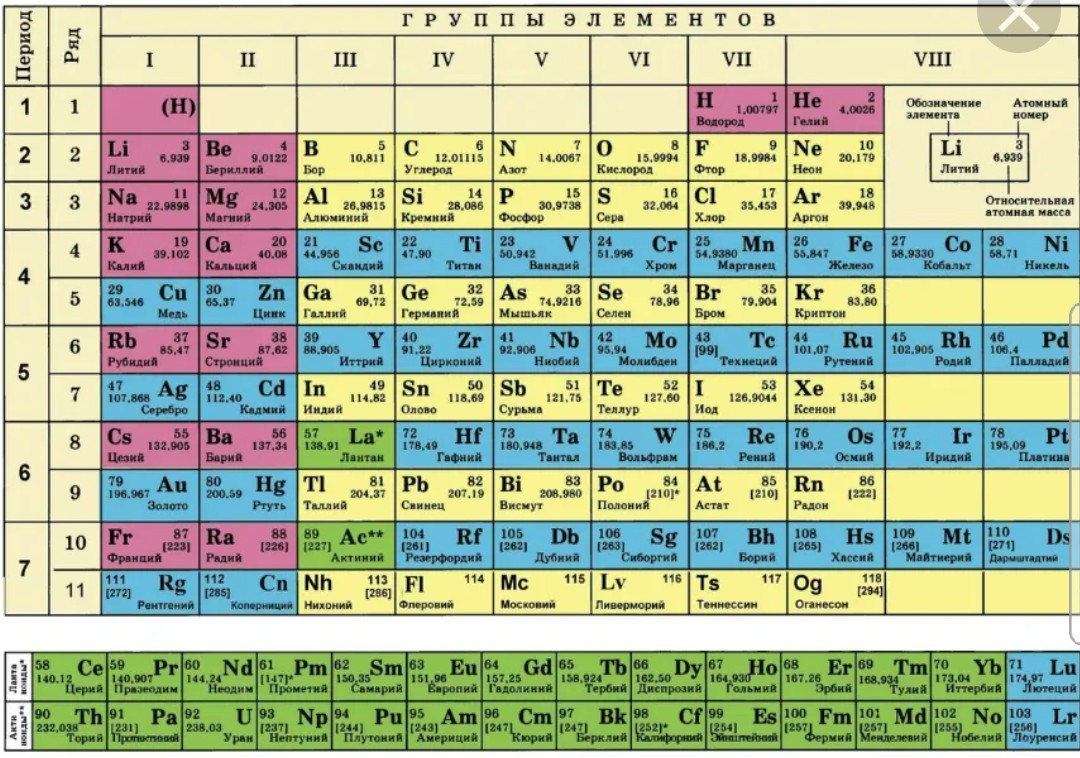
Формы таблиц различны (показать различные изображения таблицы Менделеева). В настоящее время наиболее широко используется таблица, представленная на первом форзаце учебника.
Каждый химический элемент занимает одну клетку, в
которой указаны химический знак элемента, его название, значение относительной
атомной массы и его атомный (порядковый) номер.
Основные структурные единицы периодической системы это периоды и группы. Горизонтальные ряды элементов называются периодами, а вертикальные столбцы – группами. Всего в таблице 7 периодов. Первые три периода называются малыми, остальные четыре большими. В таблице 18 групп. Группы А называются главными, а группы В – побочными. (записать в тетради определение периода и группы). В каждой группе находятся элементы со сходными химическими свойствами их атомов. Номер группы указывает (римскими цифрами), как правило, высшую валентность элементов в соединениях с кислородом.
Причину периодичности в изменении свойств химических элементов можно объяснить только на основе знаний о строении атома. К изучению строения атома мы приступим на следующем уроке.
5) Первичная проверка понимания
Давайте повторим:
Как назвал Д. И. Менделеев естественную классификацию химических элементов?(периодическая система химических элементов).
Назовите основные структурные единицы периодической
системы.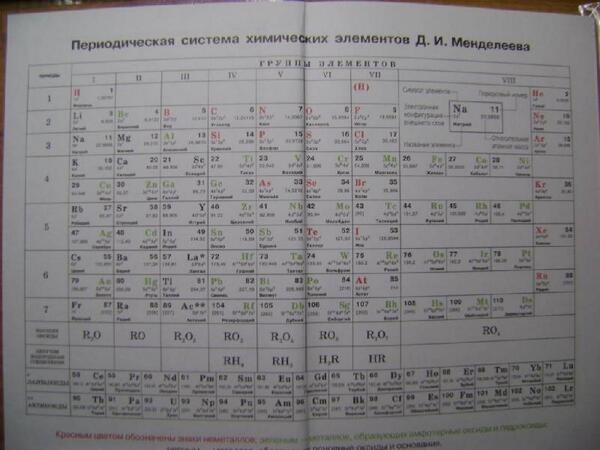 (периоды и группы).
(периоды и группы).
Что такое период? (период – это горизонтальный ряд химических элементов, расположенных в порядке возрастания их относительных атомных масс, начинающийся щелочным металлом (или водородом) и заканчивающийся благородным газом).
Какие свойства элементов закономерно изменяются в периоде? (металлические и неметаллические свойства).
Дайте определение понятию «группа».(группа – это вертикальный ряд химических элементов в периодической системе, атомы которых обладают сходными свойствами).
6) Закрепления знаний и способов действий
1. Вычислить массовую долю кислорода в высшем оксиде химического элемента, порядковый номер которого 17.
Решение.
Элемент: хлор
Высший оксид: Cl2O7
Ответ: = 61%
2.
Формула
высшего оксида некоторого химического элемента ЭО. Укажите атомные номера,
символы, номера периодов и типы групп трех химических элементов которые могут
соответствовать данной формуле (задание выполняется устно).
7) Контроль и самопроверка знаний.
Весь класс проверяет правильность выполнения письменного задания в тетради. Исправляются ошибки на доске.
8) Подведение итогов занятия
Сегодня мы рассмотрели периодическую систему химических элементов, изучили такие понятия как период и группа, закрепили полученные знания. Все ли вам было понятно? Для того чтобы лучше усвоить изученный материал необходимо выполнить домашнее задание.
9) Информация о домашнем задании. Инструктаж по его выполнению.
Запишите задание на дом: § 8 задания 5 – 8.
10) Рефлексия
Продолжить предложения:
1) Сегодня на уроке я узнал…
2) Сегодня на уроке мне понравилось…
3)
Периодический закон Д. И. Менделеева — Учебник по Химии. 8 класс. Григорович
Учебник по Химии. 8 класс. Григорович — Новая программа
Вспомните:
• высшую валентность элементов можно определить по номеру группы Периодической системы, в которой расположен элемент;
• отличить металл от неметалла можно, основываясь на общих физических свойствах металлов; ковкость, металлический блеск, электропроводность, теплопроводность и т.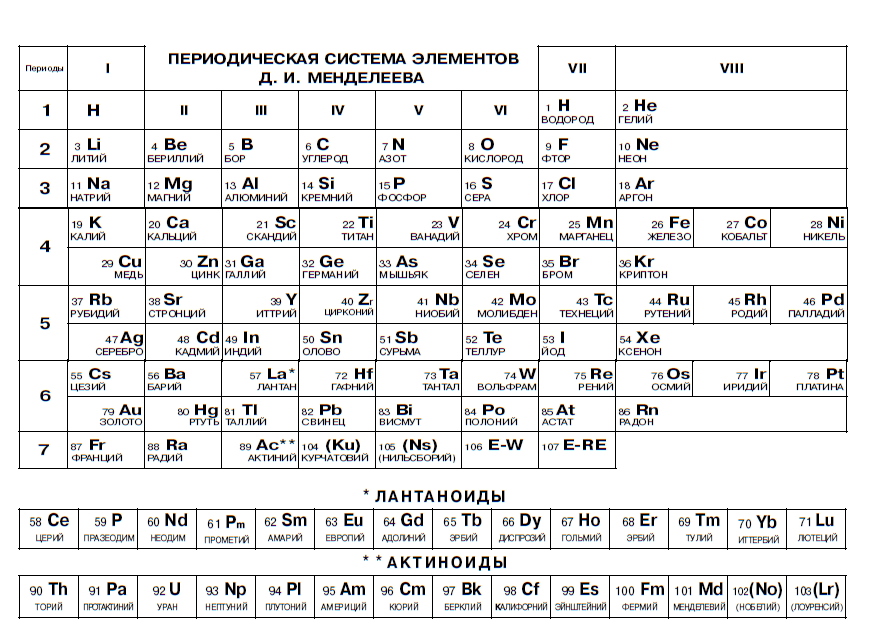
• как можно определить химический характер оксидов (§ 1).
Открытие Периодического закона
В отличие от своих предшественников, Д. И. Менделеев был глубоко убежден в существовании взаимосвязи между всеми химическими элементами: как между сходными, так и между несходными.
В середине XIX в. Менделеев начал работать над своим знаменитым учебником «Основы химии», и ему необходимо было определить, в каком порядке описывать свойства элементов. За основу систематизации элементов Менделеев взял относительную атомную массу, считая, что она является главной характеристикой химического элемента: она не изменяется при образовании элементом простого или сложного вещества.
Расположив в ряд символы всех известных к тому времени химических элементов в порядке увеличения их относительной атомной массы, он заметил, что элементы со сходными свойствами (например, щелочные элементы) не расположены непосредственно друг за другом, а появляются периодически (регулярно). Оказалось, что так же закономерно (через определенный интервал) повторяется химический характер соединений элементов.
Оказалось, что так же закономерно (через определенный интервал) повторяется химический характер соединений элементов.
Рис. 6.1. Рукопись первого варианта Периодической системы (1869)
Проанализируем, какие закономерности можно выявить при расположении элементов в ряд (табл. 3, с. 28-29).
Таблица 3. Характер химических элементов и свойства их соединений в зависимости от атомных масс
Признак | Ряд химических элементов | ||||||
Li | Be | В | C | N | O | ||
Относительная атомная масса | 7 | 9 | 11 | 12 | 14 | 16 | |
Порядковый номер | 3 | 4 | 5 | 6 | 7 | 8 | |
Характер простого вещества | M | М | Н | Н | Н | H | |
Высшая валентность | I | II | III | IV | V | II | |
Формула высшего оксида | Li2O | ВеО | B2O3 | CO2 | N2O5 | — | |
Химический характер высшего оксида | O | А | К | K | K | — | |
Период | Второй | ||||||
F | Ne | Na | Mg | Аl | Si | P | S | Сl | Аr | |
19 | 20 | 23 | 24 | 27 | 28 | 31 | 32 | 35,5 | 40 | |
9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
Н | Н | М | М | M | Н | Н | Н | Н | Н | |
I | — | I | II | III | IV | V | VI | VII | — | |
— | — | Na2O | MgO | Аl2O3 | SiO2 | Р2O5 | SO3 | Cl2O7 | — | |
— | — | О | О | А | К | K | К | K | — | |
Третий | ||||||||||
Условные обозначения: М — металл; Н — неметалл; О — основный; К — кислотный; А — амфотерный.
В ряду элементов, приведенных в таблице 3, четко прослеживается периодическое изменение признаков. Так, Литий образует простое вещество металл. Постепенно характер простых веществ меняется на неметаллический. Также постепенно увеличивается высшая валентность, которую проявляют элементы, и химический характер их оксида. Литий оксид является основным, а нитроген(V) оксид — кислотным (Оксиген, Флуор и Неон не способны образовывать оксиды).
Затем эта последовательность в изменении свойств резко обрывается. Появляется элемент Натрий, который по свойствам схож с первым элементом ряда — Литием. Далее свойства элементов изменяются так же, как и от Лития до Флуора. В ряду простых веществ происходит постепенное изменение: от типичного металла (натрия) до типичного неметалла (хлора). Наблюдается также изменение состава и характера свойств соединений, в частности переход от основного натрий оксида к кислотному хлор(VII) оксиду.
Анализируя эту последовательность элементов, Д. И. Менделеев установил, что зависимость свойств элементов и их соединений от атомной массы является периодической. В 1869 г. он сформулировал Периодический закон.
Менделеев установил, что зависимость свойств элементов и их соединений от атомной массы является периодической. В 1869 г. он сформулировал Периодический закон.
Свойства химических элементов, а также образованных ими простых и сложных веществ находятся в периодической зависимости от относительных атомных масс элементов.
Располагая известные элементы по увеличению относительной атомной массы, Менделеев заметил противоречия между массой и положением Аргона и Калия. Относительная атомная масса Калия равна 39,1, а Аргона — 39,95. Если располагать их по значению относительных атомных масс Аr, получим:
Группа ПС Химический элемент Ar Высшая валентность Характер элемента | VII Сl 35,45 VII Неметаллич. | VIII К 39,1 I Металлич. | I Аr 39,95 — Инертный | II Са 40,08 II Металлич. |
Если же вопреки атомным массам поменять местами Калий и Аргон, противоречие исчезает:
Группа ПС Химический элемент Ar Высшая валентность Характер элемента | VII Сl 35,45 VII Неметаллич. | VIII Аr 39,95 — Инертный | I К 39,1 I Металлич. | II Са 40,08 II Металл ич. |
Этот парадокс с «неправильным» размещением элементов был объяснен только в начале XX в. после открытия строения атома. Но на тот момент без знаний о строении атома это был очень смелый поступок. Если вы внимательно рассмотрите современную Периодическую систему, то сможете найти еще два примера таких исключений в расположении химических элементов.
Но на тот момент без знаний о строении атома это был очень смелый поступок. Если вы внимательно рассмотрите современную Периодическую систему, то сможете найти еще два примера таких исключений в расположении химических элементов.
Изначально формулировка закона Д. И. Менделеева была несколько иной: «Свойства простых тел, а также форма и свойства соединений элементов находятся в периодической зависимости или, выражаясь алгебраически, образуют периодическую функцию от величины атомного веса элементов». В те времена вместо «вещество» говорили «тело», а атомную массу называли атомным весом.
От ряда элементов к Периодической системе
Итак, ряд химических элементов, расположенных по увеличению их относительных атомных масс, можно разделить на отдельные участки. Каждый участок начинается щелочным элементом, а заканчивается инертным. Такие участки называют периодами. Периоды, расположенные друг под другом, образуют уже знакомую вам Периодическую систему химических элементов (рис. 6.2).
6.2).
Рис. 6.2. Первые 20 элементов, расположенные в ряд по увеличению атомной массы. В периодической таблице элементы со сходными свойствами располагают друг под другом
Ряд химических элементов, расположенных в порядке возрастания их атомных масс, начинающийся с Гидрогена или щелочного металлического элемента и заканчивающийся инертным элементом, называют периодом.
Характер элементов и свойства их простых веществ и соединений при увеличении атомных масс в периоде постепенно изменяются.
Первый период содержит только два элемента, второй и третий — по восемь. Эти периоды называют малыми. В них при переходе от Гидрогена или щелочного металлического элемента к инертному элементу высшая валентность элементов постепенно увеличивается от I (у Гидрогена и щелочных металлических элементов) до VII (у галогенов). Если бы удалось получить соединения инертных элементов Неона и Аргона, то их максимальная валентность была бы равна VIII.
В отличие от первых трех периодов, четвертый и последующие периоды (пятый, шестой, седьмой) содержат по 18 и больше элементов, поэтому их называют большими.
В больших периодах также наблюдается постепенное изменение свойств. Но если в малых периодах переход от типичного металлического элемента к типичному неметаллическому элементу происходит за семь элементов, то в больших периодах такой же переход происходит за 17 или 31 элемент. То есть в больших периодах изменение свойств происходит значительно медленнее: характер соседних элементов в больших периодах отличается не так значительно, как у соседних элементов малых периодов.
Существует легенда, будто идея о Периодической системе пришла к Менделееву во сне. Однажды его спросили, так ли это, на что ученый ответил: «Я над ней, может, двадцать лет размышлял, а вы думаете: сидел и вдруг… готово».
Выводы
1. Характер химических элементов и свойства образованных ими соединений находятся в периодической зависимости от их атомных масс.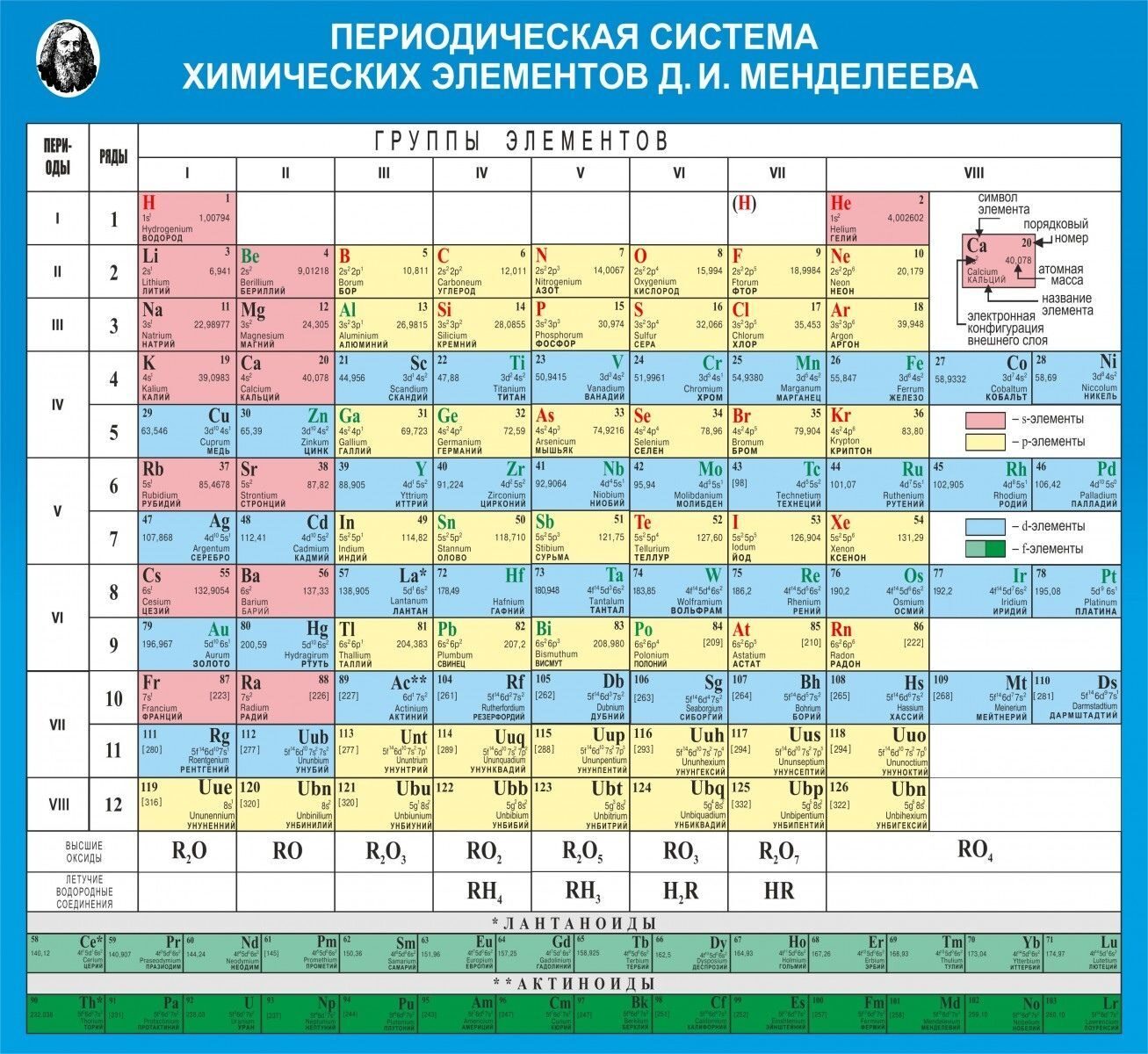 Все химические элементы разделяют на периоды, каждый из которых начинается щелочным элементом (или Гидрогеном) и заканчивается инертным элементом.
Все химические элементы разделяют на периоды, каждый из которых начинается щелочным элементом (или Гидрогеном) и заканчивается инертным элементом.
2. В периоде ослабляется металлический характер элементов и усиливается неметаллический. Так же изменяется и характер соединений элементов: соединения элементов, расположенных в начале периода, проявляют основные свойства, а в конце периода — кислотные.
Контрольные вопросы
1. Сформулируйте Периодический закон.
2. Какие свойства элементов и их соединений изменяются периодически?
3. Что называют периодом химических элементов?
4. Какие периоды называют малыми? большими? Почему их называют именно так?
5. Чем отличается изменение характера элементов в больших и малых периодах?
6. В какой части периода расположены элементы, относящиеся к семействам: а) щелочных элементов; б) галогенов; в) инертных элементов?
Задания для усвоения материала
1. Найдите в Периодической системе элементы, расположенные не в порядке увеличения относительной атомной массы. Какие противоречия появятся, если их расположить согласно их атомным массам?
Какие противоречия появятся, если их расположить согласно их атомным массам?
2. Как изменяется характер оксидов элементов в периоде? Проиллюстрируйте уравнениями реакций свойства оксидов Лития и Карбона. Какие свойства характерны для их гидратов?
3. Составьте формулы высших оксидов и гидратов оксидов элементов третьего периода. Укажите характер этих соединений (кислотный или основный).
4. Элемент в Периодической системе имеет порядковый номер 16. Какими свойствами обладают его оксиды, соответствующие высшей и низшей валентности? Образует ли этот элемент соединения с Гидрогеном?
5. Проанализируйте положение в Периодической системе элементов, способных образовывать летучие соединения с Гидрогеном (см. форзац 1). Проявление элементом каких свойств свидетельствует об образовании им летучего соединения с Гидрогеном?
6. До конца 60-х гг. XIX в. два элемента — А и Б — считали двухвалентными металлическими элементами и приписывали им неправильные атомные массы. Не найдя для них в Периодической системе места, которое соответствовало бы их свойствам, Д. И. Менделеев увеличил в полтора раза значения их атомных масс и уточнил валентность каждого из них, и тогда место для них нашлось. Неправильные атомные массы, которые приписывались элементам, были следующие; у элемента А — около 60, а у элемента Б — немногим больше 90. Найдите им место в Периодической системе и назовите эти элементы.
Не найдя для них в Периодической системе места, которое соответствовало бы их свойствам, Д. И. Менделеев увеличил в полтора раза значения их атомных масс и уточнил валентность каждого из них, и тогда место для них нашлось. Неправильные атомные массы, которые приписывались элементам, были следующие; у элемента А — около 60, а у элемента Б — немногим больше 90. Найдите им место в Периодической системе и назовите эти элементы.
7. Выполните учебный проект № 1 «Из истории открытия Периодической системы химических элементов».
Как мы учили химию в 6 классе
Сегодня хочу рассказать о том, как мы учили химию в 6 классе. Считаю наш опыт удавшимся. Решила поделиться им, чтобы не забыть. Почему мы начали учить химию так рано? Всё просто. Моя дочь не запоминает всё с первого раза. Чтобы успешно сдавать аттестации, нам нужно опережать программу. Поэтому мы решили изучать физику с 6 класса. Но когда я посмотрела учебник химии, то поняла, что очень многое перекликается. Нет смысла брать один предмет раньше другого, лучше изучать их параллельно.
Как ни странно, химия понравилась дочери больше, чем физика. Поэтому её мы уже завершили изучать в этом учебном году, а вот физика ещё тянется.
Как мы учили химию в 6 классе? Это было легко и интересно.
Химия 6 класс учебник
Первое, что предстояло выбрать — учебник. Я пересмотрела очень много учебников химии, но все они вызывали отторжение. Вот сразу, открываю страницу, читаю первые фразы — и всё. Мне не нравится. Хотела искать советские учебники, но вспомнила про белорусские. У них есть линейка учебников на русском языке. Пошла смотреть химию. И нашла то, что мне понравилось. Учебник Шиманович И. Е.
В связи с пандемией я не смогла его приобрести, но я скачала его из интернета и распечатывала к каждому уроку на принтере нужные страницы.
Как вы видите, учебник для 7 класса. В России химию начинают учить с 8 класса, поэтому материал подаётся в более концентрированном виде. А здесь сложность постепенно нарастает. И, честно говоря, сложного для шестиклассника ничего нет.
Вот содержание учебника
Фактически, дети знакомятся с основными понятиями:
- что такое химия;
- строение атома;
- относительная молекулярная масса;
- валентность;
- виды химических реакций;
- кислород, водород, вода;
- оксиды, кислоты, соли, основания (щёлочи).
Чему научилась дочь:
- находить относительную молекулярную массу вещества;
- подбирать валентности;
- составлять уравнения химических реакций;
- определять кислотность с помощью лакмусовой бумажки.
Как мы учили химию в 6 классе: дополнительные материалы
Кроме учебника мы активно пользовались вот таким задачником:
Его тоже нашли в электронном виде и распечатывали. Этот задачник составлен к белорусскому учебнику и очень хорошо его дополняет, позволяя разнообразить задания.
Конечно же, мы активно пользовались таблицей Менделеева. Я заказала небольшую ламинированную таблицу размерами А4, было очень удобно.
Я заказала небольшую ламинированную таблицу размерами А4, было очень удобно.
Ещё мы использовали вот такой набор для химических опытов:
Но можно смело покупать тот, что побольше. Хотя и этого хватило.
Как мы учили химию в 6 классе: интернет-ресурсы
В учебнике есть небольшие заметки для любознательных. Почти к каждой заметке можно было подобрать интересное видео.
Обычно я просто делала запрос в поисковой строке и выходила на Yoytube.
Часто находились истории в Галилео, другие познавательные ролики.
Когда учили водород, нашли документальный ролик про гибель дирижабля Гинденбург. Очень хорошо запомнилась горючесть водорода.
Никакими другими ресурсами не пользовались.
Что дальше?
Планирую сделать карточки, чтобы выучить основные химические элементы. Это — развлечение на лето.
В седьмом классе возьмём белорусский учебник химии для 8 класса. Я его уже скачала. А в восьмом — посмотрим, то ли возьмём русский учебник, то ли будем дальше двигаться по белорусским. Ещё дожить нужно.
Ещё дожить нужно.
| 1. |
Определи элемент
Сложность: лёгкое |
1 |
| 2. |
Главная подгруппа
Сложность: лёгкое |
1 |
3.
|
Побочная подгруппа
Сложность: лёгкое |
1 |
| 4. |
Число элементов в периодах и подгруппах
Сложность: лёгкое |
1 |
5.
|
Высшая валентность — исключения
Сложность: лёгкое |
1 |
| 6. |
Высшая валентность
Сложность: среднее |
2 |
7.
|
Периоды и группы
Сложность: среднее |
2 |
| 8. |
Элементы третьего периода
Сложность: среднее |
2 |
9.
|
Семейства элементов
Сложность: сложное |
3 |
ГДЗ по Химии для 8 класса Г.Е. Рудзитис, Ф.Г. Фельдман на 5
Авторы: Г.Е. Рудзитис, Ф.Г. Фельдман.
Издательство: Просвещение 2015
«ГДЗ по Химии 8 класс Рудзитис, Фельдман (Просвещение)» – это хорошая опора, которая поможет преодолеть все сложные моменты в понимании тематического материала и вникнуть во все специфические особенности предмета.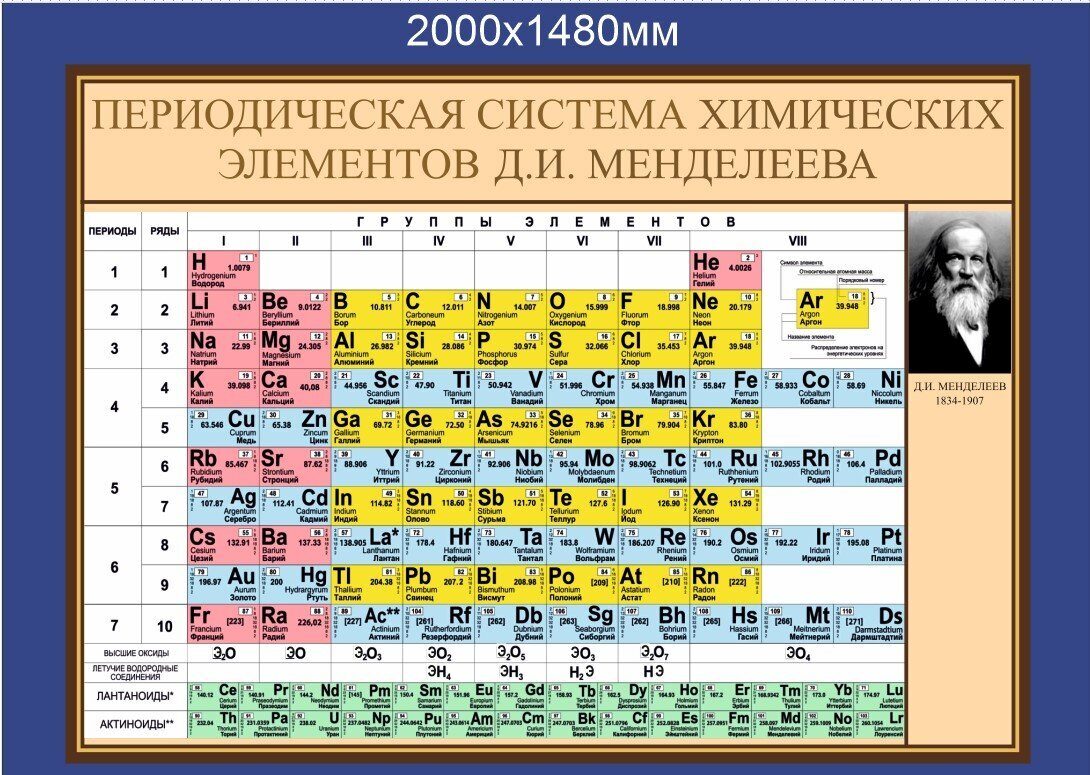
Учебная дисциплина, которая формирует систему знаний о различных веществах, их превращениях и практическом применении, носит название химия. В стенах школы ее изучение начинается с восьмого класса, и далее вплоть до выпускных экзаменов ребята приобретают навыки и умения, необходимые как для повседневной жизни, так и для дальнейшего профессионального образования. На уроках школьники получат знания, которые помогут объяснить природные явления, происходящие в окружающем мире, сформировать научную картину мира и понимание значимости науки для человечества.
Полезные свойства онлайн-решебник по химии для 8 класс от Рудзитиса
Справочник содержит досконально расписанные и верные ответы. Они подробнейшим образом изложены практически к каждому заданию учебника. С их помощью восьмиклассник сможет:
- – детально проработать особо сложный вопрос;
- – на «отлично» подготовиться к текущему опросу на уроке;
- – качественно выполнить домашнее задание;
- – существенно сэкономить время и силы на поиск нужной информации.

Навигационная система онлайн-сборника удобная и понятная. Она позволяет найти готовое решение по номеру упражнения легко и просто. Главным преимуществом решебника является цифровой формат. Он обеспечивает круглосуточный доступ к верным ответам с любого доступного устройства, будь то компьютер или телефон. Постоянное использование ГДЗ значительно облегчит и упростит освоение дисциплины, плюс ко всему ученик всегда будет во всеоружии перед любой проверкой знаний в классе.
С чем столкнутся восьмиклассники на предметных уроках
Приступая к освоению предмета, восьмиклассники в первую очередь познакомятся с важнейшими понятиями и терминами, используемыми в науке. Далее они рассмотрят следующие темы:
- Понятие и задачи химии.
- Вещества, их состав и физические свойства.
- Таблица Менделеева и схема ее построения.
- Металлы и классы неорганических соединений и др.
Помимо теоретических уроков учеников ждёт большое количество практических занятий, где они научатся составлять химические уравнения и решать расчетные задачи. Для того чтобы избежать ошибок, специалисты рекомендуют использовать в процессе обучения помощь «ГДЗ по Химии за 8 класс Рудзитис Г. Е., Фельдман Ф. Г. (Просвещение)».
Для того чтобы избежать ошибок, специалисты рекомендуют использовать в процессе обучения помощь «ГДЗ по Химии за 8 класс Рудзитис Г. Е., Фельдман Ф. Г. (Просвещение)».
«Знаки химических элементов. Периодическая система химических элементов Д.И. Менделеева». Вариант 2
САМОСТОЯТЕЛЬНАЯ РАБОТА ПО ХИМИИ
8 КЛАСС
ТЕМА: «ЗНАКИ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА»
ВАРИАНТ 2
Самостоятельные работы предназначены для текущей проверки знаний учащихся по всем программным темам 8 класса. Самостоятельные работы включают в себя 2 — 3 задания, на выполнение которых отводится от 10 до 20 минут. По усмотрению учителя задания самостоятельных работ могут быть использованы для индивидуального опроса учащихся или в качестве практических заданий во время зачетов или переводных экзаменов.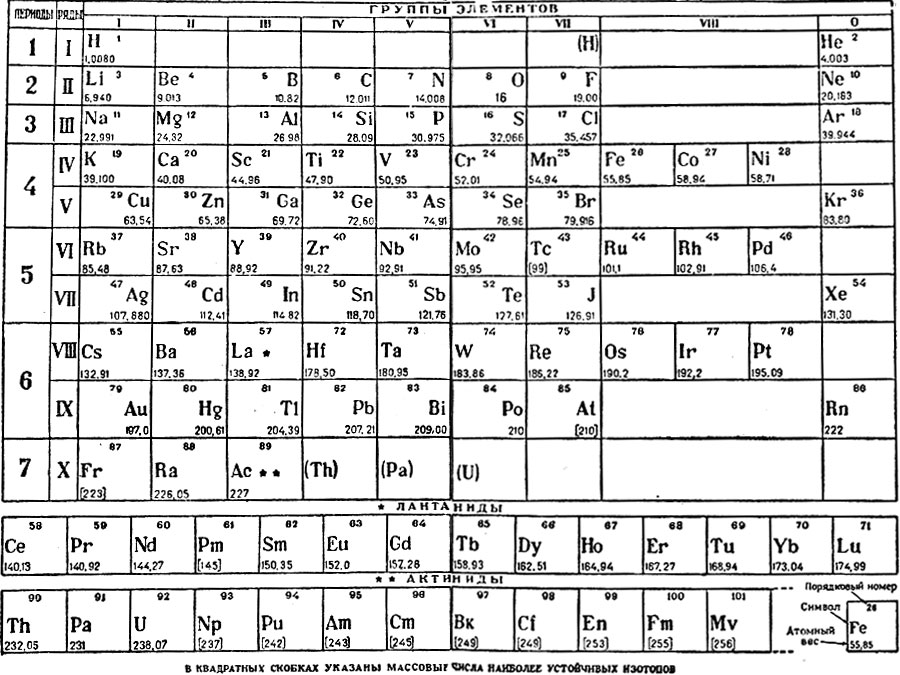
1. Заполните таблицу:
| Название химического элемента | Химический символ |
Произношение химического символа |
| Кислород | ||
| Кремний | ||
| Алюминий | ||
| Сера | ||
| Цинк |
2. Установите соответствие. Ответом к заданию является набор из цифры и двух букв:
| Химический элемент |
Положение в Периодической системе |
Химический символ |
1. Фтор Фтор |
А) IV период, 6 группа, побочная подгруппа |
а) F |
| 2. Хром |
Б) II период, 7 группа, главная подгруппа |
б) Na |
| 3. Бор |
В) III период, 1 группа, главная подгруппа |
в) Cr |
| 4. Натрий |
Г) II период, 3 группа, главная подгруппа |
г) B |
3. Выпишите в два столбика символы элементов, расположенных:
а) в главных подгруппах
б) в побочных подгруппах
N, Ni, Ga, As, Mn, Ag
Химия / 8 класс / Самостоятельные работы / Знаки химических элементов. Периодическая система химических элементов Д. И. Менделеева
И. Менделеева
Преподавателю: Данная самостоятельная работа по химии проводится с учащимися 8 класса общеобразовательной школы. По структуре и сложности задания самостоятельной работы соответствуют обязательному минимуму содержания по химии в полной средней школе, а также соответствуют тематическому поурочному планированию к учебнику О.С. Габриеляна для 2-х часовой программы. Данная самостоятельная работа может быть использована для контроля знаний учащихся по химии учителями, работающими по любым другим учебникам.
Целью данной самостоятельной работы является контроль усвоения учащимися темы «Знаки химических элементов. Периодическая система химических элементов Д.И. Менделеева».
| < Предыдущая | Следующая > |
|---|
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
класс 7А
Марка 7Б
Класс 7 (вместе A и B)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 8A
марка 8Б
Grade 8 (комбинированные A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
марка 9А
Марка 9Б
Оценка 9 (вместе A и B)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 4А
класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5А
Марка 5Б
Оценка 5 (комбинированные A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 6А
класс 6Б
Класс 6 (вместе A и B)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственным ограничением является то, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете делать ксерокопии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственным ограничением является то, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, спонсорские логотипы и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без марочного знака)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Введение в Периодическую таблицу элементов: Учебник химии 8 класс |,..
Введение в Периодическую таблицу элементов: Учебник химии 8 класс | … | bol.com Sluit vensterJouw cookievoorkeuren
Om bol.com voor jou nog beter te maken, gebruiken wij altijd functionele en analytische cookies (en daarmee vergelijkbare technieken). Ook Willen we cookies plaatsen om je bezoek aan bol.com en onze communication naar jou makkelijker en persoonlijker te maken.Met deze cookies kunnen wij en derde partijen jouw internetgedrag binnen en buiten bol.com volgen en verzamelen. Hiermee passen wij en derden onze веб-сайт, приложение, реклама и общение с интересами. Мы говорим о cookievoorkeur op в учетной записи Je. Als we je account op een ander apparaat herkennen, hoef je niet opnieuw de keuze te maken. Дверь op ‘acceptpteren’ te klikken ga je hiermee akkoord. Je kunt je cookievoorkeuren altijd weer aanpassen. Lees er meer в ons cookiebeleid.
Als we je account op een ander apparaat herkennen, hoef je niet opnieuw de keuze te maken. Дверь op ‘acceptpteren’ te klikken ga je hiermee akkoord. Je kunt je cookievoorkeuren altijd weer aanpassen. Lees er meer в ons cookiebeleid.
- Ebooks lezen is heel makkelijk.На вашем смартфоне или планшете с бесплатным приложением bol.com Kobo e-reader Kobo e-reader на смартфоне или планшете.
Саменваттинг
Вы знаете, что такое Периодическая таблица элементов? Если вы этого не сделаете, то вам повезло, потому что мы дадим вам быстрый, но очень важный обзор! Это учебное пособие станет отличным дополнением к учебной коллекции вашего ребенка. Его также можно использовать в качестве рецензента, в зависимости от того, что нужно вашему ребенку.Давай, возьми копию сегодня!
Его также можно использовать в качестве рецензента, в зависимости от того, что нужно вашему ребенку.Давай, возьми копию сегодня!
Lees de eerste pagina’s
Характеристики продукции
Inhoud
- Таал
- Энгельса
- Биндвейзе
- Электронная книга
- Verschijningsdatum
- февраль 2017 г.

- Формат электронной книги
- -13517
Lees mogelijkheden
- Lees dit ebook op
- Рабочий стол (Mac и Windows) | Электронная книга Kobo | Android (смартфон и планшет) | iOS (смартфон и планшет) | Windows (смартфон и планшет) | Электронная книга Overige
- Формат электронной книги
- -13517
Je vindt dit artikel in
- Boek, электронная книга luisterboek?
- Электронная книга
Веркооп дверной болт. ком
ком
Введение в Периодическую таблицу элементов: Учебник химии 8 класс | Детские книги по химии
3,99 веркооп дверь: bol.com
- Электронная книга прям бесчикбаар на анкоопе
- Электронные книги бесплатно
- Dag en nacht klantenservice
- Вейлиг бетален
- Waar wil je dit mee vergelijken?
Je kan in totaal vijf artikelen kiezen.
 Er is nog plaats voor
andere artikelen.
ander artikel.
Er is nog plaats voor
andere artikelen.
ander artikel.
{«pdpTaxonomyObj»: {«pageInfo»: {«pageType»: «PDP», «language»: «nl», «website»: «bol.com»}, «userInfo»: {}, «productInfo»: [ {«productId»: «9300000008664543», «ean»: «9781541909281», «title»: «Введение в Периодическую таблицу элементов: Учебник химии 8 класс | Детские книги по химии», «price»: «3.99 «,» categoryTreeList «: [{» tree «: [» Boeken «]}],» brick «:» 10000926 «,» chunk «:» 80007266 «,» publisher «:» Baby Professor «,» author «: «Baby Professor», «averageReviewRating»: «0.0», «seriesList»: [], «sellerName»: «bol.com», «uniqueProductAttribute»: «BINDING-E-book»}]}}
{«pdpAnalyticsObj»: {«pageInfo»: {«pageType»: «PDP», «country»: «NL», «shoppingChannelContextTypeAndDeviceType»: «www.bol.com, DESKTOP», «canonicalUrl»: «https: // www.bol.com/nl/nl/p/an-introduction-to-the-periodic-table-of-elements-chemistry-textbook-grade-8-children-s-chemistry-books/9300000008664543/»,»shortURL «:» / p / an-введение-в-периодической-таблице-элементов-учебник-химии-8-й класс-дети-книги-химии / 9300000008664543 / «,» countryLanguage «:» nl-nl «},» product «: {» productId «:» 9300000008664543 «,» title «:» Введение в Периодическую таблицу элементов: учебник химии 8 класс | Детские книги по химии «,» category «:» Boeken «, «бренд»: «», «кирпич»: «10000926», «продавец»: «0 _», «заказ»: правда, «цена»: «3. 99 «,» categoryNumbersFlattened «: [» 8299 «],» familyId «:» 9300000008664687 «}}}
99 «,» categoryNumbersFlattened «: [» 8299 «],» familyId «:» 9300000008664687 «}}}
Страница не найдена | ЗННХС
Страница не найдена | ЗННХС | Официальный сайт Этот веб-сайт принимает Руководство по обеспечению доступности веб-контента (WCAG 2.0) в качестве стандарта доступности для всех связанных с ним веб-разработок и услуг. WCAG 2.0 также является международным стандартом ISO 40500. Это подтверждает его как стабильный технический стандарт, на который можно ссылаться. WCAG 2.0 содержит 12 руководств, организованных по 4 принципам: воспринимаемый, работоспособный, понятный и надежный (сокращенно POUR).Для каждого руководства есть проверяемые критерии успеха. Соответствие этим критериям оценивается по трем уровням: A, AA или AAA. Руководство по пониманию и применению Руководства по обеспечению доступности веб-контента 2.0 доступно по адресу: https://www.w3.org/TR/UNDERSTANDING-WCAG20/. Специальные возможности Комбинация клавиш быстрого доступа Активация Комбинированные клавиши, используемые для каждого браузера. Chrome для Linux нажмите (Alt + Shift + shortcut_key)
Chrome для Windows нажмите (Alt + shortcut_key)
Для Firefox нажмите (Alt + Shift + shortcut_key)
Для Internet Explorer нажмите (Alt + Shift + shortcut_key), затем нажмите (ввод)
В Mac OS нажмите (Ctrl + Opt + shortcut_key) Заявление о доступности (комбинация + 0): страница утверждения, на которой будут показаны доступные ключи доступности.Домашняя страница (комбинация + H): клавиша доступа для перенаправления на домашнюю страницу.
Основное содержимое (комбинация + R): ярлык для просмотра раздела содержимого текущей страницы.
FAQ (комбинация + Q): ярлык для страницы часто задаваемых вопросов.
Контакт (комбинация + C): ярлык для страницы контактов или формы запросов.
Отзыв (комбинация + K): ярлык для страницы обратной связи.
Карта сайта (комбинация + M): ярлык для раздела карты сайта (нижний колонтитул) на странице.
Поиск (комбинация + S): ярлык для страницы поиска. Нажмите esc или нажмите кнопку закрытия, чтобы закрыть это диалоговое окно.
Chrome для Linux нажмите (Alt + Shift + shortcut_key)
Chrome для Windows нажмите (Alt + shortcut_key)
Для Firefox нажмите (Alt + Shift + shortcut_key)
Для Internet Explorer нажмите (Alt + Shift + shortcut_key), затем нажмите (ввод)
В Mac OS нажмите (Ctrl + Opt + shortcut_key) Заявление о доступности (комбинация + 0): страница утверждения, на которой будут показаны доступные ключи доступности.Домашняя страница (комбинация + H): клавиша доступа для перенаправления на домашнюю страницу.
Основное содержимое (комбинация + R): ярлык для просмотра раздела содержимого текущей страницы.
FAQ (комбинация + Q): ярлык для страницы часто задаваемых вопросов.
Контакт (комбинация + C): ярлык для страницы контактов или формы запросов.
Отзыв (комбинация + K): ярлык для страницы обратной связи.
Карта сайта (комбинация + M): ярлык для раздела карты сайта (нижний колонтитул) на странице.
Поиск (комбинация + S): ярлык для страницы поиска. Нажмите esc или нажмите кнопку закрытия, чтобы закрыть это диалоговое окно.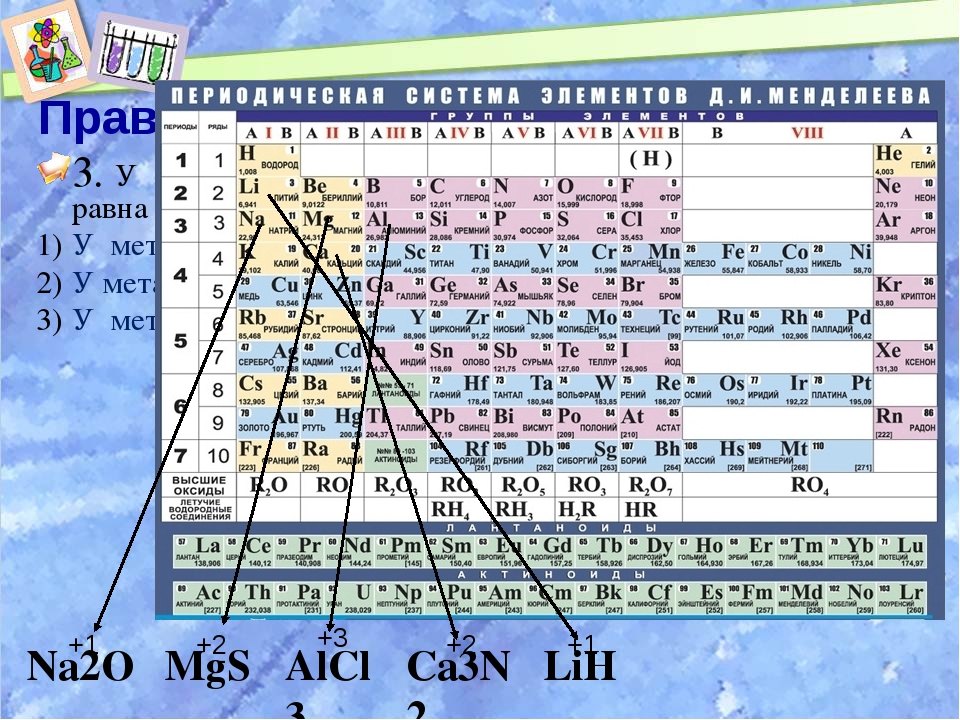 ×
×
Запрошенная вами страница могла быть перемещена в новое место или удалена с сайта.
Вернитесь на ГЛАВНУЮ СТРАНИЦУ или найдите то, что ищете, в поле поиска ниже.
ГЛАВНЫЙ ЛАГЕРЬ: Gen.Luna Street, Estaka, Dipolog City 7100 | (065)212-3604 © 2019- Городское управление Диполог.Все права защищены. | Разработано: Марожелу А. Магбухос, Джови Э. Абаа | Работает на: php 7.0.0 | MySQL 8.0 |
Раскрасьте и узнайте о Периодической таблице
Это исследование предназначено для детей от 10 лет, о чем свидетельствуют цветные смайлы. Узнать о периодической таблице элементов можно с детьми с 5 по 12 класс!
С 5 по 8 классы С 9 по 12 классы Блок 1-13: Древняя Индия, луга, элементы, текстура и форма Урок «Периодическая таблица элементов» — это химическое исследование, посвященное элементам из Уровней обучения, раздел 1–13. В Layers of Learning есть практические эксперименты в каждом разделе этой семейной учебной программы. Узнайте больше о слоях обучения.
В Layers of Learning есть практические эксперименты в каждом разделе этой семейной учебной программы. Узнайте больше о слоях обучения.
Периодическая таблица элементов — это визуальный способ, который химики разработали для организации элементов Вселенной. С помощью этого метода элементы группируются рядом с другими похожими элементами. По мере разработки таблицы Менделеева появилось много неоткрытых элементов, присутствие которых было предсказано на основе пустого места в таблице. Таблица Менделеева — одно из свидетельств того, что Вселенная упорядочена и предсказуема.
Шаг 1. Библиотечные исследования
Прежде чем приступить к исследованию, прочтите пару книг о периодической таблице элементов. Вот несколько советов, но если вы не можете их найти, поищите в своей библиотеке книги о движении, физике, гравитации и трении. Цветные смайлы над каждой книгой подскажут, для какого возраста они рекомендованы.
Как аффилированные лица Amazon, рекомендуемые книги и продукты ниже возвращают нам крошечный процент от вашей покупки. Это не влияет на ваши расходы и помогает нам управлять нашим веб-сайтом. Мы благодарим Вас!
Это не влияет на ваши расходы и помогает нам управлять нашим веб-сайтом. Мы благодарим Вас!
Шаг 2: Исследование периодической таблицы
Вам понадобятся печатные и цветные карандаши, цветные карандаши, цветные ручки или краски для таблицы Менделеева.
Нажмите на это изображение, чтобы получить периодическую таблицу элементов для печати.Начните с раскраски семейств элементов, как показано в примере ниже. Семейства — это элементы со схожими свойствами. Они ведут себя одинаково физически и химически.
Прочтите о наборах элементов в книгах, которые вы получили из библиотеки.Некоторые правила Периодической таблицы
Затем выучите некоторые правила таблицы Менделеева.
Периоды проходят горизонтально по таблице строками, а атомный номер увеличивается на единицу при перемещении слева направо. Атомный номер — это количество протонов в атоме. Атомный номер — это большое число в верхней части поля для определенного элемента.
Группы располагаются вертикально вниз по таблице, и все элементы в определенной группе имеют одинаковое количество электронов во внешней оболочке, поэтому они ведут себя одинаково.Первая группа, щелочные металлы, имеет один электрон на внешней оболочке. Во второй группе их двое. Затем мы пропускаем выпадающий раздел и переходим к группе, которая начинается с Boron. Группа бора имеет три электрона и так далее, вплоть до благородных газов, у которых восемь электронов во внешней оболочке.
Буквы в каждой ячейке являются символом химического вещества. Обозначение углерода — C, свинца — Pb, происходит от латинского слова «свинец» — свинец.
Число в нижней части прямоугольника элемента — это атомный вес или общий вес протонов, нейтронов и электронов этого элемента.Водород, который состоит из одного протона и одного электрона, имеет вес 1. (Вес электронов по сравнению с протонами и нейтронами незначителен и не учитывается.)
По мере того, как вы исследуете периодическую таблицу, вы также можете играть в эту интерактивную игру «Построить атом», чтобы попрактиковаться в построении атомов на основе элементов в периодической таблице.
Шаг 3: Покажите, что вы знаете
После того, как вы объяснили основные правила таблицы Менделеева, задайте вопросы детям, которые награждают их за хорошую успеваемость.
- К какому семейству принадлежит ксенон (Xe)?
- Какой химический символ у золота?
- Сколько электронов находится во внешней оболочке бора (B)?
- Назовите элемент в той же группе, что и Углерод.
- Какой элемент имеет химический символ Na?
- Сколько электронов находится во внешней оболочке галогенных газов?
Вы уловили идею. Это упражнение не предназначено для того, чтобы помочь детям запомнить таблицу Менделеева, а скорее для того, чтобы узнать, что означают символы и как их интерпретировать, чтобы они могли обращаться к таблице, когда им понадобится информация позже.
Дополнительные слои
Дополнительные слои — это дополнительные действия, которые вы можете выполнять, или касательные, которые вы можете использовать. Вы найдете их на боковых панелях каждого модуля Layers of Learning. Они не являются обязательными, поэтому просто выберите то, что вас интересует.
Вы найдете их на боковых панелях каждого модуля Layers of Learning. Они не являются обязательными, поэтому просто выберите то, что вас интересует.
Дополнительный слой
Люди предложили много альтернативных способов организации таблицы Менделеева. Вот одна идея.
Узнайте больше об альтернативных предложенных периодических таблицах.
В Интернете
В каталоге Layers of Learning для каждого раздела есть список веб-сайтов для дальнейшего изучения тем.
Чтобы узнать больше о периодической таблице элементов, посетите https://www.ptable.com/, где вы можете щелкнуть элементы, чтобы узнать больше о них один за другим.
Знаменитые люди
Российский химик и изобретатель Дмитрий Менделеев создал первую таблицу Менделеева в том виде, в котором мы ее знаем сегодня.
Он даже предсказал существование элементов, которые еще не были обнаружены.
Попробуйте Layers of Learning бесплатно
Получите первый полный блок «Уровни обучения» бесплатно, чтобы попробовать вместе со своими детьми. Подпишитесь на информационный бюллетень, и мы отправим вам PDF-документ с блоком 1-1 по электронной почте. Никакого давления, вы можете отказаться от подписки в любой момент и сохранить блок навсегда.
Подпишитесь на информационный бюллетень, и мы отправим вам PDF-документ с блоком 1-1 по электронной почте. Никакого давления, вы можете отказаться от подписки в любой момент и сохранить блок навсегда.
Почему некоторые элементы Периодической таблицы представлены буквами, которые не имеют четкой связи с их названиями?
Ответ
Некоторые элементы были известны в древности и поэтому имеют латинские названия.
Периодическая таблица. 2019. Фото Н.Ганачек. Национальный институт стандартов и технологий (NIST).
В периодической таблице одиннадцать элементов представлены буквами, не соответствующими их названиям:
- Натрий (Na — Natrium)
- Калий (K — Kalium)
- Железо (Fe — Ferrum)
- Медь (Cu — Купрум)
- Серебро (Ag — Аргентум)
- Олово (Sn — Stannum)
- Сурьма (Sb — Stibium)
- Вольфрам (W — Вольфрам)
- Золото (Au — Aurum)
- Ртуть (Hg — Гидрум) )
- Свинец (Pb — Plumbum)
Почти все эти элементы были известны в древние времена и поэтому имеют латинские названия. Некоторые из названий также привели к другим словам, которые распространены в английском языке. Например, от слова «plumbum», что на латыни означает «свинец» (Pb), мы получили слова «сантехник» и «водопроводчик», потому что свинец веками использовался в водопроводных трубах.
Некоторые из названий также привели к другим словам, которые распространены в английском языке. Например, от слова «plumbum», что на латыни означает «свинец» (Pb), мы получили слова «сантехник» и «водопроводчик», потому что свинец веками использовался в водопроводных трубах.
Другие имена имеют разное происхождение. Например, гидраргирум, латинское название Меркурия (Hg), произошло от оригинального греческого гидраргироса, что означало «водное серебро». Элементарная ртуть, также исторически известная как «ртуть», представляет собой блестящий серебряный металл, находящийся в жидком состоянии при комнатной температуре.
Таблица типов элементов и объяснение пластин, показывающих различные химические элементы и их атомный вес. Между 1808-1827 гг. В г. Новая система химической философии Джона Далтона. Отдел эстампов и фотографий, Библиотека Конгресса. Символ WTungsten получил от немецкого названия Wolfram. Вольфрам происходит из вольфрамита, который был одной из руд, в которой чаще всего находили вольфрам. Само название Tungsten на самом деле шведское и переводится на английский как «тяжелый камень».
Слово калий происходит от английского «pot ash», которое использовалось для выделения солей калия. Мы получили K от названия калиум, данного немецким химиком Мартином Генрихом Клапротом, которое произошло от щелочи, происходящей от арабского al-qalyah, или «растительный пепел».
Этимология названий элементов может увести вас в фантастическое приключение, и вы можете быть удивлены тем, где вы оказались. В разделе для дальнейшего чтения можно найти книги по истории химических элементов.
Периодическая таблица элементов.PubChem, Национальная медицинская библиотека США (NLM), Национальный центр биотехнологической информации, Национальные институты здравоохранения.Опубликовано: 05.05.2020. Автор: Справочная секция по науке, Библиотека Конгресса
Периодическая таблица урока для шестого класса проекта «Исследование элементов» (Часть 1/3)
Этап урока ИССЛЕДОВАТЬ — вовлечь учащихся в изучение темы, чтобы они начали строить собственное понимание. Чтобы помочь студентам изучить сложность периодической таблицы, студенты выполняют различные исследовательские задания, как описано в Руководстве для учащихся проекта «Таблица Менделеева».
Геологоразведочные работы разделены на три основных раздела:
1) Создание базовых знаний: в этом видео обсуждается Раздел 1 (находится на странице 1 Руководства для учащихся проекта «Таблица Менделеева»).
Как отмечается в видео, в зависимости от того, какое воздействие уже получили студенты, это первое задание может быть обзором или потребовать от студентов исследования, чтобы найти информацию. Обзор работы учащихся индивидуально или в классе полезен для обеспечения того, чтобы учащиеся были на одной волне с переходом к более сложным занятиям.Видео о моделях Бора, упомянутых в предыдущем видео, доступно здесь:
2) Раскрашивание и маркировка Периодической таблицы: В этом видео обсуждается Раздел 2 (находится на странице 2 Руководства для учащихся проекта «Периодическая таблица»). Ссылки на шаблоны периодической таблицы находятся здесь: Периодическая таблица элементов — Базовая или Периодическая таблица элементов — Расширенная.
Единственная реальная проблема для учащихся, связанная с этим заданием, — уделять пристальное внимание деталям при выполнении заданных шагов.У учащихся есть партнер для проверки их заполненных периодических таблиц, прежде чем отправлять их на утверждение учителю, чтобы облегчить использование предоставленного контрольного списка. Пример заполненной таблицы Менделеева приведен здесь: Проект Периодической таблицы — Цветная таблица Менделеева.
3) Заполнение карточек периодической таблицы и создание мини-периодической таблицы: В этом видео обсуждается Раздел 2 (находится на страницах 2–5) Руководства для учащихся по проекту «Таблица Менделеева»).
Вот видео, на котором студенты строят свою мини-периодическую таблицу:
Этот пример, Мини-периодическая таблица — Работа учащихся, полезно использовать в качестве образца, чтобы учащиеся могли проверить свою работу на отдельных карточках элементов и расположить карточки в правильном порядке.
Для дальнейших шагов перейдите к Части 2, которая включает в себя компоненты EXPLAIN этого урока; Время: 1-2 50-минутных урока или эквивалентные блоки.
Волшебная таблица Менделеева и серия для девочек «Элемент»
Я учитель 7-го класса, последние двадцать лет преподаю один семестр физики и семестр химии в школе Харкера в Сан-Хосе, Калифорния. В начале своей карьеры я сделал несколько наблюдений, основанных на реакции моих студентов, когда я представил им периодическую таблицу элементов.
- Большинство элементов было обнаружено мужчинами, лишь несколько элементов — женщинами. Итак, в области химии преобладают мужчины? Такое впечатление создается в сознании молодых девушек?
- Студенты также интересовались, как они запомнят свойства элементов в каждой семье и чем одна семья отличается от другой. Есть ли увлекательный, визуально стимулирующий, творческий и увлекательный способ узнать об элементах и таблице Менделеева?
В ответ на эти наблюдения я начал приписывать каждому элементу женскую личность и называл этот элемент «она».«Я также попросил студентов изобразить элементы в их сознании, и я делал наброски характеров элементов на доске и в своей записной книжке и делился этими изображениями с учениками. Я посоветовал своим ученикам рисовать изображения концепций вместе с текстом, чтобы улучшить их понимание.
Кроме того, я придумывал истории об элементах, основываясь на их свойствах. Например, я бы сказал: «Предположим, в нашей школе действует политика, согласно которой, если у ребенка 8 конфет в верхней куртке, ребенок классный! Скажем, Натрий — ребенок в нашем кампусе с двумя конфетами во внутренней куртке, восемью в куртке поверх нее и одной во внешней куртке.Она действительно хочет быть крутой, как Неон. Что бы она сделала? Затем дети кричат: «Отдайте эту самую крайнюю конфету и будь крутым, как Неон!» Эта комбинация рассказывания историй и визуального представления элементов в виде человеческих персонажей, к которой студенты могут легко относиться, наряду с практическими занятиями вызвала энтузиазм на моих уроках химии. Большинство моих учеников ценят визуальные эффекты при обучении. Это не является большим сюрпризом, так как с самого раннего возраста они знакомятся с компьютерными играми и мультимедиа.
Когда пару лет назад моя семья подарила мне iPad на день рождения, я начал рисовать персонажей стихийных девушек в электронном виде. Поскольку большинство металлов в таблице Менделеева имеют серебристо-серый цвет, я решил придать цвет элементам, основываясь на их цвете при испытании на пламя. Чтобы персонажи нравились моим ученикам-подросткам и подросткам, я также дал девочкам-элементам модную одежду, обувь и украшения, которые подчеркнули свойства элемента.Я также проиллюстрировал их таким образом, чтобы показать их силу и уверенность.
Я создал истории элементов таким образом, чтобы казалось, что в элементах есть все человеческие эмоции. Например, Фтор жадно ищет электрон и почти захватывает собаку Атома по имени Электрон! Астатина очень расстроена тем, что первооткрыватели назвали ее в честь греческого слова «астатос», означающего «нестабильный» — кому нравится, когда его называют нестабильным?
Кроме того, рассказчик, Атом, — девушка, которая любит исследовать науку, рисовать и воображать.Маленькие дети любят заводить домашних животных. Итак, домашнее животное Атома — собака по имени Электрон, которую всегда можно найти на ее орбите! Во второй и третьей книгах, посвященных щелочноземельным металлам и галогенам, я представил пятерых друзей Атома — Иона, Экзо, Эндо, Валенсию и Моула, которые присоединяются к приключениям и знакомятся с девушками-элементами с Атомом. Ион всегда позитивен и любит играть с собакой Электроном. Экзо всегда высвобождает свою энергию, как экзотермическая реакция. Эндо всегда задумчива и сосредоточена на поглощении всей информации вокруг нее, как на эндотермической реакции.Валентность довольно социальна, как и валентные электроны, участвующие в химических реакциях. Крот получила свое имя, потому что ее старшая сестра — химик!
Больше всего приключения Атома и ее друзей стали возможны благодаря волшебной таблице Менделеева, которую Атом получает однажды летом на свой день рождения. Все, что ей нужно сделать, это нажать на элемент, и Атом и ее друзья перенесутся в окружающую среду элемента! Например, они едут на шахту в штате Юта, чтобы посетить Бериллий, в деревню Стронциан в Шотландии, чтобы посетить Стронций, и на Мертвое море в Израиле, чтобы посетить Бром.Наряду с рассказом о каждом элементе в этих книгах также есть красочный рисунок каждого элемента, словарный запас по химии, вопросы для проверки и ресурсы.
Моя будущая цель — написать и проиллюстрировать все семейства периодической таблицы. Я надеюсь, что эта серия книг вдохновит девочек и побудит их заниматься полезной и увлекательной областью химии. Кроме того, я надеюсь, что эта серия книг поможет всем ученикам увидеть, что периодическая таблица действительно волшебна и полна скрытых закономерностей, ожидающих их открытия.
Ссылки на книги Element Girls.
Всегда бесплатные электронные книги в iBook:
Водород и щелочные металлы: захватывающе и взрывоопасно! — Книга 1 серии Element Girls
Моя баскетбольная игра — Урок точности и точности
Если у вас Kindle Unlimited, следующие книги бесплатны.
Книга для девочек 2-го элемента: Щелочноземельные металлы — камни и кости! — Книга 2 серии Element Girls
Книга для девочек 3-го элемента: Галогены — О! Такой реактивный! — Книга 3 серии Element Girls
.



 Er is nog plaats voor
andere artikelen.
ander artikel.
Er is nog plaats voor
andere artikelen.
ander artikel.