Вопрос 1 § 1 Химия 9 класс Габриелян Дайте характеристику элементов
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Характеристика ХЭ на основании его положения в ПС Д. И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева.
Химические
элементы в Периодической системе – это герои, и им, как и
любым героям, нужно давать определенные характеристики. За основу их характеристики
нужно брать Периодическую систему химических элементов Д. И. Менделеева.
И. Менделеева.
Описывать химический элемент нужно будет по 7 пунктам:
1. указать Положение элемента в Периодической системе Д.И. Менделеева и строение его атома
2. характер простого вещества, т.е. металлом или неметаллом является этот химический элемент
3. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними
4. сравнить свойства простого вещества со свойствами простых веществ, образованных соседними по периоду элементами
5. определить состав высшего оксида и его характер (основный, кислотный, амфотерный)
6. состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид)
7.
для
неметаллов ещё указать состав летучего водородного соединения.
Но для этого, придется вспомнить основные закономерности изменения свойств атомов
Для атомов химических элементов в группах сверху вниз
· увеличивается заряд ядра атомов, который численно равен порядковому номеру элемента
· радиус атомов тоже увеличивается, т.к. увеличивается число энергетических уровней, а число энергетических уровней определяется номером периода
· при этом число электронов остается неизменным, электроны все дальше и дальше отдаляются от ядра, поэтому их становится легче отдать и
· окислительные – ослабевают.
· высшая степень окисления остается неизменной и равна номеру группы
·
низшая
степень окисления тоже не изменяется и равна № группы –
8.
В периодах слева направо:
· заряд ядра увеличивается
· радиус уменьшается, т.к. увеличивается число электронов на внешнем уровне, которое определяется по номеру группы и электроны крепче связаны с ядром
· число энергетических уровней остается неизменным
· восстановительные свойства ослабевают
· усиливаются окислительные свойства.
· Высшая степень окисления изменяется от +1 до +8: в первой группе ‒ +1, во второй ‒ +2, в третьей ‒ +3, в четвертой ‒ +4, в пятой ‒ +5
· низшая степень окисления изменяется от -4 до -1: в четвертой группе она равна -4, в пятой -3, в шестой -2, а в седьмой -1.
Что касается простых веществ, то металлические свойства в группах
 Неметаллические
свойства, наоборот, в группах сверху вниз ослабевают, а в
периодах слева направо усиливаются.
Неметаллические
свойства, наоборот, в группах сверху вниз ослабевают, а в
периодах слева направо усиливаются.Для соединений химических элементов характерно то, что в группах сверху вниз усиливаются основные свойства, а кислотные ослабевают. Например, в I группе, основные свойства оксида калия (K2O)выражены сильнее, чем у оксида лития (Li2O), а в IV группе у оксида кремния (IV) (SiO2)– кислотные свойства выражены сильнее, чем у

Нам пришлось много вспомнить из курса химии 8 класса, но зато теперь мы может охарактеризовать металл натрий по всем признакам.
·
· Массовое число – 23
· Значит, заряд его ядра равен +11, Z = +11 (заряд ядра атома равен порядковому номеру элемента, числу протонов и числу электронов). Поэтому в атоме 11 электронов (11 ē), а число нейтронов определяется по формуле N = A – Z, т.е. 23 – 11 = 12, значит в атоме 12 нейтронов (12n).
· Натрий находится в 3-ем периоде, у него 3 энергетических уровня, на которых располагаются все его электроны. На первом уровне 2 электрона (

Т.к. у натрия 1 электрон на внешнем уровне, то этот элемент относится к металлам. В реакциях он будет отдавать 1 электрон, проявляя восстановительные свойства, и получать степень окисления +1.
Охарактеризуем натрий как простое вещество. Натрий – это металл, для него характерна металлическая химическая связь и металлическая кристаллическая решетка
Сравним
свойства натрия со свойствами его соседей по группе: металлические
свойства натрия выражены сильнее, чем у лития, но слабее, чем
у калия, т.к. в группе сверху вниз увеличивается радиус атома и электроны
больше отдаляются от ядра и их становится легче оторвать.
Сравним свойства натрия со свойствами его соседей по периоду
Составим формулу оксида натрия, и определить его характер.
Т.к. натрий – металл I A группы, то ему соответствует оксид натрия – Na2O, значит, это основный оксид и он проявляет все свойства, характерные для этих оксидов: он реагирует с кислотами и кислотными оксидами, с водой с образованием щёлочи
Гидроксид натрия
– это NaOH, он
является щёлочью – растворимым в воде основанием. Для него будут
характерны следующие свойства: реакции с кислотами и кислотными
оксидами, реакции с солями.
Натрий – металл, но он не образует летучих водородных соединений.
Охарактеризуем фосфор.
Фосфор находится в клетке номер 15, т.е. порядковый номер его – 15. Заряд ядра его атома будет +15. Число протонов, как и число электронов равно 15:
Фосфор находится в 3 периоде, значит, у него 3 энергетических уровня, на первом уровне – 2 электрона, на втором – 8, а на третьем будет пять: (2ē, 8ē, 5ē). На внешнем энергетическом уровне у фосфора 5 электронов.
Фосфор
– это неметалл, он может быть как окислителем,
так и восстановителем.
Фосфор – неметалл. Для него характерно явление аллотропии, как и для серы. Т.е. он может образовывать несколько простых веществ, отличающихся своими свойствами. Например, белый фосфор имеет белый цвет и молекулярную кристаллическую решетку, молекула имеет вид тетраэдра, а красный фосфор представляет собой полимер, черный фосфор является полупроводником и имеет металлический блеск.
Сравнить
свойства фосфора и его соседей. Неметаллические свойства фосфора
выражены сильнее, чем у мышьяка, но слабее, чем у азота, т. к.
радиус у азота меньше, чем у фосфора. По сравнению с соседями по периоду,
свойства фосфора выражены сильнее, чем у кремния, но слабее, чем
у серы.
к.
радиус у азота меньше, чем у фосфора. По сравнению с соседями по периоду,
свойства фосфора выражены сильнее, чем у кремния, но слабее, чем
у серы.
Составим формулу оксида и гидроксида фосфора.
Высший оксид фосфора – P2O5. Это кислотный оксид, который проявляет свойства, характерные для этих оксидов: он реагирует с основными оксидами, основаниями и водой с образованием соответствующей кислоты.
Высший гидроксид фосфора – это фосфорная кислота, или ортофосфорная – H3PO4, она проявляет свойства, характерные для всех кислот: реагирует с металлами, основаниями и основными оксидами, с солями.
Фосфор – неметалл, поэтому имеет летучее водородное соединение – РН3 – фосфин.
Нам пришлось
потрудиться, но мы смогли выполнить все задание.
|
|
Ответы к упражнениям § 1. Химия 9 класс.
| |||
Ответы | § 35. Характеристика химического элемента по его положению в периодической системе — Химия, 8 класс
а) Литий
1) Название химического элемента — литий, химический знак Li, относительная атомная масса 7.
2) Атомный (порядковый) номер в периодической системе 3, элемент 2-го периода (малого), IA-группы (главной).
3) Заряд ядра атома 3+ , оно содержит 3 прогона; в ядре нуклида 37Li\mathrm{^7_3Li}37Li 4 нейтрона. -}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
-}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества N2\mathrm{N_2}N2.
5) Валентность азота в высшем оксиде равна V, так как это элемент V группы. Валентность в летучем водородном соединении равна III.
6) Формула высшего оксида — N2O5\mathrm{N_2O_5}N2O5. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, предел являет собой кислоту HNO3\mathrm{HNO_3}HNO3.
7) Формула летучего водородного соединения — Nh4\mathrm{NH_3}Nh4.
в) Алюминий
1) Название химического элемента — алюминий, химический знак Al, относительная масса 27.
2) Атомный (порядковый) номер в периодической системе 13, элемент 3-го периода (малого), IIIA-группы (главной).
3) Заряд ядра атома 13+, оно содержит 13 протонов; в ядре нуклида 1327Al  14\mathrm{_{13}^{27}Al\,\, 14}1327Al14 нейтронов. -.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
-.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества — Cl2\mathrm{Cl_2}Cl2.
5) Валентность хлора в высшем оксиде равна VII, так как это элемент VII-А группы. Валентность в летучем водородном соединении равна I.
6) Формула высшего оксида — Cl2O7\mathrm{Cl_2O_7}Cl2O7. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, представляет собой кислоту — HClO4\mathrm{HClO_4}HClO4.
7) Формула летучего водородного соединения — HCl\mathrm{HCl}HCl.
Презентация «Характеристика химического элемента» — химия, презентации
библиотека
материалов
Содержание слайдов
Номер слайда 1
Характеристика химическо элемента. Урок химии в 8 классе
Урок химии в 8 классе
Номер слайда 2
Мы изучили. Структуру периодической системы химических элементов: период, группа, подгруппа. Строение атома: ядро, протоны, нейтроны, электроны. Электронное строение атома: уровни, подуровни, орбитали, электронные и графические формулы. Периодический закон: изменение свойств атомов. Классификацию неорганических соединений и свойства.
Номер слайда 3
Структура периодической системы химических элементов: период, группа, подгруппа. Задание: Указать положение в ПСХЭ– 3 период, 2 А группа Fe. Mg– 4 период, 8 Б группа
Задание: Указать положение в ПСХЭ– 3 период, 2 А группа Fe. Mg– 4 период, 8 Б группа
Номер слайда 4
Строение атома: ядро, протоны, нейтроны, электроны. Задание: Указать состав атома Be. Cu[4p, 5n,4e][29p, 35n, 29e]
Номер слайда 5
Электронное строение атома: уровни, подуровни, орбитали, электронные и графические формулы1)2) 3)
Номер слайда 6
Периодический закон: изменение свойств атомов. Задание:1) Укажите, какой атом проявляет большие металлические свойства: Mg или Ca2) Радиус какого атома меньше: Br или I3) Заряд ядра какого атома больше: Cl или S4) Укажите число энергетических уровней в атомах: N5) Укажите число электронов на внешнем уровне атомов: Si
Задание:1) Укажите, какой атом проявляет большие металлические свойства: Mg или Ca2) Радиус какого атома меньше: Br или I3) Заряд ядра какого атома больше: Cl или S4) Укажите число энергетических уровней в атомах: N5) Укажите число электронов на внешнем уровне атомов: Si
Номер слайда 7
Периодический закон: изменение свойств атомов. Проверка:1) Ca Металлические свойства увеличиваются в группах-А с увеличением заряда ядра атома2) Br Радиус атома в группах-А уменьшается с уменьшением заряда ядра атома3) Cl Заряд ядра атома численно соответствует заряду ядра атома4) N – 7n Число нейтронов равно разности между массовым числом атома и числом протонов в ядре атома5) Si – 14е Число электронов в атоме равно числу протонов
Номер слайда 8
Классификация неорганических соединений и свойства. Свойства: — основные: Mg. O, Na2 O, KOH, Cu(OH)2, Fe(OH)2 — кислотные: CO2, SO3, HCl, HNO3 — амфотерные: Al2 O3, Zn. O, Fe(OH)3, Be(OH)2, Cr(OH)3
Свойства: — основные: Mg. O, Na2 O, KOH, Cu(OH)2, Fe(OH)2 — кислотные: CO2, SO3, HCl, HNO3 — амфотерные: Al2 O3, Zn. O, Fe(OH)3, Be(OH)2, Cr(OH)3
Номер слайда 9
План характеристики химического элемента1) Положение в периодической системе2) Строение атома3) Характер простого вещества (металл, неметалл)4) Значения валентности, максимальной и минимальной степени окисления5) Формула высшего оксида и гидроксида, характер свойств.6) Формула летучего водородного соединения (для неметаллов)
Номер слайда 10
Пример: натрий. Положение в периодической системе, состав атома+11 Na Ar(Na)=23 Na – 3 период, 1 А группа. Na – [11р, 12n, 11e]
Положение в периодической системе, состав атома+11 Na Ar(Na)=23 Na – 3 период, 1 А группа. Na – [11р, 12n, 11e]
Номер слайда 11
Строение атома. Na+11)))281 Электронная формула1s22s22p63s1 Графическая формула атома
Номер слайда 12
Характер простого вещества Na — металл. Формула высшего оксида и гидроксида, характер свойств. Na2 O, Na. OH – основные свойства. Значения валентности, максимальной и минимальной степени окисления Na (I), Na (+1)
Формула высшего оксида и гидроксида, характер свойств. Na2 O, Na. OH – основные свойства. Значения валентности, максимальной и минимальной степени окисления Na (I), Na (+1)
Номер слайда 13
Домашнее задание: Учебник «Химия-8», изд. «Просвещение», автор Габриелян О. С.,параграф 33 изучить составить характеристику химических элементов алюминий, сера — по плану (см. презентацию).
9 класс Контрольная работа «Общая характеристика химических элементов» 1 вариант |
1. (1 балл) Электронная формула Mg: 1) 1s22s22p63s0 2) 1s22s22p63s1 3) 1s22s22p63s2 4) 1s22s22p63s3 |
2. 1) Cu 2) Na 3) Ar 4) Li |
3. (1 балл) Атом изотопа углерода 8O содержит: 1) 8ē во внешнем энергетическом слое 2) 8р+ в ядре 3) 3ē во внешнем энергетическом слое 4) 8р+ в ядре |
4. (1 балл) Число протонов и электронов у частицы K+ соответственно равно: 1) 19,18 2) 39,38 3) 20,19 4) 19,19 |
5. (1 балл) Число ē в ионе S2- равно: 1) 32 2) 6 3) 8 4) 18 |
6. (1 балл) Элемент главной подгруппы — это: 1) Sc 2) As 3) Ni 4) Fe |
7. 1) RO3 2) R2O3 3) R2O5 4) RO2 |
8. (1 балл) Характер высшего гидроксида кальция: 1) кислотный 2) основный 3) амфотерный 4) безразличный |
9. (1 балл) Наиболее ярко неметаллические свойства выражены у элемента: 1) VII группы, побочной подгруппы, 4 периода 2) V группы, главной подгруппы, 4 периода 3) VII группы, главной подгруппы, 2 периода 4) VII группы, главной подгруппы, 4 периода |
10. (1 балл) Ряд в котором элементы расположены в порядке возрастания восстановительных свойств — это: 1) Na, Mg, Al 2) Ca, Mg, Be 3) Cs, Rb, K 4) Li, Na, K |
11. 1) Al(OH)3 2) NaOH 3) H2SiO3 4) Ca(OH)2 |
12. (1 балл) Реакции разложения соответствует уравнение: 1) 2С2Н5 + 5О2 = 2Н2О + 4СО2 2) 2KClO3 = 2KCl + 3O2 3) CaO + Н2О = Ca(OH)2 4) CaO + НCl = CaCl2 + Н2О |
13. (1 балл) Реакция NaOH + HCl = NaCl + H2O: 1) ОВР 2) соединения 3) замещения 4) обмена |
14. (1 балл) Сокращенное ионное уравнение Н+ + OН— = Н2O↓ соответствует взаимодействию: 1) гидроксида меди (II) и раствора серной кислоты 2) гидроксида натрия и азотной кислоты 3) оксида меди (II) и соляной кислоты 4) цинка и раствора серной кислоты |
15. 1) природа реагирующих веществ 2) температура 3) концентрация реагирующих веществ 4) тип химической реакции |
16. (3 балла) Установите соответствие (ответ приведите в виде сочетания букв и цифр): ПОРЯДКОВЫЙ НОМЕР Х.Э. ФОРМУЛА ГИДРОКСИДА ХАРАКТЕР ГИДРОКСИДА 1) 7 А) Э(ОН)4 I) основание 2) 20 Б) Э(ОН)3 II) кислота 3) 3 В) Н2ЭО4 III) щелочь 4) 16 Г) ЭОН IV) амфотерный гидроксид Д) НЭО3 V) не проявляет кислотно- Е) Э(ОН)2 основных свойст |
17. |
18. (3 балла) Составьте уравнение реакции по схеме Ba2+ + SO42- = BaSO4 ↓. Определите тип химической реакции и назовите каждое вещество. |
19. (3 балла) По схеме превращений BaO → Ba(OH)2 → BaCO3 → BaCl2 составьте уравнения реакций в молекулярном виде. Для превращения 3 запишите полное и сокращенное ионные уравнения. |
20. (4 балла) Рассчитайте массу оксида кальция, который образуется при разложении 200 г карбоната кальция. |
9 класс Контрольная работа «Общая характеристика химических элементов» 2 вариант |
1. 1) 1s22s22p63s0 2) 1s22s22p63s1 3) 1s22s22p63s2 4) 1s22s22p63s3 |
2. (1 балл) Элемент, у которого распределение электронов по энергетическим уровням 2ē, 8ē, 7ē : 1) Cl 2) Na 3) Ar 4) Li |
3. (1 балл) Атому Ar соответствует электронная конфигурация частицы: 1) Са0 2) К+ 3) Сl+ 4) Sc0 |
4. (1 балл) Число протонов и электронов на внешнем энергетическом уровне у частицы Р+3 соответственно равно: 1) 15,12 2) 15,5 3) 15,8 4) 15,2 |
5. 1) Na+ и Cl— 2) Mg+2 и F— 3) P0 и S-2 4) O-2 и P-3 |
6. (1 балл) Элемент побочной подгруппы, в атоме которого 5 энергетических уровней, — это: 1) Мo 2) Zn 3) In 4) Sn |
7. (1 балл) Формула высшего оксида хрома отвечает общей формуле: 1) RO3 2) R2O3 3) R2O5 4) RO |
8. (1 балл) Характер высшего гидроксида мышьяка: 1) кислотный 2) основный 3) амфотерный 4) безразличный |
9. (1 балл) Наиболее ярко окислительные свойства выражены у элемента: 1) VI группы, главной подгруппы, 4 периода 2) VI группы, главной подгруппы, 2 периода 3) V группы, главной подгруппы, 4 периода 4) VI группы, главной подгруппы, 5 периода |
10. 1) LiOH, Be(OH)2, H3BO3 2) Ba(OH)2, Mg(OH)2, Be(OH)2 3) KOH, RbOH, CsOH 4) Al(OH)3, H3BO3, Ga(OH)3 |
11. (1 балл) Амфотерный оксид — это: 1) Al2O3 2) Na2O 3) SiO2 4) Cl2O7 |
12. (1 балл) Реакции обмена соответствует уравнение: 1) 2С2Н5 + 5О2 = 2Н2О + 4СО2 2) 2KClO3 = 2KCl + 3O2 3) CaO + Н2О = Ca(OH)2 4) CaO + НCl = CaCl2 + Н2О |
13. 1) ОВР 2) соединения 3) обмена 4) разложения |
14. (1 балл) Сокращенное ионное уравнение Cu+2 + 2OН— = Cu(OH)2↓ соответствует взаимодействию: 1) гидроксида меди (II) и соляной кислоты 2) раствора нитрата меди (II) и гидроксида железа (II) 3) оксида меди (II) и воды 4) раствора хлорида меди (II) и гидроксида калия |
15. (1 балл) Фактор, не влияющий на скорость химической реакции: 1) природа реагирующих веществ 2) температура 3) концентрация реагирующих веществ 4) тип химической реакции |
16. (3 балла) Установите соответствие (ответ приведите в виде сочетания букв и цифр): ПОРЯДКОВЫЙ
НОМЕР Х. 1) 35 А) Э(ОН)4 I) основание 2) 33 Б) Э(ОН)3 II) кислота 3) 11 В) Н3ЭО4 III) щелочь 4) 15 Г) ЭОН IV) амфотерный гидроксид Д) НЭО4 V) не проявляет кислотно- Е) Э(ОН)2 основных свойст |
17. |
18. (3 балла) Составьте уравнение реакции по схеме Ag+ + Cl— = AgCl ↓. Определите тип химической реакции и назовите каждое вещество. |
19. (3 балла) По схеме превращений C → CO2 → Na2CO3 → CaCO3 составьте уравнения реакций в молекулярном виде. Для превращения 3 запишите полное и сокращенное ионные уравнения. |
20. (4 балла) Рассчитайте массу оксида меди (II), который образуется при взаимодействии меди, взятой в достаточном количестве, с 11,2 л кислорода (н.у.). |
9 класс Контрольная работа «Общая характеристика химических элементов» 3 вариант |
1. 1) 1s22s22p63s0 2) 1s22s22p63s1 3) 1s22s22p63s2 4) 1s22s22p63s3 |
2. (1 балл) Элемент, у которого распределение электронов по энергетическим уровням 2ē, 8ē, 8ē, 2ē : 1) Ca 2) Na 3) K 4) Li |
3. (1 балл) Атом изотопа углерода 12С содержит: 1) 12ē во внешнем энергетическом слое 2) 12р+ в ядре 3) 6ē во внешнем энергетическом слое 4) 6р+ в ядре |
4. (1 балл) Число протонов и электронов частицы SO42- соответственно равно: 1) 48,48 2) 96,98 3) 48,50 4) 46,48 |
5. 1) Na+ и Cl— 2) Mg+2 и F— 3) P0 и S-2 4) O-2 и P-3 |
6. (1 балл) Элемент побочной подгруппы — это: 1) Cr 2) Br 3) Ge 4) S |
7. (1 балл) Формула высшего оксида хрома отвечает общей формуле: 1) RO3 2) R2O3 3) R2O5 4) RO |
8. (1 балл) Характер высшего гидроксида фосфора: 1) кислотный 2) основный 3) амфотерный 4) безразличный |
9. (1 балл) Наиболее ярко металлические свойства выражены у элемента: 1) II группы, побочной подгруппы, 5 периода 2) II группы, главной подгруппы, 2 периода 3) I группы, главной подгруппы, 2 периода 4) I группы, главной подгруппы, 3 периода |
10. 1) I, F, Cl, Br 2) Cl, I, Br, F 3) Si, P, S, Cl 4) F, Cl, Br, I |
11. (1 балл) Амфотерный оксид — это: 1) Al2O3 2) Na2O 3) SiO2 4) Cl2O7 |
12. (1 балл) Реакции обмена соответствует уравнение: 1) 2С2Н5 + 5О2 = 2Н2О + 4СО2 2) 2KClO3 = 2KCl + 3O2 3) CaO + Н2О = Ca(OH)2 4) CaO + НCl = CaCl2 + Н2О |
13. (1 балл) Реакция CaO + Н2О = Ca(OH)2: 1) ОВР 2) соединения 3) обмена 4) разложения |
14. 1) бария и раствора серной кислоты 2) оксида бария с соляной кислотой 3) оксида бария и раствора серной кислоты 4) хлорида бария и раствора серной кислоты |
15. (1 балл) Фактор, не влияющий на скорость химической реакции: 1) природа реагирующих веществ 2) температура 3) концентрация реагирующих веществ 4) тип химической реакции |
16. (3 балла) Установите соответствие (ответ приведите в виде сочетания букв и цифр):: ПОРЯДКОВЫЙ НОМЕР Х.Э. ФОРМУЛА ГИДРОКСИДА ХАРАКТЕР ГИДРОКСИДА 1) 6 А) Э(ОН)4 I) основание 2) 15 Б) Э(ОН)3 II) кислота 3) 12 В) Н3ЭО4 III) щелоч 4) 13 Г) ЭОН IV) амфотерный гидроксид Д) Н2ЭО3 V) не проявляет кислотно- Е) Э(ОН)2 основных свойст |
17. |
18. (3 балла) Составьте уравнение реакции по схеме Ag+ + Cl— = AgCl ↓. Определите тип химической реакции и назовите каждое вещество. |
19. (3 балла) По схеме превращений SO2 → SO3 → H2SO4 → Na2SO4 составьте уравнения реакций в молекулярном виде. Для превращения 3 запишите полное и сокращенное ионные уравнения. |
20. (4 балла) Рассчитайте объем кислорода (н.у.) необходимого для полного сгорания 1,2 г магния. |
Урок «Характеристика хімічних елементів № 1-20 за їхнім місцем у періодичній системі та будовою атома»
ТЕМА 1. ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ. БУДОВА АТОМА (ІІ частина)
ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ. БУДОВА АТОМА (ІІ частина)
Урок №13
Тема уроку: Характеристика хімічних елементів № 1-20 за їхнім місцем у періодичній системі та будовою атома.
Мета уроку:
Формування ключових та предметних компетентностей:
— використовувати в мовленні хімічні терміни, поняття, символи, сучасну українську наукову термінологію і номенклатуру;
— формулювати відповідь на поставлене запитання;
— обговорювати й розв’язувати проблеми природничо-наукового характеру, що стосуються хімічних елементів;
— застосовувати математичні методи для розв‘язування завдань хімічного характеру;
— брати участь в обговоренні питань щодо періодичної системи хімічних елементів та будови їх атомів, чітко, зрозуміло й образно висловлювати свою думку;
— використовувати сучасні пристрої для добору хімічної інформації, її оброблення, збереження і передавання;
— виробляти власні цінності, ставити мету, діяти задля досягнення її, спираючись на хімічні знання;
— виявляти ініціативність до роботи в команді, генерувати ідеї, брати відповідальність за прийняття рішень;
— працювати в групі зацікавлених людей, співпрацювати з іншими группами.
Хід уроку
Організація класу
Доброго дня! Наш урок ми почнемо з посмішки. Усміхніться один одному, подумки побажайте успіхів на цілий день. Для того, щоб впоратися на уроці з завданнями, будьте старанними та уважними. А девіз нашого уроку такий:
Не просто слухати, а чути.
Не просто дивитися, а бачити.
Не просто відповідати, а міркувати.
Дружно і плідно працювати.
Фаза актуалiзацiї
Метод «З-Х-Д» «Знаю-хочу знати-дiзнався»
— періодична система хімічних елементів Д.І.Менделєєва, підручник з хімії для 8 класу
— від 3 до 10 осіб
— 10-12 хвилин
— учням задаються питання для самостійного осмислення за обраною темою. Відповіді записуються кожним учнем в колонки. Остання колонка заповнюється вже після етапу – осмислення.
Відповіді записуються кожним учнем в колонки. Остання колонка заповнюється вже після етапу – осмислення.
Знаю | Хочу знати | Дізнався |
Структура періодичної системи хімічних елементів Д.І.Менделєєва:
|
Як згідно із структурою ПС та будовою атома охарактеризувати той чи інший хімічний елемент | Зв’язок між структурою ПС та будовою атома хімічного елемента (заповняється вкінці уроку) |
Будова атома хімічного елемента:
|
Метод «Асоцiативний кущ»
— асоціація спонукає до вільного і відкритого мислення.
— дошка, крейда, також можна – ватман та кольорові маркери
— від 3 до 30 осіб
— 5-7 хвилин
— вислухати якомога бiльше iдей. Записати в центрi ключове слово, чи фразу. Записувати всi cлова чи фрази учнiв. Ставити знаки питання над сумнiвними думками, але не завперечувати.
Результатом роботи мають бути пункти Плану-характеристики хімічного елемента
Вправа «Встав пропущене»
— така вправа зацікавить всіх та дає можливість, працюючи з періодичною системою хімічних елементів, охарактеризувати будь-який елемент за вказаними критеріями.
— періодична система хімічних елементів Д.І.Менделєєва, підручник з хімії для 8 класу
— від 2 і більше
— до 10 хвилин.
— можна працювати індивідуально, в парах та використати при цьому вправу «Хто швидше?»
№з/п | Назва хімічного елемента | Порядковий номер | Період | Група | Електронна формула |
1 |
| 4 |
|
|
|
2 |
|
|
|
| 1s2s22р3 |
3 |
|
| 2 | 4 |
|
4 |
|
|
|
| 1s22s22p63s23p6 |
Отже, розминка пройшла чудово, ми з вами достатньо озброєні знаннями про періодичну систему хімічних елементів, про будову атома, тому готові характеризувати хімічні елементи.
Перед вами дерево (плакат з намальованим деревом – прикріплений на дошці), а ваші сподівання щодо уроку хочеться порівняти з плодами. Тільки завдяки вашій наполегливій праці ми побачимо, чи перетворяться вони наприкінці уроку на плоди ваших сподівань (учні отримують різнокольорові стікери у вигляді яблук: червоні – матеріал уроку засвоїв, жовті – зрозумів не до кінця, зелені – не засвоїв)
Фаза побудови знань
Положення елемента в періодичній системі може багато розповісти про цей елемент, його сполуки, їхні властивості. Д. І. Менделєєв помітив цю закономірність і навіть зміг передбачити властивості ще не відкритих на той час хімічних елементів. Знання закономірностей зміни будови й властивостей атомів дозволяють передбачати будову та властивості елементів, їхніх сполук. Тому кількість відкритих елементів постійно збільшується.
Скористаємося алгоритмом, щоб охарактеризувати будь-який хімічний елемент за положенням у періодичній системі. (Кожен учень отримує алгоритм складання характеристики елемента, що спільно виробили на попередньому етапі уроку для роботи) .
(Кожен учень отримує алгоритм складання характеристики елемента, що спільно виробили на попередньому етапі уроку для роботи) .
Бланк характеристики елемента за положенням у періодичній системі
1. Символ, назва хімічного елемента |
|
2. Порядковий номер |
|
3. Відносна атомна маса |
|
4. Заряд ядра атома |
|
5.Загальна кількість електронів, протонів, нейтронів |
|
6. Номер періоду (великий, малий) |
|
7. Кількість електронних рівнів |
|
8. Номер групи, головна чи побічна підгрупа |
|
9. Кількість валентних електронів |
|
10. |
|
11. Електронна формула |
|
12. Електронно-графічна схема будови атома |
|
13. Формула простої речовини, метал чи неметал |
|
14. Формула вищого оксиду, його характеристика |
|
15. Формула леткої сполуки з Гідрогеном, якщо є |
|
16. Порівняльна характеристика властивостей з елементами в підгрупі |
|
17. Порівняльна характеристика властивостей з елементами в періоді |
|
Вправа «Карусель»
— використовуємо для збирання інформації про характеристику того чи іншого хімічного елемента. Учні утворюють два кола – внутрішнє і зовнішнє, сидячи обличчям один до одного. Внутрішнє коло – нерухоме, зовнішнє – за сигналом учителя всі його учасники пересуваються на один стілець вправо. Потрібно учаснику із зовнішнього кола пройти все коло, даючи відповідь на поставлені запитання учасникам внутрішнього кола (запитаннями є пункти характеристики елемента за положенням у періодичній системі). Потім учасники міняються місцями.
Внутрішнє коло – нерухоме, зовнішнє – за сигналом учителя всі його учасники пересуваються на один стілець вправо. Потрібно учаснику із зовнішнього кола пройти все коло, даючи відповідь на поставлені запитання учасникам внутрішнього кола (запитаннями є пункти характеристики елемента за положенням у періодичній системі). Потім учасники міняються місцями.
Завдання – охарактеризувати елементи за їх місцем у періодичній системі та будовою атома: Карбон, Натрій).
Вправа «Діаграма Венна»
— обираються для порівняння два елементи, наприклад, Магній і Сульфур. Три команди знаходять: 1)відмінне у будові атома Магнію, 2) відмінне у будові атома Сульфуру, 3) спільне у будові атомів обох елементів. (Спільне зазначається в полі перетину). При цьому заповнюється діаграма.
Вправа «Навчаючись – учу»
— в групі з 4 осіб обирається учень, що може пояснити, як розв’язати задачу. Після цього – кожен індивідуально її розв’язує. Правильний розв’язок демонструється на екрані.
Після цього – кожен індивідуально її розв’язує. Правильний розв’язок демонструється на екрані.
Формула вищого оксиду хімічного елемента Е2О5. Відносна молекулярна маса його леткої сполуки з Гідрогеном – 125. Визначте елемент.
Фаза консолiдацiї
Прийом «Зведена таблиця»
— характеристики для порівняння елементів учні мають назвати самі, шляхом спільної роботи. Спершу всі пропозиції характеристик записуються на дошку та узагальнюються. Потім учні мають вибрати найважливіші – аргументувати при цьому, чому саме ці, а не інші критерії важливі для порівняння. Далі дані з опрацьованого матеріалу вносяться самостійно кожним у таблицю.
Атом Літію | Характеристики для порівняння | Атом Флуору |
| Період |
|
| Група |
|
| Радіус атома |
|
| Кількість електронів на зовнішньому рівні |
|
|
|
|
|
|
|
Вправа «Біла ворона»
— у запропонованому переліку знайдіть зайвого. Поясніть свій вибір.
Поясніть свій вибір.
— Rh4, RH, RO3, h3R;
— Mg, Al, Si, C;
— N, S, P, As.
Вправа «Встанови відповідність»
— встанови відповідність між атомом хімічного елемента та кількістю електронів на його електронних шарах
1) N | а) 2, 8, 1 |
2) Cl | б) 2, 8, 5 |
3) Р | в) 2, 5 |
4) Li | г) 2, 8, 7 |
| Д) 2, 1 |
Метод «Сінквейн»
— до слова «характеристика» учням у групах пропонується скласти сенкан — вірш, що складається з п’яти рядків. Слово ”сенкан” походить від французького слова ”п’ять” і позначає вірш у п’ять рядків.
Слово ”сенкан” походить від французького слова ”п’ять” і позначає вірш у п’ять рядків.
- Перший рядок має містити слово, яке позначає тему (звичайно, це іменник).
- Другий рядок – це опис теми, який складається з двох слів (два прикметники)
- Третій рядок називає дію, пов’язану з темою, і складається з трьох слів (звичайно, це дієслова).
- Четвертий рядок є фразою, яка складається з чотирьох слів і висловлює ставлення до теми, почуття з приводу обговорюваного.
- Останній рядок складається з одного слова — синоніма до першого слова, в ньому висловлюється сутність теми, ніби робиться підсумок.
Наприклад:
Характеристика
Типова, своєрідна
Дає, допомагає, розповідає
Містить інформацію про елемент
Риса
Вправа «Дерево сподівань»
— фронтальна робота для всього класу.
— 2-3 хвилини
— кожен із учнів кольоровий стікер у формі плоду яблука кріпить до дерева сподівань, висловлюючи свої міркування про урок. Учитель підводить підсумки роботи учнів на уроці.
Давайте повернемось до плодів наших сподівань, про які йшла мова на початку уроку.
Домашнє завдання
1) вивчити відповідний § підручника;
2) підготовка до представлення та захисту проектів.
7.1 Элементы и соединения | Соединения
Элементы и соединения
- соединение
- кристаллическая решетка
- элемент
- двухатомный
- молекула
Этот первый раздел представляет собой пересмотр того, что учащиеся должны были изучить в предыдущих классах. Он занимает несколько страниц, но в основном представляет собой исправленную версию и был включен в качестве справочного материала для учащихся.В зависимости от вашего класса вам нужно будет решить, сколько времени вам нужно посвятить пересмотру этих тем, или же вы заставляете учащихся перечитывать содержание и выполнять задание в конце.
Он занимает несколько страниц, но в основном представляет собой исправленную версию и был включен в качестве справочного материала для учащихся.В зависимости от вашего класса вам нужно будет решить, сколько времени вам нужно посвятить пересмотру этих тем, или же вы заставляете учащихся перечитывать содержание и выполнять задание в конце.
Можете ли вы вспомнить, что узнали о соединениях в гр. 8 Материя и материалы? Мы начнем эту главу с обобщения и пересмотра некоторых основных идей о элементах и соединениях из Gr. 7 и 8. Это должно помочь нам связать новые идеи в этой главе с тем, что мы уже знаем.
Частицы, входящие в состав соединений
Учащиеся должны знать, что соединения могут иметь два типа структур, а именно молекулы и решетки:
- Когда соединение полностью состоит из неметаллов (например, CO 2 , H 2 O или NH 3 ), наименьшей единицей этого соединения будет молекула.

- Однако, когда соединение состоит из металла и неметалла (например, NaCl или CuO), тип связи в соединении отличается.Во время связывания атомы металла и неметалла обмениваются электронами с образованием ионов. Из-за притяжения противоположных зарядов эти ионы объединяются в огромные трехмерные кристаллы или решетки, а не образуют простые молекулы.
В этот раздел мы включили краткое упоминание кристаллических решеток, чтобы впоследствии избежать неправильного представления о том, что NaCl и другие ионные соединения состоят из молекул. Учащиеся должны знать, что NaCl, например, состоит из регулярного расположения атомов натрия и хлорида, объединенных в соотношении 1: 1, упакованных в кристаллическую структуру.
Частицы соединения всегда состоят из двух или более атомов. В области физических наук Gr. 10 вы узнаете, что эти атомы объединяются по-разному. В некоторых случаях они могут образовывать молекул . Возможно, вы помните, что «молекула» — это слово, которое ученые используют для обозначения кластера атомов, которые соединяются определенным образом. Другие соединения состоят из атомов, которые расположены в правильном порядке, называемом кристаллической решеткой .
Возможно, вы помните, что «молекула» — это слово, которое ученые используют для обозначения кластера атомов, которые соединяются определенным образом. Другие соединения состоят из атомов, которые расположены в правильном порядке, называемом кристаллической решеткой .
Молекулы соединения всегда состоят из двух или более атомов разных типов, как молекулы воды на следующей диаграмме.
Молекулы воды.Соединения, образующие кристаллическую решетку, состоят из множества атомов, но они всегда соединяются в фиксированном соотношении. Например, в хлориде натрия (поваренная соль) на каждый атом натрия в кристалле приходится один атом хлора. Самая маленькая «единица», которая повторяется в кристалле, состоит из одного Na и одного Cl. Формула NaCl представляет собой одну «формульную единицу» NaCl.
Кристаллическая решетка хлорида натрия, состоящая из атомов натрия (фиолетовый) и хлорида (зеленый) в фиксированном соотношении.
Из приведенной выше диаграммы молекул воды и решетки хлорида натрия мы видим, что соединение — это не просто смесь элементов. Смесь элементов водорода и кислорода будет выглядеть так:
Смесь молекул водорода и кислорода.Почему на диаграмме выше атомы водорода и кислорода спарены? Прежде чем мы ответим на этот вопрос, сделаем важное напоминание: элементы состоят только из одного вида атомов.
Некоторые элементы существуют в виде двухатомных молекул, например, на диаграмме справа внизу и молекулы водорода и кислорода на диаграмме «смеси» выше. Наиболее важными примерами двухатомных молекул являются H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 и I 2 . Двухатомный означает «состоящий из двух атомов ».
Некоторые элементы существуют в виде двухатомных молекул.
Вы видите, что все молекулы воды на диаграмме выше идентичны? Это подводит нас к следующему вопросу о соединениях.
Атомы в молекулах и решетках объединены в фиксированном соотношении
Например, в воде один атом кислорода (O) соединился с двумя атомами водорода (H). В этом отношении все молекулы воды абсолютно одинаковы.
Все молекулы воды состоят из одного атома O и двух атомов H, что придает воде ее особые свойства.Любая другая комбинация атомов водорода и кислорода НЕ была бы водой. Например, перекись водорода состоит из тех же элементов, что и вода (водород и кислород), но соотношение другое: два атома кислорода объединились с двумя атомами водорода.
Молекула перекиси водорода состоит из двух атомов O и двух атомов H. Это придает воде другие свойства перекиси водорода. В кристаллической решетке черного оксида железа на каждый атом кислорода (O) приходится один атом железа (Fe).
Следующий важный момент, касающийся соединений, заключается в следующем.
Каждое соединение имеет уникальное название и формулу
Вода может быть представлена формулой H 2 O. Формула говорит нам, что два атома водорода (H) соединены с одним атомом кислорода (O) в молекуле воды.
Какая формула перекиси водорода? Вы можете вспомнить название соединения с формулой CO 2 ? Не забывайте делать заметки, когда обсуждаете вещи в классе!
Формула перекиси водорода H 2 O 2 .Формула CO 2 — диоксид углерода.
Какая формула представляет одну «формульную единицу» типа оксида железа на предыдущей диаграмме?
Атомы в соединении удерживаются вместе химическими связями
- химическая связь
- реагент
- товар
- химическая формула
Что удерживает вместе кластеры атомов, которые мы называем молекулами? Когда атомы объединяются в молекулы, они делают это потому, что испытывают силу притяжения между собой. Силы, удерживающие атомы вместе, называются химическими связями .
Силы, удерживающие атомы вместе, называются химическими связями .
Далее нам нужно напомнить, откуда берутся соединения.
Соединения образуются в ходе химических реакций
Во всех химических реакциях атомы в молекулах перестраиваются, образуя новые молекулы. Вот как образуются соединения: атомы в одном наборе соединений разделяются по мере разрыва связей между ними, и они перестраиваются в новые группы по мере образования новых связей.Когда это происходит, мы говорим, что произошла химическая реакция. Взгляните на следующую иллюстрацию.
В приведенном выше примере элементы слева от стрелки называются реагентами . Они перестроились, чтобы образовать новое соединение. Он называется продуктом и показан справа от стрелки.
Можете ли вы описать, что произошло с атомами и связями в этой реакции? Обсудите, какая связь разорвалась, какие образовались и как атомы перестроились во время реакции.
Обсудите это со своим классом. Поощряйте их делать заметки во время обсуждения.
- Связь между двумя красными атомами разорвана.
- Черный атом двигался между двумя красными атомами.
- Образовались две новые связи: между черным атомом и каждым из двух красных атомов.
Последний аспект соединений, который мы узнали в Гр.8 заключается в том, что каждое соединение может быть представлено уникальной химической формулой:
Соединение имеет химическую формулу
Сравните формулу воды с диаграммой молекулы воды, которую вы видели ранее. Вы можете установить связь?
Химическая формула соединения одинакова для всех молекул этого соединения. Когда мы читаем формулу, нижние индексы говорят нам, сколько атомов определенного элемента находится в одной молекуле этого соединения:
Когда мы читаем формулу, нижние индексы говорят нам, сколько атомов определенного элемента находится в одной молекуле этого соединения:
Когда мы пишем H 2 O, мы на самом деле имеем в виду H 2 O 1 .Согласно соглашению, мы не используем 1 в качестве индекса в формулах, поэтому первая формула является правильной. Это означает, что на 1 кислород приходится 2 атома водорода. Это тоже соотношение, которое можно записать как 2: 1. В следующем упражнении мы попрактикуемся в написании формул.
ИНСТРУКЦИЯ:
- В следующей таблице названия некоторых чистых веществ приведены в левом столбце.В среднем столбце указано, из чего состоит одна молекула каждого соединения.
- Вы должны использовать эту информацию, чтобы написать формулу каждого соединения в последнем столбце справа.

- Первая строка заполнена за вас, так что у вас есть пример:
- В графе 1 указано название: вода
- Колонка 2: одна молекула воды содержит два атома H и один атом O.
- Столбец 3: Из информации во втором столбце мы можем записать формулу: H 2 O
Название вещества | Из чего он сделан? | Химическая формула |
вода | 2 атома H и 1 атом O | H 2 O |
двуокись углерода | 1 атом C и 2 атома O | |
аммиак | 1 атом N и 3 атома H | |
метан | 1 атом C и 4 атома H |
Название вещества | Из чего он сделан? | Химическая формула |
вода | 2 атома H и 1 атом O | H 2 O |
двуокись углерода | 1 атом C и 2 атома O | CO 2 |
аммиак | 1 атом N и 3 атома H | NH 3 |
метан | 1 атом C и 4 атома H | CH 4 |
ВОПРОСЫ:
Что скрепляет атомы в соединении?
Химическая связь удерживает атомы вместе.
На следующей диаграмме показано, как углерод и кислород реагируют с образованием диоксида углерода.
Каковы реагенты и каков продукт в этой реакции? Напишите эти имена на диаграмме.
реагентами являются углерод (серый кружок) и кислород (красные кружки), а продуктом является диоксид углерода.
Почему кислород представлен двумя кружками вместе?
Каждый из двух кружков представляет атом кислорода, поскольку кислород представляет собой двухатомную молекулу, что означает, что он существует в виде двух атомов кислорода, связанных вместе в двухатомные молекулы.
Оксид магния имеет формулу MgO.что это соотношение говорит нам об атомах в соединении?
Это означает, что на каждый 1 атом магния приходится 1 атом кислорода, соединенный с ним химической связью.
Теперь, когда мы освежили нашу память, мы собираемся вернуться к таблице, которую ученые используют для систематизации своих знаний об элементах.Вы можете вспомнить, как это называется?
Периодическая таблица
Первая часть этого раздела — это пересмотр того, что учащиеся должны были изучить в предыдущих классах.
- Периодическая таблица
- символ (или символ элемента)
- атомный номер
- уникальный
Мы впервые столкнулись с Периодической таблицей в Gr.7. Вот краткое изложение того, что мы уже знаем:
- Все известные элементы можно расположить в таблице, называемой Периодической таблицей.
- Открытия многих ученых на протяжении многих лет внесли свой вклад в информацию в Периодической таблице, но версия таблицы, которую мы используем сегодня, была первоначально предложена Дмитрием Менделеевым в 1800-х годах.
- Каждый элемент занимает фиксированную позицию в Периодической таблице. Элементы расположены в порядке возрастания атомного номера, при этом самый легкий элемент (водород: H) находится в верхнем левом углу.

- Положение элемента в Периодической таблице указывает нам, является ли он металлом, неметаллом или полуметаллом.
- металлов найдено в левой части таблицы;
- неметаллов находятся в дальнем правом углу таблицы; и
- полуметаллов находятся в области между металлами и неметаллами.
- Элемент можно идентифицировать 3 различными способами:
- каждый элемент имеет уникальное имя;
- каждый элемент имеет уникальный химический символ; и
- каждый элемент имеет уникальный атомный номер.
- Металлы обычно блестящие, пластичные и податливые. Большинство из них являются твердыми веществами при комнатной температуре и имеют высокие температуры плавления и кипения.
- Неметаллы могут быть твердыми, жидкими или газами при комнатной температуре.
 У них есть множество свойств, которые обычно зависят от штата, в котором они находятся.
У них есть множество свойств, которые обычно зависят от штата, в котором они находятся. - Все полуметаллы являются твердыми телами при комнатной температуре. Обычно они обладают сочетанием металлических и неметаллических свойств.
Мы узнали о происхождении Периодической таблицы в Gr. 7. Давайте также пересмотрим то, что мы узнали тогда, чтобы у нас была прочная основа для нашего нового обучения.
Периодическая таблица — это в основном таблица, которую ученые используют для перечисления известных элементов. Таблица состоит из отдельных плиток для каждого из элементов. Какую информацию мы можем найти в Периодической таблице? Об этом весь следующий раздел.
Какую информацию мы можем найти в Периодической таблице?
Информация, которая чаще всего появляется на каждой плитке Периодической таблицы, следующая:
- Химический знак; и
- Атомный номер
На схеме ниже показан пример одной из плиток Периодической таблицы. Можете ли вы определить элемент, который он представляет? Сколько протонов в его атомах?
Можете ли вы определить элемент, который он представляет? Сколько протонов в его атомах?
C — углерод. В нем 6 протонов (обозначено атомным номером).
Пример одной из плиток Периодической таблицыАтомный номер (Z) обычно пишется вверху каждой плитки для элемента в Периодической таблице, а большее атомное массовое число (A) пишется внизу каждой плитки.
На внутренней стороне обложки ваших рабочих тетрадей напечатана большая версия Периодической таблицы, которую вы можете легко найти.
Существуют разные версии Периодической таблицы, каждая из которых может содержать различную информацию об элементах. Можете ли вы определить, какая информация предоставляется об элементах в следующей таблице?
Таблица содержит только химический символ и атомный номер каждого элемента.
В следующей периодической таблице показаны только символы элементов.
Другие версии Периодической таблицы могут содержать дополнительную информацию, например:
- Имя элемента; и / или
- Атомная масса, обычно указываемая внизу каждой плитки для элемента.
На схемах ниже показаны примеры того, как иногда представляется эта информация.
Эта плитка показывает информацию об элементе медь.Интерактивный сайт Периодической таблицы Менделеева. Щелкните каждый элемент, чтобы просмотреть много интересной информации о нем http://www.chemicool.com/
Как элементы расположены в Периодической таблице?
- металл
- неметаллический
- полуметалл
- группа
- период
- электронов
- нейтронов
- протонов
Мы узнали, что элементы Периодической таблицы расположены очень специфическим образом.
Элементы расположены в порядке возрастания атомного номера. Элемент с наименьшим атомным номером — водород (H: атомный номер = 1) находится в верхнем левом углу таблицы. Элементы с наибольшим атомным номером находятся внизу таблицы.
Элементы также расположены в областях, и эти области часто представлены разными цветами. Следующая таблица Менделеева показывает нам, где можно найти металлы, неметаллы и полуметаллы.
Суммируем:
- Металлы находятся слева от Периодической таблицы, охватывая почти всю таблицу, за исключением правого верхнего угла. В таблице выше металлы синие.
- Неметаллы находятся в относительно небольшой треугольной области в верхней правой части стола. В приведенной выше таблице неметаллы отмечены красным цветом.
- Несколько элементов с металлическими и неметаллическими свойствами (называемые полуметаллами ) отделяют металлы от неметаллов.Они расположены в диагональной полосе с правой стороны стола. В приведенной выше таблице полуметаллы желтые.
Полуметаллы также иногда называют металлоидами.
Теперь, когда мы пересмотрели то, что мы уже узнали в предыдущих классах, давайте изучим некоторые новые характеристики Периодической таблицы.
Во всех таблицах есть строки и столбцы.Вы можете вспомнить разницу между вертикальной и горизонтальной? Нарисуйте короткие линии, чтобы показать разницу между «вертикальным» и «горизонтальным» в следующей таблице.
Учащиеся должны нарисовать следующее:
Вертикальный | горизонтальный |
Вертикальное перемещение «вверх-вниз» и горизонтальное перемещение «из стороны в сторону».В обычной таблице столбцы располагаются вертикально, а строки — горизонтально.
Есть специальные слова для описания столбцов и строк Периодической таблицы. На следующей диаграмме показано, как называются столбец и строки.
Группы: Вертикальные столбцы Периодической таблицы называются группами. Группы в Периодической таблице пронумерованы таким образом, что группа 1 находится слева.Сколько всего групп?
Группы пронумерованы от 1 до 18. В старых таблицах группы пронумерованы более сложным образом. Красочная таблица Менделеева из Gr. 7 (показанный ранее) — это пример стиля нумерации, который вы можете найти в старых учебниках и других научных ресурсах.
Периоды: Горизонтальные строки Периодической таблицы называются периодами. Первый период находится в верхней части таблицы.Что является первым элементом в третьем периоде?
Какой элемент находится в группе 14 и во втором периоде? Напишите его символ и название.
Наименования и химические символы
в гр. 7 мы узнали, что каждый элемент имеет уникальное имя. Мы также узнали, что каждый элемент имеет уникальный символ. Вот список простых правил, которые следует помнить при использовании химических символов:
- Каждый элемент имеет свой уникальный символ.
- Символ обычно (но не всегда) — это первые одна или две буквы названия элемента.
- Первая буква символа всегда заглавная.
- Если символ состоит из двух букв, вторая буква всегда будет строчной.
- Некоторые элементы имеют символы, которые произошли от их латинских названий.
Как ученые, мы должны знать названия и символы всех наиболее важных элементов.От вас пока не ожидается, что вы выучите их все наизусть, но в конце этой главы вы должны знать названия и химические символы первых 20 элементов в таблице. Чтобы их было немного легче запомнить, они помещены в таблицу ниже.
Песня о Периодической таблице!
Вам необходимо знать названия и символы первых 20 элементов Периодической таблицы, а также железа, меди и цинка.
ИНСТРУКЦИЯ:
- Воспользуйтесь Периодической таблицей, чтобы заполнить следующую таблицу.
- Напишите химический символ и название элемента для каждого из первых 20 элементов, идентифицируемых по их атомным номерам.
Атомный номер | Химический знак | Название элемента |
1 | ||
2 | ||
3 | ||
4 | ||
5 | ||
6 | ||
7 | ||
8 | ||
9 | ||
10 | ||
11 | ||
12 | ||
13 | ||
14 | ||
15 | ||
16 | ||
17 | ||
18 | ||
19 | ||
20 |
Атомный номер | Химический знак | Название элемента |
1 | H | Водород |
2 | He | Гелий |
3 | Li | Литий |
4 | Be | Бериллий |
5 | B | Бор |
6 | С | Углерод |
7 | N | Азот |
8 | O | Кислород |
9 | F | фтор |
10 | Ne | Неон |
11 | Na | Натрий |
12 | мг | Магний |
13 | Al | Алюминий |
14 | Si | Кремний |
15 | -P | фосфор |
16 | S | сера |
17 | Класс | Хлор |
18 | Ar | Аргон |
19 | К | Калий |
20 | Ca | Кальций |
Есть три важных промышленных металла, названия и формулы которых вам необходимо знать.Их атомные номера указаны в таблице ниже. Заполните таблицу, заполнив химические символы и названия элементов.
Атомный номер
Химический знак
Название элемента
26
29
30
Атомный номер | Химический знак | Название элемента |
26 | Fe | Утюг |
29 | Cu | Медь |
30 | Zn | Цинк |
ВОПРОСЫ:
Это также является пересмотром того, что учащиеся изучали в Gr.8 об атоме.
Что атомный номер говорит нам об атомах элемента?
Он сообщает нам, сколько протонов находится в атомах.
Сколько протонов в атомах кислорода?
Всего протонов 8 (атомный номер 8).
Сколько нейтронов содержится в большинстве атомов кислорода?
Также есть 8 нейтронов.
Учащиеся узнают об изотопах только в старших классах, а пока достаточно знать, что атомная масса указывает количество нуклонов (протонов и нейтронов), поэтому для кислорода атомная масса равна 15.999 (с округлением до ближайшего целого числа 16), поэтому количество нейтронов = 16-8, что составляет 8.
Сколько электронов будет в нейтральном атоме кислорода?
Будет 8 электронов.
На этом этапе учащиеся еще не узнали об ионах, поэтому мы рассматриваем только нейтральные атомы, в которых количество электронов равно количеству протонов.
Какой заряд у протонов и электронов?
Электроны заряжены отрицательно, а протоны — положительно.
Как протоны, нейтроны и электроны (субатомные частицы) расположены в атоме?
Протоны и нейтроны сгруппированы вместе в центре, образуя ядро, а электроны занимают очень большое пространство / облако / область вокруг ядра.
Нарисуйте модель атома кислорода в пространстве ниже. Обозначьте свою диаграмму.
Учащиеся должны нарисовать центральное ядро с 8 протонами и 8 нейтронами, причем 8 электронов образуют облако вокруг ядра. Пример модели атома азота приведен ниже в качестве ссылки:
Вы можете задаться вопросом, почему в Периодической таблице ровно 18 групп, а не 14, 10 или любое другое число.Это очень хороший вопрос! Фактическое объяснение довольно сложное и связано с распределением электронов внутри атома. Вы узнаете об этом более подробно, если возьмете Physical Sciences в Gr. 10.
Несмотря на то, что электроны в атоме движутся так быстро, что невозможно описать их фактическое «положение», ученые смогли выяснить закономерности в расположении электронов. Эти шаблоны повторяются после каждого 18-го элемента.
Свойства элементов одной группы
Элементы из одной группы часто имеют схожие физические и химические свойства. На данный момент достаточно знать, что электроны в атомах элемента определяют химические свойства этого элемента. А поскольку «электронные узоры» повторяются после каждого 18-го элемента, получается 18 групп. Поскольку элементы в группе имеют схожие «электронные структуры», они будут вести себя одинаково в химических реакциях.
Вот пример, чтобы убедить вас в этом факте:
Металлы группы 1 называются щелочными металлами . Можете ли вы написать имя и химический символ самого легкого члена группы? Вы можете не обращать внимания на водород, который на самом деле является неметаллом, но он помещен вместе с щелочными металлами в Периодической таблице, потому что он имеет аналогичную структуру электронов.
Посмотрите это видео о реакции металла с водой!
Это видео, чтобы помочь учителям продемонстрировать свойства щелочных металлов, включая горение на воздухе и реакцию с водой.Это длинное видео, но его стоит посмотреть.
Литий и все другие щелочные металлы — мягкие тускло-серые металлы. Внешний вид очень похож и имеет аналогичные физические свойства .
Все эти элементы очень своеобразным образом реагируют с водой.
Например, когда небольшой кусочек лития падает в воду, он немедленно начинает реагировать с водой.Вот химическое уравнение реакции:
2 Li + 2 H 2 O → 2 LiOH + H 2
Кусок металлического лития будет танцевать на поверхности воды, потому что в результате реакции образуется газообразный водород (H 2 ), который заставляет крошечные пузырьки вытекать из-под лития. Также выделяется тепло, и иногда водород начинает гореть поверх воды. Другой образующийся продукт — гидроксид лития.Можете ли вы найти его формулу в приведенном выше химическом уравнении?
Напишите слово уравнение под химическим уравнением выше.
Учащиеся должны написать следующее словесное уравнение: литий + вода → оксид лития + газообразный водород.
Какие реагенты и продукты участвуют в указанных выше химических реакциях?
Реагенты — литий и вода, продукты — гидроксид лития и газообразный водород.
Металлический литий хранится в масле и плавает в бутылке. Как вы думаете, почему это так? http://commons.wikimedia.org/wiki/File:Lithium_in_mineral_oil.jpgСначала спросите учащихся, почему они думают, что он может храниться, например, в масле, а не в воде. Это связано с тем, что он очень хорошо реагирует с водой, а также со временем медленно реагирует с кислородом в воздухе, поэтому лучше всего хранить его в масле. Затем спросите учащихся, почему они думают, что кусок металлического лития плавает в бутылке с маслом.Это потому, что литий — самый легкий металл во Вселенной, он легче и менее плотен, чем нефть, поэтому он плавает. Это связано с моделью частиц материи и тем, что изучали в Gr. 8 по плотности различных материалов.
Интересно, что все остальные щелочные металлы ведут себя аналогичным образом. Натрий более активен, чем литий, поэтому он не только качается на поверхности воды, но и сразу же воспламеняется.Хотя химическая реакция почти идентична:
2 Na + 2 H 2 O → 2 NaOH + H 2
Вы видите, насколько это похоже на реакцию лития с водой?
Когда большое количество натрия вступает в контакт с водой, происходит взрыв, как на этой фотографии, где вода была вылита на 1,5 кг натрия.Калий даже более активен, чем натрий, поэтому он взрывается при попадании на поверхность воды:
2 K + 2 H 2 O → 2 KOH + H 2
Небольшой кусок металлического калия взрывается, вступая в реакцию с водой.http://commons.wikimedia.org/wiki/File:Kaalumi_reaktsioon_veega.jpgВы должны заметить, что эти элементы, все из одной группы, одинаково реагируют при контакте с водой. Это то, что имеется в виду, когда мы говорим, что элементы из одной и той же группы имеют аналогичные химические свойства .
Названия соединений
CAPS требует, чтобы учащиеся лепили модели (из бусинок, бобов, пластилина или пластилина) из нескольких элементов и соединений.Мы намеренно воздерживаемся от включения действий, в которых требуется построить или нарисовать «молекулы» ионных соединений, таких как NaCl и CuO. Причина упущений такого рода связана с предыдущим примечанием, в котором объяснялось, что ионные соединения образуют решетки, а не молекулы. Их фундаментальные единицы называются не молекулами, а «формульными единицами».
- ИЮПАК
- Система ИЮПАК
- систематическое наименование
- суффикс
- префикс
Возможно, в вашем классе есть два или более человека с одинаковым именем? Тогда вы поймете, насколько запутанным может быть, когда два человека носят одно и то же имя!
Мы узнали, что каждый элемент имеет уникальное имя.Это важно, чтобы мы не путали элементы друг с другом.
Каждое соединение имеет уникальное имя
Не менее важно, чтобы каждое соединение имело уникальное имя. Следующий пример поможет вам понять, почему:
Два соединения CO и CO 2 состоят из двух одинаковых элементов, углерода и кислорода. Если мы назовем их оба «оксидом углерода» (поскольку они оба состоят из углерода и кислорода), мы легко сможем их спутать.При определенных обстоятельствах это может создать проблемы, поскольку CO гораздо более ядовит для людей и животных, чем CO 2 . Так что легко понять, почему каждому соединению нужно уникальное имя.
Когда мы пишем химические формулы для соединений, они всегда представляют собой комбинацию символов элементов в составе. Например, когда мы видим формулу NaCl, мы знаем, что это соединение состоит из Na и Cl.
Когда мы называем соединения, названия элементов в соединении комбинируются и иногда слегка изменяются, чтобы образовать название соединения.
Когда мы слышим название хлорид натрия , например, совершенно очевидно, что описываемое соединение должно состоять из натрия и хлора . Но почему это хлорид , а не хлор ? Что ж, как вы вскоре увидите, когда мы объединяем имена элементов, изменяется тот, который назван последним.
Все вышеперечисленное может показаться очень сложным, и по этой причине была разработана система именования соединений.Система была разработана Международным союзом теоретической и прикладной химии (IUPAC) . Система разработана таким образом, что название соединения описывает элементы, которые он содержит, и то, как они сочетаются.
Система именования соединений ИЮПАК очень сложна, но нам не нужно изучать все ее правила. На этом этапе нам нужно только научиться называть соединения, состоящие из двух элементов.
На этом уровне мы должны различать два типа соединений, потому что тип соединения определяет, как оно должно называться.
Тип 1: Соединения, содержащие металл и неметалл
Эти соединения называются ионными соединениями из-за типа связи. CAPS не делает различий между ковалентными и ионными соединениями на этом уровне. С одной стороны, это понятно. Учащиеся еще не узнали об ионных и ковалентных связях в соединениях и поэтому не смогут понять различие между ионными и ковалентными соединениями.С другой стороны, без явного различия, учащиеся не смогут понять, почему MgO называется оксидом магния, когда CO называется монооксидом углерода, или MgCl 2 называется хлоридом магния, а SCl 2 называется дихлоридом серы. По этой причине мы решили проводить различие между соединениями, которые содержат металл и неметалл (ионные соединения), и соединениями, которые содержат только неметаллы (ковалентные соединения).
Это не единственные возможные комбинации элементов — полуметалл может соединяться с неметаллом, например, в диоксиде кремния (SiO 2 ), — но два типа соединений, обсуждаемых здесь, представляют два наиболее распространенных типа. комбинаций элементов.
Для соединений этого типа правило простое. Металл идет первым, а неметалл — вторым. Название неметалла немного меняется: суффикс -ide заменяет окончание названия.
Суффикс — это что-то, что помещается в конец слова. «Префикс» — это что-то, что помещается в начале слова .
Все соединения этого типа образуют не молекулы, а кристаллические решетки.Что мы называем повторяющимися «единицами» в кристаллической решетке?
Вот несколько примеров:
Формула | Состоит из | Имя | Изображение одной формульной единицы соединения |
NaCl | Натрий и хлор | Натрия хлорид | |
FeS | Железо и сера | Сульфид железа | |
MgO | Магний и кислород | Оксид магния | |
LiF | Литий и фтор | Фторид лития |
ИНСТРУКЦИЯ:
- Обратитесь к Периодической таблице и заполните следующую таблицу.
- Вам необходимо определить элементы, из которых состоит соединение, и дать название соединению.
Формула | Из каких элементов он состоит? | Имя |
Li 2 O | ||
KCl | ||
CuO | ||
NaBr |
Формула | Из каких элементов он состоит? | Имя |
Li 2 O | 2 лития и 1 кислород | Оксид лития |
KCl | 1 Калий и 1 хлор | Калий хлористый |
CuO | 1 медь и 1 кислород | Оксид меди |
NaBr | 1 натрий и 1 бром | Натрия бромид |
Тип 2: Соединения, содержащие только неметаллы
Этот тип соединения немного сложнее назвать.Вы должны соблюдать три правила. Они следующие:
Правило 1:
Имя элемента, расположенного левее в Периодической таблице, идет первым, за ним следует имя элемента, расположенного дальше справа в таблице. Название второго элемента немного изменится: суффикс -ide заменяет окончание имени.
Например:
- кислород превращается в окс ide
- фтор становится фтором ide
- хлор превращается в хлор ide
- азот становится азотом ide
Правило 2:
Когда два или более соединений имеют разные номера одних и тех же элементов (например, CO и CO 2 в нашем примере выше), мы должны добавить префиксы, чтобы избежать путаницы.
Первые четыре префикса перечислены в таблице ниже:
Число атомов | Префикс |
1 | моно — |
2 | di- |
3 | три- |
4 | тетра- |
5 | пента- |
Префикс моно- обычно опускается в начале первого слова имени.Например, СО — это монооксид углерода, а не монооксид углерода .
Вот несколько примеров того, как следует применять это правило:
Соединения углерода и кислорода:
- CO — монооксид углерода (обратите внимание, что это не монооксид, а монооксид)
- CO 2 — диоксид углерода
Соединения азота и кислорода:
- NO 2 — диоксид азота
- N 2 O 4 — четырехокись азота (вы заметили, как четырехокись азота превращается в четырехокись?)
Соединения серы и кислорода:
- SO 2 — диоксид серы
- SO 3 — триоксид серы
Мы собираемся попрактиковаться в том, что уже узнали, в следующих двух коротких заданиях.Сначала напишем имена из формул.
МАТЕРИАЛЫ:
- пластилин, фасоль или бусы
ИНСТРУКЦИЯ:
- Как бы вы назвали следующие соединения? Напишите название рядом с каждой формулой в таблице ниже.
- Постройте по одной молекуле каждого соединения из пластилина, бобов или бусинок.Если вы не знаете, как расположить атомы, вот важный совет: атом, который стоит первым в имени (обычно он также будет первым атомом в формуле), должен быть помещен в центр молекулы. Все остальные атомы должны быть размещены вокруг него. Они будут связаны с атомом в центре, но не друг с другом.
- Нарисуйте изображение вашей молекулы в последнем столбце таблицы.
Формула соединения | Название соединения | Изображение одной молекулы соединения |
CO 2 | ||
ПФ 3 | ||
SF 4 | ||
CCl 4 |
Формула соединения | Название соединения | Изображение одной молекулы соединения |
CO 2 | двуокись углерода | |
H 2 O | диоксид водорода (вода) | |
ПФ 3 | трехфтористый фосфор | |
SF 4 | тетрафторид серы | |
CCl 4 | четыреххлористый углерод |
Цвет атомов не важен, если атомы одного и того же элемента имеют одинаковый цвет.Размеры не важны, но вы можете предложить учащимся, что элементы, расположенные выше в Периодической таблице, будут, как правило, меньше, чем элементы, расположенные ниже. Если учащиеся не уверены, как разместить атомы, обратите их внимание на приведенный ранее совет: атом, который стоит первым в имени (или формуле), должен быть помещен в центр молекулы. Все остальные атомы должны быть связаны с центральным атомом.
Далее напишем формулы из названий некоторых соединений.
МАТЕРИАЛЫ:
ИНСТРУКЦИЯ:
- Какие формулы вы бы дали следующим соединениям? Напишите формулу рядом с каждым именем в таблице ниже.
- Постройте модель каждой смеси из пластилина.
- Изобразите одну молекулу каждого соединения в последнем столбце таблицы.
Формула соединения | Название соединения | Изображение одной молекулы соединения |
фтороводород | ||
сероводород | ||
трехокись серы | ||
окись углерода |
Формула соединения | Название соединения | Изображение одной молекулы соединения |
HF | фтороводород | |
H2S | сероводород | |
СО 3 | трехокись серы | |
CO | окись углерода |
Цвет атомов не важен, если атомы одного и того же элемента имеют одинаковый цвет.Размеры не важны, но вы можете предложить учащимся, что элементы, расположенные выше в Периодической таблице, будут, как правило, меньше, чем элементы, расположенные ниже.
Есть еще одно правило — простое для запоминания!
Правило 3:
Многие соединения обычно не упоминаются по их систематическим названиям. Вместо этого у них есть общих имен , которые более широко известны.Например, мы используем название вода для H 2 O, аммиак для NH 3 и метан для CH 4 .
В этой главе мы рассмотрели всю информацию о соединениях и Периодической таблице, которую мы узнали в предыдущие годы. Мы добавили новую информацию в обе эти темы. Мы также научились новому важному навыку, а именно писать и интерпретировать названия и формулы соединений.
q8-состояние-пять-разные-символы | LIDO
Решение:
Свойства соединений:
- Элементы в соединении имеют фиксированную пропорцию.
- Соединения обладают определенным набором свойств.
- Соединения разлагаются только химическим путем.
- Частицы соединений могут быть только одного вида.
- Они однородны, т.е. идентичны.
Различия между элементами и соединениями
| Элементы | Соединения |
|---|---|
| У них есть только один вид атомов, например Na, H, O, Cl | Они могут иметь или не иметь один вид атома. Пример — [[> widget <]] |
| Их свойства отличаются от свойств соединений, которые они производят. Пример. Водород и кислород горючие, а вода — нет. | Они обладают свойствами, отличными от элементов, из которых они сделаны. Пример. Водород и кислород — это газы, но они составляют воду, которая является жидкостью. |
| Они не могут быть разбиты дальше, они являются основной единицей. | Их можно разложить, но только химическим путем. |
«Здравствуйте, студенты. Добро пожаловать в Лидо. А теперь. Мы собираемся обсудить вопрос физики.То есть Состояние V различные характеристики соединения дают три различия между элементами и соединениями с соответствующими примерами. Теперь здесь компоненты свойства компонентов соединений следующие: элементы и соединения находятся в соотношении. Соединения с фиксированной пропорцией обладают определенным набором свойств, и соединения могут быть расщеплены только химическим путем и Потому что соединения являются единственными в своем роде в целом. Только один придуманный, и они однородны. Они на самом деле идентичны тому, что есть.Это означает, что они идентичны, и теперь мы собираемся обсудить частицу глюкозы, которая является CC K. h3 составляет 0,06 меньше шести 6 по Блейку 6: к хорошо Colin 6 — это их соотношение. А потом Затем элемент, затем элементы и соединения. Элементы являются чистыми для определения этих элементов. Это чистое химическое вещество, состоящее из какого-то типа атома, который представляет собой кислород, как в соединении, если он содержит атомы различных элементов в фиксированной пропорции, расположенные определенным образом, например, двуокись углерода, которая представляет собой одну молекулу углерода и две молекулы кислорода. углекислый газ, который они образуют, и 1 столбец 2 1 столбец 2 1 столбец 2 Соотношение И переходим к следующему.Различающие элементы и составные элементы decel-элементы различаются по атомным номерам для числа в настоящее время 118, что составляет 94, найденных нами ранее, и соединение содержит различные элементы в фиксированном соотношении, а здесь и в элементах. Встречаются в 94-м и на Земле. Естественно. Список. Список соединений здесь бесконечен. Входят в число соединений? Всего n соединений. Мы даже не можем определить их: элементы представляют собой символы, а соединения представляют химические формулы, а элементы — элементы классификации элементов. Металлы, неметаллы и металлоиды, и неметаллы, а для соединений это органические и неорганические соединения.Например, элементы: Na, O, H. Cl. Примеры соединений: h3O, CO2, C6h22. Спасибо за внимание, ребята. «
Периодические тенденции — Chemistry LibreTexts
Периодические тенденции — это определенные закономерности, присутствующие в периодической таблице, которые иллюстрируют различные аспекты определенного элемента, включая его размер и его электронные свойства. Основные периодические тенденции включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, точку плавления и металлический характер.Периодические тенденции, возникающие в результате расположения таблицы Менделеева, предоставляют химикам бесценный инструмент для быстрого прогнозирования свойств элемента. Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодической природы элементов.
Тенденции электроотрицательности
Электроотрицательность можно понимать как химическое свойство, описывающее способность атома притягивать электроны и связываться с ними.Поскольку электроотрицательность является качественным свойством, не существует стандартизированного метода расчета электроотрицательности. Однако наиболее распространенной шкалой для количественной оценки электроотрицательности является шкала Полинга (таблица A2), названная в честь химика Линуса Полинга. Числа, присвоенные шкалой Полинга, безразмерны из-за качественного характера электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Рисунок \ (\ PageIndex {1} \): Периодическая таблица значений электроотрицательности.Электроотрицательность измеряет тенденцию атома притягиваться и образовывать связи с электронами.Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октетов (валентная или внешняя оболочка состоит из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем половину полной валентной оболочки, энергия, необходимая для получения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части таблицы Менделеева обычно теряют электроны при образовании связей. И наоборот, элементы в правой части таблицы Менделеева более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов.Природа электроотрицательности эффективно описывается следующим образом: чем больше атом склонен приобретать электроны, тем больше вероятность, что атом будет притягивать электроны к себе.
- Слева направо через период элементов электроотрицательность увеличивается. Если валентная оболочка атома заполнена менее чем наполовину, для потери электрона требуется меньше энергии, чем для его получения. И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать один.
- Сверху вниз по группе электроотрицательность уменьшается. Это связано с тем, что атомный номер увеличивается вниз по группе, и, таким образом, увеличивается расстояние между валентными электронами и ядром или увеличивается атомный радиус.
- Важные исключения из вышеперечисленных правил включают благородные газы, лантаноиды и актиниды. Благородные газы обладают полной валентной оболочкой и обычно не притягивают электроны. Лантаноиды и актиниды обладают более сложным химическим составом, в котором, как правило, не наблюдается каких-либо тенденций.Следовательно, благородные газы, лантаноиды и актиниды не имеют значений электроотрицательности.
- Что касается переходных металлов, хотя у них есть значения электроотрицательности, между ними существует небольшая разница по периоду и по группе вверх и вниз. Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и на другие элементы.
Согласно этим двум общим тенденциям, наиболее электроотрицательным элементом является фтор с 3.98 единиц Полинга.
Рисунок \ (\ PageIndex {2} \): Периодическая таблица, показывающая тенденцию электроотрицательностиТенденции энергии ионизации
Энергия ионизации — это энергия, необходимая для удаления электрона из нейтрального атома в его газовой фазе. Концептуально энергия ионизации противоположна электроотрицательности. Чем ниже эта энергия, тем легче атом превращается в катион. Следовательно, чем выше эта энергия, тем меньше вероятность превращения атома в катион. Как правило, элементы в правой части таблицы Менделеева имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена.Элементы в левой части периодической таблицы имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в периодической таблице.
Рисунок \ (\ PageIndex {3} \): График, показывающий энергию ионизации элементов от водорода до аргонаЕще одним фактором, влияющим на энергию ионизации, является электронное экранирование . Электронная защита описывает способность внутренних электронов атома экранировать положительно заряженное ядро от валентных электронов.При перемещении вправо от точки количество электронов увеличивается, а сила экранирования увеличивается. В результате электронам валентной оболочки легче ионизоваться, и, таким образом, энергия ионизации уменьшается вниз по группе. Электронное экранирование также известно как , экранирование .
Тенденции
- Энергия ионизации элементов за период обычно увеличивается слева направо. Это связано с стабильностью валентной оболочки.
- Энергия ионизации элементов в группе обычно уменьшается сверху вниз.Это происходит из-за электронного экранирования.
- Благородные газы обладают очень высокой энергией ионизации из-за их полных валентных оболочек, как показано на графике. 2} \]
- За период \ (Z_ {eff} \) увеличивается на , а n (главное квантовое число) остается прежним , поэтому энергия ионизации увеличивается на .
- Вниз по группе \ (n \) увеличивает , а \ (Z_ {eff} \) немного увеличивает ; энергия ионизации уменьшается .
Тенденции сродства электронов
Как следует из названия, сродство к электрону — это способность атома принимать электрон. В отличие от электроотрицательности, сродство к электрону — это количественное измерение изменения энергии, которое происходит, когда электрон присоединяется к нейтральному атому газа. Чем отрицательнее значение сродства к электрону, тем выше сродство атома к электронам.
Рисунок \ (\ PageIndex {5} \): Периодическая таблица, показывающая тенденцию сродства к электронуСродство к электрону обычно уменьшается вниз по группе элементов, потому что каждый атом больше, чем атом над ним (это тенденция атомного радиуса, обсуждаемая ниже). Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. Чем больше расстояние между отрицательно заряженным электроном и положительно заряженным ядром, сила притяжения относительно слабее.Следовательно, сродство к электрону уменьшается. Двигаясь слева направо через период, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон приближаться к ядру, тем самым увеличивая сродство к электрону слева направо через период.
- Сродство к электрону увеличивается слева направо в течение периода. Это вызвано уменьшением атомного радиуса.
- Сродство к электрону уменьшается сверху вниз внутри группы. Это вызвано увеличением атомного радиуса.
Тенденции атомного радиуса
Атомный радиус составляет половину расстояния между ядрами двух атомов (точно так же, как радиус равен половине диаметра круга). Однако эта идея осложняется тем фактом, что не все атомы обычно связаны друг с другом одинаково. Некоторые из них связаны ковалентными связями в молекулах, некоторые притягиваются друг к другу в ионных кристаллах, а другие удерживаются в металлических кристаллах. Тем не менее, подавляющее большинство элементов может образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одной ковалентной связью.Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Образцы атомных радиусов наблюдаются по всей периодической таблице.
Размер атома постепенно уменьшается слева направо через период элементов. Это потому, что в пределах периода или семейства элементов все электроны добавляются к одной и той же оболочке. Однако в то же время к ядру добавляются протоны, что делает его более заряженным. Эффект увеличения числа протонов больше, чем эффект увеличения числа электронов; следовательно, существует большее ядерное притяжение.Это означает, что ядро сильнее притягивает электроны, притягивая оболочку атома ближе к ядру. Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
Рисунок \ (\ PageIndex {6} \): Периодическая таблица, показывающая тренд атомного радиусаD владеет группой, атомный радиус увеличивается. Валентные электроны занимают более высокие уровни из-за увеличения квантового числа (n). В результате валентные электроны удаляются от ядра по мере увеличения «n».Электронная защита предотвращает притяжение этих внешних электронов к ядру; таким образом, они удерживаются слабо, и результирующий атомный радиус велик.
- Атомный радиус уменьшается на слева направо за период. Это вызвано увеличением на числа протонов и электронов на за период. Один протон имеет большее влияние, чем один электрон; таким образом, электроны притягиваются к ядру, что приводит к меньшему радиусу.
- Атомный радиус увеличивается на сверху вниз внутри группы.Это вызвано электронной защитой.
Тенденции температуры плавления
Точки плавления — это количество энергии, необходимое для разрыва связи (ей), чтобы преобразовать твердую фазу вещества в жидкость. Как правило, чем сильнее связь между атомами элемента, тем больше энергии требуется для разрыва этой связи. Поскольку температура прямо пропорциональна энергии, высокая энергия диссоциации связи коррелирует с высокой температурой. Температуры плавления различны и обычно не образуют заметной тенденции в периодической таблице.Однако определенные выводы можно сделать из рисунка \ (\ PageIndex {7} \).
- Металлы обычно имеют высокую температуру плавления .
- Большинство неметаллов обладают низкой температурой плавления .
- Неметаллический углерод имеет наивысшую температуру плавления среди всех элементов . Полуметаллический бор также обладает высокой температурой плавления.
Тенденции металлических характеристик
Металлический характер элемента можно определить по тому, насколько легко атом может потерять электрон.Справа налево через период металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что способствует более легкой потере электронов. Металлический характер увеличивается по мере того, как вы перемещаетесь по группе вниз, потому что атомный размер увеличивается. Когда размер атома увеличивается, внешние оболочки удаляются дальше. Главное квантовое число увеличивается, и средняя электронная плотность удаляется от ядра. Электроны валентной оболочки меньше притягиваются к ядру и, как следствие, могут легче терять электроны.Это вызывает усиление металлического характера.
- Металлические характеристики снижаются слева направо в течение периода. Это вызвано уменьшением радиуса (вызванным Z eff , как указано выше) атома, что позволяет внешним электронам легче ионизироваться.
- Металлические характеристики повышаются на группу. Электронное экранирование приводит к увеличению атомного радиуса, поэтому внешние электроны ионизируются легче, чем электроны в более мелких атомах.
- Металлический характер относится к способности терять электроны, а неметаллический характер относится к способности приобретать электроны.
Еще один более простой способ запомнить тенденцию к металлическому характеру состоит в том, что при движении влево и вниз к нижнему левому углу периодической таблицы, металлический характер усиливается в сторону групп 1 и 2 или группы щелочных и щелочноземельных металлов . Точно так же, двигаясь вверх и вправо к верхнему правому углу таблицы Менделеева, металлический характер уменьшается, потому что вы проходите с правой стороны лестницы, что указывает на неметаллы .К ним относятся группа 8, благородные газы , и другие распространенные газы, такие как кислород и азот.
- Другими словами:
- Перемещение влево через точку и вниз по группе: усиление металлического характера (в сторону щелочных и щелочных металлов)
- Перемещение вправо через период и вверх по группе: уменьшение металлического характера (в сторону неметаллов, таких как благородные газы)
Проблемы
В следующей серии задач рассматривается общее понимание вышеупомянутого материала.
1. Исходя из периодических тенденций изменения энергии ионизации, какой элемент имеет самую высокую энергию ионизации?
- Фтор (F)
- Азот (N)
- Гелий (He)
2.) Азот имеет больший атомный радиус, чем кислород.
- A.) Верно
- B.) Неверно
3.) Что имеет более металлический характер, свинец (Pb) или олово (Sn)?
4.) Какой элемент имеет более высокую температуру плавления: хлор (Cl) или бром (Br)?
5.) Какой элемент более электроотрицателен, сера (S) или селен (Se)?
6) Почему значение электроотрицательности большинства благородных газов равно нулю?
7) Расположите эти атомы в порядке уменьшения эффективного заряда ядра валентными электронами: Si, Al, Mg, S
8) Перепишите следующий список в порядке уменьшения сродства к электрону: фтор (F), фосфор (P), сера (S), бор (B).
9) Атом с атомным радиусом меньше, чем у серы (S), __________.
- A.) Кислород (O)
- B.) Хлор (Cl)
- C.) Кальций (Ca)
- D.) Литий (Li)
- E.) Ни один из вышеперечисленных
10) Неметалл имеет меньший ионный радиус по сравнению с металлом того же периода.
- A.) Верно B.) Неверно
Решения
1. Ответ: C.) Гелий (He)
Пояснение: Гелий (He) имеет самую высокую энергию ионизации, потому что, как и другие благородные газы, валентная оболочка гелия заполнена.Следовательно, гелий стабилен и не может быстро терять или приобретать электроны.
2. Ответ: A.) Верно
Пояснение: Атомный радиус увеличивается справа налево в периодической таблице. Следовательно, азот больше кислорода.
3. Ответ: Свинец (Pb)
Пояснение: Свинец и олово находятся в одном столбце. Металлический характер увеличивается вниз по колонке. Свинец находится под оловом, поэтому он имеет более металлический характер.
4. Ответ: Бром (Br)
Пояснение: У неметаллов температура плавления увеличивается вниз по столбцу.Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
5. Ответ: Сера (S)
Пояснение: Обратите внимание, что сера и селен находятся в одном столбце. Электроотрицательность увеличивается на столбец. Это указывает на то, что сера более электроотрицательна, чем селен.
6. Ответ: Большинство благородных газов имеют полновалентные оболочки.
Пояснение: Благородные газы обладают полной валентной электронной оболочкой, поэтому они чрезвычайно стабильны и с трудом теряют или приобретают электроны.
7. Ответ: S> Si> Al> Mg.
Пояснение: Электроны над закрытой оболочкой защищены закрытой оболочкой. S имеет 6 электронов над закрытой оболочкой, поэтому каждый из них ощущает притяжение 6 протонов в ядре.
8. Ответ: Фтор (F)> Сера (S)> Фосфор (P)> Бор (B)
Объяснение: Сродство к электрону обычно увеличивается слева направо и снизу вверх.
9. Ответ: C.) Кислород (O)
Пояснение: Периодические тенденции показывают, что атомный радиус увеличивается вверх по группе и слева направо в течение периода.Следовательно, кислород имеет меньший атомный радиус серы.
10. Ответ: B.) Неверно
Объяснение: Причина этого заключается в том факте, что металл обычно теряет электрон, становясь ионом, в то время как неметалл получает электрон. Это приводит к меньшему ионному радиусу для иона металла и большему ионному радиусу для иона неметалла.
Список литературы
- Пинто, Габриэль. «Использование мячей различных видов спорта для моделирования изменения атомных размеров». Дж.Chem. Educ. 1998 75 725. {cke_protected} {C}
- Куреши, Пушкин М .; Камоонпури, С. Икбал М. «Ионная сольватация: проблема ионных радиусов». J. Chem. Educ. 1991 , 68 , 109.
- Смит, Дерек В. «Энтальпии атомизации металлических элементарных веществ с использованием полуколичественной теории ионных твердых тел: простая модель для обоснования периодических тенденций». J. Chem. Educ. 1993 , 70 , 368.
- Руссо, Стив и Майк Сильвер. Вводная химия. Сан-Франциско: Пирсон, 2007. .
- Петруччи, Ральф Х. и др. Общая химия: принципы и современные приложения. 9-е изд. Нью-Джерси: Пирсон, 2007.
- Аткинс, Питер и др. al, Physical Chemistry , 7 th Edition, 2002, W.H Freeman and Company, New York, pg. 390.
- Олберти, Роберт А. и др. al, Physical Chemistry , 3 rd Edition, 2001, John Wiley & Sons, Inc., стр.380.
- Kots, John C. et. al, Chemistry & Chemical Reactivity , 5 th Edition, 2003, Thomson Learning Inc, стр. 305-309.
Авторы и авторство
- Света Рамиредди (UCD), Бинъяо Чжэн (UCD), Эмили Нгуен (UCD)
природных ресурсов и синтетических материалов | Глава 6: Химические изменения
Обсудите в классе термины «синтетический» и «натуральный».«
Объясните, что в науке «синтетический» материал — это материал, в котором исходные вещества химически изменены для получения материала с другими характеристиками. Типичный пример — пластик. Чтобы сделать это, нефть перерабатывается и химически изменяется, чтобы в конечном итоге стать пластиком. Серия химических реакций, которые используются для превращения природных ресурсов в синтетические продукты, называется химическим синтезом .
Чтобы сделать продукт «натуральным», природные ресурсы не претерпевают значительных химических изменений.Один из примеров — деревянный стул. Он более натуральный, чем синтетический, потому что его форма изменилась, но материал по-прежнему остается деревом. Стекло немного сложнее классифицировать, но его можно считать натуральным материалом. Это происходит из песка, который был растоплен, а затем охлажден. Молекулы, из которых состоит стекло, остались такими же, как и в песке.
Сообщите учащимся, что все продукты сделаны из природных ресурсов. «Натуральные» продукты производятся из природных ресурсов , таких как дерево и песок.«Синтетические» продукты также производятся из природных ресурсов. Например, пластмасса из синтетического материала изготавливается из нефти, которую выкачивают из земли. Нефть — это природный ресурс.
Спросите студентов:
- Как натуральные, так и синтетические продукты производятся из природных ресурсов.
Объясните, почему это утверждение верно.
Если вы проследите, из чего что-то сделано достаточно давно, вы обнаружите, что все вещества, используемые для создания этого продукта, происходят из нашего мира.Изначально они могут происходить из растений, животных или земли. - Как определить, что что-то следует классифицировать как синтетическое?
И синтетические, и натуральные продукты производятся из природных ресурсов, которые люди могут изменить в той форме, в которой они находились в природе. Но синтетические продукты обрабатываются и изменяются химически людьми, чтобы произвести новое вещество с другими характеристиками.
Примечание: значение слова «синтез» в слове «фотосинтез»
Студентам может быть знаком термин синтез из слова фотосинтез .Возможно, вы разбили это слово на фото и синтез , чтобы объяснить процесс, с помощью которого растения используют энергию солнца для синтеза сахара из углекислого газа и воды. Используемый таким образом синтез — это естественный процесс, который происходит в зеленых растениях и других организмах с хлорофиллом. Но для целей этого урока термин «синтез» и синтетический материал используется для обозначения того, что люди используют химические процессы для создания или синтеза нового материала.Представьте идею о том, что ученые могут синтезировать соединение, которое также можно найти в природе.
Покажите видео профессора Дэйва, Я взорвусь от синтетических витаминов?
Спросите студентов:
- Является ли витамин D, который вырабатывается нашей кожей под воздействием солнечных лучей, натуральным или синтетическим?
Когда мы находимся на солнце и наши тела вырабатывают витамин D, он считается натуральным.Но то же соединение, производимое на фабриках, которое вы можете купить в виде витаминных таблеток, считается синтетическим. - Почему ученым может быть полезно синтезировать соединение, которое можно найти в природе?
Если по какой-то причине вы не можете получить это соединение из природного источника, может быть полезно использовать синтетическую, но идентичную версию. Если сбор урожая на природе слишком дорог или чрезмерный сбор может нанести ущерб окружающей среде или разрушить среду обитания, возможно, лучше синтезировать соединение.
Объясните студентам: хотя витамин D можно найти в природе, тот факт, что ученые создают его с помощью химических процессов, делает его синтетическим. Таким образом, можно создать синтетическое вещество, идентичное тому, что встречается в природе. Эта идея особенно важна для студентов, которые будут работать над темой синтетических лекарств в исследовательской части этого урока.
- Как натуральные, так и синтетические продукты производятся из природных ресурсов.
Объясните, почему это утверждение верно.
Представьте исследовательский проект, который студенты будут выполнять, и попросите студентов выбрать синтетический продукт для изучения.
Объясните студентам, что они будут выполнять исследовательский проект, чтобы узнать о синтетическом продукте. Они будут читать различные онлайн-статьи, смотреть информационные видеоролики и пользоваться ресурсами библиотеки. Студенты попытаются найти ответы на следующие три наводящих вопроса:
- Какие природные ресурсы используются для производства синтетического продукта?
- Какие химические процессы используются для производства синтетического продукта?
- Каковы отрицательные и положительные последствия для общества производства и использования синтетического продукта по сравнению с производством и использованием более натурального продукта с аналогичной функцией?
Задайте учащимся или попросите их выбрать синтетический продукт, который они будут исследовать и по которому они будут отчитываться, из приведенного ниже списка.Решите, будете ли вы работать с учениками в группах или индивидуально.
Синтетические товары
- Полиэтиленовый пакет
- Пластиковая бутылка
- Одноразовые подгузники
- Синтетическое волокно / ткань (полиэстер, нейлон или вискоза)
- Кевлар
- Искусственный подсластитель
- Синтетическое топливо (Synfuel)
- Синтетический каучук
- Хлорохин (лекарство от малярии)
- Таксол (противораковое средство)
- Физостигмин (препарат от глаукомы)
- Аспирин
Примечание. Для каждого синтетического продукта были предоставлены ссылки на онлайн-ресурсы.Этот список представлен в конце урока. Вы можете предоставить студентам одну или несколько из этих ссылок, чтобы помочь им начать исследование. Студенты также могут использовать другие ресурсы, онлайн или нет, которые они найдут. Если у вас есть ученики, которые используют ресурсы, которые они сами находят, напомните им, что они должны учитывать автора и цель автора в предоставленной информации.
Объясните, что урок в классе будет моделировать исследования, которые студенты будут проводить на синтетическом продукте.
Сообщите учащимся, что прежде чем они начнут свой исследовательский проект, они узнают и сделают собственный синтетический продукт — гелевого червя. Объясните: если бы это был настоящий гель-червь для еды, в него были бы добавлены подсластители, витамины и фруктовые ароматизаторы. Однако цель этого урока — узнать о химическом синтезе, чтобы учащиеся сосредоточились на химических веществах, участвующих в химической реакции, а не на ароматизаторах. Кроме того, поскольку это научная лаборатория, студенты не должны пробовать или есть гелевого червя.
Объясните, что вы предоставите информацию о синтетическом гелевом черве, организованную вокруг трех наводящих вопросов. Типы информации, которую вы предоставляете в классе, будут служить моделью того, что студенты будут искать при исследовании своего синтетического продукта.
Напомните учащимся, что это следующие вопросы:
- Какие природные ресурсы используются для производства синтетического продукта?
- Какие химические процессы используются для производства синтетического продукта?
- Какие отрицательные и положительные последствия для общества от производства и использования синтетического продукта по сравнению с производством и использованием более натурального продукта с аналогичной функцией?
Расскажите о веществах, из которых делают гель-червя, и объясните, что они получены из природных ресурсов.
Вопрос 1: Какие природные ресурсы используются для производства синтетического продукта?
Скажите учащимся, что они объединят два раствора особым образом, чтобы получить одного гелевого червя. Ингредиенты раствора, которые вступают в химическую реакцию, представляют собой альгинат натрия и хлорид кальция. Оба они обычно используются в еде для улучшения ее текстуры.
Альгинат натрия
Показать иллюстрацию Коричневые водоросли
Из каких природных ресурсов поступает альгинат натрия?
Альгинат натрия производится из коричневых морских водорослей, называемых ламинариями, которые произрастают в дикой природе в океане.Его собирают и обрабатывают для получения альгината натрия.Что делают с водорослями, чтобы получить альгинат натрия?
Морские водоросли нарезают и смешивают с водой, чтобы получился густой гель. Затем его разбавляют большим количеством воды и фильтруют. Смесь выпаривают и дополнительно обрабатывают для получения порошка альгината натрия.Хлорид кальция
Показать иллюстрацию Известняк
Из каких природных ресурсов поступает хлорид кальция?
Хлорид кальция производится из известняка, который обычно добывают.Что делают с известняком для получения хлорида кальция?
Известняк реагирует с соляной кислотой или хлоридом натрия с образованием хлорида кальция.Попросите учащихся сделать синтетического гелевого червя, смешав растворы альгината натрия и хлорида кальция.
Раздайте каждому учащемуся ведомость деятельности учащегося.
Учащиеся запишут свои наблюдения и ответят на вопросы о деятельности в листе действий.«Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально, в зависимости от ваших инструкций. Чтобы найти ответы, посмотрите на версию листа с заданиями для учителя.
Вопрос 2: Какие химические процессы используются для производства синтетического продукта?
В классе студенты будут выполнять следующие практические задания, чтобы ответить на вопрос о химическом синтезе. Исследуя свой синтетический продукт, студенты не будут проводить химический синтез.Вместо этого они должны выяснить, как в целом производится продукт. Цель занятия с гелевым червем — показать учащимся пример химического синтеза.
Примечание: напомните учащимся, что они не могут попробовать или съесть синтетического гелевого червя. Убедитесь, что учащиеся вымыли руки после выполнения этого задания.
Вопрос для исследования
Почему гель-червь, сделанный из растворов хлорида кальция и альгината натрия, считается синтетическим продуктом?Материалы для каждой группы
- Раствор хлорида кальция в маленькой чашке
- Раствор альгината натрия в маленькой широкой чашке
- Одна капельница
- Бумажные полотенца
Подготовка учителей для всех групп
- Налейте ½ чайной ложки хлорида кальция в чашку.Добавьте 25 мл воды и перемешивайте до растворения хлорида кальция. Поместите около ½ чайной ложки раствора хлорида кальция в небольшую чашку для каждой группы.
- Поместите ¼ чайной ложки порошка альгината натрия в пластиковую бутылку. Подойдет пустая одноразовая пластиковая бутылка для воды объемом 8 унций с плотно закрывающейся крышкой.
- Осторожно налейте 50 мл воды в бутыль с альгинатом натрия. Плотно закройте бутылку и энергично встряхивайте около 30 секунд.
- Добавьте еще 50 мл воды в бутыль с раствором альгината натрия.Необязательно: добавьте одну каплю пищевого красителя. Плотно закройте бутылку и снова встряхните.
- Налейте одну столовую ложку (15 мл) раствора альгината натрия из флакона в порционный или широкий пластиковый стаканчик для каждой группы.
Порядок действий для студентов
- Используя пластиковую пипетку, добавьте около 10 капель раствора хлорида кальция в центр чашки, содержащей раствор альгината натрия.
- Дотянитесь до центра раствора (куда вы поместили хлорид кальция) и осторожно и медленно вытащите гелевого «червя».«
- Положите «червяка» на бумажное полотенце.
Ожидаемые результаты
Студенты смогут вытащить из чашки длинную студенистую нить (червяка) или каплю.
Примечание: напомните учащимся не пробовать и не есть гелевого червя. Скажите студентам, что они сделали синтетического гелевого червя, но что настоящие гелевые черви производятся с использованием другого процесса и других ингредиентов.
Спросите студентов
- Какими были растворы хлорида кальция и альгината натрия, когда ваш учитель впервые дал их вам?
Раствор хлорида кальция был прозрачным и бесцветным.Он был очень похож на воду. Раствор альгината натрия также был прозрачным и бесцветным, но казался более густым. - После того, как вы добавили раствор хлорида кальция в раствор альгината натрия и начали вытягивание из центра, как изменились растворы?
Вместо того, чтобы течь как жидкость, химическая реакция заставила ее выйти из чашки как гель. - Считаете ли вы гель-червь синтетическим продуктом? Почему или почему нет?
Гелевый червь — синтетический продукт, потому что он был химически изменен и теперь имеет совсем другие свойства, чем растворы альгината натрия и хлорида кальция, которые использовались для его изготовления.
Очистка
В конце урока попросите учащихся вылить растворы хлорида кальция в канализацию с большим количеством воды или в соответствии с местными правилами. Любой лишний раствор альгината натрия и гель-гельминтов следует утилизировать вместе с классным мусором. Попросите учащихся вымыть руки после уборки.Объясните химический процесс сшивания, который используется для создания синтетического гелевого червя.
Вопрос 2 Продолжение: Какие химические процессы используются для производства синтетического продукта?
Сообщите учащимся, что в своих исследованиях они должны искать следующие подсказки о химическом процессе (ах), используемом для производства их синтетического продукта:
- Можете ли вы определить одну или несколько молекул, участвующих в создании продукта?
- Происходит ли одна или несколько химических реакций?
- Вещества нагреваются?
- Испытывают ли вещества давление
- Используется ли спецтехника?
- Изменился ли метод с годами?
Объясните, что вы будете продолжать использовать гель-червя в качестве примера, чтобы направлять класс в отношении того, какую информацию им следует искать, чтобы ответить на второй вопрос при исследовании собственного синтетического продукта.
Это объяснение касается следующего:
- Можете ли вы определить одну или несколько молекул, участвующих в создании продукта?
- Происходит ли одна или несколько химических реакций?
Проектировать иллюстрацию Полимер альгината натрия.
Вот две модели молекулы альгината натрия. Одна из них представляет собой шарообразную модель, показывающую все атомы: 6 атомов углерода (черный), 7 атомов кислорода (красный), 9 атомов водорода (белый) и 1 положительный ион натрия (фиолетовый).Другая — гораздо более простая модель, использующая шестиугольник для почти всей молекулы и небольшой кружок для положительного иона натрия. Обратите внимание, что в обеих моделях ион натрия имеет положительный заряд, а место, где он связан с молекулой, имеет отрицательный заряд. Многие молекулы альгината натрия связаны вместе, образуя длинную молекулу, называемую полимером. Укажите студентам, что каждая молекула перевернута по сравнению с соседней.
Проектировать иллюстрацию Сшивание альгината натрия.
Чтобы увидеть, что происходит при добавлении хлорида кальция, нам нужно использовать как минимум две полимерные цепи альгината натрия.
Когда раствор альгината натрия и раствор хлорида кальция смешиваются, положительные ионы кальция заменяют положительные ионы натрия. Поскольку ионы кальция имеют два положительных заряда, ионы кальция связываются с отрицательной областью на двух молекулах альгината натрия и создают «поперечную связь» между двумя цепями. Многие химические реакции сшивания заставляют альгинат натрия загустевать и превращаться в гель.
Объясните, что, поскольку конечный продукт химически отличается от исходных веществ, произошел химический синтез, и гель-червь представляет собой синтетический материал.
Сообщите учащимся, что они, возможно, не смогут найти такой уровень подробностей о химическом процессе, используемом для производства их синтетического продукта. Однако им следует попытаться узнать что-нибудь о молекулах или характеристиках материалов до и после процесса синтеза их продукта.
Объясните влияние производства и использования синтетического продукта на общество по сравнению с производством и использованием более натурального продукта с аналогичной функцией.
Вопрос 3: Какое отрицательное и положительное влияние на общество оказывает производство и использование синтетического продукта по сравнению с производством и использованием более натурального продукта с аналогичной функцией?
Предложите учащимся представить себе, что гелевые черви могут производиться серийно с фруктовыми ароматизаторами, витаминами и минералами для изготовления синтетической фруктовой закуски.Объясните, что вы будете использовать идею массового производства гелевого червя в качестве примера, чтобы направить класс в отношении того, какую информацию им следует искать при изучении воздействия их синтетического продукта.
Скажите студентам, что в своих исследованиях они должны искать следующие виды экологических, социальных и экономических последствий, которые возникают в результате производства и использования их синтетических продуктов. Им также следует сравнить эти воздействия с воздействием производства и использования менее синтетической / более естественной альтернативы с аналогичной функцией.Студентам следует рассмотреть следующие вопросы:
- Являются ли используемые природные ресурсы возобновляемыми или невозобновляемыми?
- Каковы воздействия:
- Заготовка, добыча или сбор природных ресурсов?
- Обработка природных ресурсов перед их использованием для производства конечного продукта?
- Производить конечный продукт?
- Какое положительное влияние на общество оказывает использование конечного продукта?
Рассмотрите влияние производства синтетической закуски из гелевых червей по сравнению с производством кусочков настоящих фруктов.
Возобновляемый или невозобновляемый?
Альгинат натрия и хлорид кальция являются природными ресурсами. При рассмотрении наших ресурсов важно учитывать, являются ли они возобновляемыми или невозобновляемыми ресурсами. Если учащиеся не знакомы с этими терминами, познакомьте их сейчас. Объясните, что возобновляемые ресурсы пополняются естественными процессами за достаточно времени, чтобы удовлетворить потребность. Например, деревья являются возобновляемым ресурсом, а нефть — нет.Обычно использование возобновляемых ресурсов оказывает меньшее негативное влияние, потому что ресурс может быть восполнен.
Возобновляемые и невозобновляемые
Природные ресурсы, используемые для приготовления каждой закускиОсновной ингредиент (ы) Природные ресурсы, использованные для производства каждой единицы Возобновляемый?
Почему или почему нет?Гель-червяк Альгинат натрия Коричневые водоросли Возобновляемый, потому что водоросли воспроизводятся в течение нескольких лет. Хлорид кальция Известняк Невозобновляемый, потому что известняк — это скала, на формирование которой потребовались миллионы лет. Ломтики свежих фруктов Фрукты плодовое дерево, вода, и питательные вещества почвы Возобновляемый, потому что можно сажать новые деревья, дождь обеспечивает воду, а надлежащие методы ведения сельского хозяйства могут пополнять запасы питательных веществ в почве. Влияние производства синтетической гелевой закуски от червей
- Альгинат натрия
Бурые водоросли собирают в дикой природе в океане. Это дом и пища для обитателей океана. Сбор бурых водорослей в океане может повлиять на другие организмы в экосистеме. Переработка водорослей в альгинат натрия требует энергии и приводит к образованию отходов, которые необходимо контролировать. - Хлорид кальция
Придется добывать известняк.Это требует оборудования, которое потребляет энергию и загрязняет окружающую среду. При переработке известняка в хлорид кальция образуются отходы, которые необходимо контролировать. - Производство гель-червей
Для массового производства гель-червей на фабрике требуется оборудование и энергия. - Положительные результаты
Людям (в основном детям) нравится их есть.
Последствия изготовления кусочков настоящих фруктов
- Выращивайте и ухаживайте за фруктовыми деревьями
Подготовьте землю с помощью крупногабаритной техники.Это потребляет энергию и увеличивает загрязнение. Удобряйте и поливайте деревья. Некоторые удобрения могут оказаться загрязнителями, если попадут в озера и реки. В некоторых районах вода может быть менее доступной, чем в других. Возможным загрязнителем может быть использование пестицидов. - Сбор и нарезка фруктов
Сбор урожая вручную не загрязняет окружающую среду, но сбор урожая с помощью машин требует энергии и увеличивает загрязнение. Нарезание фруктов на кусочки размером с закуску, вероятно, будет производиться машиной, которая потребляет энергию и увеличивает загрязнение окружающей среды. - Положительные результаты
Людям нравится есть нарезанные фрукты. Свежие фрукты содержат витамины и питательные вещества, необходимые для хорошего здоровья.
Заключение
- Настоящие фрукты, вероятно, полезнее для здоровья и могут иметь меньше негативных последствий. Но если бы синтетические фруктовые закуски могли быть приготовлены с витаминами, другими питательными веществами и не слишком большим количеством сахара, они могли бы стать возможной альтернативой настоящим ломтикам фруктов.
Примечание: В зависимости от того, какой синтетический продукт выбирают учащиеся, информация, которую они находят для ответа на вопросы, может различаться по деталям и полноте.
Предложите учащимся изучить свой синтетический продукт с использованием ресурсов Интернета и библиотек.
Руководство студенческими исследованиями
Обсудите со студентами важность отслеживания информации, которую они находят, оценки надежности источников, которые они используют, и правильного цитирования источников. Возможно, у вас уже есть ресурсы для студентов по правильному цитированию и оценке надежности источников. Ниже мы собрали несколько примеров.
Примечание. В зависимости от того, какой синтетический продукт выбирают учащиеся, информация, которую они найдут для ответа на вопросы, может различаться по деталям и полноте.
Изучение аспектов синтетических материалов, природных ресурсов, способов производства продуктов и влияния производства на общество может быть сложной задачей для студентов. Студентам может быть сложно найти релевантные, надежные и понятные веб-сайты. Студентам может потребоваться существенное руководство для проведения исследований в Интернете.Мы предоставили несколько рекомендуемых веб-сайтов в качестве отправных точек для исследований студентов. Используйте свой собственный опыт, а также опыт школьной библиотеки и медиацентра, чтобы помочь ученикам сориентироваться в поиске полезных материалов.
Основные цели студенческих исследований
После того, как учащиеся узнают продукт, который они будут исследовать, напомните им, что им нужно искать следующую информацию:
- Какие природные ресурсы используются для производства синтетического продукта?
- Какие химические процессы используются для производства синтетического продукта?
- Каковы отрицательные и положительные последствия для общества производства и использования синтетического продукта по сравнению с производством и использованием более натурального продукта с аналогичной функцией?
Поощряйте студентов использовать результаты своих исследований, чтобы сделать вывод, перевешивают ли положительные стороны отрицательные.Если им потребуется дополнительная информация для принятия такого решения, попросите учащихся определить, что им нужно знать.
Примечание. Студентам может быть сложно найти подробную и конкретную информацию о некоторых аспектах природных ресурсов, производственных процессов и социальных последствий их синтетических материалов и продуктов. Поощряйте студентов получать как можно больше информации, чтобы понять основы ресурсов, которые идут на создание продукта, общий процесс его изготовления, а также положительное и отрицательное влияние производства и использования продукта на общество.
Следующий список предназначен для учащихся, чтобы они могли сравнить влияние синтетического продукта на общество с более натуральным продуктом с аналогичной функцией.
Продукты с аналогичными функциями (более синтетические / более натуральные)
- Полиэтиленовый пакет / бумажный пакет
- Пластиковый контейнер / Стеклянный контейнер
- Одноразовые подгузники / тканевые подгузники
- Синтетические волокна и ткань (полиэстер, нейлон или вискоза) / хлопок, шелк или шерстяные волокна и ткань
- Кевлар / Сталь
- Искусственный подсластитель / сахар
- Синтетическое топливо (Synfuel) / Нефть
- Синтетический каучук / Натуральный каучук
- Хлорохин (лекарство от малярии) / Кора хинного дерева
- Таксол (лекарственное средство от рака) / Кора тиса
- Физостигмин (препарат от глаукомы) / Калабарские бобы
- Аспирин / Кора ивы
Следующие веб-сайты могут помочь учащимся начать исследование своего синтетического продукта.
Пластиковые пакеты
Пластиковые бутылки
- Американский химический совет, Основы: определение и свойства полимеров
- Thomasnet.com, Производство пластиковых бутылок
- Объясни это! Стекло
- Воздействие на окружающую среду, Воздействие производства стекла на окружающую среду
- The Vermont Juice Co., стекло против пластика
- Мировая упаковка: пластик против стекла — почему пластиковые контейнеры лучше
- Washington Post, Почему стеклянные банки не обязательно лучше для окружающей среды, чем пластиковые
- Академия питания и диетологии, Правильно питайтесь, стекло против пластиковых контейнеров
- Общественное вещание в Орегоне, что экологичнее? Это не то, чего вы ожидали
Одноразовые подгузники
Синтетическое волокно и ткань (полиэстер, нейлон, вискоза)
- ChemMatters, нейлон
- FiberSource, Краткая история промышленных волокон
- Explain That Stuff, нейлон
- Science360, Производство ткани: нейлоновый профиль
- Смитсоновский институт, Как 75 лет назад нейлоновые чулки изменили мир
- Как производятся продукты, Вискоза
- Обмен текстиля, производственный процесс вискозы
- Объяснение химии, волокна
- Как работает материал? Почему хлопок более абсорбирующий, чем нейлон?
- Quatr.нас, что такое полиэстер?
- Швейные детали в Интернете, хлопок против полиэстера
- Сравнение материалов, хлопок и полиэстер
Кевлар
Искусственный подсластитель
- ChemMatters, Подсластители: как они работают?
- ChemMatters, Искусственные подсластители
- Scientific American, сахар против искусственных подсластителей
- CNN, Настоящий или поддельный сахар: имеет ли это значение?
- Discovery Communications, Искатель, искусственный подсластитель оставляет экологическое послевкусие
- Американское химическое общество, Наука об окружающей среде и технологии, искусственный подсластитель сохраняется в окружающей среде
- Всемирный фонд дикой природы, устойчивое сельское хозяйство — сахарный тростник
- Discover, Химия искусственных подсластителей
Синтетический каучук
Синтетическое топливо
Таксол (противораковое средство)
Физостигмин (препарат от глаукомы)
Хлорохин (лекарство от малярии)
Кортизон (препарат от артрита)
Аспирин
Попросите учащихся сделать рекламу, плакат, короткое видео, статью или другой материал о своем синтетическом продукте.
Студенческие проекты должны отвечать на следующие вопросы.
- Какие природные ресурсы используются для производства синтетического продукта?
- Какие химические процессы используются для производства синтетического продукта?
- Каковы отрицательные и положительные последствия для общества производства и использования синтетического продукта по сравнению с производством и использованием более натурального продукта с аналогичной функцией?
Поощряйте студентов использовать результаты своих исследований, чтобы сделать вывод, какой продукт был бы лучшим выбором для общества.
- Соединения определены как вещества, состоящие из двух или более различных элементов, которые химически соединены. Соединения обладают физическими и химическими свойствами, которые помогают нам их идентифицировать.
- A физическое свойство — это характеристика, которую можно наблюдать или измерять. В этом уроке мы рассмотрели некоторые из наиболее общих физических свойств соединений, включая цвет, запах, точку плавления и точку кипения .
- A химическое свойство — это характеристика вещества, которая может наблюдаться только во время некоторого типа химической реакции. Например, соединения могут иметь реакцию на кислоту, реакцию на свет или реакцию на нагревание. То, насколько хорошо вещество горит, иными словами его воспламеняемость, также является химическим свойством.
Химические связи — Принципы биологии
Как элементы взаимодействуют друг с другом, зависит от того, как расположены их электроны и сколько отверстий для электронов существует во внешней области, где электроны присутствуют в атоме. Электроны существуют на энергетических уровнях, которые образуют оболочки вокруг ядра. Ближайшая оболочка может вместить до двух электронов. Ближайшая к ядру оболочка всегда заполняется первой, прежде чем можно будет заполнить любую другую оболочку.Водород имеет один электрон; следовательно, в самой нижней оболочке занято только одно место. Гелий имеет два электрона; следовательно, он может полностью заполнить нижнюю оболочку двумя своими электронами. Если вы посмотрите на таблицу Менделеева, вы увидите, что водород и гелий — единственные два элемента в первой строке. Это потому, что в их первой оболочке есть только электроны. Водород и гелий — единственные два элемента, которые имеют самую низкую оболочку и не имеют других оболочек.
Второй и третий энергетические уровни могут содержать до восьми электронов.Восемь электронов расположены в четырех парах, и одна позиция в каждой паре заполняется электроном до того, как любые пары будут сформированы.
Еще раз взглянув на таблицу Менделеева (рис. 1), вы заметите, что там семь строк. Эти строки соответствуют количеству оболочек, которые имеют элементы в этой строке. Элементы в определенной строке имеют увеличивающееся количество электронов по мере того, как столбцы перемещаются слева направо. Хотя у каждого элемента одинаковое количество оболочек, не все оболочки полностью заполнены электронами.Если вы посмотрите на вторую строку периодической таблицы, вы найдете литий (Li), бериллий (Be), бор (B), углерод (C), азот (N), кислород (O), фтор (F), и неон (Ne). Все они имеют электроны, которые занимают только первую и вторую оболочки. Литий имеет только один электрон во внешней оболочке, бериллий имеет два электрона, бор имеет три и так далее, пока вся оболочка не будет заполнена восемью электронами, как в случае с неоном.
Не все элементы имеют достаточно электронов, чтобы заполнить свои внешние оболочки, но атом наиболее стабилен, когда все позиции электронов на внешней оболочке заполнены.Из-за этих вакансий во внешних оболочках мы видим образование химических связей или взаимодействия между двумя или более одинаковыми или разными элементами, которые приводят к образованию молекул. Чтобы достичь большей стабильности, атомы будут стремиться полностью заполнить свои внешние оболочки и связываться с другими элементами для достижения этой цели, разделяя электроны, принимая электроны от другого атома или отдавая электроны другому атому. Поскольку внешние оболочки элементов с низкими атомными номерами (вплоть до кальция с атомным номером 20) могут содержать восемь электронов, это называется правилом октетов.Элемент может отдавать, принимать или делиться электронами с другими элементами, чтобы заполнить свою внешнюю оболочку и удовлетворить правилу октетов.
Когда атом не содержит равного количества протонов и электронов, он называется ионом . Поскольку количество электронов не равно количеству протонов, каждый ион имеет чистый заряд. Положительные ионы образуются при потере электронов и называются катионами. Отрицательные ионы образуются за счет приобретения электронов и называются анионами.
Например, у натрия только один электрон на внешней оболочке.Натрию требуется меньше энергии, чтобы отдать один электрон, чем принять еще семь электронов, чтобы заполнить внешнюю оболочку. Если натрий теряет электрон, у него теперь будет 11 протонов и только 10 электронов, а общий заряд останется +1. Теперь он называется ионом натрия.
У атома хлора семь электронов во внешней оболочке. Опять же, для хлора более энергоэффективно получить один электрон, чем потерять семь. Следовательно, он стремится получить электрон, чтобы создать ион с 17 протонами и 18 электронами, придавая ему чистый отрицательный (–1) заряд.Теперь он называется хлорид-ионом. Это движение электронов от одного элемента к другому называется переносом электронов. Как показано на рисунке 1, атом натрия (Na) имеет только один электрон в своей внешней оболочке, тогда как атом хлора (Cl) имеет семь электронов в своей внешней оболочке. Атом натрия отдаст свой один электрон, чтобы опустошить свою оболочку, а атом хлора примет этот электрон, чтобы заполнить свою оболочку, став хлоридом. Оба иона теперь удовлетворяют правилу октетов и имеют полные внешние оболочки.Поскольку количество электронов больше не равно количеству протонов, каждый теперь является ионом и имеет заряд +1 (натрий) или –1 (хлорид).
Рис. 1 Элементы имеют тенденцию заполнять свои внешние оболочки электронами. Для этого они могут отдавать или принимать электроны от других элементов.Ионные связи
Существует четыре типа связей или взаимодействий: ионные, ковалентные, водородные связи и ван-дер-ваальсовы взаимодействия. Ионные и ковалентные связи — это сильные взаимодействия, для разрыва которых требуется больше энергии.Когда элемент отдает электрон из своей внешней оболочки, как в примере с атомом натрия выше, образуется положительный ион (рис. 2). Элемент, принимающий электрон, теперь заряжен отрицательно. Поскольку положительный и отрицательный заряды притягиваются, эти ионы остаются вместе и образуют ионную связь , или связь между ионами. Элементы связываются вместе с электроном одного элемента, оставаясь преимущественно с другим элементом. Когда ионы Na + и Cl — объединяются с образованием NaCl, электрон от атома натрия остается с другими семью атомами хлора, а ионы натрия и хлорида притягиваются друг к другу в решетке ионов с нулевым чистым нулем. плата.
Рисунок 2 При образовании ионного соединения металлы теряют электроны, а неметаллы приобретают электроны для достижения октета.Ковалентные облигации
Другой тип прочной химической связи между двумя или более атомами — это ковалентная связь . Эти связи образуются, когда электрон разделяется между двумя элементами, и являются самой прочной и наиболее распространенной формой химической связи в живых организмах. Ковалентные связи образуются между элементами, из которых состоят биологические молекулы в наших клетках.В отличие от ионных связей ковалентные связи не диссоциируют в воде.
Интересно, что химики и биологи по-разному измеряют прочность связи. Химики измеряют абсолютную прочность связи (теоретическую прочность), в то время как биологов больше интересует, как связь ведет себя в биологической системе, которая обычно представляет собой водную (на водной основе). В воде ионные связи распадаются гораздо легче, чем ковалентные связи, поэтому биологи сказали бы, что они слабее ковалентных связей.Если вы посмотрите в учебник химии, вы увидите нечто иное. Это отличный пример того, как одна и та же информация может привести к разным ответам в зависимости от точки зрения, с которой вы ее смотрите.
Атомы водорода и кислорода, которые объединяются в молекулы воды, связаны ковалентными связями. Электрон от атома водорода делит свое время между внешней оболочкой атома водорода и неполной внешней оболочкой атома кислорода. Чтобы полностью заполнить внешнюю оболочку атома кислорода, необходимы два электрона от двух атомов водорода, отсюда и индекс «2» в H 2 O.Электроны распределяются между атомами, разделяя свое время между ними, чтобы «заполнить» внешнюю оболочку каждого из них. Это совместное использование является более низким энергетическим состоянием для всех задействованных атомов, чем если бы они существовали без заполненных внешних оболочек.
Есть два типа ковалентных связей: полярные и неполярные. Неполярные ковалентные связи образуются между двумя атомами одного и того же элемента или между разными элементами, которые в равной степени разделяют электроны. Например, атом кислорода может связываться с другим атомом кислорода, чтобы заполнить их внешние оболочки.Эта ассоциация является неполярной , потому что электроны будут равномерно распределены между каждым атомом кислорода. Между двумя атомами кислорода образуются две ковалентные связи, потому что кислород требует, чтобы два общих электрона заполняли его внешнюю оболочку. Атомы азота образуют три ковалентные связи (также называемые тройными ковалентными) между двумя атомами азота, потому что каждому атому азота требуется три электрона, чтобы заполнить его внешнюю оболочку. Другой пример неполярной ковалентной связи обнаружен в молекуле метана (CH 4 ).У атома углерода четыре электрона во внешней оболочке, и ему нужно еще четыре, чтобы заполнить его. Он получает эти четыре из четырех атомов водорода, каждый из которых обеспечивает один. Все эти элементы делят электроны в равной степени, создавая четыре неполярные ковалентные связи (рис. 3).
В полярной ковалентной связи электроны, разделяемые атомами, проводят больше времени ближе к одному ядру, чем к другому ядру. Из-за неравномерного распределения электронов между разными ядрами возникает слегка положительный (δ +) или слегка отрицательный (δ–) заряд.Ковалентные связи между атомами водорода и кислорода в воде являются полярными ковалентными связями. Общие электроны проводят больше времени около ядра кислорода, придавая ему небольшой отрицательный заряд, чем они проводят около ядер водорода, придавая этим молекулам небольшой положительный заряд.
Рис. 3 Молекула воды (слева) изображает полярную связь со слегка положительным зарядом на атомах водорода и слегка отрицательным зарядом на кислороде. Примеры неполярных связей включают метан (в центре) и кислород (справа).Водородные облигации
Ионные и ковалентные связи — это прочные связи, для разрыва которых требуется значительная энергия. Однако не все связи между элементами являются ионными или ковалентными связями. Могут образоваться и более слабые связи. Это притяжения, возникающие между положительными и отрицательными зарядами, для разрушения которых не требуется много энергии. Две часто встречающиеся слабые связи — это водородные связи и ван-дер-ваальсовы взаимодействия. Эти связи создают уникальные свойства воды и уникальные структуры ДНК и белков.
Когда образуются полярные ковалентные связи, содержащие атом водорода, атом водорода в этой связи имеет слегка положительный заряд. Это связано с тем, что общий электрон сильнее притягивается к другому элементу и от ядра водорода. Поскольку атом водорода слегка положительный (δ +), он будет притягиваться к соседним отрицательным частичным зарядам (δ–). Когда это происходит, происходит слабое взаимодействие между зарядом δ + атома водорода одной молекулы и зарядом δ– другой молекулы.Это взаимодействие называется водородной связью. Этот тип облигации распространен; например, жидкая природа воды вызвана водородными связями между молекулами воды (рис. 4). Водородные связи придают воде уникальные свойства, поддерживающие жизнь. Если бы не водородная связь, вода была бы газом, а не жидкостью при комнатной температуре.
Рисунок 4 Водородные связи образуются между слегка положительными (δ +) и слегка отрицательными (δ–) зарядами полярных ковалентных молекул, таких как вода.Водородные связи могут образовываться между разными молекулами, и они не всегда должны включать молекулу воды. Атомы водорода в полярных связях внутри любой молекулы могут образовывать связи с другими соседними молекулами. Например, водородные связи удерживают вместе две длинные нити ДНК, чтобы придать молекуле ДНК характерную двухцепочечную структуру. Водородные связи также ответственны за некоторые трехмерные структуры белков.
Взаимодействия Ван-дер-Ваальса
Подобно водородным связям, ван-дер-ваальсовы взаимодействия представляют собой слабое притяжение или взаимодействие между молекулами.Они возникают между полярными ковалентно связанными атомами в разных молекулах. Некоторые из этих слабых притяжений вызваны временными частичными зарядами, которые образуются при движении электронов вокруг ядра. Эти слабые взаимодействия между молекулами важны в биологических системах.
Список литературыЕсли не указано иное, изображения на этой странице находятся под лицензией CC-BY 4.0 от OpenStax.
OpenStax, Концепции биологии. OpenStax CNX. 22 марта 2017 г. https://cnx.org/contents/[email protected]: IBRqRY3C @ 8 / Строительные блоки молекулы
Каковы характеристики химической реакции класса 10 по химии CBSE
Подсказка: Обычно вы должны знать, что химические реакции происходят, когда две или более молекул взаимодействуют друг с другом и претерпевают определенные изменения. Химическая реакция вызывает изменение химических свойств вещества. Полный пошаговый ответ:
Простыми словами мы можем сказать, что химическая реакция перестраивает составляющие атомы реагентов с образованием различных веществ в виде продуктов.По сути, это процесс, в котором одно или несколько веществ превращаются в одно или несколько разных веществ.
Чтобы ответить на этот вопрос, давайте рассмотрим следующие варианты и проверим, являются ли они характерными для химической реакции:
— Выделение газа: Существует множество химических реакций, которые характеризуются выделением газа.
Пример: когда карбонат натрия реагирует с разбавленной соляной кислотой, происходит выделение диоксида углерода.
\ [N {{a} _ {2}} C {{O} _ {3}} + 2HCl (водн.) \ To 2NaCl (водн.) + {{H} _ {2}} O (l) + C {{O} _ {2}} (g) \]
Образование осадка: существует множество химических реакций, которые характеризуются образованием осадка.
Пример: При реакции нитрата серебра и хлорида натрия образуется белый осадок хлорида серебра.
\ [AgN {{O} _ {3}} + NaCl \ to NaN {{O} _ {3}} + AgCl \ downarrow \]
Изменение цвета: В химии мы часто проводим титрование. По сути, это химическая реакция между кислотами и основаниями. Его конечная точка наблюдается по изменению цвета. Помимо титрования, существует также множество химических реакций (например, образование оксидов металлов), которые характеризуются изменением цвета.
Пример: Когда лимонная кислота реагирует с перманганатом калия, пурпурный цвет перманганата калия исчезает.
\ [{{C} _ {6}} {{H} _ {8}} {{O} _ {7}} + 3KMn {{O} _ {4}} \ to 3HMn {{O} _ { 4}} + {{C} _ {6}} {{H} _ {5}} {{K} _ {3}} {{O} _ {7}} \]
Изменение температуры: Есть определенные химические реакции, которые характеризуются изменением температуры. Реакции, в которых выделяется тепло, называются экзотермическими реакциями, а реакции, в которых поглощается тепло, называются эндотермическими реакциями.
Пример: Когда негашеная известь вступает в реакцию с водой, образуется гашеная известь и вырабатывается энергия. Это экзотермическая реакция.
\ [CaO + {{H} _ {2}} O \ to Ca {{\ left (OH \ right)} _ {2}} \]
Из приведенного выше обсуждения видно, что все они являются характеристикой химической реакции.
Итак, правильный ответ — «Вариант Д».
Примечание: Вы должны знать, что смеси и растворы сильно отличаются от химических реакций, поскольку мы уже знаем, что молекулы вещества остаются такими же.
Химические реакции играют важную роль в технологии, культуре и даже в самой жизни.Химические реакции изобилуют геологией Земли, атмосферы и океанов.
Физические и химические свойства соединений: типы и примеры — видео и стенограмма урока
Физические свойства
Физическое свойство — это характеристика, которую можно наблюдать или измерять. Есть много типов физических свойств, которые можно использовать для различения соединений. Давайте посмотрим на некоторые из наиболее общих физических свойств соединений. Цвет и запах — это физические свойства.И то и другое очень легко наблюдать, используя зрение и обоняние. Например, соль, о которой мы узнали, которая на самом деле представляет собой соединение хлорида натрия, имеет белый цвет и не имеет запаха, тогда как химическое соединение сероводорода, имеющее формулу h3S, бесцветно и пахнет тухлыми яйцами.
Точка плавления и точка кипения — это другие общие физические свойства. Когда вещества плавятся, они превращаются из твердого в жидкое. Точка плавления — это температура плавления твердого вещества.Например, замороженный куб h3O, который вы называете кубиком льда, имеет температуру плавления 0 градусов Цельсия. При достижении этой температуры кубик льда начинает таять в жидкую воду. Если вы продолжите увеличивать нагрев, эта жидкая вода достигнет точки кипения , , то есть температуры, при которой жидкость превращается в газ.
В случае воды точка кипения достигается при 100 градусах Цельсия. При такой температуре вода превращается в водяной пар или пар, как если бы вы видели парящую над кастрюлей с водой на плите.Конечно, не все вещества плавятся или закипают одновременно. Это помогает нам идентифицировать загадочные вещества. Например, если у вас есть жидкость, которую вы не знаете, вы можете вскипятить ее и определить температуру кипения. Вы также можете отметить другие физические свойства, такие как цвет и запах. Эта информация дает вам подсказки, которые помогут идентифицировать загадочную сущность.
Химические свойства
Химическое свойство также может использоваться для отличия одного соединения от другого.Однако это свойство не так просто наблюдать, как физическое свойство. Химическое свойство — это характеристика вещества, которую можно наблюдать только во время некоторого типа химической реакции. Например, некоторые соединения реагируют на кислоту. Когда вы напишете свое имя на доске с помощью мелка, на руке может остаться немного меловой пыли, но не более того. Однако, если вы уроните тот же самый кусок мела, который на самом деле представляет собой химическое соединение карбонат кальция или CaCO3, в стакан с соляной кислотой, он отреагирует, выпуская наблюдаемые пузырьки углекислого газа.
Другие соединения реагируют на свет. Одно из химических соединений, с которым вы, возможно, знакомы, — это перекись водорода или h3O2. На самом деле, у вас дома может быть коричневая бутылка с перекисью водорода, которую вы используете в качестве антисептика, когда получаете порезы или царапины. Вы когда-нибудь задумывались, почему бутылка с этим составом всегда коричневая? Темная бутылка защищает перекись водорода внутри от света. Если бы это было в прозрачной бутылке, соединение разложилось бы на воду и кислород. Перекись водорода и другие соединения также могут изменяться под действием тепла, поэтому мы видим, что реакция на тепло является еще одним химическим свойством соединений.
Еще одно важное химическое свойство — горючесть. Вы помните, как ранее в этом уроке я сказал, что соединение состоит из элементов и что свойства вновь образованного соединения отличаются от свойств его элементов? Что ж, старый добрый h3O настолько негорюч, насколько вы можете найти. Итак, мы можем сказать, что химическое свойство воды состоит в том, что она негорючая. Однако этого нельзя сказать о водороде, составляющем воду. Водород легко воспламеняется и легко горит.
Резюме урока
Давайте рассмотрим:
Ключевые термины
соединения: вещества, состоящие из двух или более различных элементов, которые химически объединены
физическое свойство: характеристика, которую можно наблюдать или измерять
точка плавления: температура плавления твердого вещества
точка кипения: температура, при которой жидкость превращается в газ
химическое свойство: характеристика вещества, которую можно наблюдать только во время некоторого типа химической реакции
Результат обучения
Изучив этот урок, вы должны быть в состоянии объяснить различные свойства, по которым можно идентифицировать различные соединения.

 Высший гидроксид H4PO4 – кислотный
Высший гидроксид H4PO4 – кислотный  Уравнения реакций с участием электролитов запишите также в ионной форме.
Уравнения реакций с участием электролитов запишите также в ионной форме.
 Рассмотрите их с позиций процессов окисления-восстановления.
Рассмотрите их с позиций процессов окисления-восстановления.


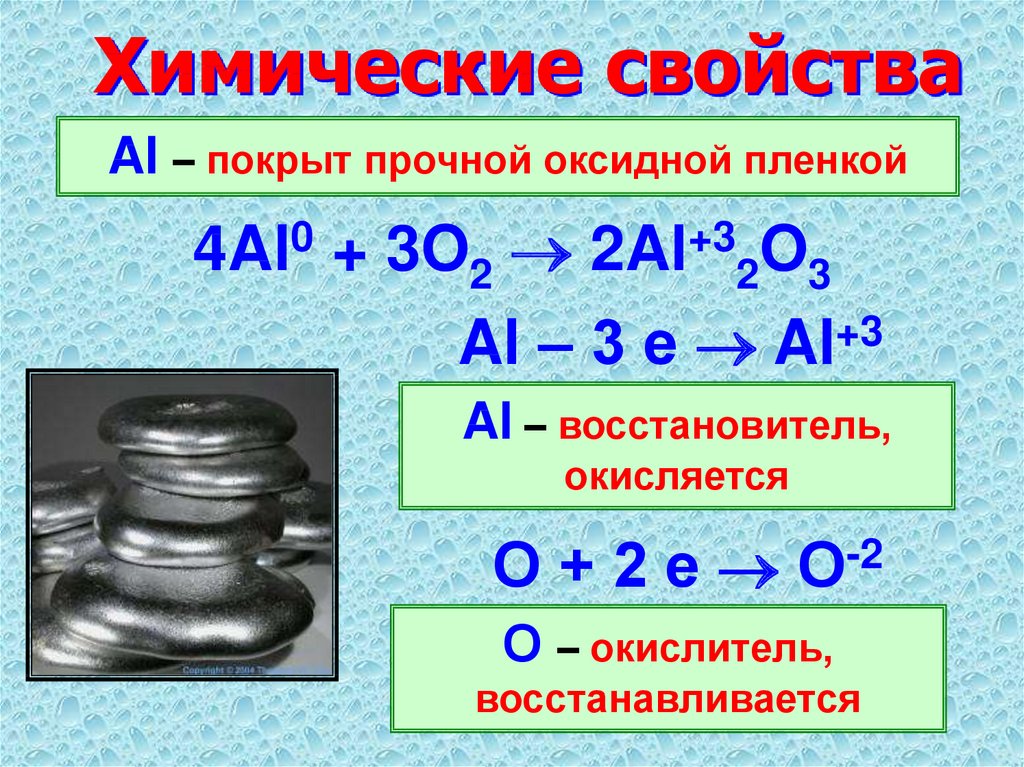

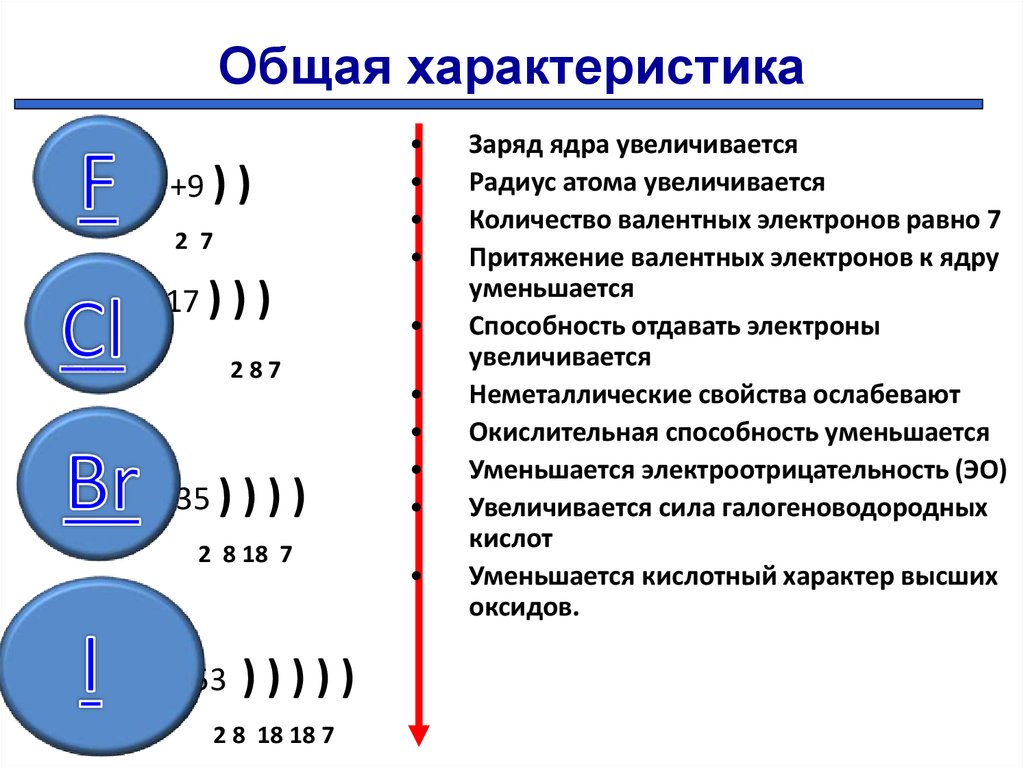 Ставрополя
Ставрополя (1 балл) Элемент, у которого распределение
электронов по энергетическим уровням
2ē, 8ē, 8ē :
(1 балл) Элемент, у которого распределение
электронов по энергетическим уровням
2ē, 8ē, 8ē : (1 балл) Формула высшего оксида фосфора
отвечает общей формуле:
(1 балл) Формула высшего оксида фосфора
отвечает общей формуле: (1 балл)
Амфотерный
гидроксид
— это:
(1 балл)
Амфотерный
гидроксид
— это: (1 балл) Фактор, не влияющий на скорость
химической реакции:
(1 балл) Фактор, не влияющий на скорость
химической реакции: (2 балла) В приведенной схеме V2O5 + Al
= Al2O3 + V,
определите степень окисления каждого
элемента и расставьте коэффициенты
методом электронного баланса.
(2 балла) В приведенной схеме V2O5 + Al
= Al2O3 + V,
определите степень окисления каждого
элемента и расставьте коэффициенты
методом электронного баланса. (1 балл)
Электронная
формула
Ne:
(1 балл)
Электронная
формула
Ne: (1 балл) Одинаковое число электронов
содержат частицы:
(1 балл) Одинаковое число электронов
содержат частицы: (1 балл) Ряд в котором гидроксиды
расположены в порядке возрастания
основных свойств — это:
(1 балл) Ряд в котором гидроксиды
расположены в порядке возрастания
основных свойств — это: (1 балл) Реакция V2O5 + Al
= Al2O3 + V:
(1 балл) Реакция V2O5 + Al
= Al2O3 + V: Э. ФОРМУЛА ГИДРОКСИДА
ХАРАКТЕР ГИДРОКСИДА
Э. ФОРМУЛА ГИДРОКСИДА
ХАРАКТЕР ГИДРОКСИДА (2 балла) В
приведенной схеме Fe2O3 + CO
= Fe
+ CO2,
определите степень окисления каждого
элемента и расставьте коэффициенты
методом электронного баланса.
(2 балла) В
приведенной схеме Fe2O3 + CO
= Fe
+ CO2,
определите степень окисления каждого
элемента и расставьте коэффициенты
методом электронного баланса. (1 балл)
Электронная
формула
Ne:
(1 балл)
Электронная
формула
Ne: (1 балл) Одинаковое число электронов
содержат частицы:
(1 балл) Одинаковое число электронов
содержат частицы: (1 балл) Ряд в котором элементы
расположены в порядке возрастания
неметаллических свойств — это:
(1 балл) Ряд в котором элементы
расположены в порядке возрастания
неметаллических свойств — это: (1 балл) Сокращенное ионное уравнение
Ba2+ + SO42+ = BaSO4 ↓ соответствует взаимодействию:
(1 балл) Сокращенное ионное уравнение
Ba2+ + SO42+ = BaSO4 ↓ соответствует взаимодействию: (2 балла) 17. (2
балла) В приведенной схеме РH3 + O2 = P2O5 + H2O,
определите степень окисления каждого
элемента и расставьте коэффициенты
методом электронного баланса.
(2 балла) 17. (2
балла) В приведенной схеме РH3 + O2 = P2O5 + H2O,
определите степень окисления каждого
элемента и расставьте коэффициенты
методом электронного баланса. Схема будови атома
Схема будови атома


 У них есть множество свойств, которые обычно зависят от штата, в котором они находятся.
У них есть множество свойств, которые обычно зависят от штата, в котором они находятся.