ГДЗ по Химии для 8‐9 класса дидактический материал А.М. Радецкий на 5
Автор: А.М. Радецкий.
Издательство: Просвещение 2016
Одним из самых сложных предметов школьной программы является химия. Ее изучение очень часто вызывает сложности у учащихся. Многие попросту не понимают предметный материал и допускают многочисленные ошибки, страдают оценки и успеваемость. Поможет исправить подобную ситуацию «ГДЗ по Химии 8-9 класс Дидактические материалы Радецкий (Просвещение)».
Химия – это часть нашей жизни, и она затрагивает практически все стороны жизнедеятельности человека. Это касается таких областей, как:
- Фармакология и медицина.
- Лёгкая и пищевая промышленность.
- Сельское хозяйство.

- Добыча нефти и газа, металлургия.
Мы ежесекундно сталкиваемся с химическими реакциями в повседневной жизни, начиная с приготовления пищи и заканчивая биологическими процессами, происходящими в нашем организме, поэтому элементарными знаниями в области химической науки должен обладать каждый.
Реальная помощь решебника дидактических материалов по химии для 8-9 классов от Радецкого
На страницах сборника расположены максимально понятные и верные ответы. Они детально расписаны практически к каждому заданию учебника. С помощью онлайн-решебника ученик сможет не только разобрать особо сложный материал и понять основную суть вопроса, но и заблаговременно подготовиться к текущему опросу на уроке, правильно сделать и оформить домашнее задание, а также закрепить уже пройденные темы. Так как структура пособия идентична учебному изданию и расположение упражнений полностью совпадает, найти готовое решение по номеру задания легко и просто. ГДЗ станут прекрасным подспорьем в учёбе.
С чем столкнутся ученики
Приступая к освоению учебной программы, восьмиклассники познакомятся с основными химическими понятиями и терминами. Далее они рассмотрят следующие темы:
- – вещества, их строение и свойства;
- – химические реакции и их характеристики;
- – металлы и неметаллы, их применение.
Курс достаточно обширный и отличается сложностью, поэтому чтобы его понять и эффективно усвоить тематику, ребятам лучше всего использовать в процессе обучения дополнительную помощь в виде «ГДЗ к дидактическим материалам по Химии за 8-9 класс Радецкий А. М. (Просвещение)».
Химия. Дидактический материал 8-9 класс — Радецкий А.
 М. | 978-5-090-78636-2 Стоимость товара может отличаться от указанной на сайте!
М. | 978-5-090-78636-2 Стоимость товара может отличаться от указанной на сайте! Наличие товара уточняйте в магазине или по телефону, указанному ниже.
8 (473) 277-16-90
г. Липецк, проспект Победы, 19А
8 (4742) 22-00-28
8 (473) 247-22-55
г. Воронеж, ул. Плехановская, д. 33
Воронеж, ул. Плехановская, д. 33
8 (473) 252-57-43
г. Воронеж, ул. Ленинский проспект д.153
8 (473) 223-17-02
г. Нововоронеж, ул. Ленина, д.8
8 (47364) 92-350
г. Воронеж, ул. Хользунова, д. 35
8 (473) 246-21-08
 Россошь, Октябрьская пл., 16б
Россошь, Октябрьская пл., 16б8 (47396) 5-29-29
г. Россошь, пр. Труда, д. 26А
8 (47396) 5-28-07
8 (4712) 51-91-15
г. Воронеж, ул.Челюскинцев, д 88А
8 (4732) 71-44-70
г. Воронеж, ул. Ростовская, д,58/24 ТЦ «Южный полюс»
Воронеж, ул. Ростовская, д,58/24 ТЦ «Южный полюс»
8 (473) 280-22-42
г. Воронеж, ул. Пушкинская, 2
8 (473) 300-41-49
г. Липецк, ул.Стаханова,38 б
8 (4742) 78-68-01
8 (4725) 39-00-10
г.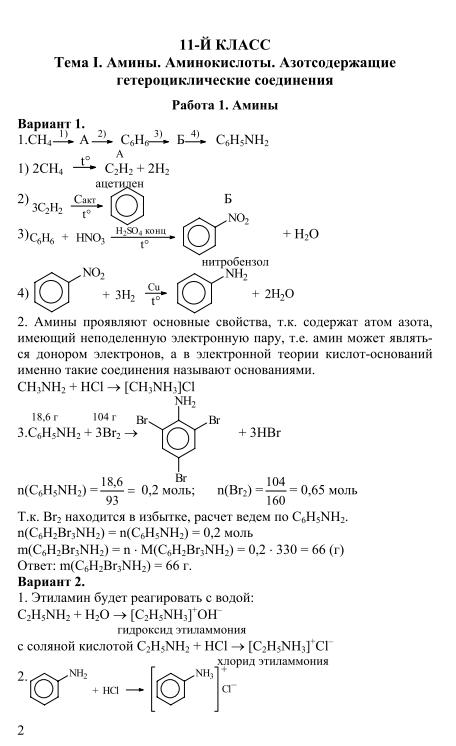 Воронеж, Московский пр-т, д. 129/1
Воронеж, Московский пр-т, д. 129/1
8 (473) 269-55-64
ТРЦ «Московский Проспект», 3-й этаж
Химия 8-9 класс. Радецкий А.М.
Чтобы жизнь в 8 классе была полегче, был специально создан гдз по химии за 8-9 класс Радецкого. В нём доступны решения абсолютно ко всем заданиям, упражнениям, а также самостоятельным работам, которые учителя могут выдать в школе как дополнительное задание.
Может так случится, что у школьника не хватаем времени чтобы понять и въехать в новый материал, тогда на помощь придёт решебник по химии за 8-9 класс Радецкого и позволит не обязательно списать домашнее задание, а закрепить и освоить пройденный материал и создать базу для новой информации по предмету. С нашим гдз у школьника будет возможность подсмотреть как надо выполнять домашнюю работу, а также шансы выполнить даже сложные задачи и написать уравнения реакций.
Все мы знаем, что учителя очень часто без предупреждения устраивают самостоятельные или контрольные работы, по химии это происходит не так уж и редко. Очень часто в качестве источники для задач выступает учебник или дидактические материалы. Если ученик хочет, чтобы оценка по контрольной работе была высокая, то хорошо подготовится к проверке знаний по химии ему помогут ответы за 8-9 класс Радецкого. _fih2+4Cl.20 ]o]2⋅53,5 ]2⋅17 ]2NH 4 Cl +CaO → 2NH 3 +CaCl+h3O20o ⋅ ⋅=o] ⋅ 2 ⋅ 53,5 2 ⋅17mij(Nh4)= § (Nh4) ⋅ ml_hj(Nh4)=0,98 ⋅ ]Hl\_lmij(Nh4 ]6,4 ]oetR5. NH 4 NO 2 → N 2 +2h3O64 ]22,4 e6, 4o ⋅ =oe64 22, 4Vij(N2)= § (N2) ⋅ Vl_hj=0,89 ⋅ eHl\_lVij(N2 e56 ]oe22,4 e2⋅22,4 e6.
_fih2+4Cl.20 ]o]2⋅53,5 ]2⋅17 ]2NH 4 Cl +CaO → 2NH 3 +CaCl+h3O20o ⋅ ⋅=o] ⋅ 2 ⋅ 53,5 2 ⋅17mij(Nh4)= § (Nh4) ⋅ ml_hj(Nh4)=0,98 ⋅ ]Hl\_lmij(Nh4 ]6,4 ]oetR5. NH 4 NO 2 → N 2 +2h3O64 ]22,4 e6, 4o ⋅ =oe64 22, 4Vij(N2)= § (N2) ⋅ Vl_hj=0,89 ⋅ eHl\_lVij(N2 e56 ]oe22,4 e2⋅22,4 e6.
N 2 +3h3 → 2NH 356o ⋅ ⋅ =oe22, 4 2 ⋅ 22, 4Vij(Nh4)= § (Nh4) ⋅ Vl_hj(Nh4)=0,5 ⋅ e9m(Nh4)=⋅ m(Nh4)=⋅ ]9PHl\_lVij(Nh4 em(Nh4 ]107 ]oeot7. NH 4 Cl → NH 3 +HCl53,5 ]22,4 eo= § (Nh4)=VijVl_hjo= ⋅ ebebHl\_l § (Nh4)=84,8%31o d]200 d]8. P → H 3 PO 431 d]107o=53,5 22, 4mij(P)=98 d]m l_hjη(P)=o⋅ d]]Hl\_lP3 ]33 ]oe132 ]2⋅22,4 e9.
(NH 4 )2SO4 +Ca(OH)2 → CaSO4+ 2NH 3 +2h3O33o ⋅ ⋅ oe=132 2 ⋅ 22, 4Vij= § (Nh4) ⋅ Vl_hj(Nh4)=11,2 ⋅ eHl\_l91+3 eo]4e10. Cu+ 4HNO3dhgp → Cu(NO3)2+ 2NO 2 +2h3O64 ]o=64 44,8mij(Cu)=m l_hjη(P) ⋅ o]=2⋅22,4 e]Hl\_lm(&X ]30 ]oe2⋅53,5 ]2⋅22,4 e11. 2NH 4 Cl +Ca(OH)2 → CaCl2+ 2NH 3 ↑ +2h3O33o ⋅ ⋅ oe= ⋅ 132 2 ⋅ 22, 4Vij(Nh4)=Vl_hj ⋅ § (Nh4)=12,561 ⋅ eHl\_l91+3 e20,2 ]o]2⋅101 ]2⋅63 ]12. 2KNO3 +h3SO4 → K2SO4+ 2HNO320, 2o ⋅ ⋅ o]= ⋅2 ⋅101 2 ⋅ 63mij(HNO3)=ml_hj ⋅ § (HNO3)=0,98 ⋅ ]Hl\_lm(HNO3 ]3240 ]oeot13. _j`Zs_]hijbf_kb1.
_j`Zs_]hijbf_kb1.
CaCO3 → CaO + CO2ω(CaCO3) = 100% – 10% = 90%m(CaCO3) = 600 ⋅ 0,9 = 540 ]540 ]o]CaCO3 → CaO + CO2100 ]56 ]540x=100 56540 ⋅ 56x== 302,4 ]100Hl\_lm(CaO) = 302,4 ]2. CaCO3 → CaO + CO2ω(CaCO3) = 100% – 20% = 80%m(CaCO3) = 200 ⋅ 0,8 = 160 ]160 ]oe100 ]22,4 eCaCO3 → CaO + CO 2160x=100 22,4160 ⋅ 22,4x== 35,84 e100Hl\_l9&22) = 35,84 e3. N2 + 3h3 → 2Nh442ω(N2) = 100% – 5% = 95%m(N2) = 50 ⋅ 0,95 = 47,5 ]47,5 ]o]28 ]2⋅17 ]N 2 + 3h3 → 2NH 347,5x=282 ⋅ 1747,5 ⋅ 2 ⋅ 17o]28η(Nh4) =m ijm l_hj=8= 0,139 beb57, 7Hl\_lη(Nh4) = 13,9%.t04. CaCO3 → CaO + CO2ω(CaCO3) = 100% – 6% = 94%m(CaCO3) = 0,94 ⋅ 400 = 376 d]376 d]o d]t0CaCO3 → CaO + CO2100 d]56 d]376x=100 5656 ⋅ 376od]100Hl\_lm(CaO) = 210,56 d]5.
CaCO3 → CaO + CO2ω(CaCO3) = 100% – 8% = 92%m(CaCO3) = 0,92 ⋅ 500 = 460 d]460 d]o d]of 3CaCO3 → CaO + CO 2100 d]56 d]22,4 f3460x=100 56460 ⋅ 56od]100460x=100 22,4460 ⋅ 22,4of3100Hl\_lm(CaO) = 257,6 d]V(CO2) = 103 f3.6.43o]2,24 e106 ]22,4 eNa 2 CO3 + 2HNO3 → 2NaNO3 + h3O + CO 2×2,24=106 22,4106 ⋅ 2,24o]22,410,6ω(Na2CO3) == 0,9815 beb10,8ωijbf = 100% – 98,15% = 1,85%Hl\_lωijbf = 1,85%.7.
Гдз по Химии 9 класс
Гдз по Химии 9 классАвторизуйтесь с помощью одного из способов
Забыли пароль?
А.Д. Микитюк
В.В. Еремин, А.А. Дроздов, Г.А. Шипарева
О.С. Габриелян, А.В. Яшукова
О.С. Габриелян С.А. Сладков
Т.А. Боровских
Н.И. Габрусева
А.Д. Микитюк
А.Д. Микитюк
Г.Е. Рудзитис, Ф.Г. Фельдман
« М.: Просвещение, 1999»
О.С. Габриелян
«М.: Дрофа, 2002»
Г.Е. Рудзитис, Ф.Г. Фельдман
«М.: Просвещение»
Л.С. Гузей, В.В. Сорокин, Р.П. Суровцева
«М.: Дрофа»
Минченков Е.Е., Цветков Л.А.
О.С. Габриелян
«М.: Дрофа»
А.М. Радецкий, В.П. Горшкова
«М.: Просвещение, 2000»
И.Г. Хомченко
«М.: Новая волна»
closeairplanecheckпособие для учителей общеобразовательных учреждений ОНЛАЙН
Радецкий А. М. Химия. Дидактический материал. 8—9 классы : пособие для учителей общеобразовательных учреждений / А. М. Радецкий. — 3-е изд. — М., 2011. — 127 с.
Пособие известного автора переработано и включено в линию учебно-методических комплектов по химии г. Е. Рудзитиса и Ф. Г. Фельдмана. Сборник может также использоваться с любыми учебниками химии для основной школы.
Содержание
Предисловие 3
8 класс
Тема I. Первоначальные химические понятия
Работа 1. Физические и химические явления. Химические элементы. Простые и сложные вещества 4
Работа 2. Химические формулы. Относительная молекулярная масса 6
Работа 3. Валентность 7
Работа 4. Химические уравнения 8
Работа 5. Типы химических реакций 9
Работа 6. Количество вещества. Моль. Молярная масса 11
Итоговая работа по теме I 12
Дополнительные задания 14
Тема II. Кислород. Горение
Работа 1. Получение и свойства кислорода 17
Работа 2. Состав воздуха. Горение веществ на воздухе 18
Итоговая работа по теме II 19
Дополнительные задания 20
Тема III. Водород
Работа 1. Получение и свойства водорода 22
Дополнительные задания 23
Тема IV. Растворы. Вода
Работа 1. Вычисление массовой доли и массы вещества в растворе 24
Дополнительные задания к работе 1 25
Работа 2. Свойства воды 26
Дополнительные задания к работе 2 27
Тема V. Обобщение сведений о важнейших классах неорганических соединений
Работа 1. Классификация неорганических соединений 28
Работа 2. Оксиды. Основания —
Дополнительные задания к работе 2 30
Работа 3. Свойства кислот. Соли —
Дополнительные задания к работе 3 31
Работа 4. Взаимосвязь между оксидами, основаниями, кислотами и солями 32
Работа 5. Химические реакции, характеризующие отдельные классы неорганических соединений 33
Дополнительные задания к работам 4—5 35
Итоговая работа по теме V 36
Тема VI. Периодический закон и периодическая таблица химических элементов Д. И. Менделеева. Строение атома
Работа 1. Периоды и группы периодической системы химических элементов 38
Работа 2. Строение атома 39
Итоговая работа по теме VI 41
Дополнительные задания 43
Тема VII. Химическая связь. Строение веществ
Работа 1. Химическая связь. Кристаллические решетки 45
Работа 2. Электроотрицательность и степень окисления 46
Работа 3. Окислительно-восстановительные реакции 48
Итоговая работа по теме VII 49
Дополнительные задания 51
Тема VIII. Закон Авогадро. Молярный объем газов
Работа 1. Решение расчетных задач 52
Дополнительные задания 53
Тема IX. Галогены
Работа 1. Хлор. Хлороводород. Соляная кислота 54
Работа 2. Фтор. Бром. Иод 55
Работа 3. Решение расчетных задач 57
Итоговая работа по теме IX 58
Дополнительные задания 59
9 класс
Тема I. Электролитическая диссоциация
Работа 1. Электролиты и неэлектролиты. Электролитическая диссоциация 62
Работа 2. Электролитическая диссоциация. Реакции ионного обмена 63
Работа 3. Реакции ионного обмена. Гидролиз солей 64
Работа 4. Химические свойства кислот, солей и оснований в свете теории электролитической диссоциации 65
Работа 5. Расчеты по уравнениям реакций, если одно из реагирующих веществ дано в избытке 66
Итоговая работа по теме I 68
Дополнительные задания 69
Тема II. Кислород и сера
Работа 1. Кислород. Сера. Серная кислота 71
Работа 2. Скорость химических реакций. Химическое равновесие 73
Итоговая работа по теме II 74
Дополнительные задания 76
Тема III. Азот и фосфор
Работа 1. Азот. Аммиак. Соли аммония 77
Работа 2. Азотная кислота и ее соли 79
Работа 3. Фосфор и его соединения 80
Работа 4. Решение расчетных задач на определение массовой или объемной доли выхода продукта реакции от теоретически возможного (и обратных задач) 81
Итоговая работа по теме III 83
Дополнительные задания 84
Тема IV. Углерод и кремний
Работа 1. Углерод. Оксиды углерода 86
Работа 2. Угольная кислота и ее соли 88
Работа 3. Кремний и его соединения 89
Итоговая работа по теме IV 90
Дополнительные задания 92
Тема V. Общие свойства металлов
Работа 1. Способы получения металлов 93
Работа 2. Химические свойства металлов 94
Тема VI. Металлы IA—IIIА-групп периодической таблицы Д. И. Менделеева
Работа 1. Щелочные и щелочно-земельные металлы 96
Работа 2. Алюминий и его соединения 97
Работа 3. Решение расчетных задач на вычисление массы или объема продукта реакции по известной массе или объему вещества, содержащего примеси 98
Итоговая работа по теме VI 99
Дополнительные задания 101
Тема VII. Железо
Работа 1. Железо и его соединения 105
Тема VIII. Металлургия
Работа 1. Способы промышленного получения металлов 106
Дополнительные задания 107
Тема IX. Краткий обзор важнейших органических веществ
Работа 1. Углеводороды 109
Работа 2. Спирты ПО
Работа 3. Карбоновые кислоты. Биологически важные органические вещества 111
Итоговая работа по теме IX 113
Дополнительные задания 114
Приложения
I. Задачи с производственным и межпредметным содержанием 116
Неметаллы —
Металлы 117
II. Генетическая связь между классами неорганических соединений 119
III. Относительная электроотрицательность элементов 120
IV. Таблица растворимости солей, кислот и оснований в воде 121
V. Относительные молекулярные массы некоторых неорганических соединений 122
VI. Соотношения между единицами массы и объема 123
Решебник ⏩ ГДЗ Химия 11 класс ⚡ А. М. Радецкий, Т. Н. Курьянова 2000
ГДЗ 11 класс Химияпоказать обложку
Авторы: А. М. Радецкий, Т. Н. Курьянова
Год: 2000
Рейтинг: 4.4Оцените книгуСамые популярные книги
показать обложку
Авторы:А. Г. Мерзляк, В. Б. Полонский, М. С. Якир, Ю. М. Рабинович
Год:2013
Описание:Сборник задач и контрольных работ
показать обложку
Авторы:В. М. Бойко, И. Л. Дитчук
Год:2017
Описание:Тетрадь для практических работ
показать обложку
Авторы:В. И. Соболь
Год:2015
Описание:Рабочая тетрадь
показать обложку
Авторы:В. Г. Барьяхтар, Ф. Я. Божинова, С. А. Довгий
Год:2015
показать обложку
Авторы:Naomi Simmons
Год:2019
Описание:Family and Friends 4 workbook 2nd edition
показать обложку
Авторы:В. Г. Барьяхтар, Ф. Я. Божинова, Е. А. Кирюхина, С. А. Довгий
Год:2016
- ✅ ГДЗ ✅
- ⚡ 11 класс ⚡
- Химия ✍
- Дидактический материал по общей химии, 11 класс
Что даст выпускникам ГДЗ по химии для 11 класса А.М. Радецкий
Химия — это один из самых сложных предметов в школьной программе. Как бы не старался выпускник и как бы тщательно он не работал на хороший аттестат, справиться со свалившейся нагрузкой без помощи пособий он просто не сможет. Именно поэтому, зачастую выпускники вынуждены прибегать к помощи ГДЗ по химии для 11 класса А.М. Радецкий, Т.Н. Курьянова, 2000. Издание А.М. Радецкий, Т.Н. Курьянова, ГДЗ по химии для 11 класса, 2000 — это пособие, которое призвано подтолкнуть подростков к более тщательному изучение материала. Дело в том, что химия в выпускном классе преподается на достаточно высоком уровне. Следовательно, во время выполнения письменного задания подросток должен буквально пошагово расписать все свои действия. Только после того, как все хода будут записаны подросток может сверить полученный ответ с тем, который предлагает ГДЗ для 11 класса по химии А.М. Радецкий, Т.Н. Курьянова, 2000 и проверить правильно ли он выполнил задание. Самое главное, что если школьник не усвоит материал и не сможет подробно расписать все свои действия, знание правильного ответа, который он спишет из пособия ему ровным счетом ничего не даст. Именно поэтому, не стоит опасаться, что школьник будет просто списывать правильные ответы и забросит учебу. С ГДЗ для 11 класса по химии А.М. Радецкий, Т.Н. Курьянова, 2000 вариант бездумного списывания невозможен.
Химия в 11 классе — как работать с ГДЗ
Издание А.М. Радецкий, Т.Н. Курьянова, ГДЗ по химии для 11 класса, 2000 открывает перед выпускниками уйму возможностей. Во-первых, работая с ГДЗ по химии для 11 класса А.М. Радецкий, Т.Н. Курьянова, 2000 школьники имеют возможность повторить пройденный материал не путем зубрежки правил и формул, а за счет решения практических заданий. Во-вторых, при работе с ГДЗ для 11 класса по химии А.М. Радецкий, Т.Н. Курьянова, 2000 у подростков всегда есть возможность подготовиться к контрольной работе за счет выполнения заданий из школьного учебника. Самое главное, что работая с ГДЗ по химии для 11 класса А.М. Радецкий, Т.Н. Курьянова, 2000 выпускник всегда будет видеть объективную картину относительно того, насколько хорошо он владеет материалом. Именно благодаря ГДЗ по химии для 11 класса А.М. Радецкий, Т.Н. Курьянова, 2000 идя на контрольную работу школьник будет понимать каковы его реальные шансы получить хорошую оценку, а это значит, что он сможет вовремя подтянуть особо сложные темы.
Учебных материалов по химии. Дополнительные материалы по химии
Химия — одна из наук, изучающих природу. Или, скорее, элементарные частицы (атомы и молекулы), вещества, которые они образуют, и законы, по которым протекают химические реакции. Исторически сложилось так, что вся дисциплина состоит из двух разделов: неорганической химии и органической химии. До конца 18 века. эти термины означают только то, к какому царству природы (животному, растительному или минеральному) принадлежат полученные соединения.Но с начала 19 века их значение изменилось. Теперь указывают, есть ли в полученном веществе углерод. Неорганическая химия соприкасается с науками о «неживой» природе: геологией, минералогией, геохимией. И органический — наоборот, с биохимией и биологией.
Для школьников, желающих улучшить свои знания по химии, предлагается большое количество дополнительной литературы. Именно «дополнительные», потому что школьные учебники всегда были и останутся основными.Все книги соответствуют образовательному стандарту РФ и могут быть использованы для самостоятельной работы.
Примером может служить «Краткий курс химии. Пособие для поступающих в вузы »Кузьменко Н.Е. Книга содержит фундаментальные основы, которые должен понимать каждый выпускник, планирующий стать инженером-химиком, врачом или биологом. Это одна из самых полных проблемных сборников по предмету, в которых Кроме того, дано достаточное количество теории.
Книга привлекает внимание, используя, как доказано, наиболее эффективные способы подачи материала — иллюстративную и табличную. Он называется «Вся химия в 50 таблицах». Автор — Стахеев Ю.А. Пособие можно использовать для ознакомления при подготовке к экзамену. Учителя могут использовать его для подготовки раздаточных карточек к урокам. Помимо таблиц, в книге представлена информация о решении основных типов задач по химии.
Но, чтобы освоить методику решения практических задач, лучше выбрать что-то более фундаментальное.Например, «1001 задача по химии с ответами, инструкциями, решениями» Слета Л.А. Он охватывает все разделы общей, органической и неорганической химии и подходит как школьникам, так и студентам. В нем есть два типа задач: качественные и количественные (расчетные). Помимо заданий школьного курса, в сборник вошли задания региональных олимпиад. Заключительная часть содержит ответы, подробные решения и комментарии.
Еще одна книга, о которой обязательно стоит помнить — «Краткий справочник по химии» Куриленко О.Д.Преимущество учебников данного типа в том, что они предоставляют информацию по химии в удобной сжатой форме, которая необходима не только школьникам или студентам, но и работникам химической промышленности, сельского хозяйства, лабораторий и т. Д.
Есть и другие полезные книги: «Химия. Учебник для вузов «Никольский А.Б.», «Энциклопедический словарь юного химика» (авторский коллектив), «Органическая химия. Шпаргалка »(авторский коллектив) и др. Все они написаны с одной целью — помочь студентам освоить эту увлекательную дисциплину.
2-е изд. — М .: Просвещение, 2011. — 144 с.
Формат: pdf
Размер: 2.9 Мб
drive.google
Дидактические материалы по химии для 10-11 классов. ЯВЛЯЮСЬ. Радецкий, В. Горшкова, Л. Кругликова ( 1999 г. , 2-е изд., 80-е гг.)
Формат: djvu / zip (отсканировано немного небрежно, заканчивается на странице 75, а страницы 76-77 в начале, между страницами 5 и 6)
Размер: 65 0 Кб
/ Скачать файл
Содержание (изд.2011, 144с.)
Предисловие 3
10 класс
Тема I. Теория химического строения органических соединений. Электронная природа химической связи
Работа 1. Химическая структура органических веществ. Изомерия. Электронная природа химических связей … 4
Тема II. Предельные углеводороды (алканы или парафины)
Работа 1. Номенклатура и гомология алканов 5
Работа 2. Изомерия, получение и химические свойства алканов 7
Работа 3.Задания на проектирование 11
Заключительная работа по теме II 13
Дополнительные задания 15
Тема III. Ненасыщенные углеводороды (алкены, алкадиены и алкины)
Работа 1. Номенклатура, гомология и изомерия алкенов 17
Работа 2. Получение и химические свойства алкенов 20
Работа 3. Диеновые углеводороды. Натуральный каучук 21
Работа 4. Ацетиленовые углеводороды (алкины) 22
Работа 5. Задания на проектирование 23
Заключительные работы по теме III 27
Дополнительные задания 29
Тема IV.Ароматические углеводороды (арены)
Работа 1. Номенклатура, изомерия и химические свойства аренов 31
Работа 2. Взаимосвязь предельных, ненасыщенных и ароматических углеводородов 32
Работа 3. Проектные задания 33
Дополнительные задания 34
Тема V. Естественная источники углеводородов и их переработка
Работа 1. Природные источники углеводородов 35
Дополнительные задания 36
Тема VI. Спирты и фенолы
Работа 1. Насыщенные одноатомные спирты 36
Работа 2.Многоатомные спирты и фенолы 38
Работа 3. Проектные задания 39
Дополнительные задачи 40
Тема VII. Альдегиды, кетоны и карбоновые кислоты
Работа 1. Альдегиды 42
Работа 2. Карбоновые кислоты 44
Работа 3. Проектные задания 46
Работа 4. Генетическая взаимосвязь между углеводородами, спиртами, альдегидами и карбоновыми кислотами 47
Работа 5. Спирты, фенолы , альдегиды, карбоновые кислоты (экспериментальные и вычислительные задачи) 48
Выпускные работы по темам VI, VII 50
Дополнительные задания 52
Тема VIII.Сложные эфиры. Жиры
Задание 1. Сложные эфиры 54
Задание 2. Сложные эфиры, жиры 55
Работа 3. Проектные задания 56
Дополнительные задания 57
Тема IX. Углеводы
Работа 1. Глюкоза, сахароза 59
Работа 2. Крахмал, целлюлоза 60
Работа 3. Спирты, альдегиды, карбоновые кислоты, углеводы (экспериментальные и расчетные задачи) 61
Работа 4. Проектные задания 62
Заключительная работа по темам VIII , IX 63
Дополнительные задания 64
Тема X. Азотсодержащие органические соединения
Задание 1.Амины 66
Работа 2. Аминокислоты, белки 67
Работа 3. Задания дизайна 68
Заключительная работа по теме X 69
Дополнительные задания 70
Тема XI. Синтетические полимеры
Работа 1. Общая характеристика ВМФ. Пластмассы … 72
Задание 2. Каучуки 73
Задание 3. Волокна 74
Дополнительные задания 75
Тема XII. Обобщение знаний по курсу органической химии
Работа 1. Типы изомерии органических веществ 76
Работа 2.Генетическая связь органических соединений 77
Выпускная работа по курсу органической химии 78
Дополнительные мероприятия 82
11 класс
Тема I. Важнейшие химические понятия и законы
Работа 1. Задачи по выводу формул веществ на основе закона постоянства состава веществ 83
Тема II. Периодический закон и периодическая система химических элементов Д. И. Менделеева с точки зрения теории строения атомов
Работа 1.Строение атомов и электронные оболочки атомов 84
Работа 2. Валентные возможности атомов.
Периодическое изменение свойств химических элементов и их соединений 86
Тема III. Структура материи
Работа 1. Структура материи 88
Работа 2. Решение проектных задач для приготовления растворов различной концентрации 89
Выпускная работа по темам I, II, III 91
Дополнительные задания 93
Тема IV. Химические реакции
Работа 1.Классификация химических реакций 95
Работа 2. Скорость химических реакций. Химическое равновесие 96
Работа 3. Электролиты и неэлектролиты. Теория электролитической диссоциации. Реакции в растворах электролитов 99
Работа 4. Гидролиз органических и неорганических соединений 101
Заключительная работа по теме IV 102
Дополнительные задания 105
Тема V. Металлы
Работа 1. Получение металлов. Электролиз. Коррозия металлов 109
Работа 2. Металлы 1А-группа 111
Работа 3.Металлы NA-группы 112
Работа 4. Алюминий и его соединения 114
Работа 5. Медь, железо, хром — металлы B-группы 115
Работа 6. Металлические сплавы. Оксиды и гидроксиды металлов 117
Выпускная работа по теме V 118
Дополнительные задания 120
Тема VI. Неметаллы
Работа 1. Обзор неметаллов. Оксиды и водородные соединения неметаллов 124
Работа 2. Свойства оксидов неметаллов. Кислородсодержащие кислоты 126
Заключительная работа по теме VI 128
Дополнительные мероприятия 130
Заключительная работа по курсу общей химии 135
Заявки 138
Реферат — 1999, 2-е изд., 80 с .:
10 класс (стр. 4-50)
Тема I. Теория химического строения органических соединений.
Работа 1 (4 опции)
Тема II. Углеводороды насыщенные (алканы). Циклопарафины (циклоалканы).
Тема III. Углеводороды ненасыщенные (алкены, алкины).
Задание 1 — задание 6 (каждое задание содержит 4 варианта)
Тема IV. Ароматические углеводороды (арены).
Задание 1 — задание 4 (каждое задание содержит 4 варианта)
Тема V. Спирты и фенолы.
Задание 1 — задание 3 (каждое содержит 4 варианта или проектные задачи)
Тема Vi. Альдегиды и карбоновые кислоты.
Задание 1 — Задание 6 (каждое содержит 4 варианта или проектные задачи)
Тема Vii. Сложные эфиры. Жиры.
Работа 1 — Работа 2 (каждая работа содержит 4 варианта)
Тема VIII. Углеводы.
Задание 1 — Задание 5 (каждое содержит 4 варианта или проектные задачи)
11 класс (стр.51-77)
Тема I. Амины. Аминокислоты. Азотсодержащие гетероциклические соединения.
Задание 1 — задание 4 (каждое задание содержит 4 варианта)
Тема II. Вещества синтетические высокомолекулярные и полимерные материалы на их основе.
Тема III. Обобщение знаний по курсу органической химии.
Работа 1 — Работа 3 (по 4 варианта)
Проблемы с производством и междисциплинарным содержанием (1-20)
Продвинутые задачи (1-10)
Данную презентацию можно использовать на занятиях при изучении нового материала, при повторении и обобщении темы «Арены» и всего курса органической химии, а также при дистанционном обучении студентов.Презентация состоит из 33 слайдов и содержит полное содержание темы, иллюстрации, тестовые задания, биографию ученого Ф.А.Слайд 1 Слайд 5 Слайд 12
Данную презентацию можно использовать на уроках химии при изучении нового материала (23 урок по тематическому планированию «Гара Н.Н. Химия. Уроки в 8 классе») «Горение и медленное окисление. Тепловой эффект химических реакций», с повторением и обобщением по теме «Кислород», а также с дистанционным обучением студентов.Презентация состоит из 31 слайда и содержит полное содержание темы, иллюстрации, задачи, алгоритмы решения задач с использованием термохимических уравнений, раскрывает основные понятия …
Оборудование: интерактивная доска, проектор, программы Microsoft Office Word. Тип урока: изучение новой темы. Формы работы: лобовая, коллективная, индивидуальная. Аннотация: открытый урок на тему «Химические элементы, их названия, символы. Концепция металлов и неметаллов »с применением программы Module 7, разработанной казахстанскими учеными совместно с Кембриджским университетом.Задачи: Познакомить студентов с понятием химический элемент Формировать умение предсказывать свойства элемента …
Заключительное занятие «Углеводороды» по модульной технологии. Материал содержит краткое содержание урока и модуль с заданиями. Реферат позволяет обобщить знания студентов об углеводородах (классификация, названия, изомерия, решение задач, эксперимент). Задачи урока: проследить зависимость свойств веществ от структуры, закрепить понятия: молекулярная структура, тип гибридизации, типы изомерии, номенклатура, свойства органических соединений, отработать умение применять полученные знания на практике с …
Презентация к уроку на тему «Углеводороды» содержит 18 слайдов. Цель урока: обобщить знания учащихся об углеводородах. Задачи урока: проследить зависимость свойств веществ от структуры, закрепить понятия: молекулярная структура, тип гибридизации, гомологический ряд, типы изомерии, номенклатура, свойства органических соединений, отработать умение применять знания. в составлении схем генетической связи, решении задач по выведению молекулярных формул органических соединений, распознаванию алканов, алкенов…
В статье дается описание методики проекта, обосновывается целесообразность ее использования на уроках химии и во внеурочное время. Выбор количества часов и формы проведения таких уроков зависит от типа проекта. Предполагается высокая степень самостоятельности студентов в реализации проекта. Актуализированные предметные знания по химии закрепляются, углубляются, расширяются в процессе работы над проектом и усвоения студентами новых знаний.На занятиях рекомендуется использовать другой метод …
Методическая разработка интерактивного урока химии в 9 классе по теме «Реакции ионного обмена» и презентация к уроку. Используемые групповые, индивидуальные формы работы, игровые моменты, демонстрационные эксперименты, проблемные задания, мультимедийные презентации. Форма занятия — игра-соревнование между командами. Этот урок можно рекомендовать для проведения обобщающих уроков по теме, открытых уроков в течение недели или десятилетия химии, а также для обмена опытом…
Химических материалов. Дополнительные материалы по химии Дополнительные материалы по химии
Вот переработанное пособие, вошедшее в учебно-методический комплекс по химии для общеобразовательных школ. Решебник подготовлен группой известных специалистов в области химии А. Радецкий, В. Горшкова. и Кругликова Л.Н., помогут справиться со всеми заданиями из дидактических материалов для 10-11 классов.
Кому помогают сборники с готовыми ответами:
1.в первую очередь студенты, которые могут самостоятельно решать непонятные задачи и проверять себя;
2. для выпускников, которым необходим справочный материал для качественной подготовки к экзаменам и итоговому тестированию;
3. те родители, которые следят за успеваемостью своего ребенка даже в выпускных классах;
4. Учителя, как дополнительный материал к классу, помогающий в составлении плана урока.
В соответствии с первоначальной редакцией ГДЗ для дидактических материалов 10-11 классов разделены на две большие части: десятый и одиннадцатый классы.Первая часть включает восемь тем. Как и ожидалось, первая тема расскажет об основах предмета, в частности о теории химического строения органических соединений … И уже со второй главы десятиклассники узнают об особенностях насыщенных углеводородов, это о алканы и циклоалканы. В следующих параграфах рассматриваются ненасыщенные углеводороды, такие как алкены и алкины.
Четвертая глава посвящена аренам как ароматическим углеводородам.Информация о спиртах и фенолах находится в следующей главе. Шестая глава включает готовые ответы на задания по альдегидам и карбоновым кислотам … В седьмой и восьмой темах сборника ГДЗ по химии для 10-11 классов дидактические материалы Радецкий школьники познакомятся со сложными эфирами и названными жирами. и углеводы соответственно.
Одиннадцатый класс этого руководства разделен всего на три темы. И первая широкая тема включает ряд подтем, а именно: основные свойства аминов; особенности аминокислот и азотсодержащих гетероциклических соединений.Вторая — довольно сложная тема, посвященная синтетическим высокомолекулярным веществам и полимерным материалам, полученным на их основе. А по окончании учебного курса по предмету химия одиннадцатиклассники обобщат свои знания по курсу органической химии и напишут итоговый тест.
Авторы решебника дают правильные ответы на все работы из вышеперечисленных тем руководства. Также не оставили без внимания задачи повышенной сложности и задачи с производственным и межобъектным контентом.Также студенты найдут решения дополнительных заданий по темам. Материал этого сборника можно использовать как дополнение к любым учебникам химии для средней школы.
2-е изд. — М .: Просвещение, 2011. — 144 с.
Формат: pdf
Размер: 2.9 Мб
drive.google
Дидактические материалы по химии для 10-11 классов. ЯВЛЯЮСЬ. Радецкий, В. Горшкова, Л. Кругликова ( 1999 г. , 2-е изд., 80с.)
Формат: djvu / zip (отсканировано немного небрежно, заканчивается на странице 75, а страницы 76-77 в начале, между страницами 5 и 6)
Размер: 65 0 Кб
/ Скачать файл
Содержание (изд. 2011 г., 144 с.)
Предисловие 3
10 класс
Тема I. Теория химического строения органических соединений. Электронная природа химические связи
Задание 1. Химическое строение органического вещества … Изомерия.Электронная природа химических связей … 4
Тема II. Предельные углеводороды (алканы или парафины)
Работа 1. Номенклатура и гомология алканов 5
Работа 2. Изомерия, получение и химические свойства алканов 7
Работа 3. Проектные задания 11
Заключительная работа по теме II 13
Дополнительные задачи 15
Тема III. Ненасыщенные углеводороды (алкены, алкадиены и алкины)
Работа 1. Номенклатура, гомология и изомерия алкенов 17
Работа 2.Получение и химические свойства алкенов 20
Работа 3. Диеновые углеводороды. Натуральный каучук 21
Работа 4. Ацетиленовые углеводороды (алкины) 22
Работа 5. Задания на проектирование 23
Заключительные работы по теме III 27
Дополнительные задания 29
Тема IV. Ароматические углеводороды (арены)
Работа 1. Номенклатура, изомерия и химические свойства аренов 31
Работа 2. Взаимосвязь предельных, ненасыщенных и ароматических углеводородов 32
Работа 3. Проектные задания 33
Дополнительные задания 34
Тема V.Природные источники углеводородов и их переработка
Работа 1. Природные источники углеводородов 35
Дополнительные задания 36
Тема VI. Спирты и фенолы
Работа 1. Насыщенные одноатомные спирты 36
Работа 2. Многоатомные спирты и фенолы 38
Работа 3. Проектные задания 39
Дополнительные задания 40
Тема VII. Альдегиды, кетоны и карбоновые кислоты
Работа 1. Альдегиды 42
Работа 2. Карбоновые кислоты 44
Работа 3. Проектные задания 46
Работа 4.Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот 47
Работа 5. Спирты, фенолы, альдегиды, карбоновые кислоты (экспериментальные и вычислительные задачи) 48
Заключительная работа по темам VI, VII 50
Дополнительные задания 52
Тема VIII. Сложные эфиры … Жиры
Задание 1. Сложные эфиры 54
Задание 2. Сложные эфиры, жиры 55
Работа 3. Проектные задания 56
Дополнительные задания 57
Тема IX. Углеводы
Работа 1. Глюкоза, сахароза 59
Работа 2.Крахмал, целлюлоза 60
Работа 3. Спирты, альдегиды, карбоновые кислоты, углеводы (экспериментальные и вычислительные задачи) 61
Работа 4. Проектные задания 62
Заключительная работа по темам VIII, IX 63
Дополнительные задания 64
Тема X. Азот- содержащие органические соединения
Задание 1. Амины 66
Работа 2. Аминокислоты, белки 67
Работа 3. Проектные задания 68
Заключительная работа по теме X 69
Дополнительные задания 70
Тема XI. Синтетические полимеры
Работа 1.Общая характеристика ВМФ. Пластмассы … 72
Задание 2. Каучуки 73
Задание 3. Волокна 74
Дополнительные задания 75
Тема XII. Обобщение знаний по курсу органической химии
Работа 1. Типы изомерии органических веществ 76
Работа 2. Генетическая взаимосвязь органических соединений 77
Выпускная работа по курсу органической химии 78
Дополнительная деятельность 82
11 класс
Тема I. Важнейшие химические концепции и законы
Работа 1.Проблемы вывода формул веществ на основе закона постоянства состава веществ 83
Тема II. Периодический закон и химические элементы периодической системы Д.И. Менделеева с точки зрения учения о строении атомов
Работа 1. Строение атомов и электронных оболочек атомов 84
Работа 2. Валентные способности атомов.
Периодическое изменение свойств химических элементов и их соединений 86
Тема III.Структура материи
Работа 1. Структура материи 88
Работа 2. Решение проектных задач для приготовления растворов различной концентрации 89
Выпускная работа по темам I, II, III 91
Дополнительные задания 93
Тема IV. Химические реакции
Работа 1. Классификация химических реакций 95
Работа 2. Скорость химических реакций. Химическое равновесие 96
Работа 3. Электролиты и неэлектролиты. Теория электролитической диссоциации.Реакции в растворах электролитов 99
Работа 4. Гидролиз органических и неорганических соединений 101
Заключительная работа по теме IV 102
Дополнительные задания 105
Тема V. Металлы
Работа 1. Получение металлов. Электролиз. Коррозия металлов 109
Работа 2. Металлы 1А-группа 111
Работа 3. Металлы NA-группы 112
Работа 4. Алюминий и его соединения 114
Работа 5. Медь, железо, хром — металлы B-группы 115
Работа 6. Металлические сплавы. Оксиды и гидроксиды металлов 117
Выпускная работа по теме V 118
Дополнительные задания 120
Тема VI.Неметаллы
Работа 1. Обзор неметаллов. Оксиды и соединения водорода, неметаллы 124
Работа 2. Свойства оксидов неметаллов. Кислородные кислоты 126
Заключительная работа по теме VI 128
Дополнительные мероприятия 130
Заключительная работа по курсу общей химии 135
Приложения 138
Реферат — 1999, 2-е изд., 80 с .:
10 класс (стр. 4-50)
Тема I. Теория химического строения органических соединений.
Работа 1 (4 опции)
Тема II. Углеводороды насыщенные (алканы). Циклопарафины (циклоалканы).
Тема III. Углеводороды ненасыщенные (алкены, алкины).
Задание 1 — задание 6 (каждое задание содержит 4 варианта)
Тема IV. Ароматические углеводороды (арены).
Задание 1 — задание 4 (каждое задание содержит 4 варианта)
Тема V. Спирты и фенолы.
Задание 1 — задание 3 (каждое содержит 4 варианта или проектные задачи)
Тема Vi. Альдегиды и карбоновые кислоты.
Задание 1 — Задание 6 (каждое содержит 4 варианта или проектные задачи)
Тема Vii. Сложные эфиры. Жиры.
Работа 1 — Работа 2 (каждая работа содержит 4 варианта)
Тема VIII. Углеводы.
Задание 1 — Задание 5 (каждое содержит 4 варианта или проектные задачи)
11 класс (стр. 51-77)
Тема I. Амины. Аминокислоты. Азотсодержащие гетероциклические соединения.
Задание 1 — задание 4 (каждое задание содержит 4 варианта)
Тема II. Вещества синтетические высокомолекулярные и полимерные материалы на их основе.
Тема III. Обобщение знаний по курсу органической химии.
Работа 1 — Работа 3 (по 4 варианта)
Проблемы с производством и междисциплинарным содержанием (1-20)
Продвинутые задачи (1-10)
Данная презентация может быть использована на занятиях при изучении нового материала, при повторении и обобщении темы «Арены» и всего курса органической химии, а также при дистанционном обучении студентов.Презентация состоит из 33 слайдов и содержит полное содержание темы, иллюстрации, тесты, биографию ученого Ф.А.Слайд 1 Слайд 5 Слайд 12
Данную презентацию можно использовать на уроках химии при изучении нового материала (23 урок по тематическому планированию «Гара Н.Н. Химия. Уроки в 8 классе») «Горение и медленное окисление. Тепловой эффект химических реакций», с повторением и обобщением по теме «Кислород», а также с дистанционным обучением студентов.Презентация состоит из 31 слайда и содержит полное содержание темы, иллюстрации, задачи, алгоритмы решения задач с использованием термохимических уравнений, раскрывает основные понятия …
Оборудование: интерактивная доска, проектор, программы Microsoft Office Word. Тип урока: изучение новой темы. Формы работы: лобовая, коллективная, индивидуальная. Аннотация: открытый урок на тему «Химические элементы, их названия, символы. Концепция металлов и неметаллов »с применением программы Module 7, разработанной казахстанскими учеными совместно с Кембриджским университетом.Задачи: Ознакомить учащихся с понятием химический элемент. Сформировать умение предсказывать свойства элемента …
Заключительное занятие «Углеводороды» по модульной технологии. Материал содержит краткое содержание урока и модуль с заданиями. Реферат позволяет обобщить знания студентов об углеводородах (классификация, названия, изомерия, решение задач, эксперимент). Задачи урока: проследить зависимость свойств веществ от структуры, закрепить понятия: молекулярная структура, тип гибридизации, типы изомерии, номенклатура, свойства органических соединений, отработать умение применять полученные знания на практике с …
Презентация к уроку на тему «Углеводороды» содержит 18 слайдов. Цель урока: обобщить знания учащихся об углеводородах. Задачи урока: проследить зависимость свойств веществ от структуры, закрепить понятия: молекулярная структура, тип гибридизации, гомологический ряд, типы изомерии, номенклатура, свойства органических соединений, отработать умение применять знания. в составлении схем генетической связи, решении задач по выведению молекулярных формул органических соединений, распознаванию алканов, алкенов…
В статье описана методика проектов, обоснована целесообразность ее использования на уроках химии и во внеурочное время. Выбор количества часов и формы проведения таких уроков зависит от типа проекта. Предполагается высокая степень самостоятельности студентов в реализации проекта. Актуализированные предметные знания по химии закрепляются, углубляются, расширяются в процессе работы над проектом и усвоения студентами новых знаний.На занятиях рекомендуется использовать другой метод …
Методическая разработка интерактивного урока химии в 9 классе по теме «Реакции ионного обмена» и презентация к уроку. Используются групповые, индивидуальные формы работы, игровые моменты, демонстрационные эксперименты, проблемные задания, мультимедийные презентации. Форма урока — игра-соревнование между командами. Этот урок можно рекомендовать для проведения обобщающих уроков по теме, открытых уроков в рамках недели или десятилетия химии, а также с целью обмена опытом…
Суть процесса электролитической диссоциации синопсиса. Электролитическая диссоциация
2
7
Анионы Катионы Анодный Катод — +
Раствор Кристалл NaCl Na + + Cl Н2ОН2О Н2ОН2О Рис.4.
10 раствор HCl Н + + Cl — Н2ОН2О Н2ОН2О Рис HCl Cl — H + H + + — Н + Н Сl-Сl-
14 Контрольный тест… Вариант 1. Вариант 2. 1. Неэлектролиты включают: 1) карбонат натрия 2) этиловый спирт 3) соляную кислоту 4) нитрат цинка 1. Неэлектролиты включают: 1) хлорид бария 2) сахар 3) серную кислоту 4 ) карбонат калия 2 С образованием катионов металлов и анионов кислотного остатка диссоциирует: 1). гидроксид меди (II) 2). гидроксид натрия 3). хлорид алюминия 4). угольная кислота 2. С образованием катионов металлов и анионов кислотного остатка диссоциирует: 1) сахароза 2) гидроксид натрия 3) бромид алюминия 4) азотная кислота 3.Оба вещества в группе являются электролитами: 1). Ch5, CO2 2). C2H5OH, HNO3 3). CaO, BaSO4 4). NaCl, KOH 3. Оба вещества в группе являются электролитами: 1). глицерин, SO2 2). CuCl2, КОН 3). BaO, K2SO4 4). Fe (OH) 3, h3SiO3 4. Больше всего ионов водорода образуется при диссоциации: 1). Привет 2). h3CO3 3). h3S 4). h3SiO3 4. Больше всего ионов водорода образуется при диссоциации: 1). h4PO4 2). h3SO4 3). HNO3 4). HF 5. Сумма коэффициентов в уравнении диссоциации сульфата алюминия составляет: 1).4 2). 6 3). 2 4) Сумма коэффициентов в уравнении диссоциации карбоната натрия составляет: 1). 4 2). 3 3). 2 4). 1
Задачи урока:
- Образовательные: освоить определения научных понятий: «электролиты», «неэлектролиты», «электролитическая диссоциация», «катионы», «анионы»; объяснить эти важнейшие концепции на основе демонстрационного эксперимента; объяснить сущность и механизм процесса диссоциации;
- Разработки: развивают познавательную активность студентов, развивают способность наблюдать, делать выводы, объяснять ход эксперимента.Развивайте интерес к химии, развивайте логическое мышление.
- Образовательные: для повышения познавательной активности и активности студентов.
Тип урока: комбинированный.
Девиз урока: «Ни один сосуд не вмещает больше своего объема, кроме сосуда знаний, он постоянно расширяется». Арабская пословица.
На занятиях
1. Организационный момент.
2. Введение.
Вступительный разговор учителя и учеников.
Электрический ток — это направленное движение заряженных частиц. В металлах это направленное движение осуществляется относительно свободными электронами. Но оказывается, что не только металлы, но и растворы и расплавы солей, кислот и оснований могут проводить электрический ток.
В 1887 году шведский ученый Сванте Аррениус сформулировал положения теории электролитической диссоциации веществ, а русские ученые-химики В.А. Кистяковский, И. дополнил его представлениями об ионной гидратации.
3. Освоение нового материала.
Теория электролитической диссоциации (TED):
1. Электролиты — это вещества, растворы и расплавы которых проводят электрический ток. Это растворимые кислоты, соли, основания, т.е. вещества с ковалентными полярными и ионными связями. Демонстрационный эксперимент: исследование электропроводности растворов NaCl, HCl, КОН, сахара, воды.
2. Неэлектролиты — это вещества, растворы и расплавы которых не проводят электрический ток.Это нерастворимые в воде вещества, а также вещества с неполярной или малополярной ковалентной связью, органические вещества, жидкий кислород, азот, вода, нерастворимые основания, соли, кислоты.
3. Электролитическая диссоциация — это процесс разложения электролита на ионы.
NaCl -> Na + + Cl — HCl -> H + + Cl —
КОН -> К + + ОН —
4. В растворах или расплавленных электролитах ионы движутся хаотично, но при прохождении тока положительно заряженные ионы притягиваются к катоду (-) и называются катионами, а отрицательно заряженные ионы притягиваются к аноду (+) и называются анионы.Процесс диссоциации обратим. 5. Ионы отличаются от атомов как по строению, так и по свойствам. В водных растворах ионы находятся в гидратированном состоянии.
Механизм диссоциации объясняется тем, что электролиты под действием растворителя самопроизвольно диссоциируют (разлагаются) на ионы. Диссоциация также может происходить при плавлении твердых электролитов (термическая диссоциация).
4. Физические минуты.
5. Закрепление материала.
1. Разделите вещества на электролиты и неэлектролиты: сульфат калия, карбонат кальция, бензол, кислород, гидроксид калия, глюкозу, серную кислоту, гидроксид бария, воду, серу.
Контроль выполнения задания: самоконтроль с борта.
2. Выберите вещества, которые могут диссоциировать на ионы: сульфат бария, нитрат алюминия, гидроксид натрия, азот, сахар, соляная кислота.
3. Составьте уравнения диссоциации этих веществ.
Контроль выполнения задания: работа в парах.
Контрольный тест.
Творческое задание.
Если сульфат меди растворен в воде, то наблюдается синее окрашивание раствора и раствор проводит ток, а если сульфат меди растворен в бензине, то окрашивание не наблюдается, раствор не становится синим.Объясните этот феномен.
6. Подведение итогов.
В конце урока необходимо повторить то, что мы узнали нового сегодня. Объявите оценки. И хвалите ребят за хорошую работу.
Таким образом, вы можете поставить более одной оценки каждому ученику за урок. И учить новый материал легко, доступно и интересно детям.
7. Домашнее задание.
1, (Рудзитис Г.Е., Фельрман Ф.Г.) Радецкий с. 38, вариант 1-4 (1 задание).
Современные технологии и методы обучения: проблема — поиск, постановка и решение междисциплинарных вопросов; выполнение сложных задач по сравнению объектов; работать с таблицами с помощью NIT.
Описание организации творческой деятельности студентов: Беседа; ответ на поставленный вопрос после просмотра эксперимента, самостоятельной и практической работы; оценка собственных знаний; творческое домашнее задание.
Описание педагогических идей и инициатив: Визуализация мультимедийного эксперимента; тестирование с установленным временем для каждого вопроса; творческое домашнее задание
Методы и технологии обучения: проблемное — исследовательское обучение, развивающее обучение, развитие логического мышления, работа в группах, работа в парах.
Результаты: Главный результат данной разработки — заметное повышение качества обучения.
Качество облучения (по результатам контрольно-диагностических работ):
2007-2008 — 72%
2008-2009. — 80%
Этот урок посвящен изучению темы «Электролитическая диссоциация». В процессе изучения этой темы вы поймете суть некоторых удивительных фактов: почему растворы кислот, солей и щелочей проводят электрический ток; почему точка кипения раствора электролита выше по сравнению с раствором неэлектролита.
Тема: Химическая связь.
Урок: Электролитическая диссоциация
Тема нашего урока « Электролитическая диссоциация ». Мы постараемся объяснить некоторые удивительные факты:
Почему растворы кислот, солей и щелочей проводят электрический ток?
Почему точка кипения раствора электролита всегда будет выше, чем точка кипения раствора неэлектролита той же концентрации.
Сванте Аррениус
В 1887 году шведский физик — химик Сванте Аррениус, Изучая электропроводность водных растворов, он предположил, что в таких растворах вещества разлагаются на заряженные частицы — ионы, которые могут перемещаться к электродам — отрицательно заряженный катод и положительно заряженный. заряженный анод.
Это причина электрического тока в растворах. Этот процесс называется электролитической диссоциацией (дословный перевод — расщепление, разложение под действием электричества).Это название также предполагает, что диссоциация происходит под действием электрического тока. Дальнейшие исследования показали, что это не так: ионов являются только носителями заряда в растворе и существуют в нем независимо от того, проходит ли он через ток раствора или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которую часто называют в честь этого ученого. Основная идея этой теории состоит в том, что электролиты самопроизвольно разлагаются на ионы под действием растворителя.И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Электрический ток — это направленное движение свободных заряженных частиц … Вы уже знаете, что растворов и расплавов солей и щелочей электропроводны, поскольку они состоят не из нейтральных молекул, а из заряженных частиц — ионов. При плавлении или растворении ионы становятся свободными носителями электрического заряда.
Процесс разложения вещества на свободные ионы при растворении или плавлении называется электролитической диссоциацией.
Рис. 1. Схема разложения на ионы хлорида натрия
Суть электролитической диссоциации состоит в том, что ионы освобождаются под действием молекулы воды. Рис. 1. Процесс разложения электролита на ионы отображается с помощью химического уравнения … Запишем уравнение диссоциации хлорида натрия и бромида кальция. При диссоциации одного моля хлорида натрия образуется один моль катионов натрия и один моль хлорид-анионов. NaCl ⇄ Na + + Класс —
При диссоциации одного моля бромида кальция образуются один моль катионов кальция и два моля бромид-анионов.
Ca Br 2 ⇄ Ca 2+ + 2 Br —
Примечание: , поскольку формула для электрически нейтральной частицы записана в левой части уравнения, общий заряд иона должен быть равен нулю .
Выход : при диссоциации солей образуются катионы металлов и анионы кислотного остатка.
Рассмотрим процесс электролитической диссоциации щелочей. Запишем уравнение диссоциации в растворе гидроксида калия и гидроксида бария.
При диссоциации одного моля гидроксида калия образуются один моль катионов калия и один моль анионов гидроксида. КОН ⇄ К + + ОН —
При диссоциации одного моля гидроксида бария образуются один моль катионов бария и два моля анионов гидроксида. Ba ( OH ) 2 ⇄ Ba 2+ + 2 ОН —
Выход: При электролитической диссоциации щелочей образуются катионы металлов и анионы гидроксидов.
Водонерастворимые основания практически не подвергаются электролитической диссоциации , так как они практически не растворимы в воде, а при нагревании разлагаются, так что их нельзя расплавить.
Рис. 2. Строение молекул хлороводорода и воды
Рассмотрим процесс электролитической диссоциации кислот. Молекулы кислоты образованы ковалентной полярной связью, что означает, что кислоты состоят не из ионов, а из молекул.
Возникает вопрос — как же тогда диссоциирует кислота, то есть как в кислотах образуются свободные заряженные частицы? Оказывается, ионы образуются в кислых растворах при растворении.
Рассмотрим процесс электролитической диссоциации хлороводорода в воде , но для этого запишем строение молекул хлороводорода и воды. Рис. 2.
Обе молекулы образованы ковалентной полярной связью. Электронная плотность в молекуле хлористого водорода смещена в сторону атома хлора, а в молекуле воды — в сторону атома кислорода. Молекула воды способна оторвать катион водорода от молекулы хлористого водорода, образуя катион гидроксония H 3 O +.
В уравнении реакции электролитической диссоциации не всегда учитывается образование катиона гидроксония — обычно говорят, что образуется катион водорода.
Тогда уравнение диссоциации хлористого водорода выглядит так:
HCl ⇄ H + + Класс —
При диссоциации одного моля хлористого водорода образуется один моль катиона водорода и один моль хлорид-анионов.
Ступенчатая диссоциация серной кислоты
Рассмотрим процесс электролитической диссоциации серной кислоты. Серная кислота диссоциирует ступенчато, в две стадии.
I -я стадия диссоциации
На первой стадии удаляется один катион водорода и образуется гидросульфатный анион.
II — I стадия диссоциации
На второй стадии происходит дальнейшая диссоциация гидросульфат-анионов. Hso 4 — ⇄ H + + СО 4 2-
Эта стадия обратима, то есть образующиеся сульфат-ионы могут присоединять к себе катионы водорода и превращаться в гидросульфат-анионы. Об этом свидетельствует знак обратимости.
Есть кислоты, которые не диссоциируют полностью даже на первой стадии — такие кислоты слабые. Например, угольная кислота H 2 CO 3.
Теперь мы можем объяснить, почему точка кипения раствора электролита будет выше, чем точка кипения раствора неэлектролита.
При растворении молекулы растворенного вещества взаимодействуют с молекулами растворителя, например воды. Чем больше частиц растворенного вещества находится в одном объеме воды, тем выше будет его точка кипения. Теперь представьте, что равные количества вещества-электролита и вещества, не являющегося электролитом, растворены в равных объемах воды.Электролит в воде разложится на ионы, а это значит, что количество его частиц будет больше, чем в случае растворения неэлектролита. Таким образом, наличие свободных частиц в электролите объясняет, почему точка кипения раствора электролита будет выше, чем точка кипения раствора неэлектролита.
Краткое содержание урока
На этом уроке вы узнали, что растворы кислот, солей и щелочей электропроводны, поскольку при их растворении образуются заряженные частицы — ионы.Этот процесс называется электролитической диссоциацией. При диссоциации солей образуются катионы металлов и анионы кислотных остатков. При диссоциации щелочей образуются катионы металлов и гидроксид-анионы. При диссоциации кислот образуются катионы водорода и анионы кислотных остатков.
1. Рудзитис Г.Э. Неорганическая и органическая химия … 9 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф. Фельдман. М .: Просвещение. 2009 119с .: Ил.
2.Попель П.П. Химия: 8 класс: учебник для общеобразовательных учреждений / ПП. Попель, Л. Кривля. -К .: ИЦ «Академия», 2008.-240 с .: ил.
3. Габриелян О.С. Химия. 9 класс. Учебник. Издательство: Дрофа: 2001. 224с.
1. No. 1,2 6 (с.13) Рудзитис Г.Е. Неорганическая и органическая химия. 9 класс: учебник для общеобразовательных учреждений: начальный уровень / Г.Е. Рудзитис, Ф. Фельдман. М .: Просвещение. 2009 119с .: Ил.
2. Что такое электролитическая диссоциация? Вещества каких классов являются электролитами?
3.Вещества с каким типом связи являются электролитами?
Конспект
урок химии в 8 классе
школа №16 г. Саранска
Студенты 4 курса химического факультета
Физико-химический институт
МГУ им. Н.П. Огарева
Тема урока: Электролитическая диссоциация.
Задачи урока:
Образовательные: сформировать основные понятия об электролитах и неэлектролитах, написать уравнения диссоциации, рассмотреть механизм диссоциации веществ с разными типами связей.
Образовательные: Формирование навыков командной работы в сочетании с индивидуальной работой, повышение творческой активности студентов, познавательный интерес к химии, чувство ответственности перед товарищами.
Развивающие: Развитие познавательных способностей учащихся, формирование независимого мышления, умения логически рассуждать, обобщать и делать выводы из полученных знаний.
Тип занятия: комбинированный.
Методика занятий:
Общие: пояснительно-иллюстративная;
Частное: словесное — наглядное — практическое.
Оборудование и реактивы: вода дистиллированная, KCl (раствор и тв.), Раствор сахарозы, щелочь, HCl, CuSO 4. , прибор для исследования электропроводности растворов этих веществ, стакан.
План урока:
Организационный момент 1 мин.
Проверка домашнего задания 10 мин.
Изучение нового материала 30 мин.
Обобщение 3 мин.
Подведение итогов 1 мин.
(выставление оценок, домашнее задание)
Привет, ребята!
Рад приветствовать вас на уроке.
Дорогие друзья!
От себя поздравляю всех.
Каждый из вас хорош по-своему:
Для людей, для бизнеса, всем полезно.
А теперь, ребята, не грустите
И решайте задачи
Давай, смело налетайте
И получайте задания.
Карточка: «Избыточное решение»
Назовите «лишнее» (выпадающее из ряда) решение из пяти предложенных. Как вы думаете, почему это он лишний? Что общего у остальных четырех решений?
медно-цинковый сплав (латунь)
раствор йода в спирте (йодная настойка)
медно-оловянный сплав (бронза)
медно-никелевый сплав (мельхиор)
алюминиево-медный сплав (дюралюминий)
Отсутствует карточка решения
Какое из следующих решений (a — c) вы бы поставили вместо вопросительного знака на шаге 5? Объясните, почему вы выбрали это решение? Почему другие решения не подходят?
раствор кислорода в воде
раствор серной кислоты в воде
раствор сахара в воде
раствор азотной кислоты в воде
а) диоксид углерода в воздухе, б) раствор хлорида натрия в воде,
в) сплав золота и серебра.
На этот раз вопросы задают фронтально:
Давайте вспомним роль решений в природе и практической деятельности людей.
Разъяснить суть физико-химической теории растворов. Зачем их нужно совмещать?
Итак, какое решение?
Что свидетельствует о химическом взаимодействии растворенного вещества с водой?
Что такое: гидратация, гидраты, кристаллогидраты?
Какова растворимость веществ в воде?
Как количественно определяются понятия «хорошо растворим в воде», «мало растворим», «практически нерастворим»?
Давайте сыграем в игру, передаваемую кому-то:
На доске написан вопрос: классифицируется ли это вещество как труднорастворимое, хорошо растворимое или практически нерастворимое? (работа с таблицей растворимости)
Класс разделен на шесть групп (по строкам).Каждая группа получает альбомный лист, разделенный на четыре столбца (имя ученика и ответы на вопрос) и столько строк, сколько игроков в команде.
Задача состоит в том, чтобы найти другое соединение от соседей и выполнить задачи.
Если ученик может сразу ответить на вопрос, он записывает ответ и быстро передает лист члену команды, сидящему сзади. И команда, лист которой первой доходит до учителя, получает дополнительные баллы.
Позвольте прочитать вам стихотворение:
Жил один ионный кристалл,
Дом огромен для ионов,
Он был красив и ровен.
Но с ним случилась беда.
На него упала капля
И кристалл мгновенно исчез:
Распространился на ионы
Его ловкая вода.
Вся семья была удивлена:
«Что случилось на улице?»
А чтобы ответить на этот вопрос, сегодняшняя тема «Электролитическая диссоциация.»(дискета №1: название темы.) И цель нашего урока — ознакомиться с новыми концепциями этой темы.
Итак, вы знаете, что есть вещества, которые хорошо проводят электрический ток — это (проводники).
Проводники делятся на проводники первого типа — металлы и на проводники второго вида — электролиты.
Помните, что такое электрический ток? (Это направленное движение заряженных частиц.)
Потому что мы будем работать с электрическим током. аппарата, необходимо соблюдать правила техники безопасности.Какие правила вы знаете? (не касайтесь оголенных проводов, электродов руками, особенно мокрыми; при включении прибора выключите главный выключатель, не оставляйте его включенным; тушите песком)
Проведем эксперимент по изучению электропроводности растворов некоторых веществ.
Устройство состоит из стакана, в который наливают раствор исследуемого вещества. На стекло помещается пластина из эбонита с установленными в ней двумя угольными электродами, к клеммам которых подключаются провода.Один из них подключен к лампочке. Выходной контакт от лампочки и провод от другой клеммы идут к источнику тока.
Опускаем электроды в стакан с твердой кристаллической солью CuSO 4 (лампа не загорается), затем в раствор CuSO 4 (лампа загорается), затем в растворы HCl, сахарозы, щелочи и дистиллированной воды.
В процессе эксперимента ребята заполняют таблицу:
и т.д.
Скажите, а почему раствор хлорида натрия проводит электрический ток, а раствор сахарозы — нет? (Это связано с образованием ионов.) Что такое ион? (это мельчайшие заряженные частицы вещества, обуславливающие химические и физические свойства этого вещества).
Таким образом, по способности проводить электрический ток вещества делятся на электролиты и неэлектролиты. (Дискета № 1: определения понятий: электролиты и неэлектролиты)
Из проведенного эксперимента ясно, что электролиты включают растворы солей, кислот, оснований и неэлектролитов — органических соединений, твердых веществ, газов.
Подскажите, а чем электролиты отличаются от неэлектролитов? (По типу подключения.). Те. электролиты включают вещества с ионными и ковалентно полярными связями.
Способность электролитов проводить электрический ток принципиально отличается от способности проводить электрический ток металлов. Почему? (поскольку электропроводность металлов обусловлена движением электронов, а электропроводность электролитов связана с движением ионов.)
Изучим поведение веществ в водном растворе на примере хлорида натрия.
Опыт: электроды погружаются в стакан с раствором хлорида натрия (загорается свет).
Из результата эксперимента делаем вывод, что под воздействием воды вещества претерпевают изменения. Вода заставляет электролиты распадаться на ионы. Этот процесс называется диссоциацией.
Этот процесс изучал шведский ученый Сванте Аррениус.Послушаем сообщение вашего одноклассника о его заслугах по химии (диск № 2: портрет Сванте Аррениуса)
Будучи приверженцем физической теории растворов, шведский ученый Сванте Аррениус не смог ответить на вопрос: почему происходит диссоциация соли и щелочи встречаются в водном растворе? Ответ дали русские химики Каблуков и Кистяковский. Суть их добавок заключается в следующем (под записью): причиной диссоциации электролита в растворе является его гидратация, т.е.е. взаимодействие с молекулами воды. И ионы, которые образуются при диссоциации, будут гидратированы, т.е. связаны с молекулами воды, и их свойства будут отличаться от негидратированных.
Что такое молекула воды? В общем, молекула воды не заряжена. Но внутри молекулы воды атомы кислорода и водорода расположены так, что положительный и отрицательный заряды находятся на противоположных концах молекулы. Следовательно, молекула воды является диполем:
Рассмотрим механизм диссоциации хлорида натрия при растворении.Какой тип подключения есть у этого подключения? (ионный). (диск №2: диссоциация веществ с ионной структурой).
Отмечу, что легче всего диссоциируют электролиты с ионной структурой.
Диссоциация веществ с ионными связями происходит в три стадии:
сначала хаотически движущиеся молекулы воды около кристалла ионы ориентируются на них противоположно заряженными полюсами — происходит ориентация.
то диполи воды притягиваются, взаимодействуют с ионами поверхностного слоя кристалла, происходит гидратация.
молекула воды, переходя в раствор, захватывает с собой гидратированные ионы. Происходит диссоциация.
А как молекулы полярного электролита реагируют с молекулами воды?
Аналогично, но еще одна стадия (диск №2: диссоциация веществ с ковалентно-полярной связью):
ориентация
гидратация
ионизация, т.е. превращение ковалентно полярной связи в ионную.
диссоциация
Таким образом, электролитическая диссоциация — это процесс разложения электролита на ионы при растворении.
Следует иметь в виду, что в растворах электролитов хаотически движущиеся ионы могут сталкиваться и объединяться в молекулу. Это процесс ассоциации.
Обратите внимание на знак в уравнении диссоциации. (диск №1: запись уравнения диссоциации). Поскольку количество молекул воды, к которым присоединяются ионы, неизвестно, процесс диссоциации электролитов изображается упрощенно: NaCl = Na + + Cl —
Например, запишите сокращенное уравнение диссоциации для некоторых веществ с ионной структурой : Ca (OH) 2, Na 2 SO 4, Na 3 PO 4, Al 2 (SO 4).
На сегодняшнем уроке вы узнали, что такое электролитическая диссоциация, механизм диссоциации.
Исходя из всего сказанного, скажите, какие процессы зашифрованы в стихотворении:
Жил один ионный кристалл,
Дом огромен для ионов,
Он был красив и ровен.
Но с ним случилась беда.
На него упала капля
И кристалл мгновенно исчез:
Распространился на ионы
Его ловкая вода.
Вся семья была удивлена:
«Что случилось на улице?»
Вдруг рядом появилась серия молекул,
Они поднялись шумным роем,
Их окружила плотная формация:
«Мы хотим предложить героям
нашу дружбу навсегда …»
Водород на анионы
Гидроксид на катионы,
Ионы не могут выйти из них
Ни то, ни другое.
(растворение вещества с ионной связью, ориентация молекул воды, гидратация, диссоциация)
Домашнее задание: § 35, нет.2,5,6 п. 147.
Мяч цветов Методическая разработка (9 класс) по теме. Сценарий «Бал красивых цветов» Мелескина Н.В., учитель начальных классов
.Задачи:
— Научиться произносить стихи и головоломки четко, с интонацией, выразительно
Скачать:
Превью:
МБДОУ Комсомольский детский сад «Ромашка»
Сценарий летнего развлечения «Цветочный бал»
2 младшие — средняя группа 2012
Чеботова М.V.
Цель: Сформировать представление детей о разнообразии цветковых растений.
Задачи:
— Корабельный уход за растениями по всему миру,
— Пополнить активный детский словарь,
— развить артикуляционный аппарат детей,
— Научиться улавливать стихи и загадки четко, с интонацией, выразительно.
Музыка включает детей. Они обходят зал и садятся на стулья.
Веды: Здравствуйте, дорогие друзья! Добро пожаловать на бал красок.!!!
Сегодня нас ждет много сюрпризов и гостей. Кажется, здесь один из гостей …
(Волшебная фея Фея Фея для музыки).
Фея: Жду сегодня в гости, на бал фильмы приведу
Для радости и красоты цветут весной всеми красками
Но не будем их рвать, друзья, со мной вы согласны?
Дети: Да …
Дети в цветах в цветах идут в центр мюзик-холла. Они становятся полукругом, лицом к публике, читают стихи.
1. Творчество в шапке Незабудка
Маленькая, нежная,
Прямо у Visiti
Как будто в кормовую половину
Напиться
Чаши с голубым небом
Эти милые цветы
Я знаю их, знает Оля
Хорошо ты их знаешь?
2. Уиверс в шляпе Мак
Макс узкой тропкой посмотрел на поляну
«Кто тут самый ловкий?
Давай по кругу!»
И под ветром Маки снял куртки,
Готовим к драке, сжав кулаки .
Вот какие маки,
Маки — Заби!
3. Голые в шапке Ромашки.
На лугу и в поле
Ромашка встречаем
Лепестки Белые верим на ней
Ядро, желтое, цветок такой
Как будто младенец — солнце
Влезла в него.
4. Сливки в шапкеОдуванчик.
Пустышка Санни
Рэй Голден.
Потеря одуванчика —
Первый, молодой.
У него чудесный
Золотой цвет
Он большое солнышко
Маленький привет.
4. Сливки в шапкеVasilka
Недорого в ржаной области
Василек там найдешь
Хоть и не красный он, а синий,
Все на звездочки похожи.
5. Голая в шляпе Белл tler
Этот звонок звонка
Звонок, чтобы не желать
Или не привык к шуму
Или проглотил язык.
6. Перерыв в шляпе Ириса
Я травянистое растение
С сиреневым оттенком
Но стресс переставляю
И превращаюсь в конфету.
7.Требуется в шапкеРозы
Есть разные цветы
Полевые и тепличные
Все цвета разные
И все они красивые
Но один цветок
Что глаз не может беда
Это отличная роза!
Как ангел воздушный, нежный
На балу в красках — Баронесса она!
Дети после прочтения стихов и загадок сидят в зрительном зале на стульях.
F: Предлагаю поиграть в такую игру «Кто знает больше». Загадываю загадки, а ты их отгадаешь.
Пазлов:
1. Крытый горошек на зеленой ножке (долине)
2. Бородавка в поле ржи,
Есть цветок, который вы найдете во ржи.
Ярко-синий и пушистый,
Только жалко. Что не пушистое. (василек)
3. Хист на лугах сестер
Глаз золотистый, Реснички белые (Ромашка)
4.i, колокольчики, цвет голубой,
С языком, а звона нет (колокольчик)
5. Шарик пушистый
Беля в поле чистый,
И дует ветер
Стандарт остался (одуванчик)
6.Подходит сжечь мою болтушку
Хочется сделать погремушку (мак)
7.Ликать пахуки
И хвостик колючий (розочка)
8.Новые луговые Парачутики
Качели на веточке. (одуванчик)
F: Ребята, вы так замазаны, офигенно. Вы все отгадываете мои загадки!
А я еще игру подготовил. Хочет играть!
Давай поиграем — «Желтая игра».
Желтое солнце смотрит на землю (поднимите ручки)
Желтый подсолнух за солнцем смотрит. (качают руками)
Желтые груши на ветках висят.(фонари)
Желтые цыплята злятся. (клевать)
Желтая бабочка, желтый жук. (машеут руками)
Лютики желтые, ромашка желтая. (вращайте руками)
Желтое солнце, желтый песок.
Желтый цвет радости, радуйся, друг! (хлоп)
F: А теперь можно и танцевать! (Звуки аудиозаписи «Вальс цветов» из балета Чайковского «Щелкунчик»)
F: Вот и подошел к концу наш праздник цветов! Понравился праздник?
И ты мне понравился в гостях.Я обязательно приеду к вам в гости снова. До скорого! (Фея уходит).
Ведущий: Трое мальчиков, остальные входят в состав жюри. Необходимо разделить девушек на две команды. Подготовьте необходимую атрибутику для каждой команды: лист бумаги А4, фломастеры, пуговицы, нить иголкой, небольшой кусочек любого материала, 3 картофелины.
Свинец 1:
В этот чудесный весенний день,
Мы хотим поздравить вас, милые дамы.
Каждый из вас прекрасен, как цветок.
Но не только в день восьмого марта.
Желаем милых девушек
Всегда оставайся такой:
Добрых, умных, смелых.
Ведущая 2: Дорогие наши девушки, разрешите присоединиться к этим поздравлениям. Ведь Международный женский день — самый главный и любимый весенний праздник. Сегодня мы собрались здесь, чтобы поздравить наших девочек, мам, учителей, бабушек, одним словом, всех женщин.
Свинец 1. Безусловно, каждая девушка любит цветы, поэтому сегодня мы устроим своеобразный шар красивых цветов. Для начала нужно вызвать свои команды и выбрать капитанов.
Ведущий 2: Милые девушки, назовите свои команды в честь любого цветка.
Отведение 1: Когда вы определились с именем команды. Будет наш первый конкурс, который называется «Цветочный герб». Для этого каждой команде предлагается нарисовать герб своей команды, главное изображение которого будет цветок, в честь которого и названа команда. А справедливое жюри оценит вашу работу по пятибалльной шкале.
Спустя пять минут, когда девочки справляются с заданием, в классе выходит первая тройка в неаккуратном виде (некальцинированные волосы, рубашка слегка выгнута).
Отведение 3: Безумный день. Все мужики, как сумасшедшие были: беги, суетись. Все цвета раскаялись. Сегодня восьмое марта?
Отведение 1: Как еще раз?
Отведение 2: Почему снова?
Отведение 1: В общем, что вы себе позволяете? Почему ты опоздала, пришла в непонятной форме? Где поздравления нашим девочкам?
Отведение 3: Я никого не хочу поздравлять. Считаю этот праздник совершенно ненужным и совершенно бесполезным.
Ведущий 1: И у меня возникла идея.Дорогие наши девушки, давайте докажем нашему другу, что восьмое марта — поистине волшебный и чудесный праздник всех женщин.
Отведение 3: Ну, попробуй. Что у вас здесь: Шар красивых цветов?
Отведение 2: Да. Посмотрим, как наши девочки справились с задачей. Всем удалось нарисовать герб своей команды? Оценка жюри, пожалуйста, работайте.
Ведущий 3: Ну цветы, как цветы. Ничего особенного. Могу я задавать вопросы девушкам? Я хочу посмотреть, как они справятся с моей задачей.
Лид 1: Конечно, для этого нам понадобится по одному участнику от каждой команды.За правильный ответ жюри ставит пять баллов той или иной команде.
Свинец 3:
1. Какие цвета являются главным символом празднования восьмого марта? (Мимоза и тюльпаны).
2. Какая сумма дается в праздничные дни? (нечетное количество).
3. Какой цветок является символом страстной любви? (Красная роза).
4. Какие цвета делают в Китае при расставании или расставании? (Цветы желтого цвета).
5.Кто занимается составлением различных букетов и цветочных композиций? (флорист).
6. Помните песни, в которых упоминаются названия цветов или цветущих деревьев? (белые розы, лилии, букет сирени, золотая чайная роза).
7. Какие цветы делают на первое сентября? (гладиолус).
8. Помните названия полевых цветов? (Василеук, Ромашка).
9. Какие цветы должна была найти героиня сказки «Двенадцать месяцев»? (Подснежники).
10. Какие цветочки используют девушки для гадания на любовь? (ромашка).
Отведение 2: Молодцы, девочки. Теперь предлагаю посмотреть, какие наши рукодельницы девочки. Для этого предлагаю участнику, выбранному из каждой команды, пришить эту пуговицу к этому куску ткани. Тот, кто сделает это быстро, крепко и красиво, принесет своей команде пять очков.
Ведущая 3: Вы знаете, дорогие друзья, я начинаю замечать. Что наши девочки очень умные, как и большие рукодельницы.Но хочу проверить, как они справятся со следующей задачей. Выбранный участник необходимо очистить от кожуры 3 картофелины. Кто сделает это быстрее и лучше, принесет своей команде следующие пять очков.
Отведение 1: Что ж, наши девочки справились и с этой задачей. Для вас вообще нет никаких сомнений в значимости восьмого марта. Теперь пусть каждый участник сравнит себя с каким-нибудь цветком и расскажет, почему она сравнивает себя с ним.
Ведущая 2: Дорогие наши девушки, вы все прекрасны, как цветы.Теперь жюри подведет итоги. Затем подарки будут вручены.
Пока жюри подводит итоги, ведущие 3.
Ведущие 3: Наши дорогие девочки, спасибо, что доказали и показали мне особое значение восьмого марта. Теперь я понимаю, что не только в этот день мы должны окружать вас заботой и защищать вас. Восьмое марта — день, когда мы можем доказать вашу преданность и любовь вам, особенно нашим дорогим маме и бабушкам. Присоединяюсь ко всем поздравлениям и с нетерпением буду ждать следующего восьмого марта.
Ведущий 2: Что ж, для того, чтобы выразить свою любовь и верность, этого праздника дождаться совершенно необходимо, можно делать это каждый день.
Отведение 1: Друзья, жюри готово огласить результаты. А теперь позвольте, милые девушки. Дарить тебе подарки.
Lead 3:
Сегодня мы собрались здесь,
Чтобы поздравить вас.
Восьмое марта — день чудес,
Когда все женщины достойны множества комплиментов.
Lead 1:
Не устаем повторять,
Какие ты у нас красивые, как цветы,
Умные, добрые, милые,
И обаятельные, приветливые, ты лучше всех на белом свете.
Свинец 2:
Так оставайся таким навсегда,
Идти по жизни стало легче.
И мы надеемся сохранить
Наша милая дружба навсегда.
Все вместе: с праздником, любимым и дорогим!
Кадырбаева Р.А. — Учитель химии и биологии МБОУ СКРОМ № 1
стр. Свети Светилинского района Оренбургской области
Праздник «Цветочный бал»
Гол :
Образовательные: Познакомьте студентов с коллектором
цветущих растений, с мифами, легендами, сказками,
, связанные с этими цветами, с историей, географией,
стихи, музыка где отражено упоминание
этих цветов.
Образовательные: эстетическое воспитание, история воспитания,
экологическое образование.
Развивающие: Развивайте способность говорить, навыки и навыки исполнения
аппликации от подруги, возможность научить
материала и себя.
Задания: В рамках предметной недели по биологии, химии и географии познакомить учащихся среднего уровня с прекрасным миром цветов.
К празднику слайд-шоу «Мир цветов», музыкальные произведения Моисея и переложения песен с упоминанием цветов.
Из каждого класса в сценарии в сценарии участвуют 3 участника, они готовят эмблемы цветка, который они представляют; И участвуйте в сценарии — декларируют стихи, рассказывают легенды и рассказывают интересные факты из истории красок.
Для конкурса со зрителями готовятся загадки, а для конкурса аппликаций готовятся из лаконичных материалов — клея, ножниц, кусочков ткани, шерсти, цветной бумаги, цветных ниток, кусочков пряжи, лент, бус и картона.
Сценарий праздника «Бал цветов»
1 Ведущий: Есть просто храм
Есть храм науки,
А еще есть храм природы —
Рисующими руками леса
Навстречу солнцу и ветрам.
Он свят в любое время суток,
Открыть нам в жару и грязь,
Иди сюда,
Будь сердцем немного,
Не оскверняйте ее святыни!
2 Хост: Посмотрите, какой чудесный удивительный мир нас окружает.Тебе нравятся цветы? Каждый цветок — как звезда, упавшая с неба. Природа — Мать потратила миллионы лет на то, чтобы сотворить такое простенькое чудо, наполнила его своей силой, вдохнула в него радость и любовь к жизни, а потому мы, чувствуя эти тонкие вибрации, протягиваем к ним все свое творение, чтобы познать эту любовь и наполняй Сам.
1 Ведущий: Цветы украшают нашу жизнь, и сегодня им посвящен наш праздник!
2 Host: Когда белый цвет становится белым, когда мороз трескается, весна падает, и первые весенние цветы утонут в своих ароматах.
1 Ведущий: Наш бал открывают ученики 5 «а» класса.
Студенты 5 А класса
1. Когда тепло так мало для цвета,
Когда снег не сошел полностью
Сквозь заснеженное покрывало,
Подснежники слабо цветут.
2. Но где взять краски яркие для цвета,
Когда был цветок решетчатый снег?
Снежный холод фантазии и рвения
Творец художника остановился.
3. Весна влечет нас как сладкое достояние,
Еще дарят яркие цветы,
Будет подснежник от робкого счастья,
В знак невинной чистой красоты.
1. Ведь для весны — он первенец возлюбленной,
И она была так уж его безликим.
Ой, а где взять подснежник для любимой?
Его так цветут под миг!
2. Пусть будет над лесом
Снег нет,
Пусть под снегом
Сонные луга;
Пусть на спящей реке
Лоттинг льда, —
Раз пришел разведчик,
И весна наступит!
3. Сквозь снег слился подснежник,
Он ждал тепла твоих рук
Такая беспомощная и нежная,
Белый лепесток Фаво.
2 Хост: Слово имеет класс 5 «b».
Ученики 5 «б» класса
1. Следующий весенний подарок — цветок, который мы знаем из древнерусской легенды: Море Царевна Волхов любила юношу Садко, но сердце отдала любимице полей и лесов Любаве.Нежный Волхов сошел на берег и заплакал. А там, где упали слезы князей, выросла долина — символ чистоты, любви и печали.
2. Про первую долину! Из-под снега
Вы просите солнечного света;
какая девственница нонга
В ароматной чистоте твоей!
3. Ландыш ландыша, долина нежная,
Белая лилия, Лили Снежная,
Наш цветок.
Вы встали между зелеными заслонками,
Так что ты, только одевающийся,
Посмотреть могли.
Колокола трясутся
В воздухе в воздухе мая
Бел и чисто.
Ты, как звезды, светишься травами,
Ты выкройка тонкая
Полный лист.
1. Этот очаровательный, загадочный цветок с тонким ароматом, слегка кружащейся головкой, до боли в сердце, до «безумного обожания» любил Петр Ильич Чайковский. Во Флоренции, ошеломленный резким запахом магнолии и буйволовых роз, композитор так ухватился за то, что апеллировал к поэзии.
2. В чем секрет ваших оберегов? —
Не знаю. Но у меня есть ваш добрый друг,
Как струя вина, и нагревается, и пьяна,
Как музыка, она светит мне дыхание,
И, как огонь, питает тепло салона.
3. Но долина прекрасна не только тайным персонажем, но и помощником. Препараты из Майской долины используются для лечения сердечно-сосудистой системы.
1 Ведущий: В каждой стране есть свое национальное растение и свой национальный цветок.Он частично отражает культуру и рассказывает об истории государства, представляя его миру. Понятие «национальный цветок» очень древнее: оно возникло раньше, чем в большинстве стран были установлены государственные флаги. Тогда национальный цветок играл еще большую роль, являясь знакомым определенным людям символом.
2 Host: Но теперь цветы не совсем утратили свою роль на международной арене и часто являются «логотипами» своих стран. Вот несколько «национальных цветов».
1 Ведущий: Ваш цветок представляет 6 «А» класса
Студенты 6 «а» класса
1. Расцвел нарцисс!
Очарование!
В нем столько чистоты
и светлого шяня!
До глубины души
он озарил меня
И сердце thayalo
от нежного тепла …
Цветы в каком-то
солнечном подсвечнике
и белые и желтые
раскололись.
2. Он жил в Китае, бедная старуха вместе с сыном.Они пережили нужду и лишения. Однажды мать забила горсть риса, чтобы приготовить сыну обед. Вдруг в дом постучал путник и попросил меня поесть. Добрая женщина дала ему последний рис и заплакала — теперь ей нечем кормить сына. Этот путешественник был богом воды. Он решил поблагодарить женщину и бросился в пруд, расположенный неподалеку. А на следующее утро пруд вырос нежным цветком. С тех пор Нарцисс в Китае является символом благодарности.
3. Нарцисс цветет во время китайского Нового года, поэтому в Китае он стал символом радости, удачи и счастливого брака.Его присутствие обязательно в каждом доме в новогодние праздники.
1. Согласно древнегреческой легенде:
Цветок, названный Нарциссой,
Когда-то был прекрасным князем,
Но он вдруг стал его любимцем —
Эта богиня была прихотью.
Он любил день и ночь
С его чудесным отражением.
Не ел, не пил, прогонял друзей …
Смерть была лишь мгновением.
Богиня, спасающая жизнь
В цветке Нарциссы исполнилось
(Шиммер — Нимфа связалась).
С тех пор он начал цвести.
2. Причина была мелочь простая:
Он как-то сказал богиню,
Что теперь
С его безмерной красотой.
И был наказан одновременно
Богиня возмездия за горе.
Примени свой ум, приложи свое лицо,
Но не присоединяйтесь к богам в спорах.
3. Вы знаете, что существует язык цветов, и на этом языке Нарцисс означает эгоизм.
2 Хост: Сколько маленьких шедевров
Обитает на земле.
Боже мой, какая щедрость!
Сколько счастья и улыбок,
Вдохновение и любовь
Дайте нам создание этих
Название — Цветы!
1 Ведущий: Ученики 6 «б» класса
Ученики 6 «б» класса
1. Как прекрасен этот огненный цветок!
На длинном стебле гордая и одинокая.
Красивые лепестки закрытого бутона.
Четыре века Мир в нем влюблен …
Что находится в сердце тюльпана без цены?
В чем его красота, в чем загадка?
Так хочется верить … посмотрите —
Очаровательные дюймы внутри …
2. Тюльпан появился в Голландии только в 1634 году, и впервые разведение было полностью коммерческим. Заметив увлечение немцев и других народов этим цветком, расчетливый голландец начал разводить его по как можно большему количеству новых сортов, и вся его прибыльная торговля шла массово, и даже люди, очень мало относившиеся к садоводству, вскоре начали быть полмолвлеными.Не все население.
3. Один страстный любитель приобрел за огромную цену единственный, по словам продавца, экземпляр тюльпана и, вернувшись домой, обнаружил, что еще один экземпляр этого же экземпляра существует в Гарлеме. Вне себя от горя он спешит в Гарлем, приобретает за сумасшедшие деньги этот второй экземпляр, бросает его на землю и, лепя ноги, восклицает с праздником: «Ну, теперь мой тюльпан — единственный в мире! »
1. Исследователь Золоцкий в своей книге о цветах пишет, что тюльпаны были напрямую связаны с появлением биржи.
За одну луковицу тюльпан заплатили сразу 24 четверти пшеницы, 48 четвертей ржи, 4 жирных быка, 8 свиней, 12 овец, 2 бочки вуали, 4 бочки из-под пива, масло, сыр, связочные платья и одну серебряную чашку. ! Даже третий класс стоил кареты и пары лошадей.
2. Голландская принцесса Юлиан в свое время подарила Оттаве (Канада) Сто тысяч луковиц этого цветка в знак признательности за то, что во время Второй мировой войны королевская семья Нидерландов нашла убежище в столице Канады.А также в знак признания заслуг этой страны в освобождении своей Родины.
3. Тюльпан на языке красок означает признание в любви.
1 Ведущий: Цветы окружают нас, несут радость и умиротворение, поднимают к великим делам. Многие сказки, сказки, легенды, стихи сложили народ о цветах; Возникло много загадок. Вы их знаете? Теперь у нас будет такой конкурс загадок.
(Конкурс загадок со зрителями)
2 Host: Его цветок представляет учеников 7 «а» класса
Ученики 7 «а» класса
1. На лужайке у реки
Порошок васильков.
Синий, как небо …
Голубая, как вода …
Хотя вы их увидите,
Я никогда не забуду.
На языке красок — Василюк — изящество и нежность.
3. Еще сто лет назад Василек должен был сопровождать пышные пиршества немцев. Этот цветок был любимым цветком императора Вильгельма I и его матери, королевы Луизы.Есть много историй о том, что Василек был счастливым мастером Прусского королевского дома. Вот один из них.
1. Говорят, что на одном балу, посвященном несчастному королевскому ясному императору Наполеону и его генералам, королева Луиза появилась без каких-либо драгоценных украшений, только с венком из васильков на голове. И когда французы стали остро высказываться по этому поводу, королева заметила: «Да, господа, все наши драгоценности раздроблены, часть продана хотя бы для нужд нашей разрушенной страны; а наши поля настолько мокрые, что даже полевой цветок сейчас большая редкость.«
2 . Победителей не нашли, им ответили, и заставили замолчать. Прошло много лет, и предчувствие королевы Луизы оправдалось. Василек не обманул. Королевская семья, находившаяся в изгнании и угнетении, была восстановлена в своих правах, а принцесса Шарлотта, выйдя замуж за императора Николая I, за маленькую, малолетнюю принцессу, могущественную всероссийскую императрицу.
3. И вот, когда много лет спустя императрица проезжала по Кенигсбергу, жители этого города, желая ей доставить удовольствие и напомнить о времени, жившем в его окрестностях, устроили ей торжественное собрание, на котором васильки сыграли выдающуюся роль. роль.Самая красивая из девушек принесла ей чудесную корзину этих цветов, а остальные бросили васильки на землю и встали у нее на пути. Императрица была редкостью до слез с таким сердечным признанием и выразила свою глубокую благодарность за то, что Кенигсбергес предпочел встретить его так дорого для нее Василюк.
1 Ведущий: Что такое цветы? Трава по сути.
А как Красия заботится посмотри.
А аромат пьянящий …
Spin — назад дороги нет.
2 Хост: Слово имеет класс 7 «b»
Ученики 7 «б» класса
1. Бело-розовые лилии —
Символ верности до слез.
Лепестки четких линий
Относитесь к образу звезд
Большие, невообразимые,
Те, которыми льется свет
Те, которые дарят близким
Во всем мире нет болтовни.
2 . Но ни в одной стране Лилия не имела такого исторического значения, как во Франции.Он связан с именами основателя французской монархии Хлорида, королей Людовика VII, Филиппа III, Франциска I. О появлении трех золотых лилий на французских королях ходят старинные легенды. Лилия I стала эмблемой королевской власти во Франции со времен Хлодайта.
3. Впервые во Франции появляется белое знамя с тремя золотыми лилиями. Впоследствии это эмблема королевской власти и преданности Папскому Преполаю.Людовик IX Святой вел своих рыцарей в крестовые походы под знаменами, на которых были изображены три лилии, символизирующие сострадание, справедливость и милосердие — три добродетели, которые отличали правление этого короля. С Людовиком Xii Лилия становится главным украшением всех садов Франции и называется цветком Людовика. Людовик XIII учредил Орден Белой Лилии, который стал логотипом партии Бурбонов.
1. Во Франции издавна цветок лилии считался выражением величайшего расположения и уважения.В аристократических семьях было принято жених каждое утро, вплоть до самой свадьбы, отправлял невесте белые лилии в букете цветов. Сама Франция называлась королевством лилий, а французский король — королем лилий.
2. Лилия считалась очень почетным знаком на французском гербе. Например, король Карл, желая почтить память Жанны d, ARC, присвоил ее родным местным титулам, дал им имя Де Лис, то есть Лили, и герб, который находится на синем поле меча с двумя лилиями на бока и венок из лилий наверху.
3. На языке цветов белая лилия означает молодость.
1 Ведущий: Боже мой, какая щедрость!
Это все мне?
От восхода до заката
Летом, осенью, весной
Как из рогов аутфилла
Как завязали цветы!
2 мастера : Допускаю — в зародыше через каждые
Мудрость всех цветочных фей.
1 Ведущий: Ваш цветок олицетворяет учеников 8 «класса
Ученики 8 «а» класса
1. Утренний шепот роз,
Иногда просыпаетесь утром?
Спасибо его судьбе
А состояние покоя?
За красоту любим розы,
Их чудесный запах, аромат
За радость, которую вы приносите людям
Они бросают на них беглый взгляд!
2. И лепестки роз
Красный бархат и шипы.
Защищает красоту
Не надеясь на листву.
Палитра ей нравится
Изящный и умный.
Понимает, что листва,
Не спасает от врага
Как будет способ, она заведет
Никто не понадобится.
3. В христианском символизме красная роза была символом мученичества, а белая — символом невинности. Есть орден рыцарей Розы и Креста и войны Йорков и Ланкастеров 255–1485. Был назван Война Алои и Белая роза.Таким образом, белые и красные розы перешли на эмблемы, щиты и знамя. Английские цветы В память об этой долгой войне были привезены особые сорта роз с белыми и красными лепестками, которые назвали ее Ланкастер — Йорк.
1. На языке красок — белая роза молчит, желтая роза — неверность,
красная роза — любовь и страдание, а красная и белая роза вместе — огонь сердца.
2. Роза, гнавшаяся за кубиком и феттом, манделей и рождеством, Пушкин и Бальмонт — все и всегда — во все времена.
3. После захоронения Мирозданья,
Жизнь свежая яркость, мир в очаровательном венке
Это было прекрасно, как в детстве.
Белая роза было
Образ полной чистоты;
Дева Янг Шияла
Алый блеск красоты.
2 master : слово предоставляется 8 «b» класс
2. В Японии изображение хризантемы является священным, и только члены императорского дома имеют право нести материю, опираясь на законы штата.Остальные в случае нарушения этого закона наказываются смертной казнью. Смертная казнь наказуема, и каждая попытка изобразить эту эмблему Японской империи и символ имперской власти, и поэтому изображение ее японского правительства иногда прибегает даже к предотвращению подделки правительственных денежных знаков.
3. Причина столь высокого почитания этого цветка японцами лучше всего проясняет само его название: «Кику» (Солнце). Он — символ этого сияния, дающего жизнь всему на Земле.Долгое время изображение солнечного цветка считалось священным. Хризантема развивается на японском национальном флаге, отчеканена на монетах, изображена на бумажных купюрах.
1. Когда-то эти цвета были на весе золота и считались собственностью императора. В 1876 году был создан Орден Хризантем. Высшая награда, которую мог заслужить человек.
2. Сегодня это самый распространенный осенний цветок.
В них смирение, вдохновение
Необычайная красота …
3.Хризантемы в вазе —
В хрустальном сосуде,
В плетеной корзине,
На широкой тарелке …
Можно лепестков —
давно восхищаюсь
Ведь в зародыше
Красота хризантемы …
1 Ведущий: Посмотрите вокруг, какой прекрасный и удивительный мир нас окружает — леса, поля и реки, море. Океаны и горы, небо и солнце, животные и растения. Это все — природа! Наша жизнь неотделима от нее.Позаботься о ней!
2 Хост: Если я дам цветок,
Если вы сломаете цветок,
Если все: и я, и ты,
Если сломаем цветы —
Опорожнить все стаканы
И красоты не будет!
1 Ведущий: На этом наши цветные пленки готовы! Спасибо всем!
Приложения
Загадки о цветах.
1. Задумчивая,
В желтой короне,
Темные веснушки
На круглом лице.
(Подсолнечник)
2. Народ полевых цветов,
Для гадания подходит.
(ромашка)
3. Эх, колокольчики, синего цвета, —
С языком, но звона нет!
(звонок)
4. Желтые цветы —
Лак для щек,
Пять капризов
А листы сменные.
5. Первый выход с Земли
на Проталянке.
Морозов не боится
Хотя и маленький.
(Подснежник)
6. Лист — парный,
Цветы — янтарь,
Фрукты — коварные:
И калек.
(зверобой)
7. На склонах растет трава
И холмы зеленые.
Запах сильного и душевного
И ее зеленый лист
Идем на чай.
Какая трава, ответь?
(орегано, хабре)
8. По краю болота
Золото что-то:
Пышная чаша —
Желтая рубашка.
(купание)
9. Цветочная трубка,
С белой юбкой
И фрукт сумасшедший:
С шипами, с ядом.
10. Трассы имеют отстойник —
На ее липкой рубашке.
Кувшин на плечеpatro
К краю ядовитым черным.
11. Печаль в траве Росоять
Золотой фонарь.
Потом дымеринг
И превратился в пух.
(одуванчик)
12.Цветок как пузырь,
Венчик.
Цветет не пух,
Звонит? Не слышу.
13. В саду петух —
Фиолетовый гребешок
И в хвосте битвы,
Сабелькая Кривой
14. Бутон — для красоты, шипы —
за угрозу.
Цветок красивее не найти …
15. На шесте — флаги.
Под шестом — мечи.
(Гладиолус)
16.прибыл из Голландии
И мороз не помеха!
Между цветами он «назвал Пан»,
Колпачок цветков ..
(Тюльпан)
17. Аленький цветочек, сжатый в кулак —
Он стал сушеным рундотом …
Сценарий летнего праздника «Цветочный бал»
Назначение: Организация увлекательного, познавательного досуга для детей старшего дошкольного, младшего и среднего школьного возраста.
Задач:
1.Требуются знания детей о цветах и их значении.
2. Обеспечить развитие эстетических чувств, воспитание у детей любви и бережного отношения к природе, творческих способностей.
3. Развивать у детей логическое мышление, память, внимание
Дети под веселую музыку включены на детскую площадку.
Ведущий: От добра, любви и света нарисовано чудо лета!
Доходит до ржаного поля, прыгает, скачет летний дождь!
Урожай зелени, крита и в руках, у реки,
Мука все на диво разноцветные цветы.
Вот и пришло летнее время, деформация!
Посмотрите назад, а там цветут разные цветы!
Как здорово, что лето все еще продолжается! Ведь это совсем немного и сойдет на землю встречать осень. А пока нас ждет веселое лето!
Ребята! Сегодня нас пригласили на бал красок и расскажем о них много нового и интересного.
Цветы — удивительное и прекрасное творение природы. Вокруг себя вы видите их огромное множество.Они разнообразны по цвету, форме и запаху. Но какими бы они ни были, они украшают нашу планету. И действительно, сложно представить нашу жизнь без красок. Даже зимой, когда за окном и холодно, на окне в доме в доме есть комнатные цветы, и они кажутся незаметными. Как радуга на землю спускается и покрывает разноцветный ковер лугов и поля, уборщица в лесу, цветы, цветы лаваша цветут на воде. Их много на клумбах, в парках, в садах.Им восхищаются и поют поэты, художники, музыканты. Украшаем ваши дома, одежду, дарим друг другу любовь, спасибо, уважение
Слушай, негромко звучит музыка,
Цветочная фея спешит к нам в гости.
Под «Вальс цветов» П. Чайковский в зале включает цветочную фею.
Цветочная фея:
Цветочная фея, позвони мне
Я про цвета, детки, я все знаю.
Пришла к нам беда —
цветов все украли
Баба Яг.
(Баба Яга бегает под музыку.)
Баба Яга:
Почему вы все здесь собрались? Веселитесь и смейтесь? Кто разрешил?
Детский : Мы приехали на праздник красок!
Баба Яга : — К празднику красок ?!
А цветы — мой главный враг.
Заточил их в подземелье,
С этим нужно тебя принять.
У меня есть задачи для вас —
Решите их, значит
Цветочки отпущу —
И боле мешать не буду.
Цветочная фея:
Ну, ребята помогите,
И цветов освободите!
Ведущий: — Ребята, помогите цветочной фее?
Баба Яга : — Ну давай, сюрприз,
Ты мне стихи рассказываешь.
Только не про ерунду,
А про цветы в саду,
Про степь, луг,
Гора и поле —
В мире много красок,
Кто будет первым, дети?
Свинец : Да Баба — Яга про цветы, сложенные песни, стихи.Цветы украшают нашу жизнь, мы восхищаемся их красотой.
Ребята, выходите,
Стихи расскажите!
Дети рассказывают несколько стихотворений о цветах.
Бархатцы
Как кошка — когти,
Называется — «Гвоздь»,
А «календула» — по-научному
Только уже скучно.
« Василек»
Дорогой в области ржи
Там, во ржи, найдешь цветок:
Ярко-голубой и пушистый
Жаль только, что не ароматный.
«Одуванчик»
Упало солнышко кладет золотое
Подрос первый молодой одуванчик.
У него чудесный золотой цвет.
От Великого Солнца, маленький портрет.
«Ромашка»
Нарядные платья, желтые броши.
Красивое платье не дорого.
Такие смешные эти ромашки.
Вот, поиграйте детьми, в пятнах.
«Колокол»
Колокол! Белл!
Неужели это ты!
Так звенят и так трепещут
Где травы и цветы
МАК
Только солнышко взойдет —
Мак в саду зацветет.
Бабочка-капуэтрианка
Цветок опускается.
Часы — и цветок
Еще на двух лепестках.
Подсолнечник
Дневной подсолнух в саду
Улыбающаяся погода.
На круговой орбите
Раскладывает рыжий.
Я, — хвастается выпивкой, —
Земля вместе с солнцем теплая!
Баба Яга : — Ты снова выиграл! Что хорошего все о цветах знают.
Девушка выходит в костюме розы.
Роза — символ совершенства,
Мудрости и чистоты.
Его первенство признано.
Средние цветочные движения.
Я пришла не одна, а с подругами, только цветы на клумбы нужно отправлять, помогите?
Ведущий: Конечно, поможем, наши дети очень любят природу и обязательно помогут.
Игра «Флауэрба». (На участке разложены обручи разного цвета, у детей средней группы цветы разного цвета, в сигнале дети должны попасть в обруч своего цвета, как цветок в руке).
Роза: Ребята молодцы, замечательные клумбы получились. Вы позволите нам остаться на празднике?
— Просто нравитесь людям! Игра «Собери цветы». (Дети младшего коллектива собирают разбросанные по участку цветы). Свинец : Вы помните, как вести себя с цветами. Ответы детей: да
Сцена «Не переворачивайте цветы!»
Мальчики: 1. Хочу сорвать сразу все цветы в букетах!
2. Ничего не оставляйте, RVI все до одного!
Ведущий: — Ну, друзья, это тоже, что вы делаете, мальчик?
Понимаете, цветок почти живой, головой не качает.
Какие странные действия появились у ребят:
Rruge цветов все подряд.
Если я положу цветок, если вы сломаете цветок,
Если мы сломаем цветы, тогда не будет красоты!
Пусть все любуются цветами среди полей,
Ведущая: Хочешь поиграть? Есть мобильная игра «Венок», в которой роль «садовника» играет Баба Яга. Дети становятся в звании на одном конце сайта: это «Цветы в саду»,
ВОДА: — Садовник находится на расстоянии 3-4 метров от детей.
Садовник подходит к цветам и говорит:
Иду сорвать цветок,
Из цветов плести венок.
Дети — Цветы ответ:
Мы не хотим, чтобы нас ломали
И венки нас грызли.
Мы хотим остаться в саду
Мы будем восхищаться нами.
Сказав последние слова детям — Цветы убегают, а садовник пытается кого-нибудь выдвинуть. Пойман сидит на стуле. А кто останется тот и выиграет
Баба Яга:
Я буду тяжело дышать, если
Согласен.Бить!
Только я трахаю ребят,
Отгадай загадки!
Баба Яга загадывает загадки про цветы.
— Вот синий колокольчик,
Он качает головой.
Не слышны только звуки,
Как его зовут, подскажите.
(звонок)
Много атласных лепестков —
Желтый, Белый, Пестри, Красный.
Вы посмотрите на меня,
Мне звонят… (Гвоздика)
Чудесный цветок
Он как яркий свет
Пышная, важная, как сковорода,
Цветет … (тюльпан)
Летом таем венок
Оксане, Маше, фары,
Аленке, две натуры.
Все венки — из … (ромашек)
У нас грибы в корзине возили
А еще цветок голубой.
Полевой цветок —
Стройный нежный … (Василек)
Посмотрите на забор
Притащили Королевский сад.
Не тюльпан и не мимоз
И в колючках красота … (роза)
В мае — желтый, а в июле —
Он пушистый комок.
Посмотрели его —
Отсосал … (одуванчик)
Декад летом
Клумбы, парки, клумбы
Мы ваша морковь
И звоним… (ногот).
Баба Яга:
Молодец! Ну что сказать!
Свинец :
Игра «Собери ромашки»
Дети делятся на 2 команды и собирают ромашки.
Игра Gossi Wreath,
Ведущий: Сейчас мы поиграем с вами в игру «Венок сплетен», будем танцевать под музыку. И как только он закончится, ребята в цветах шапки должны оказаться каждый в своем кругу и «сплести» большой венок (ромашки с ромашками, колокольчики, тюльпаны и т. Д.))
Баба Яга: все ! Сторожить! Пора сдаваться!
Прям я начал с тобой соревноваться!
Пора выходить!
Цветочная фея: —
Мы тебя не отпустим, Баба Яга, играй-ка ты с нами!
Шуточная игра «Бабушка — Евгения»
Баба Яга : Все, ребята, уезжаю домой. Теперь я позабочусь о цветах, позабочусь о них. До свидания!
Ведущий : Ребята, Цветочная фея
приглашает вас повеселиться ив веселом танце крутиться!
Цветочная фея: Для вас, ребята, теперь наш танец с моими подругами — цветы.Вальс цветов »
Цветочная фея
А теперь ребята поиграем в игру — загадка
Какой цветок появился на свету на миниатюре? (Тюльпан-цветок счастья).
Какие цветы росли в Кай и Герде? (Розы)
Какие цветы являются главным символом праздника 8 марта? (Мимоза и тюльпаны). Какие цветы должна была найти героиня сказки «Двенадцать месяцев»? (Подснежники)
Кто занимается составлением различных букетов и цветочных композиций? (флорист).
Свинец : Мы хотим, чтобы
Нам всех цветами сюда призывать.
Пусть красавица
Земля украсит.
Полевые, луговые и садовые цветы,
Приглашаем вас прийти, не жалейте красоты! А теперь дети младшей группы исполнят танцевальную песню «Цветы»
Ведущая:
Игра «быстро»
Дети стоят в кругу. Перед каждым из них раскладывается по одному цветку. Под музыку дети начинают двигаться по кругу.Когда стихнет музыка, нужно успеть взять цветок. Игра проводится несколько раз, после каждого раза из круга снимается 2-3 цветка. Дети, не получившие цветок, выбывают из игры. Игра заканчивается, когда появляется несколько детей. Они громко кричат: «Молодец!»
Цветочная фея
Ну, и я должен со мной попрощаться,
Ступай в свое королевство!
До свидания, ребята! До новых встреч!
Ведущий: Вот и подошел к концу наш замечательный праздник, прощаемся с цветами и ждем своих гостей в следующем году.
Настал час Пассавании
Увы, яркий бал закончился!
Заберем цветы!
До свидания, новые встречи!
Галина Морозова
Сценарий праздника «Бал цветов»
« Сценарий Летнее развлечение « Бал цветы » С дисплеем мультимедиа «Музыка цветы »
Морозова Галина Викторовна, музыкальный руководитель МБДОУ «ЦРР-детский сад №104» Железнодорожный р-н, городской округ, г. Воронеж
Цель и задачи.
1. Раскройте и суммируйте малышам около цвета ; доставить
детских удовольствий и эстетических впечатлений.
2. Поднять эмоционально-позитивное отношение к природе, воспитать гуманное отношение к природе.
3. Формировать у детей экологические знания и культуру отношения к природе.
4. Развивать художественные способности и эстетические чувства, умение замечать прекрасное, любоваться и любоваться объектами природы.
Интеграция : «Познание» , «Коммуникация» , «Социализация» , «Здоровье»
«Ярко светит солнышко, в воздухе тепло.
А куда ни глянь — все светло!
Все Б. цветок цветы сколько болеет!
Все такие разные : Желтый и красный!
Белый, как бы более ясный, как бы небо, голубой! «
Курс развлечений.
Ведущий. Пришла к нам румяна лето
И заезжаем на зеленые насаждения.
Сколько кругов солнца сколько света
НО цветков Как пестрый ковер.
Есть много праздников веселых
В мире и в нашей стране
Есть дневной учитель, шахтер
Есть даже праздник Земли …
Почему бы не устроить
Мы новые праздник-день-цвет ?
Цвета и взрослый , и детский
Любовь готова платить.
Дети, пойдем сегодня в Волшебное путешествие — Страна цветы . Садитесь в поезд, и наше путешествие начинается! Дети встают друг с другом, руки кладут на плечи (ремень) Впереди стоящего ребенка и, двигаясь рукой, обходят вокруг и садятся на стулья.
Песня «Разное-облако»
Ведущий. Лето в солнечной одежде
Привезла цветок в ладони !
Вы выбираете цветы
И собирайте букеты!
Дети собирают букеты из красного цвета в красном обруче , букеты из желтого цвета в желтом обруче .
Игра «Собери цветков » .
1-й ребенок. У нас сегодня мяч цветочек
Бал красок и веселья.
Шар разноцветные лепестки
Настройка цвета .
2-й ребенок. Мы рады захотеть
У нас все цветы звоните сюда .
Пусть красиво
Земля украсит.
3-й ребенок. Поле, луг
И сад цветы
Приглашаем вас прийти
Не жалейте красоты!
Получается колокол.
Приглашение прослушано
И только солнце взошло
Перешагнул через наш луг
Ведущий.Blook Blue
Мы рады встрече с вами.
А теперь поиграем с колокольчиком, блестящим цветком .
Игра «Колокол, растущий»
(Дети бегают под музыку вокруг стульев, на которых расставлены колокольчики. По окончании музыки нужно успеть схватить колокольчик и достать. Кто не получит колокольчик, покидает игру.)
Ведущий. Ну спасибо, колокольчик. Заходите на свое место в холле, а мы встречаем гостей дальше.
Девочки выходят — ромашка, человек прочитали :
1. Я ромашковое поле
И все дети меня знают.
2. рядом с ромашкой, белая борода
Солнце прячется в кармане.
Девушки водные танцы «Ромашковое поле»
Ведущий. Сегодня красавица , праздник цветов !
А кто готов о них догадываться?
О. Загадки цвета .
На лужайке, возле леса, распустилось цветок .
Желтый, как солнечный свет, на зеленой ножке.
И как только это будет безосновательно, шапки наденут
Мягкий, послушный ветерок!
(Одуванчики)
Я в зимнем саду
Провожу целый день.
Захват акварельных красок.
Рисунок (Анютины глазки)
Забил озноб, спал под сугробом.
Весной уволили, а летом раскрыли.
Стал белой, как невеста, и розовой, очаровательной. (Пион)
Ведущий. Здесь цветы , смотрите
Потерянные лепестки
Лепестков возьмешь
И цветы собирают .
Игра «Кто быстрее соберет цветок »
Ведущий. А теперь я расскажу вам одну историю. Выходи на поляну девушки воскликнули : «Какой красивый луг! Сколько на мне цветов !»
Ведущий читает стихотворение «Лилия из лилии и масла» J.РИВЗ,
пер. с английского
Ой, если бы ландыши могли позвонить,
Серебро звенит весь лес звенит.
И если лютики вызвали звук,
Это золотое тёплое жужжание охватило бы весь луг.
И феи выйдут в ночной тишине
Под музыку этого танца на Луне!
Показ слайдов «Музыка цветы »
Ведущий надевает большую шляпу с цветком :
I — Флора, королева всех цветов ,
Нарцисс и гладиолус поклоняются мне.
Все цветы приглашают на бал !
На цветочном карнавале !
Из четырех корзин предлагается выбрать «Экипировка» -Сон-цвет
ленты из гофрированной бумаги в каждую руку (желтая, синяя,
фиолетовый, белый). Дети танцуют импровизированный танец.
Музыкальное сопровождение «Марш Радецкий» И. Штраус.
Флора. Я закрываю здесь Цветочный шар
Устали все цветы .Готовый мяч
И наш карнавал завершен!
Музыкальное сопровождение «Вальс цветы ». П. Чайковский.
Флора выставляет на поднос разноцветные конфеты .
Устали все цветы . Готовый мяч
И наш карнавал завершен!
И на хранении в агрегации.
Для радости и веселья!
Цветы — чудо природы .
Их нужно беречь и любить.
Цветы Можно маме в подарок
И бабушке подарить.
Не рви в дубе
Не надо их махать и топтать.
Дети любят природу!
Узнай ее красоту, чтобы понять!
Анализ УМК Габриеляна в химии. Методические рекомендации по изучению химии с использованием УМК О. с. Габриеляна и с учетом требований основного общего образования ГЭФ. Линия химии и новый образовательный стандарт
Последнее время Тема из разных aBC и алфавитов Для меня лично стала просто жгучей.Мой годовалый сын увлекся буквами, увлекся серьезно, он их везде видит, несколько раз пытается повторить любой звук, чтобы повторить кого угодно (я уже про то, что наименьшее адекватнее называть звуками, а не письмами, с твоим сыном я это делаю), показывает в книгах, на вывесках, называет сам или просит меня перезвонить.
Сейчас очень много льгот и просто игрушек с алфавитом и буквами, Но пришлось с пристрастием рассматривать их и скрупулезно выбирать варианты, наиболее достойные моей маленькой надписи.Расскажу о том, что попалось мне на глаза и что меня, мягко говоря, удивило.
Первый шедевр, который есть у нас дома, — это «Морской алфавит». , у нее есть несколько режимов, самый приличный из которых, на мой взгляд, тот, где мелодии просто играют, не связанные с не связанными буквами.
Все остальное очень и очень спорно. В первом режиме в ответ на нажатие кнопки с буквой мы слышим ее название «БЫТЬ», «Ха» и т. Д., И уже один из следующих режимов подтверждает мое твердое убеждение, что учат детей сначала, а то и вовсе для чтения вообще нужны звуки, а не буквы .«Морской алфавит» просит составить любое слово, например, «рот», вы последовательно нажимаете нужные буквы, она произносит «Эр», «О», «ТЕ», после чего «рот» завершает и хвалит вас за правильная задача. Я, конечно, рад, что молодец, но даже я не взрослый человек, умеющий читать человека непонятно как из Eote (даже ассоциации опустошу 🙂 Получился «ротик», а что, собственно, и в этом праве … И это пока не о чисто физическом недостатке — буквы тисненые, но цвет такой же, как фон кнопок, на которых они написаны, виден плохо и бодро.
Долго пока я не проснулся в сыне с интересом к буквам купил такую доску, которая в каталоге продукции гордо называется «Русский алфавит» , Признайтесь, на картинке не рассматривал, но когда я Увидев ее дома, я пришел к выводу, что это может быть что угодно, но только не обычная русская ухо-глазная азбука.
Как мой друг совершенно справедливо, «я не могу понять, почему люди в некоторых местах в каких-то местах вообще …», и мой муж предположил, что этот алфавит предназначен для разрушения устоявшихся стереотипов 🙂
Да, причины таких авторских перестановок в алфавите действительно не ясны, и следует ли приводить последовательность букв русского алфавита в этом дактическом материале.
Еще одна важная вещь, на которую следует обратить внимание, выбирая такие алфавиты с картинками для каждой буквы, это то, что нарисованные картинки должны иметь определенное, и первое, что приходит к ребенку, имя «Таким образом, нет буквы» E «, нарисованной рядом к «елке», не убедит ребенка в том, что на картинке не елка, а ель. Интересно, что сами создатели тоже передвигаются по городу по городу в поисках ели, заправляя пихту и танцуют воду вокруг the ate? 🙂
И еще об одном моменте, на который мало кто обращает внимание, но, тем не менее, он очень важный и может смутить еще не искушенных в чтении детей — многие звуки искажаются в некоторых положениях.. Например, согласные могут звучать мягко после смягчения гласных, например, в слове «лев», и эта картинка (как изображенная здесь лиса) очень популярна в алфавитах в букве «L», звучит как «l», а не «л», то же самое с очень популярными «диван» и «мяч». И безударные гласные вообще могут «притворяться» другими звуками, огромные проблемы в этом смысле с буквой «О», которая в ударе положение и в начале слова встречается очень редко, и большая часть алфавита предлагает нам услышать звук «О» в словах «Обезьяна», «Окно», «Огурец» или «Овца».Произнесите их, и если вы услышите ровно «Ой», я с радостью признаю, что это было неправильно (может спасти осла, если вы успеете назвать его ослом, алфавит с изображением «облака» или в Другими словами, где «О», действительно, лично я ни разу не видел, если найду и покажу, буду признателен).
Winewing вариант, у нас появились буквы из набора магнитный алфавит , хорошо, тут испортить и уж мало что можно, правда для меня остается загадкой, на каком основании и с какой хитростью предназначение этих же букв (в набор из нескольких одинаковых клювов) раскрашены разными цветами и почему вообще буквы красного, синего, зеленого и желтого цветов.
Сейчас сыну сохраняются в основном самодельные (nodress) письма и про наши игры с буквами я расскажу отдельно, а также про то, как правильно выбрать букву, наверное …
А теперь резюме, покупая ребенок к алфавиту или некоторым играм с буквами, убедитесь, что :
Буквы были видны четко (что касается алфавита с картинками, было бы очень хорошо, чтобы картинки не попадали в буквы, так как буква письмо должно быть четким)
.все буквы были одного размера
. Цвета букв были как «классические» (гласные — красные, согласные — синие, мягкие и твердые знаки — зеленые, либо все буквы — черные)
. Картинки под буквами были узнаваемы и максимально
. Предметы, изображенные на картинках, были однозначно и желанными, имели одно наиболее распространенное название, затем изображенные предметы ребенок называл бы правильно (если возникнет хоть малейшее сомнение, пора сначала назвать то, что нарисовано на картинке, не давая ребенок к фантастике)
.Названия соответствующих предметов действительно начинались на том звуке, рядом с которым они были нарисованы (безударные гласные в начале слов могут звучать не так, как нужно слышать ребенку, чтобы узнать букву, смягчая гласные после согласного, сделать согласный звук мягкий)
. Алфавит электронный лучше не покупать очень детишкам, у которых очень много желания просто светить в кнопках — все навредят, звуки будут произноситься «стопкой» и такой же «пучок-маленький» будет у ребенка в его голове.
В статье использованы фотографии с сайтов.
В учебниках химии О.С. Габриэлян является наиболее доступным для школьников изложенным материалом, задания в конце абзацев направлены на формирование различных лесов.
В умк хотелось бы добавить направления проектно-исследовательской работы и справочник по химии для обучения в вузах.
Пятая Татьяна Васильевна , учитель химии и биологии Мау (с) ОГТ № 13 г. Тюмени
Многих из нас много лет учили преподавать Габриелян О.С., и увидеть это на вашем вебинаре для меня было настоящим удовольствием! Как приятно, что автор столь заслуженных учебников может общаться с людьми из разных уголков нашей Родины! Спасибо за ваши вебинары по химии.
Керчинская Р.К. , учитель химии, Ейск
Посмотрела всю серию вебинаров Ахметова М.А. Иногда была плохая связь, но все же большое спасибо за возможность проконсультировать по вопросам, которые меня волновали при подготовке своих учеников к экзамену! С сентября начинаю смотреть твои вебинары по химии!
Филимонова П.U. , Учитель химии и биологии, Г. Гусь-Кристал
Плюсы УМК по химии Габриелян О.С.: ясность изложения материала, цвет, примеры из жизни и истории. Очень хотелось бы иметь электронное приложение для учителей: «Планирование в Word» с датами по плану и собственно с домашним заданием.
Шевченко Алла Вячеславрвна , учитель химии МБОУ Лицей N4, Воронеж
Все учебники имеют глубоко продуманную, выверенную, научно и методически обоснованную структуру.UMC полностью соответствует ГЭФ нового поколения, позволяет полностью реализовать системно-деятельностный подход к обучению и воспитанию, что способствует развитию ключевых компетенций, формированию универсального академического действия.
Наличие рабочих тетрадей и тетрадей для лабораторных и практических работ Позволяет сэкономить время студентов, кроме того, рабочие тетради являются незаменимым учебным пособием При подготовке учащихся к будущей сдаче ГИА (ОГЭ) и ЕГЭ.
Зубовова Е.Г. , учитель химии и биологии МОУ СОШ №17 г.
| Анализ ЦМД в химии Анализ составил: Ткаченко С.Н., Учитель биологии и химии МБОУ СОШ № 2 Кимовск год 2013 Анализ УМД по химии для 8-11 классов Рудзитис Г.Е., Фельдман Ф.Г. (издательство «Просвещение») Состав ЦМД «Химия» для 8-11 классов:
Программа для 8-9 классов В содержании данного курса представлены фундаментальные теоретические знания, в том числе изучение состава и структуры веществ, зависимости их свойств от структуры, конструирование веществ с заданными свойствами, изучение закономерностей химических превращений и способов управления ими с целью производства веществ, материалов, энергии.В фактологической части программы представлена информация о неорганических и органических веществах. Теоретической основой изучения неорганической химии является атомно-молекулярное учение, периодический закон Д.И. Менделеева с краткими сведениями о строении атомов, типах химической связи, законах химических реакций. Изучение органической химии основано на учении А. Бутлерова О. Химическое строение веществ. В изучении курса большая роль отводится химическому эксперименту. Программа для 10-11 классов (базовый уровень) Программа составлена на базовом уровне в двух вариантах: 140 часов в год (2 часа в неделю) и 70 часов в год (1 час в неделю).Данная программа рекомендована студентам, не выбравшим в будущем специальность, связанную с химией. Этот курс обучения изучается после курса химии для 8-9 классов, где они познакомились с важнейшими химическими понятиями, неорганическими и органическими веществами, применимыми в промышленности и в повседневной жизни. Программа предусматривает формирование универсальных ученых и умений, универсальных методов деятельности и ключевых компетенций. Курс 10 Класс — Органическая химия, теоретической основой которой является теория строения органических соединений. Весь курс пронизан идеей о зависимости свойств веществ от состава и строения, от природы функциональных групп, а также генетических связей между классами органических соединений. 11 класс — это систематизация, обобщение, углубление знаний ранее изученных теорий и законов химической науки, химических процессов и производства. Программа химического обмена основана на концентрическом подходе.Особенность его — поддерживать высокий теоретический уровень и максимально проводить тренировки. Дифференцированный подход к изложению заданий и упражнений в конце абзацев позволяет выявить уровень усвоения предмета.Ключевые темы курса химии раскрываются логично, последовательно, принцип материаловедения отложен. Сводные таблицы химических свойств позволяют сконцентрировать внимание студентов на их изучении. Зачатки прослеживаются в учебнике. Несомненное достоинство учебников — это иллюстративная серия; Подходит он удачно, а главное информативно. Его отличает простота, доступность, четкость изображения, отсутствие лишних деталей, отвлекающих внимание школьников, полное соответствие изложенному материалу, соответствие возрастным и психоэмоциональным особенностям учащегося соответствующего класса. Учебники выпускаются с электронным приложением, в котором есть целый учебник, необходимые таблицы, множество изображений и видео лабораторных экспериментов, иллюстрирующих способы получения и свойства химических соединений. Учебники, входящие в учебно-методический комплекс, включены в федеральный перечень учебников, рекомендованных Министерством образования и науки Российской Федерации для использования Б. учебного процесса в общеобразовательных учреждениях.Все они соответствуют требованиям федеральной базовой учебной программы и федерального компонента. Государственный стандарт, концепция модернизации российского образования.
Мультимедийные приложения:
Недостатки Представленный учебно-методический комплект Я полагаю:
|

