Олимпиада по химии 9 класс, задания с ответами
Примеры олимпиадных заданий по химии для 9 класса вы найдете на этой странице. Мы составили тренировочный комплект олимпиадных тестов и задач, которые помогут учащимся подготовиться к олимпиаде, повторив и обобщив ранее изученный материал. Учителям предлагается использовать представленный материал для проведения урока химии, посвященного разбору олимпиадных заданий.
Ко всем заданиям указаны ответы и подробные решения. Поэтому школьники могут использовать этот комплект для самоподготовки. Они смогут оценить уровень своих знаний, сверившись после решения заданий с ответами внизу страницы. Мы не рекомендуем подсматривать в ответы до того, как вы попробуете решить задания самостоятельно. Только так вы сможете подготовиться к олимпиаде.
Скачайте задания, заполнив форму!
После того как укажете данные, кнопка скачивания станет активной
Тестовые задания
1.
Б) ВаS04
В) Ва3(Р04)2
Г) Ва3Р2
2. Трехэлементное вещество — это … А) серная кислота
Б) негашеная известь (оксид кальция)
В) хлорид железа (III)
Г) медный купорос.
З. Сумма коэффициентов в молекулярном уравнении реакции (СuОН)2С03 + НС1 = СuС12 + С02 + …
А) 10
Б) 11
В) 12
Г) 9
4. Количество вещества (моль), содержащееся в 6,255 г хлорида фосфора (V)
А) 0,5
Б) 0,3
В) 0,03
Г) 0,15
5. Число протонов и нейтронов в ядре изотопа 40 К
А) р = 20, n=19
Б) р = 40, n = 19
В) р= 19, n = 21
Г) р = 21, n=19
6. Реакция, в результате которой выпадает осадок
Б) К2С03 + Н2S04
В) Cu(OH)2 +HNO3
Г) Nа2S + Рb(N03)2
7. В 250 мл воды растворили 150 г хлорида кальция. Массовая доля соли в растворе (в процентах) равна:
А) 60
Б) 37,5
В) 75
Г) 62,5
8. Массовая доля кислорода наибольшая в соединении:
А) сульфат калия
Б) сульфит калия
В) фосфат калия
Г) карбонат калия
9. В молекулярном уравнении реакции Ba(OH)2 + Ba(h3PO4)2 —> средняя соль + …
В молекулярном уравнении реакции Ba(OH)2 + Ba(h3PO4)2 —> средняя соль + …
сумма коэффициентов равна:
А) 4
Б) 6
В) 8
Г) 10
10. Масса (в граммах) сернистого ангидрида, занимающего объем при нормальных условиях 7 л, равна:
Б) 25
В) 10
Г) 13,75
Открытые вопросы
Вопрос 1
При взаимодействии 9,6 г оксида металла (III) с серной кислотой образуется 24 г сульфата металла (III). Определите металл.
Вопрос 2
Напишите уравнения реакций, при помощи которых, используя простые вещества кальций, фосфор и кислород, можно получить фосфат кальция.
Вопрос 3
50 г смеси карбонатов бария и натрия растворили в избытке соляной кислоты. Добавление к полученному в результате реакций раствору избытка раствора сульфата натрия приводит к выпадению 46,6 г осадка.
Напишите уравнения протекающих реакций и определите массовые доли (в %) карбонатов в смеси.
Вопрос 4
25 г цинкового порошка поместили в 100 г раствора нитрата серебра. Через некоторое время порошок отфильтровали, высушили и взвесили; масса порошка составила 26,51 г. Определите массовую концентрацию нитрата цинка в растворе.
Через некоторое время порошок отфильтровали, высушили и взвесили; масса порошка составила 26,51 г. Определите массовую концентрацию нитрата цинка в растворе.
Вопрос 5
Студенистое голубое вещество А нейтрализуется бесцветным веществом Б с образованием голубого раствора вещества В. При выпаривании раствора и прокаливании осадка образуются: газ бурого цвета Г, газ Д (бесцветный, в котором вспыхивает тлеющая лучинка) и твердое вещество Е черного цвета, которое может вступать в реакцию с веществом Б с образованием вещества В. Определите вещества А, Б, В, Г, Д и Е и приведите уравнения соответствующих реакций.
Ответы на тесты
| Тестовое задание | № 1 | № 2 | № 3 | № 4 | № 5 |
| Ответ | В | А | Б | В | В |
| Тестовое задание | № 6 | № 7 | № 8 | № 9 | № 10 |
| Ответ | Г | В | А | В | А |
Ответы на открытые вопросы
Ответ на вопрос 1:
Me2O3 + 3 h3SO4 = Me2(SO4)3 + 3 h3O
(2х + 48) г ? моль (2х + 288) г/ моль n (X) = m (X) ? M (X)
9,6 ? 2х + 48 = 24 ? 2х + 288; х = 56 (Fe –железо)
Ответ на вопрос 2:
4 Р + 5О2 = 2 Р2О5
2 Сa + O 2 = 2 CaO
3 СaO + P2 O5 = Ca3 (PO4)2
Ответ на вопрос 3:
Уравнения протекающих реакций:
BaCO3 + 2HCl = BaCl2 + CO2 + h3O (1)
Na2CO3 + 2HCl = 2NaCl + CO2 + h3O (2)
BaCl2 + Na2SO4 = BaSO4 + 2NaCl (3)
По массе осадка BaSO4 и уравнениям реакций (3) и (1) определим массу BaCO3.
По уравнению реакции (3) рассчитаем количество вещества BaCl2:
n(BaCl2) = n(BaSO4) = 46,6 / 233 = 0,2 моль
По уравнению реакции (1) рассчитаем количество вещества BaCO3 и затем его массу:
m(BaCO3) = 0,2 ? 197 = 39,4 г
Определим массовые доли карбонатов в смеси:
w( BaCO3) = 39,4 / 50 = 0,788 или 78,8%
w(Na2CO3) = 100 – 78,8 = 21,2%
Ответ: w(BaCO3) = 78,8% w(Na2CO3) = 21,2%
Ответ на вопрос 4:
Уравнение реакции
Zn + 2AgNO3 = Zn(NO3)2 + 2Ag
Формула для расчета
w(Zn(NO3)2) = m(Zn(NO3)2/(mр-ра + m(Zn) – m(Ag))
Пусть растворилось х моль Zn, тогда:
m(Zn) = 65х г
по уравнению реакции
v(Ag) = 2x, m(Ag) = 2 .108x = 216x г
по уравнению материального баланса
m0(Zn) – m(Zn) + m(Ag) = m1(Zn + Ag)
25 – 65x + 216x = 26,51 x = 0,01 моль Zn
По уравнению реакции – образуется 0,01 моль Zn(NO3)2,
w(Zn(NO3)2) = 1,89/(100 + 0,01 .
 65 – 216 . 0,01) = 0,0192, или 1,92 %.
65 – 216 . 0,01) = 0,0192, или 1,92 %.Ответ на вопрос 5:
Студенистое голубое вещество А – Cu(OH)2
бесцветное вещество Б – HNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2h3O
t0 t0ttВВ В Cu(NO3)2 раствор этого вещества имеет голубую окраску. При прокаливании криста кристаллов этой соли образуются 3 вещества:
t0
2Cu(NO3)2 = 2CuO + 4NO2 + O2
CuO (в CuO (вещество Е черного цвета)
NO2 (г NO2 (газ Г бурого цвета)
O2 (бес O2 (бесцветный газ Д, в котором вспыхивает тлеющая лучинка)
CuO + CuO + 2HNO3 = Cu(NO3)2 + h3O
Скачайте задания, заполнив форму!
После того как укажете данные, кнопка скачивания станет активной
Другие классы
Обновлено: , автор: Валерия Токареватесты онлайн, решение задач, билеты с ответами для 9 класса
Тесты онлайн
- Тест по неорганической химии
- Тест по органической химии
- Тесты онлайн — Характеристика химического элемента New!
Билеты: химия 9 класс, («Вестник образования», 2007, № 6)
Билет № 1
1.
2. Опыт. Проведение реакций, подтверждающих химические свойства хлороводородной кислоты.
Билет № 2
1. Простые и сложные вещества: различие в их составе. Основные классы неорганических соединений: примеры соединений, различие в их составе.
2.Задача. Вычисление массовой доли вещества, находящегося в растворе.
Билет № 3
1. Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д. И. Менделеева.
2. Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Билет № 4
1. Металлы: положение этих химических элементов в периодической системе, строение их атомов (на примере атомов натрия, магния, алюминия). Характерные физические свойства металлов. Химические свойства металлов: взаимодействие с кислородом, водой, кислотами.
Характерные физические свойства металлов. Химические свойства металлов: взаимодействие с кислородом, водой, кислотами.
2. Опыт. Получение и собирание кислорода. Доказательство наличия кислорода в сосуде.
Билет № 5
1. Неметаллы: положение этих химических элементов в периодической системе, строение их атомов (на примере атомов хлора, кислорода, азота). Отличие физических свойств неметаллов от свойств металлов. Реакции неметаллов с простыми веществами: металлами, водородом, кислородом.
2. Задача. Вычисление объема полученного газа, если известна масса исходного вещества.
Билет № 6
1. Виды химической связи: ковалентная (полярная и неполярная), ионная; их сходство и различие. Типы кристаллических решеток. Примеры веществ с различными типами решеток.
2. Опыт. Получение и собирание аммиака.
Билет № 7
1. Взаимосвязь между классами неорганических соединений: возможность получения одних веществ из других (примеры реакций).
2. Задача.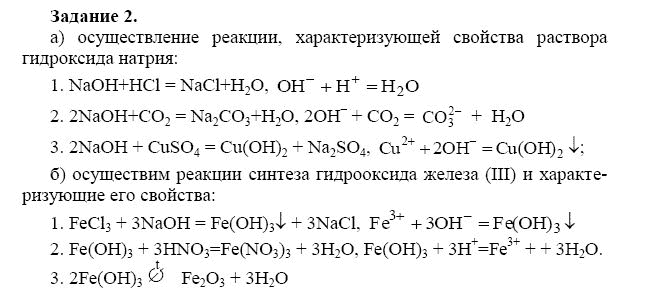
Билет № 8
1. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; выделению или поглощению энергии; изменению степени окисления химических элементов. Примеры реакций различных типов.
2. Опыт. Проведение реакций, подтверждающих качественный состав предложенной соли, например сульфата меди (II).
Билет № 9
1. Окислительно-восстановительные реакции. Окислитель и восстановитель (на примере двух реакций).
2. Задача. Вычисление массы продукта реакции, если для его получения взят раствор с определенной массовой долей (%) исходного вещества.
Билет № 10
1. Реакции ионного обмена, условия их протекания до конца (на примере двух реакций). Отличие реакций ионного обмена от реакций окислительно-восстановительных.
2. Задача. Вычисление массовой доли (%) химического элемента в веществе, формула которого приведена.
Билет № 11
1. Кислоты в свете представлений об электролитической диссоциации. Химические свойства кислот: взаимодействие c металлами, основными оксидами, основаниями, солями (на примере хлороводородной кислоты).
2. Опыт. Выделение поваренной соли из ее смеси с речным песком.
Билет № 12
1. Амфотерные гидроксиды, их химические свойства: взаимодействие с кислотами, щелочами, разложение при нагревании (на примере гидроксида цинка).
2. Опыт. Получение и собирание водорода. Доказательство наличия водорода в пробирке.
Билет №13
1. Щелочи в свете представлений об электролитической диссоциации. Химические свойства щелочей: взаимодействие с кислотами, кислотными оксидами, солями (на примере гидроксида натрия или гидроксида кальция).
2. Задача. Вычисление массы исходного вещества, если известно количество вещества одного из продуктов реакции.
Билет № 14
1. Водород: положение этого химического элемента в периодической системе, строение его атома и молекулы. Физические и химические свойства водорода, получение и применение.
Физические и химические свойства водорода, получение и применение.
2. Задача. Вычисление количества вещества газа, необходимого для реакции с определенным количеством вещества другого газа.
Билет № 15
1. Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды: разложение, отношение к натрию, оксидам кальция, оксиду серы (IV). Основные загрязнители природной воды.
2. Опыт. Распознавание соли угольной кислоты среди трех предложенных солей.
Билет № 16
1. Сера: положение этого химического элемента в периодической системе, строение его атома. Физические и химические свойства серы. Оксиды серы, их химические свойства.
2. Опыт. Проведение реакций, подтверждающих свойства гидроксида кальция.
Билет № 17
1. Оксиды: их классификация и химические свойства (взаимодействие с водой, кислотами и щелочами).
2. Задача. Вычисление массы продукта реакции, если известно количество вещества одного из исходных веществ.
Билет № 18
1. Углерод: положение этого химического элемента в периодической системе, строение его атома. Алмаз. Графит. Оксиды углерода, их принадлежность к подклассам оксидов. Угольная кислота и ее соли.
2. Опыт. Распознавание раствора соли соляной (хлороводородной) кислоты среди трех предложенных растворов.
Билет № 19
1. Кальций: положение этого химического элемента в периодической системе, строение его атома, физические свойства. Химические свойства кальция: взаимодействие с кислородом, водой, кислотами.
2. Задача. Вычисление количества вещества продукта реакции, если известна масса одного из исходных веществ.
Билет № 20
1. Железо: положение этого химического элемента в периодической системе. Химические свойства железа: взаимодействие с серой, хлороводородной кислотой, растворами солей. Оксиды и гидроксиды железа.
2. Опыт. Распознавание среди трех предложенных веществ кислоты и щелочи.
Билет № 21
1. Серная кислота, ее химические свойства в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях (взаимодействие с металлами, оксидами металлов, основаниями и солями).
2. Получение и собирание углекислого газа. Доказательство наличия этого газа в сосуде.
Билет № 22
1. Натрий: положение этого химического элемента в периодической системе, строение его атома, физические свойства. Химические свойства натрия: взаимодействие с неметаллами, водой.
2. Опыт. Осуществление превращения: соль → нерастворимое основание → оксид металла.
Билет № 23
1. Круговорот химических элементов в природе (на примере углерода или азота). Роль живых существ в круговороте химических элементов.
2. Задача. Вычисление объема газа, вступившего в реакцию, если известна масса одного из продуктов реакции.
Билет №24
1. Аммиак: состав молекулы, химическая связь в молекуле. Физические и химические свойства аммиака.
2. Опыт. Распознавание раствора соли серной кислоты среди трех предложенных растворов солей.
Билет № 25
1. Источники химического загрязнения воздуха. Пагубные последствия химического загрязнения воздуха. Меры предупреждения химических загрязнений воздуха.
Меры предупреждения химических загрязнений воздуха.
2. Задача. Вычисление объема газа, необходимого для реакции с определенным количеством вещества другого вещества.
Отвечаем на вопросы, присланные посетителями сайта
- Кислород: состав молекулы, физические и химические свойства
- Соли в свете представления об электролитической диссоциации. Химические свойства солей: взаимодействие с металлами, кислотами, щелочами и солями.
- Соли угольной кислоты: карбонаты натрия, калия, кальция, их практическое значение. Распознавание карбонатов.
- Получение металлов из оксидов с помощью восстановителей: водорода, алюминия, оксида углерода (II). Роль металлов и сплавов в современной технике.
- Скорость химических реакций и факторы от которых она зависит: природа реагирующих веществ, их концентрация, температура протекания химических реакций, поверхность соприкосновения реагирующих веществ, катализаторы.
- Решение задач на растворы, с избытком одного из реагирующих веществ
- Причины многообразия органических веществ: химическое строение, элементарный (качественный) состав.
 Примеры углеводорода и кислородсодержащих органических соединений
Примеры углеводорода и кислородсодержащих органических соединений - Метан, этилен, ацетилен: химическое строение, горение. Реакция полимеризации
- Расчет массовой доли примесей в исходном сырье
- Электролитическая диссоциация кислот, солей
- Этанол, этаналь, этановая кислота; химическое строение, реакция горения. Реакция этерификации
- Опыт: проведение реакций, характеризующих свойства нерастворимых оснований на примере гидроксида меди (II)
- Решение задач на тепловой эффект
- Решение задач на практический выход
- Гидролиз солей
- Опыт: проделайте реакции, подтверждающие качественный состав хлорида аммония
- Опыт: проделайте реакции, подтверждающие качественный состав хлорида бария
- Опыт: определите с помощью качественной реакции карбонат, сульфат натрия и серную кислоту
- Почему цинк в электрохимическом ряду напряжения металлов стоит до водорода? Ответ подтвердить опытом
- Расчет формулы вещества по массе продуктов сгорания
- Расчет молекулярной формулы по массовой доле элементов
- Задачи на смешивание растворов (ЕГЭ математика)
- Словарик по биологии и химии
- Как записывать уравнения диссоциации
- Чем реагент отличается от реактива
Задания к билетам: химия 9 кл (для примера)
Билет № 2
2. Рассчитайте массовую долю растворенного вещества, если при выпаривании 20 г раствора было получено 4 г соли.
Рассчитайте массовую долю растворенного вещества, если при выпаривании 20 г раствора было получено 4 г соли.
Билет № 3
2. Какое количество вещества водорода выделится при взаимодействии цинка с соляной кислотой массой 146 г?
Билет № 5
2. Сколько литров водорода выделится при разложении электрическим током воды массой 72 г?
Билет № 7
2. Сколько литров кислорода необходимо для сгорания 89,6 литров водорода?
Билет № 9
2. Сколько граммов хлорида цинка получится при растворении избытка цинка в 20 граммах 10%-ного раствора соляной кислоты?
Билет № 10
2. Рассчитайте массовую долю элементов в оксиде серы (VI) SO3.
Билет № 13
2. Сколько граммов соляной кислоты необходимо для получения 4 моль хлорида цинка?
Билет № 14
2. Какое количество вещества водорода прореагирует с 4 моль кислорода?
Билет № 17
2. Сколько г хлорида цинка можно получить, имея 0,5 моль соляной кислоты?
Билет № 19
2. Сколько моль хлорида цинка можно получить, имея 365 г соляной кислоты?
Сколько моль хлорида цинка можно получить, имея 365 г соляной кислоты?
Билет № 23
2. Сколько литров водорода сгорело, если образовалось 72 г воды?
Билет № 25
2. Сколько литров кислорода потребуется для сгорания 10 моль водорода?
Контрольные работы по химии — примерные задания
- Химия, 8 класс. Контрольная работа за 1 четверть
- 8 класс. Контрольная работа за 2 четверть
- 8 класс. Контрольная работа за 3 четверть
- 8 класс. Контрольная работа за год
- 9 класс. Контрольная работа за 1 четверть
- 9 класс. Контрольная работа за 2 четверть
- 9 класс. Контрольная работа за 3 четверть
- 9 класс. Контрольная работа за год
- 10 класс. Контрольная работа за 1 полугодие
- 10 класс. Контрольная работа за год (неорганическая химия)
- 11 класс. Контрольная работа за год
Образцы решения задач по химии.
ВНИМАНИЕ!!!
УЧАЩИЕСЯ 9 КЛАССОВ!!!
Для успешной сдачи экзамена по химии в некоторых билетах вам необходимо будет решить задачу.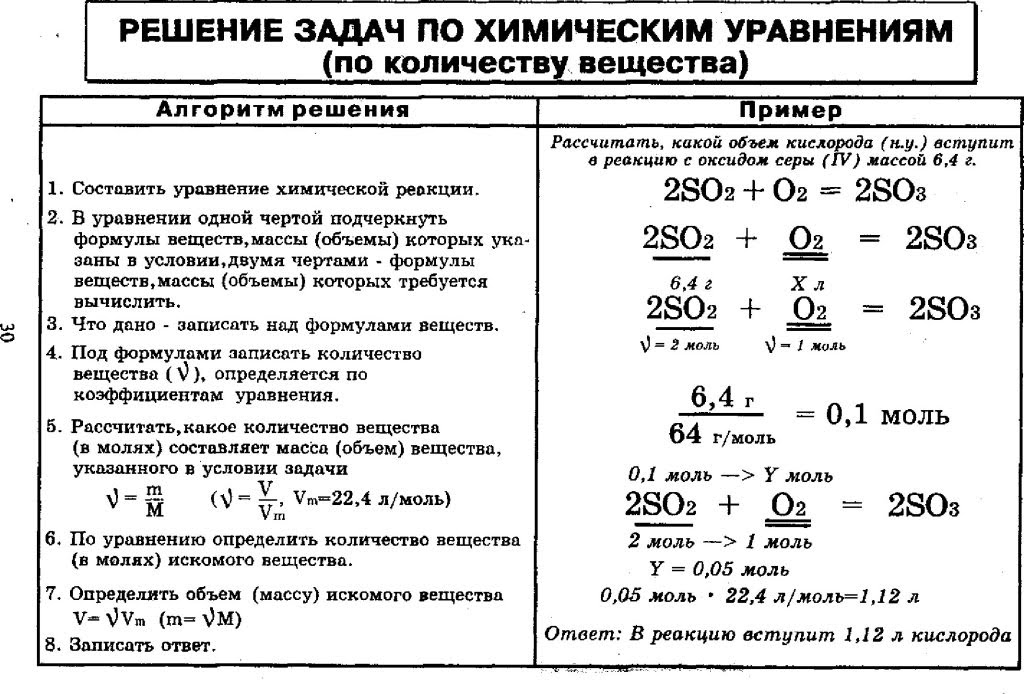 Предлагаем вам рассмотреть, разобрать и закрепить в памяти решение типовых задач по химии.
Предлагаем вам рассмотреть, разобрать и закрепить в памяти решение типовых задач по химии.
Задача на вычисление массовой доли вещества, находящегося в растворе.
В 150 г воды растворили 50г фосфорной кислоты. Найдите массовую долю кислоты в полученном растворе.
Записываем известные величины в условие задачи.
Дано: m(h3O) = 150г, m(h4PO4) = 50г
А так же записываем, что нам необходимо найти в результате решения задачи.
Найти : w (h4PO4) — ?
Приступаем к решению задачи.
Решение: 1). Находим массу получившегося раствора. Для этого просто сложим массу воды и массу прилитой к ней фосфорной кислоты.
m(раствора) = 150г + 50 г = 200 г
2). Для решения нам необходимо знать формулу массовой доли. Записываем формулу массовой доли вещества в растворе.
w (вещества) = * 100%
Подставляем в формулу массу фосфорной кислоты из условия задачи и рассчитанную массу раствора. и производим математические подсчеты.
и производим математические подсчеты.
w (h4PO4) = * 100%= 25%
Записываем ответ.
Ответ: w (h4PO4) =25%
Задача на вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Вычислите количество вещества железа, которое получится в результате взаимодействия водорода с 480г оксида железа(III).
Записываем известные величины в условие задачи.
Дано: m(Fe2O3) = 4
Так же записываем, что необходимо найти в результате решения задачи.
Найти : n (Fe) — ?
Приступаем к решению задачи.
Решение: 1). Для решения подобных задач сперва нужно записать уравнение реакции, описанной в условии задачи.
Fe2O3 + 3 h3 2Fe + 3h3О
2). Затем запишем формулу количества вещества.
n = , где n- количество вещества, m — масса этого вещества, а M — молярная масса вещества.
По условию задачи нам не известна масса получившегося железа, т. е. в формуле количества вещества нам неизвестны две величины. Поэтому мы будем искать количество вещества по количеству вещества оксида железа (III). Количества вещества железа и оксида железа(III) следующим отношением.
е. в формуле количества вещества нам неизвестны две величины. Поэтому мы будем искать количество вещества по количеству вещества оксида железа (III). Количества вещества железа и оксида железа(III) следующим отношением.
= ;где 2- стехиометрический коэффициент из уравнения реакции, стоящий перед железом, а 1 – коэффициент, стоящий перед оксидом железа(III).
отсюда n (Fe)= 2 n (Fe2O3)
3). Находим количество вещества оксида железа(III).
n (Fe2O3) = = 3 моль, где 480г – масса оксида железа (III), 160 – молярная масса оксида железа (III), которую мы вычисляем на основании относительных атомных масс железа и кислорода, а также учитывая количество этих атомов в оксиде железа (III): М(Fe2O3)= 2х 56 + 3х 16=112 + 48 = 160
4). Находим количество вещества железа, получившегося в ходе реакции.
n (Fe) = 2 : 3 моль = 6 моль
Запишем ответ.
Ответ: n (Fe) = 6 моль
Задача на вычисление объема полученного газа, если известна масса исходного вещества.
Какой объем водорода образуется при взаимодействии соляной кислоты с 54 г алюминия?
Записываем условие задачи.
Дано: m(Al) = 54г
А так же записываем, что нам необходимо найти в результате решения задачи.
Найти : V (h3) — ?
Приступаем к решению задачи.
Решение: 1) записываем уравнение реакции по условию задачи.
2 Al + 6 HCl 2 AlCl3 +3 h3
2). Запишем формулу объема вещества.
V = Vm *n, где V – объем вещества, Vm — молярный объем газа при нормальных условиях (н. у.) величина постоянная и равная 22, 4 *n — количество вещества данного газа.
V (Н2) = Vm * n (Н2)
3). Но в этой формуле нам неизвестно количество вещества водорода.
4). Найдем количество вещества водорода по количеству вещества алюминия по следующему соотношению.
= ; отсюда n (h3) = 3 n (Al): 2 , где 3 и 2 – стехиометрические коэффициенты, стоящие соответственно перед водородом и алюминием.
5). Найдем количество вещества алюминия по формуле количества вещества n =
n (Al) =
n (Al) = = 2 моль
6). А теперь высчитаем получившееся в ходе реакции количество вещества водорода по формуле n (h3) = 3 n (Al).
n (h3) = 3 х 2= 6 моль
7). Найдем полученный объем водорода по формуле V (Н2) = Vm * n (Н2)
V (Н2) =22, 4 * 6 моль= 134 ,4 л
Запишем ответ.
Ответ: V (Н2) =134 ,4 л
Задача на вычисление количества вещества (или объема) газа, необходимого для реакции с определенным количеством вещества (или объемом) другого газа.
Какое количество вещества кислорода потребуется для взаимодействия с 8 моль водорода при нормальных условиях?
Запишем условия задачи.
Дано: n (h3) = 8моль
А так же запишем, что необходимо найти в результате решения задачи.
Найти : n(O2) — ?
Приступаем к решению задачи.
Решение: 1). Запишем уравнение реакции, следуя условию задачи.
2 h3 + О2 2 h3О
2). Количество вещества водорода и количество вещества кислорода связывает следующее соотношение :
= ; где 2 и 1 – стехиометрические коэффициенты, стоящие перед водородом и кислородом соответственно в уравнении реакции.
3). Отсюда 2 n (O2)= n (h3)
А количество вещества кислорода равно : n (O2)= n (h3):2
4). Нам остается подставить в полученную формулу данные из условия задачи.
n (О2) = 8моль :2 = 4 моль
5). Запишем ответ.
Ответ: n (О2) = 4 моль
решение задач по химии практической напрвленности | Материал по химии (9 класс) по теме:
Решение типовых задач по химии
«Не для муки, а для науки.»
(Народная мудрость)
Расчеты по уравнениям химических реакций
Классификация химических реакций. Реакции соединения, разложения, замещения, двойного обмена, окислительно-восстановительные реакции. Уравнения химических реакций. Подбор стехиометрических коэффициентов в уравнениях реакций. Расчеты по уравнениям реакций. Определение количества вещества и массы реагентов и продуктов. Определение объема газообразных реагентов и продуктов. Теоретический и практический выход продукта реакции. Степень чистоты химических веществ.
Расчеты по уравнениям реакций. Определение количества вещества и массы реагентов и продуктов. Определение объема газообразных реагентов и продуктов. Теоретический и практический выход продукта реакции. Степень чистоты химических веществ.
Примеры решения типовых задач
Задача 1. При рентгеноскопическом исследовании организма человека применяют так называемые рентгеноконтрастные вещества. Так, перед просвечиванием желудка пациенту дают выпить суспензию труднорастворимого сульфата бария, не пропускающего рентгеновское излучение. Какие количества оксида бария и серной кислоты потребуются для получения 100 сульфата бария?
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
BaO + h3SO4 = BaSO4 + h3O
m(BaSO4) = 100 г; M(BaSO4) = 233 г/моль
n(BaO) = ?
n(h3SO4) = ?
В соответствии с коэффициентами уравнения реакции, которые в нашем случае все равны 1, для получения заданного количества BaSO4 требуются:
n(BaO) = n(BaSO4) = m(BaSO4) / M(BaSO4) = 100 : 233
[г : (г/моль)] = 0,43 моль
n(h3SO4) = n(BaSO4) = m(BaSO4) / M(BaSO4) = 100 : 233
[г : (г/моль)] = 0,43 моль
Ответ. Для получения 100 г сульфата бария требуются 0,43 моль оксида бария и 0,43 моль серной кислоты.
Для получения 100 г сульфата бария требуются 0,43 моль оксида бария и 0,43 моль серной кислоты.
Задача 2. Прежде чем вылить в канализацию жидкие отходы лабораторных работ, содержащие соляную кислоту, полагается их нейтрализовать щелочью (например, гидроксидом натрия) или содой (карбонатом натрия). Определите массы NaOH и Na2CO3, необходимые для нейтрализации отходов, содержащих 0,45 моль HCl. Какой объем газа (при н.у.) выделится при нейтрализации указанного количества отходов содой?
Решение. Запишем уравнения реакций и условия задачи в формульном виде:
(1) HCl + NaOH = NaCl + h3O
(2) 2HCl + Na2CO3 = 2NaCl + h3O + CO2
n(HCl) = 0,45 моль; M(NaOH) = 40 г/моль;
M(Na2CO3) = 106 г/моль; VM = 22,4 л/моль (н.у.)
n(NaOH) = ? m(NaOH) = ?
n(Na2CO3) = ? m(Na2CO3) = ?
V(CO2) = ? (н.у.)
Для нейтрализации заданного количества HCl в соответствии с уравнениями реакций (1) и (2) требуется:
n(NaOH) = n(HCl) = 0,45 моль;
m(NaOH) = n(NaOH) .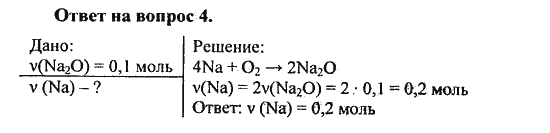 M(NaOH) = 0,45 . 40
M(NaOH) = 0,45 . 40
[моль . г/моль] = 18 г
n(Na2CO3) = n(HCl) / 2 = 0,45 : 2 [моль] = 0,225 моль;
m(Na2CO3) = n(Na2CO3) / M(Na2CO3) = 0,225 . 106
[моль . г/моль] = 23,85 г
Для расчета объема углекислого газа, выделившегося при нейтрализации по реакции (2), дополнительно используется уравнение, связывающие между собой количество газообразного вещества, его объем и молярный объем:
n(CO2) = n(HCl) / 2 = 0,45 : 2 [моль] = 0,225 моль;
V(CO2) = n(CO2) . VM = 0,225 . 22,4 [моль . л/моль] = 5,04 л
Ответ. 18 г NaOH; 23,85 г Na2CO3; 5,04 л CO2
Задача 3. Антуан-Лоран Лавуазье открыл природу горения различных веществ в кислороде после своего знаменитого двенадцатидневного опыта. В этом опыте он сначала длительное время нагревал в запаянной реторте навеску ртути, а позже (и при более высокой температуре) — образовавшийся на первом этапе опыта оксид ртути(II). При этом выделялся кислород, и Лавуазье стал вместе с Джозефом Пристли и Карлом Шееле первооткрывателем этого важнейшего химического элемента. Рассчитайте количество и объем кислорода (при н.у.), собранный при разложении 108,5 г HgO.
Рассчитайте количество и объем кислорода (при н.у.), собранный при разложении 108,5 г HgO.
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
2HgO = 2Hg + O2
m(HgO) = 108,5 г; M(HgO) = 217 г/моль
VM = 22,4 л/моль (н.у.)
V(O2) = ? (н.у.)
Количество кислорода n(O2), который выделяется при разложении оксида ртути(II), составляет:
n(O2) = 1/2 n(HgO) = 1/2 m(HgO) / M(HgO) = 108,5 / (217 . 2}
[г : (г/моль)] = 0,25 моль,
а его объем при н.у. — V(O2) = n(O2) . VM = 0,25 . 22,4
[моль . л/моль] = 5,6 л
Ответ. 0,25 моль, или 5,6 л (при н.у.) кислорода.
Задача 4. Важнейшая проблема в промышленном производстве удобрений — получение так называемого «связанного азота». В настоящее время ее решают путем синтеза аммиака из азота и водорода. Какой объем аммиака (при н.у.) можно получить в этом процессе, если объем исходного водорода равен 300 л, а практический выход (z) — 43 %?
Решение. Запишем уравнение реакции и условие задачи в формульном виде:
N2 + 3h3 = 2Nh4
V(h3) = 300 л; z(Nh4) = 43% = 0,43
V(Nh4) = ? (н. у.)
у.)
Объем аммиака V(Nh4), который можно получить в соответствии с условием задачи, составляет:
V(Nh4)практ = V(Nh4)теор . z(Nh4) = 2/3 . V(h3) . z(Nh4) =
= 2/3 . 300 . 0,45 [л] = 86 л
Ответ. 86 л (при н.у.) аммиака.
3.1. Оконные стекла и дверцы вытяжных шкафов в химической лаборатории часто бывают покрыты белым налетом, состоящим из кристаллов хлорида аммония. Причина этого явления — постоянное присутствие в воздухе лабораторий аммиака и хлороводорода. Рассчитайте количество и объем (при н.у.) этих газов, если образовалось 5 г хлорида аммония.
3.2. Природный газ содержит главным образом метан Ch5, но в нем присутствуют и примеси, например, ядовитый сероводород h3S — до 50 г на 1 кг метана. Чтобы удалить примесь сероводорода, можно провести его окисление перманганатом калия в кислой среде до серы. Рассчитайте количество серы, которую можно таким образом выделить из 1 т природного газа. Определите также, какая масса серной кислоты может быть получена, если всю выделенную серу направить в цех производства h3SO4.
3.3. Толщи известняка на земной поверхности и под землей медленно «размываются» под действием почвенных вод, где растворен диоксид углерода. Какую массу карбоната кальция CaCO3 может перевести в растворимый гидрокарбонат кальция состава Ca(HCO3)2 вода, в которой растворено 10 моль CO2? Практический выход для реакции химического растворения считайте равным 90%.
3.4. Предельно допустимая среднесуточная концентрация монооксида углерода в воздухе составляет 3,0 мг/м3. Простейший газоанализатор, позволяющий определить наличие в воздухе ядовитой примеси СО, содержит белый порошок оксида иода(V), нанесенный на пемзу и помещенный в стеклянную трубочку. При взаимодействии I2O5 c CO идет окислительно-восстановительная реакция с выделением иода, который окрашивает содержимое трубочки в черный цвет. Какое количество монооксида углерода вызовет выделение 0,1 г иода в трубке газоанализатора? Какой объем воздуха (при н.у.), содержащего 3,0 мг/м3 CO, надо будет пропустить через трубку, чтобы в ней выделилось 0,1 г иода?
3. 5. Коррозия железа на воздухе в присутствии большого количества воды приводит к образованию метагидроксида железа состава FeO(OH). Рассчитайте, какая масса железа подверглась коррозии, если количество полученного в результате этого процесса FeO(OH) составило 11,5 моль. Определите также объем (при н.у.) кислорода, участвовавшего в реакции.
5. Коррозия железа на воздухе в присутствии большого количества воды приводит к образованию метагидроксида железа состава FeO(OH). Рассчитайте, какая масса железа подверглась коррозии, если количество полученного в результате этого процесса FeO(OH) составило 11,5 моль. Определите также объем (при н.у.) кислорода, участвовавшего в реакции.
3.6. При выпечке печенья в качестве разрыхлителя теста используют пищевую соду (гидрокарбонат натрия) с добавкой уксусной кислоты. Эта смесь при нагревании разлагается, выделяя углекислый газ. Рассчитайте объем (при н.у.) CO2, который выделится при использовании 1 чайной ложки (5 г) NaHCO3 и избытка Ch4COOH.
3.7. Взаимодействие минерала магнетита (оксида железа состава Fe3O4) с монооксидом углерода CO приводит к получению железа и выделению углекислого газа CO2. В результате реакции было выделено 65,3 кг железа. Рассчитайте практический выход железа, если масса исходного магнетита составляла 110 кг. Определите объем (при н.у.) полученного газа.
3.8. Жженую известь, применяемую в строительстве, получают прокаливанием известняка. Определите массовую долю основного вещества (карбоната кальция) в известняке, если прокаливание его образца массой 5,0 кг привело к выделению 1,0 м3 углекислого газа (при н.у.).
3.9. Карл-Вильгельм Шееле в 1774 году получил кислород термическим разложением перманганата калия KMnO4. Помимо кислорода, при этом получаются оксид марганца(IV) и манганат калия K2MnO4. Кислород, выделенный при разложении 33,5 г перманганата калия, использовали для сжигания серы и при этом получили 2,1 л (при н.у.) диоксида серы SO2. Определите практический выход кислорода при разложении перманганата калия. Рассчитайте массу серы, затраченной на сжигание.
3.10. Разбитый термометр, в котором было 20,5 г ртути, выбросили в пруд. Прошло 4 месяца, и вследствие сложных биохимических процессов около 5% этого опасного металла перешло в раствор в виде солей ртути(II) типа нитрата ртути(II) Hg(NO3)2. Определите количество и массу катионов ртути(II) в пруду. Определите, представляет ли опасность прудовая вода, если объем воды в пруду 80 м3, а санитарная норма предусматривает содержание не более чем 0,01 г Hg2+ в 1 м3.
Определите, представляет ли опасность прудовая вода, если объем воды в пруду 80 м3, а санитарная норма предусматривает содержание не более чем 0,01 г Hg2+ в 1 м3.
3.11. Для обеззараживания воды ее часто хлорируют. При этом неизбежна утечка ядовитого газа в атмосферу. Чтобы удалить хлор из вентиляционного воздуха, используют «антихлор» — увлажненный сульфит натрия Na2SO3. Какая масса сульфита натрия потребуется для поглощения всего хлора из 5000 м3 воздуха, если содержание в нем Cl2 в 10 раз превышает среднесуточное предельно допустимое и составляет 0,3 мг/м3?
3.12. Рассчитайте объем (при н.у.) хлора, который идет на обеззараживание 10 м3 воды, если на каждый литр воды расходуется 0,002 мг хлора. Напишите уравнение реакции взаимодействия хлора с водой и поясните, на чем основано его обеззараживающее действие.
3.13. При сильных отравлениях белым фосфором пострадавшему назначают прием очень разбавленного раствора сульфата меди(II). Процессы, протекающие в организме больного, сводятся к окислительно-восстановительной реакции фосфора с катионами меди(II) с выделением металлической меди и образованием относительно безвредных количеств ортофосфорной и серной кислоты. Какое количество и массу сульфата меди(II) должен получить пострадавший для полного окисления 0,1 мг фосфора, если считать выход этого процесса 100%-ным?
Какое количество и массу сульфата меди(II) должен получить пострадавший для полного окисления 0,1 мг фосфора, если считать выход этого процесса 100%-ным?
3.14. Пролитую ртуть можно собрать с помощью медной проволоки, алюминиевой фольги и даже листом бумаги, но во всех этих случаях собранную ртуть нужно обезвредить (например, обработать концентрированной азотной кислотой). Какое количество HNO3 потребуется для обезвреживания 19,5 г ртути, собранной на полу после того, как в доме был разбит термометр? Каков объем выделяющегося при этом газа (при н.у.)? Если ртуть была собрана не полностью, рекомендуют обработать трещины и щели пола и другие «подозрительные» места в комнате порошком серы. Напишите уравнение реакции, протекающей с участием ртути и серы.
3.15. Оксид диазота («веселящий газ»), обладающий слабонаркотическим действием был открыт английским химиком Гемфри Дэви в начале XIX века. Для получения N2O Дэви использовал реакцию термического разложения нитрата аммония. При этом, помимо основных продуктов разложения, образуются и другие газы (например, NO и NO2). Рассчитайте практический выход оксида диазота, если масса нитрата аммония была равна 11,5 г, а объем полученного N2O — 2,1 л (при н.у.).
Рассчитайте практический выход оксида диазота, если масса нитрата аммония была равна 11,5 г, а объем полученного N2O — 2,1 л (при н.у.).
3.16. Установлено, что для очистки газовых выбросов от диоксида азота применяется карбонат натрия, который при взаимодействии с NO2 дает нитрат натрия, нитрит натрия и углекислый газ. Рассчитайте массу карбоната натрия, который обезвреживает выбросы, содержащие 5 л диоксида азота (при н.у.).
3.17. Органические вещества растений образуются из углекислого газа, присутствующего в воздухе, и воды, поступающей из почвы. В зеленых листьях растений эти неорганические вещества превращаются в органическое вещество глюкозу C6h22O6. Этот процесс сопровождается выделением кислорода. Рассчитайте, какой объем кислорода (при н.у.) выделяется в атмосферу зелеными растениями при образовании 1 кг глюкозы.
3.18. Сжигая органическое топливо, человечество ежегодно отправляет в атмосферу 12 млн. т оксида азота(II) NO. Какую массу азотной кислоты можно было бы получить из всего этого количества NO при условии, что практический выход составит 80%?
3. 19. Каждый автомобиль расходует в год примерно 4 т кислорода. Какую массу оксида ртути(II) HgO следует подвергнуть разложению с выделением кислорода, чтобы обеспечить годовую потребность одного автомобиля?
19. Каждый автомобиль расходует в год примерно 4 т кислорода. Какую массу оксида ртути(II) HgO следует подвергнуть разложению с выделением кислорода, чтобы обеспечить годовую потребность одного автомобиля?
3.20. Известно, что сероводород, циркулируя в биосфере, может окисляться под действием аэробных бактерий до свободной серы. Именно это, как полагают геохимики, было причиной возникновения залежей самородной серы. Рассчитайте, какой объем (при н.у.) сероводорода был поглощен и переработан бактериями, если образовалось 450 т серы.
Ответы
3.1. 0,093 моль (2,09 л) Nh4 и 0,093 моль (2,09 л) HCl
3.2. 50 кг серы и 153 кг h3SO4
3.3. 900 г CaCO3
3.4. 0,0020 моль CO; 18 м3 воздуха
3.5. 644 г железа,193,2 л O2
3.6. 1,33 л CO2
3.7. Практический выход 82%
3.8. 0,893, или 89,3% карбоната кальция в известняке
3.9. Практический выход 88,4%, масса серы 3,0 г
3.10. 0,051 моль (1,025 г) Hg2+; вода опасна для здоровья, так как в ней содержится 0,013 г/м3 Hg2+ (выше нормы)
3. 11. 2,66 г Na2SO3
11. 2,66 г Na2SO3
3.12. 6,3 мл Cl2
3.13. 8,01 . 10—6 моль; 1,29 мг CuSO4
3.14. 0,39 моль HNO3; 4,35 л NO2
3.15. Практический выход 65,2%
3.16. 11,8 кг Na2CO3
3.17. 746,7 л кислорода
3.18. 20,2 млн.т азотной кислоты
3.19. 54,1 т HgO
3.20. 315000 м3 h3S (при н.у.)
Архив заданий | Московская олимпиада школьников по химии
Архив заданий | ГлавнаяЗадания и рекомендации к решению экспериментального тура заключительного этапа 2020-2021 уч. года
8 класс 9 класс 10 класс 11 класс
Задания теоретического тура заключительного этапа 2020-2021 уч. года
8 класс 9 класс 10 класс 11 класс
Решения задач теоретического тура заключительного этапа 2020-2021 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и ответы отборочного этапа 2020-2021 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура заключительного этапа 2019-2020 уч. года
года
8 класс 9 класс 10 класс 11 класс
Задания и ответы отборочного этапа 2019-2020 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура заключительного этапа 2018-2019 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и ответы отборочного этапа 2018-2019 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура заключительного этапа 2017-2018 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и ответы отборочного этапа 2017-2018 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура 2016-2017 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и ответы отборочного этапа 2016-2017 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура 2015-2016 уч. года
года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура 2014-2015 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения отборочного интернет-тура 2014-2015 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения очного теоретического тура 16.02.2014
8 КЛАСС 9 КЛАСС 10 КЛАСС 11 КЛАСС
Задания и решения очного теоретического тура 17.02.2013
8 класс 9 класс 10 класс 11 класс
Задания и решения отборочного интернет-тура 2012-2013 уч. года
8 класс 9 класс 10 класс 11 класс
Задания и решения 2002-2003
8 класс 9 класс 10 класс 11 класс
Задания и решения 2003-2004
8 класс 9 класс 10 класс 11 класс
Задания и решения 2004-2005
8 класс 9 класс 10 класс 11 класс
Задания и решения 2005-2006
8 класс 9 класс 10 класс 11 класс
Задания и решения 2006-2007
8 класс 9 класс 10 класс 11 класс
Задания и решения 2007-2008
8 класс 9 класс 10 класс 11 класс
Задания и решения 2008-2009
8 класс 9 класс 10 класс 11 класс
Задания и решения 2009-2010
8 класс 9 класс 10 класс 11 класс
Задания и решения 2010-2011
8 класс 9 класс 10 класс 11 класс
Задания и решения 2011-2012
8 класс 9 класс 10 класс 11 класс
ГДЗ по химии 9 класс задачник Кузнецова, Левкин Вентана-Граф
Химия — дисциплина, по которой необходимы в качестве вступительного результаты ЕГЭ во множество ВУЗов самых разных направленностей:
— технология;
— медицина;
— агрономия;
— биокибернетика и ряд других.
Вторая часть блока экзаменационных вопросов — решение задач по дисциплине. И именно от качественного выполнения этого компонента в итоге зависит величина набранных баллов. Успешно подготовиться позволит систематическая проработка типовых, комбинированных и творческих заданий.
Помогут в этом специальные пособия, практикумы. Например, в рамках комплекса «Алгоритм успеха» рекомендован задачник по химии 9 класс, авторы: Левкин А. Н., Кузнецова Н. Е. Эффективность и полезность этой книги отмечается педагогами-предметниками не только в качестве пособия для подготовки к итоговым испытаниям, но и для тех девятиклассников, кто планирует участие в предметных олимпиадах. Здесь есть соответствующие уровню задачи.
Форма изложения материала позволяет заниматься самостоятельно. Для самопроверки можно использовать решебник к пособию. Занимаясь и сравнивая полученные результаты с ГДЗ регулярно, несложно успешно подготовиться и научиться быстро и точно решать задачи по химии, грамотно записывать результаты их решения.
Интересные и полезные практикумы по химии для девятиклассников
Сдавать химию на ОГЭ в качестве дисциплины по выбору предпочитает немало выпускников. Это связано, в частности, с тем, что в медицинских и агроколледжах этот предмет является одним из ведущих. А эти учебные заведения, в свою очередь, одни из наиболее востребованных у выпускников-девятиклассников. Организовать подготовительную работу можно самостоятельно. Важнейшим этапом самоподготовки является поиск качественных учебных материалов и решебников к ним. Решать эту задачу можно самостоятельно или с помощью школьного педагога-предметника, репетитора, руководителя подготовительных курсов и кружков.
Занимаясь по ГДЗ, девятиклассники должны быть ориентированы на принципы:
— регулярности процесса. Учитывая, что материал химии в девятом классе непростой, важно иметь достаточный запас времени и эффективно тратить его на подготовку. Оптимально начинать активно готовиться с самого первого учебного дня;
— системности, составления предварительного плана, учитывающего собственный начальный уровень подготовки, способности, возможности, задачи и цели;
— самоконтроля, проводимого через определенный период времени. Отслеживая динамику работы, результатов, девятиклассники смогут понять, что именно и как надо скорректировать, оперативно разрешить все возникающие вопросы и проблемы.
Отслеживая динамику работы, результатов, девятиклассники смогут понять, что именно и как надо скорректировать, оперативно разрешить все возникающие вопросы и проблемы.
В числе полезной, интересной и грамотной литературы-практикума эксперты называют задачник Кузнецовой Н. Е. и Левкина А. Н. по химии за 9 класс — он часто применяется как в работе репетиторов, так и самостоятельно выпускниками. Книга входит в УМК «Алгоритм успеха», считающийся одним из наиболее эффективных подготовительных комплексов, учитывающих требования формата итоговых испытаний. Сборник хорошо систематизирован и позволяет решать широкий спектр задач — по текущей подготовке и отработке заданий ОГЭ, разбору сложных тем теми, кто готовится к олимпиадам по химии и т. д.
Среди преимуществ этого практикума — разнообразие приведенных в нем заданий. Помимо типовых, выносимых на экзамен, здесь можно найти упражнения с элементами качественного анализа, а также творческие задания и задачи повышенного уровня сложности для девятиклассников, включая олимпиадные и конкурсные. Интересны и комбинированные — они помогают глубже понять науку, учат мыслить логически и грамотно.
Интересны и комбинированные — они помогают глубже понять науку, учат мыслить логически и грамотно.
Олимпиадные задачи по химии с решениями. 9 класс.
Задача 1.
“Азотносеребряная соль AgNO3, известная в практике под именем ляписа (lapis infernalis), получается растворением в азотной кислоте металлического серебра. Если для растворения взято нечистое серебро, то в растворе получается смесь азотномедной и азотносеребряной солей. Если такую смесь испарить досуха, а затем остаток осторожно сплавить до температуры начала каления, то вся азотномедная соль разлагается, а большинство азотносеребряной соли не изменяется. Обрабатывая сплавленную массу водой, извлекают эту последнюю…” (Д.И. Менделеев, “Основы химии”, т.2, стр.303–4, М.,Л., 1947)
Напишите уравнения реакций, происходящих при растворении “нечистого серебра” в конц. азотной кислоте и при прокаливании сухого остатка.
Определите содержание серебра (массовые доли в %), если для растворения было взято 2,000 г “нечистого серебра”, а масса остатка, полученного в результате прокаливания, составила 3,069 г.
Определите массу осадка, образующегося при добавлении избытка раствора хлорида натрия к раствору 2,000 г “нечистого серебра” в азотной кислоте.
Решение
а) Ag + 2HNO3 = AgNO3 + NO2 + h3O
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
б) 2Cu(NO3)2 = 2CuO + 4NO2 + O2
Масса серебра в исходном сплаве – х (г), тогда масса меди – (2–х) г.
Количество серебра составляет: n Ag = x/107,87 (моль) и равно количеству образующегося нитрата серебра.
Количество меди равно: n Cu = (2–x)/63,55 (моль) и равно количеству образующегося оксида меди.
Тогда масса нитрата серебра равна: 169,87x/107,87 = 1,575x (г).
Масса оксида меди составляет: 79,55(2–x)/63,55 = 2,504 – 1,252х (г).
Общая масса сухого остатка после прокаливания равна:
m(AgNO3) + m(CuO) = 1,575x + 2,504 –1,252x = 2,504 – 0,323x (г)
По условию масса остатка после прокаливания равна 3,069 (г), тогда:
2,504 – 0,323x = 3,069
0,323x = 0,565
x = 1,749 (г)
1,75: 2 ? 100 = 87, 5 (%)
Масса хлорида серебра равна: 1,749 ? 143,45 : 108 =2,323 (г).
Задача 2.
В соответствии с продуктами и, сохраняя коэффициенты, восстановите уравнения реакций:1) …. + …. + …. = 3h4PO4 + 5NO
2) …. + …. = 5KI + KIO3 + 3h3O
3) …. + ….. = 2N2 + K2SO4 + 4h3O
4) …..+ ….. + …. = 4h3 + Na2SiO3
5) …. + …. + …. = K2SO4 + 2MnSO4 + 2h3SO4
Решение
1) 5HNO3 + 3P + 2h3O = 3h4PO4 + 5NO
2) 3I2 + 6KOH = 5KI + KIO3 + 3h3O
3) 2 KNO2 + (Nh5)2SO4 = 2N2 + K2SO4 + 4h3O
4) Sih5 + 2NaOH + h3O = 4h3 + Na2SiO3
5) 2KMnO4 + 5SO2 + 2h3O = K2SO4 + 2MnSO4 + 2h3SO4
Задача 3.
На схеме приведены превращения соединения X:X + O2 ® … + h3O X + CO2 ® … + h3O
X + Na ® … + h3 X + h3S ® …
X + CuO ® N2 + … + …
Предложите X и запишите уравнения осуществленных превращений.
Решение
X = Nh4
4Nh4 + 3O2 = 2N2 + 6h3O или 4Nh4 + 5O2 = 4NO + 6h3O (на платиновом катализаторе)
2Nh4 + 2Na = 2NaNh3 + h3
2Nh4 + 3CuO = N2 + 3Cu + 3h3O
2Nh4 + h3S = (Nh5)2S или Nh4 + h3S = Nh5HS
2Nh4 + CO2 = (Nh3)2CO + h3O
Задача 4.
После проведения реакции в смеси двух газов (с исходной плотностью по воздуху 1,048) ее плотность по воздуху увеличилась до 1,310. При пропускании продуктов реакции через раствор гидроксида натрия их объем уменьшается вдвое, а плотность остатка по гелию составляет 8,000.
Определите качественный и количественный состав (в объемных %) исходной газовой смеси и состав смеси после реакции.
Напишите уравнения происходящих реакций.
Решение
Молярная масса остатка составляет 8 ? 4 = 32 (г/моль), что может соответствовать кислороду – O2. Поскольку этот газ составлял ровно половину от продуктов реакции, то для х = мол. масса второго газа имеем (х+32)/2=1,31? 29, откуда х = 1,31? 29? 2 – 32 = 43,98 (г/моль), что может соответствовать газам CO2, N2O, C3H8. Раствором щелочи может поглощаться CO2. Тогда в смеси после реакции могут быть CO2 и O2 – (избыток) (1:1).
Такая смесь может образоваться после взаимодействия CO и O2 (в избытке O2):
2CO + O2 = 2 CO2.
Тогда исходная газовая смесь – CO и O2 в соотношении 2:(1+2=3), или 40% CO и 60 % O2.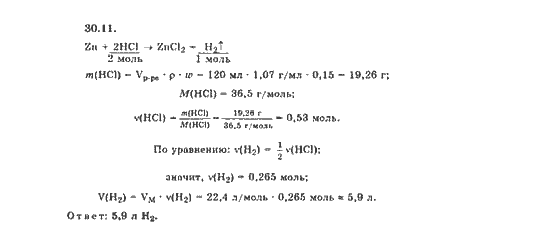 Состав смеси после реакции : CO2 (50%), O2 (50%).
Состав смеси после реакции : CO2 (50%), O2 (50%).
Реакция поглощения CO2: 2NaOH + CO2 = Na2CO3 + h3O.
Задача 5.
Смесь двух галогенидов калия общей массой 5,00 г растворили в воде. При добавлении к полученному раствору избытка раствора нитрата серебра было получено 8,58 г осадка. Определите, какие галогениды калия могли быть взяты в смеси, качественный состав и возможную окраску осадка.
Решение
Уравнение реакции образования осадка:
KX + AgNO3 = AgX? + KNO3, где X = Cl, Br, I.
Фторид калия осадка не дает, т.к. AgF хорошо растворим в воде (172 г на 100 г воды при 20о С).
Если осадок образован двумя галогенидами можно определить общее количество галогенидов в исходной смеси: n = (8,58 – 5) : (Ar(Ag) – Ar(K)) = 3,58 : (107,868 – 39,098) = 0,0521 (моль), что для индивидуальных галогенидов калия соответствует массе:
KCl – 3,816 (г)
KBr – 6,092 (г)
KI – 8,518 (г)
Т.о. в смеси могли находиться только пары KCl – KBr, KCl – KI (5 г смеси KBr – KI не могли бы дать такую массу осадков галогенидов серебра).
Если в смеси был фторид калия, то с ним в паре мог находиться только хлорид калия, т.к. бромид и иодид калия не могли бы дать такую массу осадка.
Тогда для возможных смесей:
Смесь
Осадок
Окраска
KCl – KBr
AgCl + AgBr
светло–желтая
KCl – KI
AgCl + AgI
Желтая
KF – KCl
AgCl
Белая
| Дата | Тема | Описание | Раздаточные материалы и приложения | 1) Введение 2) Powerpoint по безопасности в лаборатории (посмотрите это, если вы пропустили первый день) 3) Работа в Science Lab Scavenger Hunt (поиск мусора и определение лабораторного оборудования) 4) Онлайн-опрос студентов | Лабораторная безопасность Контракт на безопасность | Заполните онлайн-анкету для начинающих студентов. Прочтите старый договор о правилах безопасности в лаборатории — раздаточный материал и план помещения и подпишите его. Прочтите старый договор о правилах безопасности в лаборатории — раздаточный материал и план помещения и подпишите его. | ||
| 2 | Пересмотр класса 9 * классификация материи, физических и химических свойств и изменений; Диаграммы Бора-Резерфорда, таблица Менделеева | Диаграмма свойств материи Периодическая таблица Бора-Резерфорда — заполнено | Учебное пособие Страница 134 # 1abde, 2, 3, 4 | |||||
| 5 3 | Обзор 9-го класса (продолжение) 1) Атом (см. Ссылку за последний день) 2) Диаграммы Бора-Резерфорда 3) Ионы и как элементы образуют соединения 4) Если время, поработайте над развитием навыков лабораторных исследований.К этому раздаточному материалу будут обращаться в течение семестра, чтобы развить ваши навыки лабораторных исследований и помочь вам с финальным заданием. Пожалуйста, держите его под рукой. | | Учебное пособие Страница 146 # 5, 6, 7ab, 8abc | |||||
| 4 | Лаборатория по переработке бумаги 1) Обсуждение письменной лаборатории.  2) Выполните лабораторную работу. | Образец таблицы наблюдений Рецепт выходящего учителя | Перепишите процедуру в прошедшее время без личных местоимений, используя полные предложения. Карта наблюдений и вопросы из лабораторного раздаточного материала должны быть заполнены и отправлены на следующий день. | |||||
| 5 | 1) Групповая деятельность — определение тенденций в присвоении имен 2) Урок по присвоению имен ионным соединениям (см. Стр. 139-) 3) Практика присвоения имен ионным соединениям | Названия и формулы ионных соединений — Примечание заполняется, если вы отсутствовали на этом уроке. | Заполните лицевую сторону первой страницы пакета наименований химии по наименованию ионных соединений. | |||||
| | 6 | Обозначение многоатомных соединений Примечание 1) Выполните викторину и примите участие в 2) Урок по многоатомным ионам Копия для учителя по полиатомным соединениям Примечание для Smartboard | | Заполните обратную сторону рабочего листа. | ||||
| 7 | Примечание по молекулярным соединениям | Молекулярные соединения — слайд-шоу
ПАКЕТ НАЗВАНИЯ ХИМИИ — ОТВЕТЫ Построить молекулу — Фет | Заполните раздаточный материал, выданный в классе. | |||||
| | 8 | Ionic and Molecular Naming Review, 1) Рассмотрите и ответьте на любые дополнительные практические вопросы 2) Обзор конкурса 3) Практический тест по именованию соединений | Compound Naming Races 1, 2, 3 Студент провел мероприятие по присвоению имен Еще больше имен и формул — ключ ответа Найдите ошибки! — Ключ ответа | 1) Подготовьте таблицу наблюдений и прочтите ее завтра в лаборатории 2) Тест на следующий день по наименованию соединений | ||||
| 9 | 1) Викторина по наименованию соединений 2) Просмотрите, как сделать хорошую наблюдательную таблицу.  | Подготовьте таблицу наблюдений и прочтите результаты лаборатории на завтра. Учебное пособие Сохранение массы: прочтите страницу 159-164 Вопросы, страница 164 # 1, 2, 3 (4 бонуса) | ||||||
| 10 | 1) Лаборатория консервации массы 2 ) Делитесь данными и обсуждайте лабораторные вопросы Учитель Копия Сохранения Массовых Задач для Smartboard | | Ответьте на вопрос № 7 из раздаточного материала лаборатории (все остальные должны быть выполнены) Попробуйте вопрос № 1 из рабочего листа «Сохранение массы» (последняя страница этой ссылки) | |||||
| 11 | Химические уравнения балансировки | Уравнения балансировки — набор 2 ответов Уравнения баланса — набор 3 ответов Wow! Больше ответов о балансировке Вау! Больше практики балансировки! — Комплект 4 (с прикрепленными ответами) | Практика — если вы готовы
На следующий день нужно сделать не менее 6. На этом листе есть несколько хитрых. Если вы хотите продолжить, попробуйте практический лист На этом листе есть несколько хитрых. Если вы хотите продолжить, попробуйте практический лист | |||||
| День A День B День C | 12 | Типы химических реакций Дни а, б, в 1a) Практический лист со вчерашнего дня — возьмите около 2a) Типы реакций, активность и определения 3b) Типы реакций Демонстрации (должны выполняться в классе и уравновешиваться вместе) 4c) Реакции синтеза и разложения: раздаточный материал 5c) Реакции одинарного и двойного вытеснения: раздаточный материал 6c) Введение в задание по химии | День A День B Типы химических реакций: активность ОТВЕТЫ Типы реакций Сводное видео (5:33) День C Раздаточный материал по синтезу и разложению — ответы Одинарное и двойное вытеснение Раздаточный материал — ОТВЕТЫ Задание на исследование в области химии Задание на исследование в области химии Раздаточный материал | Учебное пособие Подключение: Читать стр.  200-201 и кратко изложите своими словами 200-201 и кратко изложите своими словами вопросов стр. 201 # 1-5 Прочитать стр. 202-203 (только чтение) Читать стр. 204-205 (только чтение) | ||||
| 2 октября 2019 | 13 | Кислоты и основания и pH 1) Практическая викторина по типам реакций 2) Кислоты и основания Примечание 3) Кислоты и основания Практика 4 ) Выберите темы для задания по химии (см. Ссылку Химические споры вверху этой веб-страницы) | Кислоты и основания Примечание — ответы Таблица названий кислот и оснований, стр. 1 — Ответы Таблица названий кислот и оснований, стр. 2 — ответы Задание на исследование в области химии Задание в химической промышленности — Текущая версия Химическая промышленность Промышленность — Лист ответов | Компьютерная лаборатория № ________ | ||||
| | 15 | аналогично рабочим листам типа реакции, но вы на самом деле проводите реакции)Образец таблицы наблюдений | Обзор теста- — Скоро тест. Проверьте календарь! — вы можете начать этот обзор1) Обзор Кубка Стэнли 2) Обзор химии Проверьте календарь! — вы можете начать этот обзор1) Обзор Кубка Стэнли 2) Обзор химии | |||||
| | 16 | Нейтрализация | Примечание по нейтрализации — ответы Рабочий лист по практике нейтрализации | | | Шкала pH 1) pH Примечание 2) Действие: Измерение pH кислот и оснований в бытовой химии | Примечание шкалы pH — Ответы | Лаборатория: pH Lab — Список материалов Одаренные — Разработайте процедуру для определения последовательность веществ в порядке от самого высокого до самого низкого pH. Gifted — Выясните, какое изменение цвета происходит для каждого из индикаторов, указывающих на кислоту или щелочь. |
| | 18 | ПЕРИОД ПРОВЕРКИ ХИМИЧЕСКИХ ИСПЫТАНИЙ | Сначала выполните работу, а затем проверьте! 1) Обзор чашки Стэнли Ключ ответа на обзор чашки Стэнли 2) Chemistry Review Ключ ответаChemistry Review 3) Практический тест по химии | Учебное пособие Соединения Химические уравнения и балансировка: стр.  174 № 1-12, 16 174 № 1-12, 16 Типы реакций: стр. 214 № 1-13, 15 Кислоты и основания: стр. 252 № 1-16 Смешанные задачи: стр. 258 # 1-12 | ||||
| 19 | ХИМИЧЕСКИЙ ТЕСТ Проект исследования химии Срок выполнения ___________ | Chemistry Kahoot! |
Думая о химических реакциях | Химические реакции
Обзор главы
1 неделя
Эта глава основывается на введении в химические уравнения, приведенном в главах 1 и 3 книги Gr.8 Материя и материалы.
На этом этапе учащиеся должны знать, что атомы перестраиваются во время химической реакции. Атомы не меняются; меняется только их расположение по отношению друг к другу.
учащихся познакомились с диаграммами частиц в Gr. 8, и этот навык будет дополнительно усилен в этой главе. Мы попытались познакомить учащихся с идеей, что химические реакции можно рассматривать по-разному. В конечном итоге они должны уметь писать химические уравнения, но это очень сложный навык. Начиная со словесных уравнений и переходя к субмикроскопическим представлениям (графические уравнения) перед переводом последнего в символический формат (химические уравнения), мы надеемся построить / поддержать изучение химических уравнений, а также развить способность учащихся представлять события на субмикроскопическая шкала.
В конечном итоге они должны уметь писать химические уравнения, но это очень сложный навык. Начиная со словесных уравнений и переходя к субмикроскопическим представлениям (графические уравнения) перед переводом последнего в символический формат (химические уравнения), мы надеемся построить / поддержать изучение химических уравнений, а также развить способность учащихся представлять события на субмикроскопическая шкала.
2.1 Размышление о химических уравнениях (0.5 часов)
Задачи | Навыки | Рекомендация |
Упражнение: Рисование воды | Рисунок | Дополнительно (рекомендуется) |
2. 2 Как мы представляем химические уравнения? (1 час)
2 Как мы представляем химические уравнения? (1 час)
Задачи | Навыки | Рекомендация |
Упражнение: Определение различных типов уравнений | Идентификация, сортировка и классификация, интерпретация | Дополнительно (рекомендуется) |
2.3 Сбалансированные уравнения (1,5 часа)
Задачи | Навыки | Рекомендация |
Действие: Когда реакция уравновешивается? | Устный перевод, написание формул, уравновешивание уравнений | Дополнительно (рекомендуется) |
Активность: Сжигание магния в кислороде | Устный перевод, написание формул, уравновешивание уравнений | CAPS рекомендуется |
Активность: Железо реагирует с кислородом | Устный перевод, написание формул, уравновешивание уравнений, сравнение | CAPS рекомендуется |
Активность: Медь реагирует с кислородом | Устный перевод, написание формул, уравнения баланса, сравнение, рисование | CAPS рекомендуется |
в гр. 8 Вещество и материалы мы узнали о химических реакциях впервые. Можете ли вы вспомнить основные идеи о химических реакциях? Вот они снова:
8 Вещество и материалы мы узнали о химических реакциях впервые. Можете ли вы вспомнить основные идеи о химических реакциях? Вот они снова:
В этой главе мы собираемся развить эти идеи. Мы сосредоточимся на двух вещах:
Это подготовит нас к следующим главам, в которых мы будем рассматривать различные типы химических реакций.
Однако, прежде чем мы перейдем к химическим реакциям, важно напомнить себе о различных способах, которыми мы до сих пор думали о химических соединениях.В следующем разделе будет показано, как все они сочетаются друг с другом.
Думая о химических реакциях
- облигация
- реагент
- товар
- химическая реакция
- макроскопический
- субмикроскопический
- символический
Ученые учатся думать о соединениях на трех разных уровнях:
- макроскопический
- микроскопический
- субмикроскопический
Как молодой ученый, вы уже познакомились с подобным мышлением.Эти три уровня можно также рассматривать как три разных способа представления соединений. Следующее упражнение поможет вам понять, что это значит.
ИНСТРУКЦИЯ:
Инструкция к этому занятию очень проста: нарисуйте изображение воды. Вы можете использовать место ниже для своего рисунка.
Не давать никаких дальнейших инструкций, но разрешить учащимся интерпретировать вопрос так, как они хотят.Попросите учащихся показать свои работы. Некоторые могут нарисовать пейзаж с водой (плотину или реку), а другие могут нарисовать стакан или подобный сосуд с прозрачной бесцветной жидкостью внутри. Возможно, один или два нарисуют молекулу воды или химическую формулу воды. Попросите учащихся перерисовать свои картинки на доске.
Ваш рисунок может выглядеть как на одной из схем, представленных ниже. Все они представляют воду. Но какой из них правильный?
Все они правильные!
Три диаграммы, представленные выше, представляют воду, но они сильно отличаются друг от друга.Мы говорим, что это три разных представления одного и того же, а именно воды.
На следующей диаграмме показано, как три представления сочетаются друг с другом.
Молекула воды в правом верхнем углу показывает, как будет выглядеть частица воды (i). Мы не можем видеть частицы воды нашими глазами, поэтому мы должны их вообразить. Вот почему молекула воды находится внутри мысленного пузыря. Мы называем это субмикроскопическим представлением .
Субмикроскопический означает «меньше микроскопического» или «слишком маленький, чтобы увидеть его в микроскоп». Иногда полезно думать, что это то, что мы бы увидели, если бы у нас были специальные «субмикроскопические очки», чтобы «видеть» на атомном уровне!
Стакан с водой показывает, как выглядит вода для наших глаз (ii). Мы называем это макроскопическим представлением , потому что оно наблюдаемо.Это означает, что его можно наблюдать, используя наши чувства, такие как зрение, осязание, слух, вкус или осязание.
В химической формуле слева используются химические символы для обозначения воды (iii). Мы узнали, что химические формулы состоят из символов элементов. Мы можем думать о химических символах и формулах как о химическом «языке», потому что они рассказывают историю. «История», рассказываемая формулой H 2 O, состоит в том, что молекула воды состоит из двух атомов H и одного атома O.Формула «H 2 O» является символическим представлением .
Опытные ученые могут легко перемещаться между этими тремя уровнями. Они могут мысленно переводить символический язык химических формул в субмикроскопические картинки. Это то, что мы будем практиковать в этой главе.
Прежде чем двигаться дальше, попробуйте другой пример, где вы рисуете 3 разных уровня углекислого газа в пространстве ниже. обозначьте каждый уровень.
Учащиеся могут нарисовать закрытый контейнер с чистым газом для макроскопического представления. Они должны написать формулу CO 2 для символического представления. Они должны нарисовать молекулу углекислого газа для субмикроскопического представления следующим образом:
Самый маленький в мире фильм, сделанный с использованием атомов и как его создали ученые
Как мы представляем химические реакции?
- химическое уравнение
- коэффициент
- нижний индекс
Как бы вы определили химическую реакцию? Запишите несколько своих идей.Следующие слова могут помочь вам сформулировать предложения.
реагенты, продукты, связи, перегруппированные, атомы, молекулы, новые соединения |
Попросите учащихся сначала сделать заметки и описать, что, по их мнению, представляет собой химическая реакция. Вы даже можете просто задать им вопрос и получить их определения.
Химическая реакция — это перегруппировка атомов, при которой одно или несколько соединений превращаются в новые соединения.
Все химические реакции могут быть представлены уравнениями и моделями. Некоторым людям химические уравнения могут показаться очень трудными для понимания. Поскольку атомы и молекулы не видны, их нужно вообразить, а это может быть довольно сложно! К счастью, у нас была некоторая подготовка, потому что мы рисовали молекулы со времен Gr. 7.
Каждый раз, когда атомы отделяются друг от друга и рекомбинируют в различные комбинации атомов, мы говорим, что произошла химическая реакция.Никакие атомы не теряются и не приобретаются, они просто меняются местами.
1. Словесные уравнения
В математических уравнениях мы используем знак равенства (=), например 2 + 2 = 4, но в уравнениях научной химии мы используем стрелку (→), например C + O 2 → CO 2 .
Когда мы представляем химическую реакцию словами, мы записываем словесное уравнение . Например, когда газообразный водород реагирует с газообразным кислородом с образованием воды, мы можем записать словесное уравнение реакции следующим образом:
водород + кислород → вода
Слева от стрелки у нас есть ситуация «до».Эта сторона представляет вещества, которые у нас есть до реакции. Их называют реагентами . Каковы реагенты этой реакции?
Реагенты: водород и кислород.
Справа от стрелки — ситуация «после». Эта сторона представляет собой вещества, которые у нас есть после того, как реакция произошла. Называются они изделиями . Что является продуктом этой реакции?
2.Уравнения изображения
Та же самая реакция водорода с кислородом может быть представлена на рисунках, называемых субмикроскопическими диаграммами. На диаграмме ниже показано, что атомы в двух молекулах водорода (H 2 ) и одной молекуле кислорода (O 2 ) слева перегруппировываются, образуя две молекулы воды (H 2 O) справа от стрелки. . Атомы водорода — белые кружки, а атомы кислорода — красные кружки.
Что это за представление: макроскопическое, субмикроскопическое или символическое?
Субмикроскопический, потому что показывает частицы.
Теперь мы собираемся преобразовать нашу субмикроскопическую картинку в символикон:
Что является продуктом указанной выше реакции? Каковы реагенты указанной выше реакции? Напишите их формулы.
Продукт — H 2 O. Реагенты — H 2 и O 2 .
3. Химические уравнения
Когда мы представляем химическую реакцию в терминах химических формул (символов), это называется химическим уравнением .Химическое уравнение вышеуказанной реакции будет следующим:
2 H 2 + O 2 → 2 H 2 O
Что это за представление: макроскопическое, субмикроскопическое или символическое?
Символьный, потому что в нем используются формулы (символы).
У нас все еще есть реагенты слева и продукты справа.
ИНСТРУКЦИЯ:
Заполните следующую таблицу, указав различные типы представленных уравнений, а именно словесные, графические или химические уравнения.
Уравнение | Тип уравнения |
углекислый газ + вода → глюкоза + кислород | |
Fe + O 2 → Fe 2 O 3 | |
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O |
Уравнение | Тип уравнения |
Уравнение изображения | |
углекислый газ + вода → глюкоза + кислород | Словесное уравнение |
Fe + O 2 → Fe 2 O 3 | Символьное / химическое уравнение |
Уравнение изображения | |
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O | Символьное / химическое уравнение |
ВОПРОСЫ:
Какой процесс представляет собой уравнение углекислый газ + вода → глюкоза + кислород?
Какой процесс представляет уравнение C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O?
Если вы посмотрите на уравнение реакции выше, вы заметите два вида чисел:
Коэффициенты и индексы означают разные вещи, как вы увидите в следующем разделе.
Коэффициенты и индексы в химических уравнениях
Почему в химическом уравнении воды перед формулой воды (H 2 O) стоит цифра 2? Это связано с тем, что в нашей реакции две молекулы H 2 O могут быть образованы из двух молекул H 2 и одной молекулы O 2 .
Цифры перед формулами в химическом уравнении называются коэффициентами .Они представляют собой количество отдельных молекул, находящихся в химической реакции.
Вы заметите, что O 2 не имеет коэффициента в приведенной выше реакции. Отсутствие коэффициента означает, что в реакции участвует всего одна молекула этого вещества.
В предыдущей главе мы узнали, как интерпретировать химические формулы. Когда мы читаем формулу, нижние индексы говорят нам, сколько атомов определенного элемента находится в одной молекуле этого соединения.
Сбалансированные уравнения
- сбалансированный
- химическая формула
- ржавчина
- потускнение
Теперь мы собираемся узнать, что означает, когда реакция сбалансирована . Вот снова наша субмикроскопическая картина.
Когда учащиеся рисуют двухатомную молекулу, два атома должны касаться , чтобы показать, что они химически связаны, иначе это неверно.
Подсчитайте, сколько атомов H находится в левой части реакции. Сколько справа?
Четыре атома H слева и четыре атома H справа.
Подсчитайте, сколько атомов O находится в левой части реакции. Сколько справа?
Два атома O слева и два атома O справа.
Вы заметили, что количество и типы атомов одинаковы слева и справа от реакции? Реагенты содержат четыре атома H и два атома O.Продукты содержат четыре атома H и два атома O.
Когда это верно для уравнения реакции, мы говорим, что уравнение сбалансировано .
ИНСТРУКЦИЯ:
- Изучите приведенное ниже уравнение. Черные атомы — это углерод (C), а красные — кислород (O). Они не всегда будут этого цвета — это просто представление.
- Ответьте на следующие вопросы.
ВОПРОСЫ:
Что это за представление: макроскопическое, субмикроскопическое или символическое?Субмикроскопический, потому что показывает частицы.
Напишите символическое представление (химическое уравнение) указанной выше реакции.Напишите формулы реагентов этой реакции.
Напишите формулу продукта реакции.
Подсчитайте, сколько атомов углерода находится в левой части реакции.Сколько справа?
Один атом C слева и один атом C справа.
Подсчитайте, сколько атомов O находится в левой части реакции. Сколько справа?Два атома O слева и два атома O справа.
Уравновешена ли реакция? Почему ты так говоришь?Да, реакция уравновешена, потому что равное количество атомов одного и того же типа находится по обе стороны уравнения реакции.
Теперь, когда мы знаем, как распознать сбалансированное уравнение, мы собираемся научиться балансировать его!
Что такое сбалансированное уравнение? Запишите собственное определение.
Либо попросите учащихся записать свои собственные определения и затем зачитать их классу, либо они могут просто предложить ответы. Вы можете научить учащихся начать с: Мы говорим, что уравнение сбалансировано, когда … Возможный ответ: «Мы говорим, что реакция сбалансирована, когда общее количество и типы атомов в реагентах равны таковым в продуктах».
Мы собираемся использовать несколько примеров реальных реакций, чтобы научиться балансировать уравнения.В следующих главах мы увидим, как эти реакции выглядят в реальной жизни, а пока мы просто сосредоточимся на том, как уравновесить уравнения.
Магниевые хлопья часто используются в некоторых фейерверках, таких как бенгальские огни, потому что, когда они горят, они создают яркие мерцающие искры.
Когда металлический магний горит в кислороде, мы можем написать следующее словесное уравнение для реакции, которая происходит между этими двумя элементами:
магний + кислород → оксид магния
Магниевые хлопья горят в кислороде в бенгальском огне.http://www.flickr.com/photos/derekskey/32193/ВОПРОСЫ:
Каковы реагенты реакции?Реагенты: магний и кислород.
Оксид магния.
Мы можем преобразовать слово уравнение в химическое уравнение:
Mg + O 2 → MgO
Что это за представление: макроскопическое, субмикроскопическое или символическое?Символьный, потому что в нем используются формулы (символы).
Уравнено ли уравнение? Если вы не уверены, посчитайте количество атомов каждого типа слева и справа. Возможно, это поможет взглянуть на субмикроскопическое изображение (диаграмму частиц) реакции:
Вы можете записать свои результаты в таблицу ниже:
Число атомов | Реагенты | Продукты |
мг | ||
O |
Число атомов | Реагенты | Продукты |
мг | 1 | 1 |
O | 2 | 1 |
Нет, уравнение не сбалансировано, потому что количество атомов в реагентах и продуктах неодинаково.
Итак, как мы можем сбалансировать уравнение, описывающее горение магния в кислороде? При уравновешивании реакций есть одно простое правило:
Вы можете добавлять только те соединения, которые уже присутствуют в уравнении.Это означает, что можно изменять только коэффициенты, но не индексы!
Попробуем несколько альтернативных решений. Помогло бы добавить атом О справа, вот так?
Теперь атомы O сбалансированы по обе стороны уравнения, но справа больше нет MgO. Мы изменили формулу справа на MgO 2 . Это означает, что мы изменили индекс в формуле. Вы не можете изменить формулу соединения при балансировке химических уравнений.
Спросите учащихся, почему это запрещено. MgO — это то же самое, что MgO 2 ? Напомните им предыдущий пример H 2 O и H 2 O 2 , которые были разными соединениями. MgO и MgO 2 не могут быть одним и тем же соединением, потому что у них разные химические формулы. Соотношение атомов Mg и O в двух соединениях разное. (Соединение MgO 2 даже не существует, но вам не нужно вдаваться в подробности.)
Добавление одиночных атомов к любой части уравнения также запрещено. Это означает, что следующее уравнение также неверно:
Помните, что мы можем использовать только химические формулы, которые уже есть в уравнении. Нам нужны два MgO справа, чтобы уравновесить два O в O 2 . Нам также нужны два Mg слева, чтобы уравновесить два MgO справа.
Можете ли вы построить это уравнение с помощью шариков из пластилина или бусинок? Когда вы конвертируете «реагенты» пластилина в «продукты», остаются ли после этого неиспользованные «атомы»?
Нет, нет.Предложите учащимся выполнить это задание и потренируйтесь составлять уравнение, используя сбалансированное количество атомов.
Теперь давайте сделаем еще один шаг. Мы собираемся преобразовать наше сбалансированное субмикроскопическое уравнение в символическое химическое уравнение. Напишите сбалансированное уравнение горения магния в кислороде с образованием оксида магния.
Запишите это на доске и еще раз объясните, как сбалансировано уравнение:
2 Mg + O 2 → 2 MgO
Вот несколько важных правил для уравновешивания химических уравнений:
- Когда мы уравновешиваем уравнения реакций, мы можем ТОЛЬКО добавлять коэффициенты к химическим формулам, которые уже есть в уравнении.
- Мы НЕ можем изменять химические формулы любых реагентов или продуктов, изменяя индексы в формуле.
- НЕЛЬЗЯ добавлять другие реагенты или продукты. Это включает добавление отдельных атомов любого из элементов, уже включенных в уравнение реакции.
- Мы НЕ можем удалять реагенты или продукты.
Теперь мы готовы попрактиковаться в балансировании других уравнений реакции.
Когда железо ржавеет, это происходит потому, что металлическое железо реагирует с кислородом воздуха с образованием оксида железа.
Старая машина с ржавчиной на капоте. http://www.flickr.com/photos/dok1/3513263469/ Фото ржавой бочки крупным планом. http://www.flickr.com/photos/jeua/7217824700/Слово уравнение выглядит следующим образом:
железо + кислород → оксид железа
Химическое уравнение выглядит следующим образом:
Fe + O 2 → Fe 2 O 3
Уравнено ли уравнение? Нарисуйте картинку под микроскопом, чтобы помочь вам определиться.
Схемаученика должна выглядеть так. Им может быть сложно преобразовать уравнения в диаграммы. Помогите им интерпретировать формулы следующим образом: Fe само по себе означает, что существует только один атом железа (Fe). O 2 означает, что должны быть два атома O, связанные, чтобы образовать молекулу. Fe 2 O 3 означает, что два атома Fe и три атома O сгруппированы вместе.
Цвета не важны, если все атомы одного и того же элемента имеют одинаковый цвет.Расположение атомов в «кластере» Fe 2 O 3 также не имеет значения. Поскольку Fe 2 O 3 является ионным соединением, мы обычно не будем говорить о «молекуле» Fe 2 O 3 . Как и все другие ионные соединения, он состоит из больших кластеров ионов Fe3 + и O 2 — в регулярной кристаллической упаковке, которая простирается в трех измерениях, во многом подобно ионной решетке NaCl на рисунке ниже (также показанном в главе 1).
Не рекомендуется упоминать здесь эту информацию, так как на данном этапе она скорее запутает учащихся, чем улучшит их понимание уравновешивающих уравнений.
Вы также можете использовать таблицу, подобную приведенной ниже:
Число атомов | Реагенты | Продукты |
Fe | ||
O |
Число атомов | Реагенты | Продукты |
Fe | 1 | 2 |
O | 2 | 3 |
Ваш вердикт: уравнение сбалансировано? Поясните свой ответ.
Нет, уравнение не сбалансировано, потому что количество атомов в реагентах и продуктах неодинаково.
Как уравновесить реакцию? Ниже приведены три возможности (планы A, B и C). Вы должны оценить каждый план и сказать, разрешен он или нет.
План А
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте один атом Fe на стороне реагента. | ||
Измените O 2 на O 3 на стороне реагента в уравнении. |
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте один атом Fe на стороне реагента. | Есть | Атом Fe уже является реагентом. |
Измените O 2 на O 3 на стороне реагента в уравнении. | Нет | Изменения формул не допускаются. |
Изменились ли какие-то коэффициенты? Помните, что это разрешено.
Изменились ли какие-либо формулы или были добавлены новые формулы? Помните, что это ЗАПРЕЩЕНО.
Как вы думаете: сработает ли этот план? Поясните свой ответ.
Нет, потому что формула была изменена.
План Б
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте один атом Fe на стороне реагента. | ||
Добавить один атом кислорода на стороне реагента. |
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте один атом Fe на стороне реагента. | Есть | Атом Fe уже является реагентом. |
Добавить один атом кислорода на стороне реагента. | Нет | Добавление одиночных атомов запрещено, если они уже не находятся в реакции КАК ОДИНОЧНЫЕ АТОМЫ. |
Изменились ли какие-то коэффициенты? Помните, что это разрешено.
Изменились ли какие-либо формулы или были добавлены новые формулы? Помните, что это ЗАПРЕЩЕНО.
Как вы думаете: сработает ли этот план? Объясните, почему да или почему нет.
Нет, потому что добавлять формулы нельзя.
План C
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте три атома Fe на стороне реагента. | ||
Добавить две молекулы O 2 на стороне реагента. | ||
Добавьте один Fe 2 O 3 на стороне продукта. |
Внесены изменения | Разрешено ли это изменение? Да нет? | Причина |
Добавьте три атома Fe на стороне реагента. | Есть | Атом Fe уже является реагентом. |
Добавить две молекулы O 2 на стороне реагента. | Есть | Молекула O 2 уже является реагентом. |
Добавьте один Fe 2 O 3 на стороне продукта. | Есть | Fe 2 O 3 уже является продуктом. |
Изменились ли какие-то коэффициенты? Помните, что это разрешено.
Изменились ли какие-либо формулы или были добавлены новые формулы? Помните, что это ЗАПРЕЩЕНО.
Как вы думаете: сработает ли этот план? Объясните, почему да или почему нет.
Да, потому что ни одно из правил балансировки уравнений не было нарушено.
Какой из трех планов (A, B или C) помог нам сбалансировать уравнение, используя только разрешенные ходы?Есть ли какие-то другие планы, которые вы могли бы придумать, чтобы сбалансировать это уравнение?
Следует поощрять учащихся к использованию других возможностей.Они должны прийти к выводу, что реакция, предложенная в Плане C, является единственно правильной.
В следующем упражнении мы сбалансируем уравнение, которое намного проще, но мы не собираемся включать все объяснения предыдущего упражнения.
Вы когда-нибудь замечали, как изделия из меди со временем тускнеют?
Одна из этих медных монет потускнела, поскольку покрылась черным веществом.http://www.flickr.com/photos/dno1967b/69965/
Этот темный слой потускнения является результатом медленной реакции между медью и кислородом с образованием оксида меди.
ВОПРОСЫ:
Напишите словесное уравнение для этой реакции. Все слова находятся в предложении выше, их просто нужно разместить в правильных местах.Учащиеся должны заполнить следующие ответы:
Преобразуйте словесное уравнение в химическое уравнение.Пока не нужно балансировать. Преобразуйте химическое уравнение в графическое уравнение. Это не обязательно должно быть сбалансировано.Рисунок ученика должен выглядеть следующим образом. Цвета не обязательно должны быть такими, как показано здесь, но они должны показывать разницу между различными элементами.Если у учащихся нет карандашей разного цвета, они также могут использовать разные шаблоны, чтобы различать разные атомы.
Теперь перерисуйте уравнение изображения, чтобы оно было сбалансированным. Помните, что нельзя добавлять «новые» соединения; нам разрешено рисовать только те молекулы, которые уже есть. преобразовать сбалансированное уравнение изображения в сбалансированное химическое уравнение.В следующих главах будет больше возможностей писать и уравновешивать химические уравнения.
ПЛАН УРОКА АТОМ — ПОЛНЫЙ УРОК НАУКИ С ИСПОЛЬЗОВАНИЕМ МЕТОДА ИНСТРУКЦИИ 5E
В конце этого плана урока по атомам студенты смогут описать структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов. , и электроны.Кроме того, учащиеся смогут определить, что протоны определяют идентичность элемента. Каждый урок разработан с использованием метода обучения 5E для обеспечения максимального понимания учащимися.
В следующем посте вы пройдете через все шаги и действия из плана урока по атомам.
ОБЯЗАТЕЛЬСТВО
Объективное введение
В начале урока класс выполняет «Подумай-попарно-поделись», чтобы обсудить цель.
Классная деятельность
Задайте вопрос классу (используйте PowerPoint, чтобы показать вопросы):
- Какая самая маленькая часть материи?
- Что такое атом?
- Какие три основные части атома?
- Где в атоме расположены эти части?
- Что означает наличие у атомной частицы электрического заряда?
Студенческая деятельность
Используя шаблон модели Бора, включая PowerPoint, и леденцы трех разных цветов, попросите учащихся создать модели этих атомов.Назначьте код для протонов, нейтронов и электронов:
- Водород
- Гелий
- Литий
- Бериллий
- Бор — (Дебил)
По мере работы с этими моделями атомов попросите учащихся начать замечать какие-либо закономерности. Также введите атомную массу. Студенты будут практиковаться во время лабораторной работы на станции, так что это нормально, если они не уверены после этого задания.
Учитель поможет развеять любые заблуждения об атомах.Основное заблуждение состоит в том, что студенты могут думать, что атомы двумерны, используя эту модель.
Расчетное время занятий для помолвки: 20-30 минут
РАЗВЕДКА
Эта лабораторная станция, ориентированная на студентов, создана для того, чтобы студенты могли начать изучение кислот и оснований. Четыре станции считаются входными станциями, где учащиеся изучают новую информацию о естественном отборе, а четыре станции являются выходными станциями, где учащиеся будут демонстрировать свое мастерство входных станций.Каждая из станций отличается, чтобы бросить вызов студентам, использующим разный стиль обучения. Вы можете узнать больше о том, как я организовал лаборатории станции здесь.
УЗНАЙТЕ ЭТО!
Студенты будут работать в парах над созданием моделей атомов с использованием шаблона Бора. Студенты должны будут следовать указаниям на карточках с заданиями и с помощью маленьких квадратов, которые представляют субатомные частицы (протоны, нейтроны и электроны), создают определенные атомы. Карты также проинформируют учащихся о зарядах каждой субатомной частицы.
ПОСМОТРИТЕ!
На этой станции студенты будут смотреть видео с описанием атомов. Затем студенты ответят на некоторые вопросы, относящиеся к видео, и запишут свои ответы на листах лабораторных станций. Например, что такое атом? Что находится в центре атома? Какие две субатомные частицы составляют центр атома? Какой заряд у протонов, нейтронов, и электронов ?
ИССЛЕДУЙТЕ ЭТО!
Исследовательская станция позволит студентам взаимодействовать с создателем виртуального атома с помощью веб-сайта PhET.Учащиеся будут следовать указаниям на карточках с заданиями для создания атомов на основе указанного числа протонов, нейтронов и электронов. Студентам нужно будет построить и идентифицировать атом. По мере того, как ученики строят случайный атом, они обнаруживают, какая субатомная частица определяет идентичность атома.
ПРОЧИТАЙТЕ!
Эта станция предоставит студентам одну страницу для чтения об атомной структуре. В ходе чтения учащиеся узнают, что атом является самой маленькой единицей материи.Они узнают об основной структуре атома. Студенты узнают о зарядах каждой из частей, протонов, нейтронов, электронов. Учащиеся ответят на 4 дополнительных вопроса, чтобы продемонстрировать понимание предмета при чтении.
ОЦЕНИТЬ!
На этапе оценивания учащиеся должны доказать свое мастерство в отношении концепций, которые они изучали в лаборатории. Вопросы составлены в стандартизированном формате с несколькими вариантами ответов. Студентам будет задано несколько вопросов: Определите правильное утверждение из 4 четырех вариантов, которые говорят об атомах.Какова роль электронов в атоме? Какие из следующих субатомных частиц определяют идентичность атома? Сколько электронов в литии?
НАПИШИТЕ!
Студенты, которые могут ответить на открытые вопросы о лаборатории, действительно понимают изучаемые концепции. На этой станции студенты будут отвечать на три карточки с заданиями, чтобы объяснить разницу между протонами, нейтронами и электронами. Опишите ядро атома. Какая субатомная частица определяет идентичность атома?
ИЛЛЮСТРИРУЙТЕ ЭТО!
Вашим ученикам-наставникам понравится эта станция.Студенты воссоздают атом кислорода на своем лабораторном листе. Затем ученики должны будут маркировать все, что связано с их моделью.
ОРГАНИЗУЙТЕ ЭТО!
Станция «Организуйте ит» позволяет вашим ученикам размещать карточки в нужном столбце и строке, которые описывают расположение, заряд и размер протонов, нейтронов и электронов.
Расчетное время занятий для исследования: 1-2 часа занятий по 45 минут
ПОЯСНЕНИЕ
Объясняющие задания станут намного более интересными для класса, когда они завершат лабораторию на исследовательской станции.Во время объяснения учитель проясняет любые неправильные представления об атомах с помощью интерактивной PowerPoint, якорных диаграмм и интерактивных занятий с записной книжкой.
Урок по атомам включает в себя PowerPoint с упражнениями, разбросанными повсюду, чтобы учащиеся были вовлечены.
Студенты также будут взаимодействовать со своими журналами, используя шаблоны INB для атомов. Каждое занятие INB призвано помочь студентам разделить информацию на части для лучшего понимания концепции.Шаблоны INB атомов позволяют студентам сосредоточить свои заметки на идентификации описаний и зарядов каждой субатомной частицы. Кроме того, шаблоны INB помогут учащимся понять информацию, представленную на химическом символе, и как определить атомную массу и количество протонов и электронов по символу, используя аббревиатуры APE-MAN.
Расчетное время занятий для исследования: 2-3 часа занятий по 45 минут
РАЗРАБОТКА
Раздел, посвященный описанию метода обучения 5E, предназначен для того, чтобы дать учащимся возможность выбрать, как они могут доказать свое владение концепцией.Когда ученикам предоставляется выбор, их «участие» намного больше, чем когда учитель говорит им о проекте, который им предстоит создать. Проект разработки позволит студентам создать презентацию об атомах.
Расчетное время занятий на проработку: 2–3 урока по 45 минут (также можно использовать в качестве домашнего проекта)
ОЦЕНКА
Последняя часть модели 5E — оценка понимания учащимися. В каждый урок 5E входит домашнее задание, оценка и модифицированная оценка.Исследования показали, что домашнее задание должно быть значимым и применимым к реальной деятельности, чтобы быть эффективным. Когда это возможно, мне нравится давать открытые оценки, чтобы по-настоящему оценить понимание учащимся.
Расчетное время в классе для оценки: 1, 45 минут урока
СКАЧАТЬ ПОЛНЫЙ УРОК СЕЙЧАС
Полный урок доступен для загрузки в моем магазине TpT. Сэкономьте кучу времени и возьмите его сейчас.
mdriscoll / SNC1P — 9 класс прикладных наук
Обоснование курса:
Этот курс позволяет студентам развить понимание основных понятий в биологии, химии, науках о Земле и космосе и физике, а также применять свои научные знания в повседневных ситуациях.Им также предоставляется возможность развивать практические навыки, связанные с научными исследованиями.
Краткое содержание курса: SNC1P Outline.pdf
Дополнительная справка:
См. Еженедельную доску в классе. Дополнительная помощь доступна в большинстве дней во время обеда.
Как пользоваться этим сайтом:
Для большинства уроков вы увидите два файла. Одна — это заметка PowerPoint / Smart Notebook, используемая в классе, другая — раздаточный материал для учащихся, который им раздают в классе.Им нужно будет заполнить пропуски в записке и завершить ежедневную работу над этими раздаточными материалами.
Если ученик отсутствует, ему нужно будет распечатать раздаточный материал для ученика и ИСПОЛЬЗОВАТЬ записку, чтобы помочь им заполнить записку и назначенную работу.
Кроме того, под каждым блоком размещены планы блоков, информация о проекте блока, информация об испытаниях и т. Д.
Критерии успеха и рубрики:
Косновным задачам будут прикреплены критерии успеха и рубрики.Это место будет использоваться для небольших заданий в классе:
Краткие письменные ответы: критерии успеха письменных ответов.pdf
Изучение навыков:
Этот веб-сайт свяжет вас со всеми видами учебных навыков: http://www.educationcorner.com/study-skills.html
Химический факультет: |
Большие идеи:
Элементы и соединения обладают определенными свойствами, которые определяют их использование.
Использование элементов и соединений оказывает как положительное, так и отрицательное воздействие на общество и окружающую среду.
План объекта: План объекта.pdf
Блок Проект:
Веб-сайт «Все о моем атоме»: http://www.chemicool.com/
Лист заданий «Все о моем Atom»: Урок 5 «Все о моем Atom» .pdf / 3D Model of My Atom Project Details.pdf
дней исследований: 23 и 26 сентября (в компьютерной лаборатории)
дней строительства: сентябрь.27 и 28 (потребуются материалы в классе 27 сентября)
Срок сдачи: 29 сентября (в конце урока, чтобы учащиеся могли использовать этот день для создания своих этикеток и завершения любого здания)
Таблица Менделеева: Таблица Менделеева.pdf
Раздаточные материалы:
Урок 1 Physical Properties Note.pdf / Урок 1 Physical Properties.pdf
Урок 2 Физические свойства и свойства lab.pdf / Урок 2 Физические свойства.pdf
Видеообзор(Химические и физические СВОЙСТВА https://www.youtube.com/watch?v=Z5L2NOMEWT0)
Урок 3a PhaseChanges Gizmo.docx.pdf (Период компьютерной лаборатории)
Видеообзор: https://www.youtube.com/watch?v=EwzkYTfHFbo
Урок 3 Physical and Chemical Changes Note.pdf / Урок 3 Physical and Chemical Changes.pdf
Видеообзор: https://www.youtube.com/watch?v=4ZGULLWEy1c
Урок 4 Лаборатория уникальных свойств и плотности.pdf / Урок 4 Уникальные свойства.pdf / Урок 4 Рабочий лист плотности.pdf
Видеообзор: https://www.youtube.com/watch?v=kE8I_M2pyg8&t=240s
Урок 5a Как работают фейерверки.pdf
Урок 5 Atoms & Elements.pdf / Урок 5 Atoms and Elements Student.pdf
Видеообзор: https://www.youtube.com/watch?v=cV4jJZCIMPo
Урок 6 Периодическая таблица.pdf / Урок 6 Примечание о таблице Менделеева.pdf
Видеообзор: https: // www.youtube.com/watch?v=Sk9R-VrcW0E
Видеообзор: https://www.youtube.com/watch?v=rsKDGXmguGI
Урок 7 Объединение атомов в соединения.pdf / Урок 7 Объединение атомов в соединения note.pdf
Video Reivew: Counting Atoms Video: https://www.youtube.com/watch?v=J8YLFXhxYFA
Урок 8 Изготовление моделей. Pdf
Урок 9 Compound Assignment.pdf / Урок 9 Investigating Compounds iPad Activity.pdf
Урок 10 Именование соединений.pdf / Урок 10 Примечания к именованию соединений. pdf
Видеообзор: видео о присвоении имен ионным соединениям: https://youtu.be/2VRz7t8bB1Q (СМОТРЕТЬ ТОЛЬКО ЧАСТЬ НАЗВАНИЯ !!!) Видеообзор
: Обозначение / формулы ковалентных соединений Видео: http://youtu.be/zGtwkLr4ayQ
Урок 11: Сокращение отходов от пластмасс Google Classroom Assignment
Код Google Класса: 1sd0gjw
Не забывайте, что вы должны войти в свою учетную запись pvncvc, чтобы получить доступ к Google Classroom, инструкции (Computer Login.pdf)
Обзор модульного теста:
Техника изучения — Создание заметок для изучения с использованием метода Корнелла: Cornell Notes.pdf
Multiple Choice / Matching Review: Test Review MC and Matching.pdf
Обзор короткого ответа: Краткий обзор теста.pdf
Answers: пакет проверки модульных тестов Answers.pdf
Вы получите таблицу Менделеева и все формулы, схемы именования.
Отделение биологии: |
Большие идеи:
Экосистемы состоят из множества компонентов, включая, во многих случаях, человека.
Устойчивость экосистем зависит от сбалансированного взаимодействия между их компонентами.
Деятельность человека может повлиять на устойчивость водных и наземных экосистем.
План объекта: План объекта, октябрь и ноябрь 2016 г.pdf
Unit Project: опубликовано в нашем Google Classroom
Всю информацию, необходимую для Unit Project, можно найти на нашей странице Google Classroom.Вот как вы входите в Google Classroom:
1. Google, Google Classroom (убедитесь, что вы используете Chrome в качестве браузера)
2. Войдите в систему, используя свою учетную запись PVNCVC (вы не можете использовать личную учетную запись Gmail!):
Имя пользователя: первые четыре буквы фамилии + первые четыре буквы (официального) имени: smitjohn (таким образом, имя пользователя: [email protected], это то же имя пользователя, которое вы используете для входа на школьные компьютеры)
Пароль: имя пользователя + день в месяц год рождения (без нулей перед днем или месяцем): smitjohn3112000 (день рождения 3 ноября 2000 г.) ИЛИ это пароль, который вы установили!
3.Введите свой идентификатор Google Classroom: 1sd0gjw (это ноль посередине)
Как только вы войдете в систему, вы должны увидеть задание, завершить задание, по завершении вы должны нажать «Сдать» на своей странице GoogleDoc, и тогда ваша работа будет отправлена мне в электронном виде.
Раздаточные материалы:
Введение в модуль (STSE и начало работы) .pdf
1 Life on Earth Note.pdf / 1 Раздаточный материал для студентов «Жизнь на Земле».pdf
Видеообзор: https://www.youtube.com/watch?v=VMxjzWHbyFM / https://www.youtube.com/watch?v=UXh_7wbnS3A
2 Знакомство с экосистемами note.pdf / 2 Раздаточный материал для студентов «Знакомство с экосистемами» .pdf
Видеообзор: https://www.youtube.com/watch?v=7Wfs2L5IydY
3 FoodChain Gizmo.pdf
4 Взаимодействия в экосистемах (примечание) .pdf / 4 Взаимодействия в экосистемах раздаточный материал для студентов.pdf
Видеообзор: https: // www.youtube.com/watch?v=MuKs9o1s8h8 / https://www.youtube.com/watch?v=Vtb3I8Vzlfg
5 В центре внимания математика.pdf
6 Биотические и абиотические воздействия на экосистемы. Pdf / 6 Биотические и абиотические воздействия на экосистемы (примечание для учащихся) .pdf
Видеообзор: https://www.youtube.com/watch?v=7Wfs2L5IydY
7 Biome Lesson.pdf (http://www.pbslearningmedia.org/resource/ess05.sci.ess.watcyc.biomemap / биомы /)
Видеообзор: https://www.youtube.com/watch?v=0fb8143ndo8&t=251s
8 Aquatic Ecosystems (Примечание) .pdf / 8 Aquatic Ecosystemss.pdf
Review for Mid-Unit Assessment.pdf
9 Invasive Species Webquest.docx
10 Biodiversity Under Attack.pdf / 10 Biodiversity Under Attack Student Handout.pdf
11 Загрязнение и кислотные осадки.pdf / 11 Раздаточный материал для студентов, посвященный загрязнению и кислотным осадкам.pdf
Видеообзор: https://www.youtube.com/watch?v=VILCk2CpUCw
12 Pests & Pesticides.pdf / 12 Pests & Pesticides Student Handout.pdf / 12 Какие пестициды используются в вашей пище — Scientific American.pdf
Видеообзор(биоаккумуляция и биоамплификация): https://www.youtube.com/watch?v=J9i6a_NRahg
Видеообзор: https://www.youtube.com/watch?v=1-fXYR9FTfM
Обзор модульного теста:
Методика обучения — Использование карточек
Обзор модульного теста.pdf
Отделение наук о Земле и космосе: |
Большие идеи:
Небесные объекты в солнечной системе и во Вселенной обладают особыми свойствами, которые можно исследовать и понимать.
Технологии, разработанные для освоения космоса, находят практическое применение на Земле.
План объекта: План объекта 2016.pdf
Unit Project: Space Unit Task — Handout.pdf
Раздаточные материалы:
Урок 1 «Роль небесных тел в традициях» и .pdf / Урок 1 «Роль небесных тел в традициях и верованиях» (примечание для учащихся) .pdf
Созвездие Сайтов:
http://www.dibonsmith.com/constel.htm
http: // www.windows2universe.org/mythology/const_nav.html
http://www.seasky.org/constellations/constellations-intro.html
Видеообзор: https://www.youtube.com/watch?v=6FB0rDsR_rc / https://www.youtube.com/watch?v=M41yLjQ2ot0
Урок 2 Technology & Space Observation.pdf / Урок 2 Technology & Space Observation (студент) .pdf
http://www.jpl.nasa.gov/
Видеообзор: https: // www.youtube.com/watch?v=gWy2-o9uwrc
Урок 3 Звезды и галактики.pdf / Урок 3 Звезды и галактики (Студент) .pdf
(вам необходимо войти в свою учетную запись Google Classroom, чтобы завершить сегодняшний веб-квест — см. Инструкции в разделе биологии)
Видеообзор: https://www.youtube.com/watch?v=ld75W1dz-h0
Урок 4 Наша звезда, Солнце.pdf / Урок 4 Наша звезда, Солнце (Студент) .pdf
Видеообзор: https: // www.youtube.com/watch?v=l64YwNl1wr0 / https://www.youtube.com/watch?v=6FB0rDsR_rc
Урок 5 Небесные тела, планеты и луны.pdf / Урок 5 Небесные тела, планеты и луны student.pdf
Видеообзор: https://www.youtube.com/watch?v=Dvhl891zGqU / https://www.youtube.com/watch?v=WoPtsnIcSv8
Урок 6 «Небесные события», студент.pdf
Видеообзор(Eclipses): https://www.youtube.com/watch?v=kgbK2FZFFdw
http://www.seasky.org/astronomy/astronomy-calendar-current.html
Урок 7 Небесные тела — другие части Вселенной.pdf
Видеообзор: https://www.youtube.com/watch?v=02wrLS-ue1Q / https://www.youtube.com/watch?v=7JU5Y_2Tr_E
Урок 8 Life on Earth.pdf / Урок 8 Life on Earth student.pdf
http: // science.nationalgeographic.com/science/space/planets/
http://www.kidzone.ws/planets/
http://www.enchantedlearning.com/subjects/astronomy/planets/
Урок 9 «Космические путешествия и ваше здоровье», студент.pdf / Урок 9, «Космические путешествия и ваше здоровье» .pdf
Видеообзор: https://www.youtube.com/watch?v=HSrVO5C9kwQ
Обзор теста:
Стратегия обзора: интеллектуальные карты (если вы упустили, как их делать в классе, ознакомьтесь с: https: // imindmap.ru / how-to-mind-map /)
Space Test Review (2016) .pdf / Unit Test Review Answers.pdf
Apollo 13 Информация: http://www.space.com/17250-apollo-13-facts.html (если вы пропустите фильм в классе, прочтите эту статью!)
Физический блок: |
Большие идеи:
Электроэнергия — это форма энергии, производимая из различных невозобновляемых и возобновляемых источников.
Производство и потребление электроэнергии имеет социальные, экономические и экологические последствия.
Статическое и текущее электричество имеют разные свойства, определяющие их использование.
План объекта: План объекта (январь 2017 г.) .pdf
Модульный проект: Нет модульного проекта в 2016-17 учебном году
Раздаточные материалы:
Урок 0 Начало работы.pdf
Урок 1 Статическое электричество — Зарядка трением.pdf / Урок 1 Статическое электричество — Зарядка трением.pdf
Видеообзор: https://www.youtube.com/watch?v=yc2-363MIQs / https://www.youtube.com/watch?v=nfGaMdKXMks
Урок 2 Статическое электричество — Зарядка контактом (PPT) .pdf / Урок 2 Статическое электричество — Зарядка контактом.pdf
Видеообзор: https://www.youtube.com/watch?v=dqwm36hj46Q
Видеообзор серииElectrostatic: https: // www.youtube.com/watch?v=BWbVobaN6DA
Урок 3 Проводники и изоляторы Примечание.pdf / Урок 3 Проводники и изоляторы.pdf
Видеообзор: https://www.youtube.com/watch?v=qUhxmXZwPmg
Урок 4 Простые схемы (студент) .pdf / Урок 4 Простые схемы.pdf
Видеообзор: https://www.youtube.com/watch?v=VnnpLaKsqGU
Урок 5 Параллельные и последовательные схемы.pdf / Урок 5 Последовательные и параллельные схемы.pdf
Видеообзор: https: // www.youtube.com/watch?v=O8GgRIIB1Yc
Урок 6 «Электрические устройства» .pdf / Урок 6 «Электрические устройства» .pdf
Видеообзор: https://www.youtube.com/watch?v=5mLjJUR2mro
Урок 7 Power Generation note.pdf / Урок 7 Power Generation.pdf
Видеообзор: https://www.youtube.com/user/opgvideos
Урок 8 Альтернативное производство электроэнергии.pdf / Урок 8 Альтернативное производство энергии.pdf
Видеообзор: Solar: https: // www.youtube.com/watch?v=EnYjlsGXugo
Ветер: https://www.youtube.com/watch?v=qSWm_nprfqE
Обзор теста: Практический тест на электричество SNC1P с ответами.pdf
Информация о CAT
Распространяется по классу. Должны быть проработаны в классе до 26 января 2016 г.
Срок сдачи в день экзамена (1 февраля 2017 г.)
Связаться с г-жойДрисколл по электронной почте с вопросами или приходите на дополнительные сеансы помощи (время и даты см. На доске).
Информация об экзаменеДата написания: ср. 1 февраля в комнате 241 (наш обычный класс)
IEP Студенты напишут в Ресурсной комнате, чтобы они могли получить необходимые им условия.
Контрольные вопросы — найдены на CAT
Дополнительные сеансы помощи на доске в классе
9–12 классы
Планы уроков естествознания для 9–12 классов
- Пляж Эрозия — учащийся сможет использовать материалы, доступные на Интернет для описания изменений береговой линии Америки за последнее столетие.
- Конфеты Освещение — это быстрый и простой эксперимент, который можно использовать для ознакомления с блок по химическим связям или свету. Студенты будут очарованы реакция, которая возникает, когда они жуют грушанку Спасатель в темноте.
- Класс Парк развлечений — ученик сможет создать аттракцион, который найдет в парке развлечений и объясните законы физики, которым он следует.
- Хаббл Телескоп — телескоп Хаббла предоставил нам много удивительных образы нашей Вселенной.Всегда ведутся споры среди ученых, политиков, и другие за деньги, потраченные на продолжение поисков Вселенной с такой дорогой телескоп. Это задание вовлекает ваших учеников в дебатирует и просит их выбрать сторону и защищать ее. Дебаты прошли хорошо может быть очень интересным, поэтому поощряйте своих учеников расслабляться и получать удовольствие от каждого чужие точки зрения.
- Водород Перекись и картофель — наблюдая за пеной перекиси водорода, когда она появляется в контакте с некоторыми материалами завораживает.Но всегда ли это так реагировать и почему? Этот урок позволяет студентам экспериментировать и выяснить.
- Кислый и Основной — Как узнать, что является основным, а что кислым.
- Животное Гибридизация — на этом уроке учащиеся изучат возможности гибридизации животных путем создания профилей возможных гибридов животных.
- Балансировка RedOx Reactions — Учитель будет использовать предыдущие знания ученика в предыдущий урок: степени окисления, перенос электронов, окисление и снижение.
- Bellwork Черты характера — учащиеся знакомятся с определением и применение черт характера на уроке химии.
- Биомы и круговорот воды — различите, как водораздел и круговорот воды определять уникальные биомы.
- Кровь Ввод текста — учащиеся смогут предсказать возможные группы крови потомство.
- Грудь Против бутылки — Сделайте учащихся более осведомленными при принятии решения в качестве стать родителями в будущем.
- Ячейка Раздел Часть 1 — TSWD понимание терминов и процесса участвует в клеточной репликации.
- Ячейка Organelle WebQuest — Цели урока биологии для девятого класса предназначены для учащихся, чтобы они могли понять клетки растений и животных и усвоить технологические навыки для выполнения поставленной задачи.
- Сотовая связь Дивизион — Студенты поймут важность митоза и мейоз как средство размножения живых организмов.
- Ячейка Division Unit — класс обсудит общепринятые явления диффузии. в своей жизни, (e.г., прилавок парфюмерии в ТЦ, выпечка хлеба в духовке).
- Изменение Материя — Студенты смогут различать физические и химические свойства вещества.
- Характеристики видов мидий — студенты смогут определить 5 видов различные мидии, по набору физических характеристик, поскольку они используют дихотомию ключ.
- Химики с характером — учащиеся будут ценить настойчивость, терпение, порядочность, права других, уверенность в себе, самодисциплина и мудрость, найденная в основателях химии.
- Совместная работа Урок Франкенштейна — Введение в анатомию основных органов человека и текущие события генетических мутаций, которые будут связаны с совместным Тема Франкенштейна.
- Сообщества, Биомы и экосистемы — ограничивающие факторы и пределы толерантности являются факторами, определяющими, где находятся наземные биомы и водные экосистемы. существовать.
- Дебаты с характером — студенты изучат два основных взгляда на причины глобального потепления (деятельность человека vs.солнечные изменения).
- Плотность Задачи — учащиеся смогут использовать треугольник плотности для решения для разных переменных.
- Разрушение от землетрясений — TLW различают различные разрушения вызванные землетрясениями.
- Диабет и как контролировать — По окончании урока у студентов будет четкое понимание сахарного диабета, связанных с ним осложнений и как правильно контролировать уровень глюкозы в крови с помощью глюкометра.
- Размерный Анализ — студенты смогут конвертировать измерения в пределах и между Метрической и английской системами измерения.
- ДНК и синтез белка — от транскрипции до трансляции.
- ДНК Репликация — студенты поймут важность репликации ДНК в создании новых клеток в организме.
- ДНК Структура — студенты будут знать основную структуру молекулы ДНК. и уметь применять их для построения модели.
- Экосистема — Обзор экосистемы и важных терминов и компонентов, включая пищевая цепь — пищевые сети. Энергетические пирамиды и взаимодействие экосистема между живым и неживым.
- Электрон Конфигурация — набор из трех правил может использоваться для определения электронное расположение 90% элементов.
- Элемент Проект — Учитель объяснит, что важная часть исследования науки — это исследования и технологии, которые сопутствуют всем отраслям науки.
- EMS Совершенно новый мир — введение в роли и обязанности EMS ЕМТ.
- Под угрозой исчезновения Виды и сельское хозяйство — Научить важности совместной работы окружающей среды и сельского хозяйства.
- Ферменты в действии — познакомьте студентов с концепцией фермента и субстрата. реакции при употреблении повседневной пищи.
- Оценка Изобилие: квадранты — учащиеся должны уметь использовать квадрант метод оценки численности в поле.
- Эволюционный Теория — Обсуждаются заблуждения относительно теории эволюции.
- Разведка нашей Вселенной — Этот урок знакомит студентов с основными свойствами и особенностями планеты в нашей солнечной системе, начиная с Меркурия и заканчивая внешними.
- Исследование Технология — Студенты должны понимать, что технологии позволяют им использовать свои навыки решения проблем, чтобы найти решения проблем.
- Факторы Это влияет на фотосинтез — чтобы знать, как пять факторов, интенсивность света, Концентрация CO2, потребление воды, температура и влажность влияют на скорость фотосинтеза.
- Цветы заниматься сексом — Репродуктивная анатомия цветов [и как Мендель спаривался цветы, чтобы получить морщинистый, гладкий, желтый и зеленый горошек.Таким образом, он открыл генетику.]
- ГАЗ ЗАКОНЫ — Чтобы учащийся понял, что при постоянном давлении объем данной массы газа прямо пропорционален его абсолютной температура.
- Как сладкая твоя жвачка? — Процентный состав и эмпирическая формула.
- Ураганы & Экосистема влияет — Студенты поймут, как человеческая деятельность может влиять на рост растений в экосистеме, тем самым влияя на пищевые цепи & пищевые сети.
- Введение к анализу родословной — Основные символы родословной и связь родословная к генетическим ситуациям, которые вызывают определенные черты.
- Кинематика — Студенты смогут определить, что такое расстояние и смещение. и определить, какая величина является вектором, а какая — скаляром.
- Лего — Написать инструкции для простых структур Лего, которые достаточно понятны чтобы позволить другим следовать и строить ту же структуру.
- Жилая и неживые существа — в конце урока учащиеся узнают что такое позвоночное, главное различие между позвоночными и беспозвоночными и важность позвоночника.
- Магниты & Магнитные поля — вовлеките всех учащихся в обсуждение свойств магнитов и магнитных полей.
- члена Солнечной системы — узнайте, как планеты классифицируются и характеристики каждой из планет солнечной системы.
- Метрическая система Преобразование системы — учащиеся смогут преобразовывать метрические единицы измерения. в метрической системе.
- Митоз — A Phase Cells Go Through — Чтобы узнать этапы деления клеток.
- Momentum и энергия — вовлекайте студентов в опыт, который бросает вызов предыдущим концепции существующих знаний.
- Нитроглицерин и Альфред Нобель — студенты также поймут области, составляющие Нобелевская премия.
- Ньютон Физика / Ускорение — Как определить ускорение движущегося объект, использующий скорость и время, а также силу и массу?
- Уход Исследования — опишите, почему исследования важны для медсестер. и обсудите, зачем нужна практика, основанная на доказательствах.
- Завод Структура и рост — Покройте каждую часть растения и объясните функция этого органа, в том числе; корни, стебли и листья.
- Процессы of Design / Engineering 1 — Студенты будут правильно использовать инструменты для рисования с повышением мастерства и точности.
- Профили На основе топографических данных — TLW понимает, что есть два разных виды пейзажа в картографии.
- Вопрос Отношения между ответами — учащимся, испытывающим трудности с читателем, нужно больше помощь с пониманием, чтобы помочь им стать успешными, независимыми читатели.
- Репродуктивный Системы — учащийся сможет понять репродуктивную функцию мужчин и женщин. системы и их функции.
- Рок цикл и биомы — учащиеся смогут описать рок-цикл и использовать его для определения типов камней.
- Научный Метод — Студенты смогут различать разные аспекты теста.
- Простой Эффективность машины — вывод будет включать три возможные причины для увеличения трения.
- студентов На орбите Солнечной системы — учащиеся разовьют понимание планеты и признательность за место Земли в солнечной системе.
- Физиология грудной клетки — Ознакомление с основными противопоказаниями по кузову в целом.
- Наука о материи — студенты поймут, что химию является предметом изучения из вещества, из которого состоит вселенная.
- Стадии митоза — Студенты должны сотрудничать друг с другом и работайте в группах по 3 человека, чтобы нарисовать стадии митоза.
- Транспортировка Ячеистые материалы — цель состоит в том, чтобы учащиеся узнали и узнали процесс передачи материалов в камеры и из них.
- Вирусный Модели — учащиеся узнают, как структура вируса делает это эффективный возбудитель инфекции.
- Vital Признаки — учащиеся поймут, почему измеряются показатели жизнедеятельности и процедуры для точного измерения температуры, пульса и дыхания.
- Что Этот? — Чтобы понять, о чем вы говорите в разговоре и о чем каждое слово представляет.
- Что Периодическая таблица? — Регулярно и эффективно используйте онлайн-информацию ресурсы для удовлетворения потребностей в сотрудничестве и исследованиях.
- Когда Объединение углеродов — этот урок представляет собой введение в органическую химию, сосредоточив внимание на использовании слова «органический» в контексте химии и улучшить предварительные знания учащихся о характеристиках сцепления углерода.
Далее 50 9–12 классы Планы уроков естествознания
Элемент, смесь, соединение — активность
(3 Рейтинги)Быстрый просмотр
Уровень оценки: 11 (10-12)
Требуемое время: 30 минут
Расходные материалы на группу: 2 доллара США.00
Размер группы: 4
Зависимость деятельности:
Тематические области: Химия
Резюме
Учащиеся лучше понимают различные типы материалов, такие как чистые вещества и смеси, и учатся различать гомогенные и гетерогенные смеси, обсуждая набор примеров материалов, с которыми они сталкиваются в своей повседневной жизни.Инженерное соединение
Материаловеды и инженеры-механики сосредотачиваются на понимании природы и свойств различных материалов, чтобы они могли повторять их и создавать более надежные продукты. Они используют преимущества различной прочности и способности различных материалов для создания композитов с существенно разными физическими или химическими свойствами. Понимание свойств данного материала, элемента, компонента или композита является важной частью процесса инженерного проектирования.
Цели обучения
После этого задания студенты должны уметь:
- Различайте и описывайте три типа материи: элементы, соединения, смеси.
- Определите чистые и нечистые материалы.
- Приведите несколько примеров элементов, смесей и соединений.
- Объясните различные свойства каждой группы материалов.
- Объясните, как инженеры-химики используют эти термины при решении задач, связанных с очисткой воды и перегонкой сырой нефти.
- Объясните, как инженеры-материаловеды и инженеры-механики используют эти термины при создании новых композитных материалов.
- Объясните, что такое металлические сплавы, и объясните значение металлических сплавов в материаловедении и материаловедении.
- Приведите некоторые применения неметаллических сплавов.
Образовательные стандарты
Каждый урок или задание TeachEngineering соотносится с одним или несколькими научными дисциплинами K-12, образовательные стандарты в области технологий, инженерии или математики (STEM).
Все 100000+ стандартов K-12 STEM, охватываемых TeachEngineering , собираются, обслуживаются и упаковываются сетью стандартов Achievement Standards Network (ASN) , проект D2L (www.achievementstandards.org).
В ASN стандарты иерархически структурированы: сначала по источникам; например , по штатам; внутри источника по типу; например , естественные науки или математика; внутри типа по подтипу, затем по классу, и т. д. .
Международная ассоциация преподавателей технологий и инженерии — Технология- Химические технологии предоставляют людям возможность изменять или модифицировать материалы и производить химические продукты.
(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом? Спасибо за ваш отзыв!
- Материалы имеют разное качество и могут быть классифицированы как натуральные, синтетические или смешанные.(Оценки
9 —
12) Подробнее
Посмотреть согласованную учебную программу
Вы согласны с таким раскладом? Спасибо за ваш отзыв!
Какое альтернативное выравнивание вы предлагаете для этого контента?
Список материалов
Поделиться со всем классом:
- 20 комплектов болтов, гаек и шайб
- 9 пластиковых тарелок
- лента и маркер для нумерации посуды
- четыре примера элементов:
- алюминий (один небольшой лист фольги)
- медь (небольшой кусок проволоки или трубки)
- утюг (стружка или магнит)
- уголь (в виде чистого угольного карандаша или графита)
- четыре примера соединений:
- вода или H 2 0 (~ 100 мл)
- поваренная соль или NaCl (~ 10 г)
- пищевая сода или NaHCO 3 (~ 10 г)
- яичная скорлупа или морская ракушка, или CaCO 3
- четыре примера смесей, как гомогенных, так и гетеогенных:
- надутый мешок Ziploc (на примере воздуха)
- бутылка кока-колы или другой газированной воды
- заправка для салата (например, уксус из масла и воды)
- соленая вода
- Таблица данных, по одной на учащегося
Рабочие листы и приложения
Посетите [www.teachengineering.org/activities/view/uoh_sep_mixtures_activity1] для печати или загрузки.Больше подобной программы
Разделительные смесиСтуденты узнают, как классифицировать материалы как смеси, элементы или соединения и определять свойства каждого типа. Также вводится концепция разделения смесей, поскольку почти каждый элемент или соединение в природе находится в нечистом состоянии, таком как смесь двух или более веществ, и…
Есть железо ?!Чтобы получить представление о смесях и концепции разделения смесей, учащиеся используют сильные магниты, чтобы найти элемент железа в хлопьях хлопьев для завтрака, обогащенных железом. Благодаря этой деятельности они видят, как железный компонент этой гетерогенной смеси (злака) сохраняет свои свойства и…
Интересный взгляд на науку о материалахСтуденты знакомятся с междисциплинарной областью материаловедения. С помощью демонстрации класса и презентации PowerPoint® они узнают основные классы материалов (металлы, керамика, полимеры, композиты) и их отличия друг от друга с учетом таких понятий, как напряжение, деформация, пластичность…
Введение / Мотивация
Мы все полностью окружены материей. Чтобы лучше понять этот вопрос — как он влияет на вас, как вы влияете на него и как этим можно манипулировать в наших интересах — нам необходимо получить базовое понимание типов и свойств материи. Разнообразие материи в мире и во Вселенной поражает.Если мы хотим понять это разнообразие, мы должны начать со способа организации и описания материи.
Вся материя состоит из элементов, которые являются основными веществами, которые не могут быть расщеплены химическими средствами. Элемент представляет собой вещество, которое не может быть далее восстановлено до более простых веществ обычными способами. По сути, элемент — это вещество, состоящее из одного типа атомов.
Соединение представляет собой чистое вещество, состоящее из двух или более различных атомов, химически связанных друг с другом.Это означает, что он не может быть разделен на составляющие механическими или физическими средствами, а может быть разрушен только химическим путем.
Смесь — это материал, содержащий два или более элементов или соединений, которые находятся в тесном контакте и смешиваются в любой пропорции. Например, воздух, морская вода, сырая нефть и т. Д. Составляющие смеси можно разделить физическими средствами, такими как фильтрация, испарение, сублимация и магнитная сепарация. Составляющие смеси сохраняют свой первоначальный набор свойств.Кроме того, смеси можно разделить на гомогенные и гетерогенные. Гомогенная смесь имеет одинаковый внешний вид и состав по всей своей массе. Например, сахар или соль, растворенные в воде, спирт в воде и т. Д. Гетерогенная смесь состоит из явно разных веществ или фаз. Три фазы или состояния вещества — это газ, жидкость и твердое тело. Неоднородная смесь не имеет однородного состава по своей массе.
Новые материалы являются одними из величайших достижений всех времен, и с самого начала истории они играли ключевую роль в росте, процветании, безопасности и качестве жизни людей.Новые материалы открывают двери новым технологиям, будь то гражданская, химическая, строительная, ядерная, авиационная, сельскохозяйственная, механическая, биомедицинская или электротехническая инженерия.
Изучение металлических сплавов, которые представляют собой смесь различных металлов, составляет важную часть материаловедения и материаловедения. Из всех металлических сплавов, используемых сегодня, сплавы железа (сталь, нержавеющая сталь, чугун, инструментальная сталь, легированные стали) составляют самую большую долю как по количеству, так и по коммерческой стоимости.Железо, легированное углеродом в различных пропорциях, дает стали с низким, средним и высоким содержанием углерода. Что касается сталей, твердость и предел прочности стали напрямую связаны с количеством присутствующего углерода, при этом повышение уровня углерода также приводит к снижению пластичности и вязкости. Добавление кремния и графитизация производят чугун. Добавление хрома, никеля и молибдена к углеродистой стали (более 10%) дает нам нержавеющую сталь.
Другими важными металлическими сплавами являются сплавы алюминия, титана, меди и магния.Медные сплавы известны давно (с бронзового века), тогда как сплавы трех других металлов были разработаны относительно недавно. Сплавы алюминия, титана и магния также известны и ценятся за их высокое отношение прочности к весу и, в случае магния, за их способность обеспечивать электромагнитное экранирование. Эти материалы идеальны для ситуаций, в которых высокое отношение прочности к весу более важно, чем общая стоимость, например, в аэрокосмической промышленности и некоторых областях автомобильной техники.
Помимо металлов, полимеры и керамика также являются важной частью материаловедения. Полимеры — это сырье (смолы), используемое для производства того, что мы обычно называем пластмассами. Пластмассы на самом деле являются конечным продуктом, созданным после того, как один или несколько полимеров или добавок были добавлены в смолу во время обработки, которой затем придают окончательную форму.
Еще одно промышленное применение — производство композитных материалов. Композиционные материалы — это структурированные материалы, состоящие из двух или более макроскопических фаз.Области применения варьируются от конструктивных элементов, таких как железобетон, до теплоизоляционных плиток, которые играют ключевую и неотъемлемую роль в системе тепловой защиты космического шаттла НАСА, которая защищает поверхность шаттла от тепла при повторном входе в атмосферу Земли. . Одним из примеров является армированный углерод-углерод (RCC). Светло-серый материал выдерживает температуру входа до 1510 ° C (2750 ° F) и защищает передние кромки крыла и носовую часть космического челнока. RCC — это ламинированный композитный материал, изготовленный из графитовой вискозной ткани и пропитанный фенольной смолой.
Другие примеры можно увидеть в «пластиковых» корпусах телевизоров, сотовых телефонов и других современных устройств. Эти пластиковые кожухи обычно представляют собой композитный материал.
Процедура
Перед деятельностью
Соберите материалы и сделайте копии таблицы данных, по одной на каждого учащегося.
Приготовьте девять пластиковых тарелок для болтов, гаек и шайб, как описано ниже. Поместите их на стол (называемый Таблицей А). Обозначьте номера блюд как-нибудь, например, скотчем или маркером.
- Блюдо 1: 4 шайбы
- Тарелка 2: 4 болта
- Блюдо 3: 4 ореха
- Тарелка 4: соедините 1 гайку с 1 болтом (4 комплекта)
- Тарелка 5: соедините 2 гайки с 1 болтом (4 комплекта)
- Тарелка 6: соедините 1 гайку и 1 шайбу с 1 болтом (4 комплекта)
- Блюдо 7: шайба 1, 1 гайка, 1 состав, как в тарелке 5, и 1 состав, как в тарелке 6
- Тарелка 8: 2 шайбы, 1 гайка и 2 болта
- Состав блюда 9: 1, как в чашке 4, и состав 2, как в чашке 5.
Поместите примеры элементов, соединений и смесей в другую таблицу (называемую таблицей B) и пометьте их. Вы также можете маркировать соединения их конкретной химической формулой (например, поваренная соль будет NaCl).
Со студентами
- Разделите класс на группы по четыре ученика в каждой. Раздайте пустые таблицы данных.
- Обратите внимание каждого учащегося на Таблицу A. Наборы шайб, болтов и гаек можно использовать для передачи концепции элементов, смесей и соединений.Объясните учащимся: если они воспринимают каждую шайбу, болт и гайку как отдельный атом, тогда содержимое тарелок 1, 2 и 3 является элементами, потому что все они являются одним и тем же атомом и не могут быть далее сведены к более простым веществам. Содержимое тарелок 4, 5 и 6 является составным, потому что они показывают одно вещество, состоящее из двух или более разных атомов, химически связанных друг с другом, а содержимое тарелок 7, 8 и 9 является смесями, потому что они представляют собой материалы, содержащие два или более элементов или соединений и смешиваются в любых пропорциях.
- После обсуждения таблицы A предложите каждой группе пройтись по таблице B, сравнить и сопоставить различные элементы в таблице и составить список своих обсуждений. Попросите их классифицировать материалы в каждой посуде как элемент, гомогенную смесь, гетерогенную смесь или соединение, записав это в свои таблицы данных. Попросите учащихся обсудить свои списки. (Ожидается, что некоторые классифицируют материалы как элементы, смеси и соединения.)
- На этом этапе объясните различные типы вопросов, используя классную доску по мере необходимости.Затем снова обсудите все материалы в Таблице B и разделите их на классы элементов, смесей (гомогенных и гетерогенных) и соединений.
Словарь / Определения
соединение: чистое химическое вещество, состоящее из двух или более различных химических элементов.
элемент: вещество, состоящее из одного типа атома.
гетерогенная смесь: смесь, состоящая из явно различных веществ или фаз.
однородная смесь: смесь, имеющая одинаковый однородный внешний вид и состав по всей своей массе.
смесь: вещество, состоящее из двух или более материалов, которые химически не соединены.
раствор: однородная смесь, состоящая из двух или более веществ.
Оценка
Вопросы : Задайте студентам исследовательские вопросы в ходе заключительного обсуждения в классе.Ответы учащихся и их вклад в обсуждение раскрывают их понимание концепций деятельности. Как вариант, попросите учащихся индивидуально ответить на вопросы в форме заключительного письменного теста.
Вопросы для расследования
- Опишите три типа материи: элементы, соединения и смеси.
- Определите чистые и нечистые материалы.
- Приведите несколько примеров элементов, смесей и соединений.
- Объясните различные свойства каждой группы материалов.
- Объясните, как инженеры-химики используют эти термины при решении задач, связанных с очисткой воды и перегонкой сырой нефти.
- Объясните, как инженеры-материаловеды и инженеры-механики используют эти термины при создании новых композитных материалов.
- Объясните, что такое металлические сплавы, и объясните значение металлических сплавов в материаловедении и материаловедении.
- Приведите некоторые применения неметаллических сплавов.
авторское право
© 2013 Регенты Университета Колорадо; оригинал © 2010 Хьюстонский университетАвторы
Парния Мохаммади; Роберто ДималиватПрограмма поддержки
Национальный научный фонд GK-12 и программы исследований для учителей (RET), Университет ХьюстонаБлагодарности
Это содержимое цифровой библиотеки было разработано Инженерным колледжем Хьюстонского университета в рамках гранта Национального научного фонда GK-12 номер DGE 0840889.Однако это содержание не обязательно отражает политику NSF, и вы не должны рассчитывать на одобрение со стороны федерального правительства.
Последнее изменение: 20 июля 2021 г.
BJU Press 9 класс Наука
Новинка! Физические науки, 6-е издание
BJU Press ‘ Набор предметов по физическим наукам.6-е изд. разделен на четыре блока — два по химии и два по физике. Единицы химии перемещают студента от материи и того, из чего она состоит, к тому, как материя взаимодействует в химических реакциях, ядерных изменениях, растворах, кислотах и основаниях. На уроках физики учащиеся узнают о том, как движутся материя и энергия и почему они движутся; они изучают различные формы энергии и то, как энергия движется по всему миру. Все это стремление понять мир, созданный Богом. Четкие, научно точные изображения помогают им представить себе структуры, которые они изучают.Тематические исследования, исследования мировоззрения, мини-лаборатории, этические ящики и вопросы помогают студентам мыслить как ученые и рассматривать физику с библейской точки зрения. 9 класс.
BJU Press ‘ Рабочий текст для студентов-физиков, 6-е изд. разделен на четыре блока — два по химии и два по физике. Единицы химии перемещают студента от материи и того, из чего она состоит, к тому, как материя взаимодействует в химических реакциях, ядерных изменениях, растворах, кислотах и основаниях.На уроках физики учащиеся узнают о том, как движутся материя и энергия и почему они движутся; они изучают различные формы энергии и то, как энергия движется по всему миру. Все это стремление понять мир, созданный Богом. Четкие, научно точные изображения помогают им представить себе структуры, которые они изучают. Тематические исследования, исследования мировоззрения, мини-лаборатории, этические ящики и вопросы помогают студентам мыслить как ученые и рассматривать физику с библейской точки зрения. 584 страницы, мягкая обложка.9 класс.
BJU Press ‘ Physical Science Teacher Edition 6-е изд. 2 тт. представляет стратегии обучения, основанные на исследованиях, включая активное обучение, исследовательскую деятельность, групповые обсуждения и формирующие оценки, которые соответствуют образовательным целям. Стратегии сосредоточены на объяснении концепций учащимся, переходя от конкретного к абстрактному и связывая научные концепции и процессы с предшествующим обучением.Стратегии рассматривают как аффективную, так и когнитивную сферу. В версии для учителей есть учебное руководство по каждому разделу, элементы с кодировкой значков, такие как веб-ссылки и демонстрации, полные ответы на контрольные вопросы и справочная информация для улучшения обучения в классе. Версия для учителя также включает в себя обзор плана уроков на весь год. 760 страниц в спиральном переплете. 9 класс.
BJU Press ‘ Учебное пособие для студентов физических наук, 6-е изд. дает студентам возможность исследовать мир Бога с помощью различных лабораторных занятий. Лабораторное руководство помогает студентам укрепить свое понимание, связывая содержание с проблемами реального мира. Студенты развивают критические научные, инженерные навыки и навыки решения проблем путем наблюдения, записи и анализа образцов и данных для создания моделей. Затем они тестируют эти модели, чтобы понять их работоспособность. Студенты будут иметь возможность пройти как лабораторные работы STEM, так и лабораторные исследования на основе запросов. 280 страниц в мягком переплете.9 класс.
BJU Press ‘ Physical Science Teacher Edition 6-е изд. 2 тт. представляет стратегии обучения, основанные на исследованиях, включая активное обучение, исследовательскую деятельность, групповые обсуждения и формирующие оценки, которые соответствуют образовательным целям. Стратегии сосредоточены на объяснении концепций учащимся, переходя от конкретного к абстрактному и связывая научные концепции и процессы с предшествующим обучением.Стратегии рассматривают как аффективную, так и когнитивную сферу. В версии для учителей есть учебное руководство по каждому разделу, элементы с кодировкой значков, такие как веб-ссылки и демонстрации, полные ответы на контрольные вопросы и справочная информация для улучшения обучения в классе. Версия для учителя также включает в себя обзор плана уроков на весь год. 760 страниц в спиральном переплете. 9 класс.
Этот набор тестов предназначен для использования для оценки студентов, использующих учебную программу BJU Press «Physical Science Assessments, 6-е издание».Клеевой переплет для легкого удаления.
Ключ с ответами к этой оценке прилагается к 6-му изданию «Physical Science, Assessments», которое продается отдельно от BJU Press. Полностраничные тесты для учащихся воспроизводятся с наложением правильных ответов.

 Примеры углеводорода и кислородсодержащих органических соединений
Примеры углеводорода и кислородсодержащих органических соединений