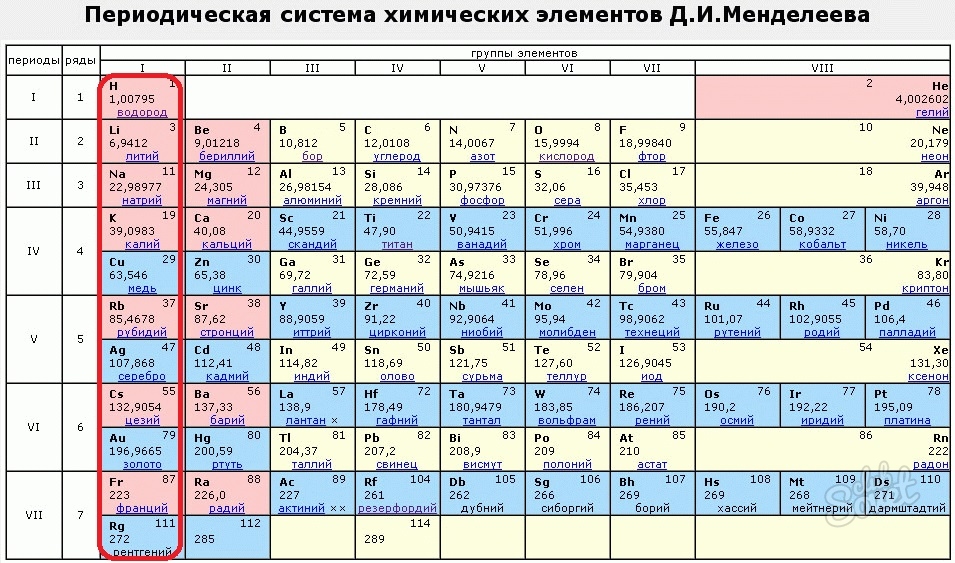
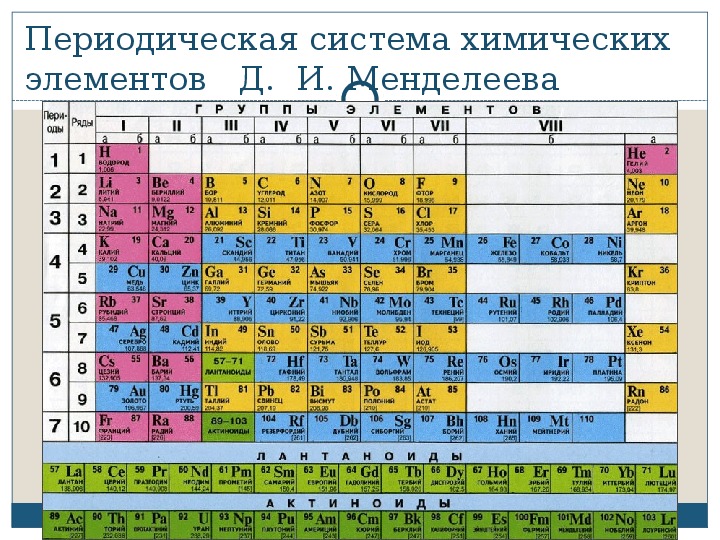
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов.
Паспорт урока химии в 8 классе
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов.Учитель
Костюкова О.А
Образовательная цель
Развитие теоретического мышления восьмиклассников на основе осмысления Периодической системы химических элементов
Д.И. Менделеева
Планируемые образовательные результаты
По окончании изучения темы ученик:
МР — самостоятельно формулирует тему урока;
МР — устанавливает причинно-следственные связи;
МР — планирует познавательную деятельность;
МР — сопоставляет ответы с эталоном ответов;
ЛР — высказывает свое собственное мнение;
ЛР – оценивает результат своей деятельности;
ПР — применяют полученные знания на практике;
Программные требования к образовательным результатам раздела «Периодическая система химических элементов Д.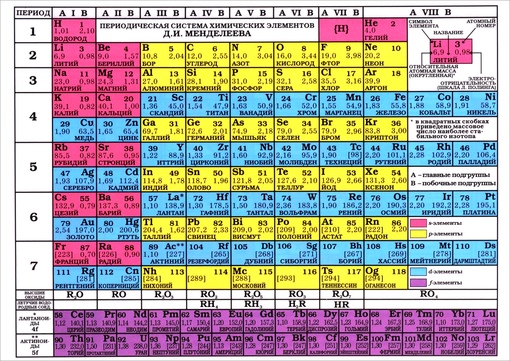 И. Менделеева. Знаки химических элементов».
И. Менделеева. Знаки химических элементов».
Ученик научиться:
называть: принцип построения таблицы; расположение химического элемента в периодах и группах;
определять: малые и большие периоды, главную и побочную подгруппы;
объяснять: закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп.
Ученик получит возможность научиться:
использовать приобретенные знания и умения в практической деятельности: располагать элементы в порядке возрастания или уменьшения металлических или неметаллических свойств;
сравнивать химические элементы на основе положения элемента в периодической системе.
Программное содержание
Основная классификация химических элементов Д.И. Менделеева. Периодическая система как естественно — научная классификация химических элементов.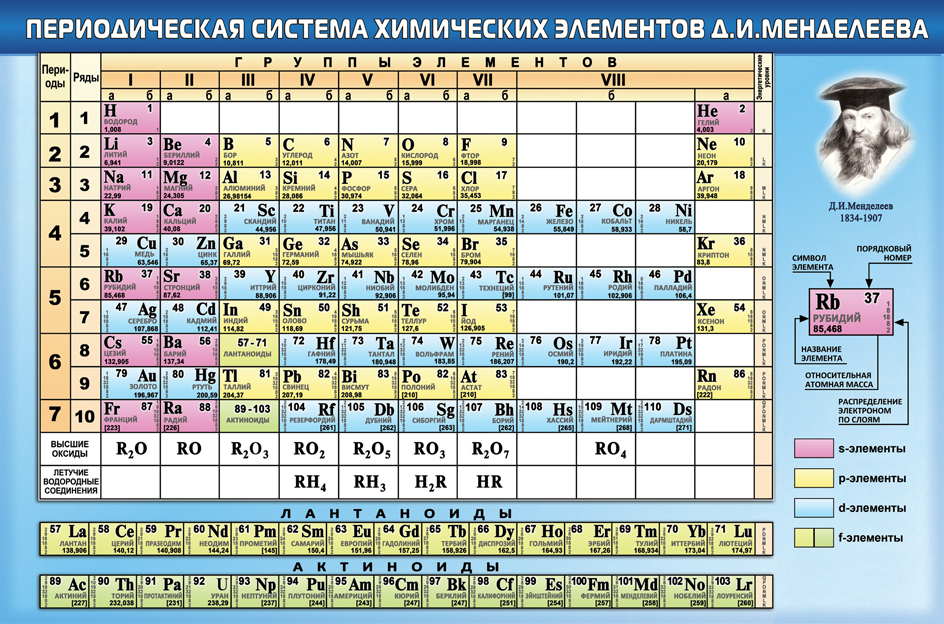 Табличная форма представления классификации химических элементов. Структура таблицы «Периодическая система химических элементов Д.И. Менделеева» (короткая форма): А- и Б –группы, периоды.
Табличная форма представления классификации химических элементов. Структура таблицы «Периодическая система химических элементов Д.И. Менделеева» (короткая форма): А- и Б –группы, периоды.
Мировоззренческая идея
Гениальное и простое – результат долгого и упорного труда.
Ценностно-смысловые ориентиры
Чувство гордости за российскую химическую науку.
План изучения учебного материала
1.Подтверждения периодического закона.
2.Периодическая таблица.
3.Самостоятельная работа.
Основные понятия
Тип урока
урок изучения нового материала
Форма урока
обсуждение с доказательствами
Образовательная технология
развивающего обучения
Оснащение урока
учебник:О.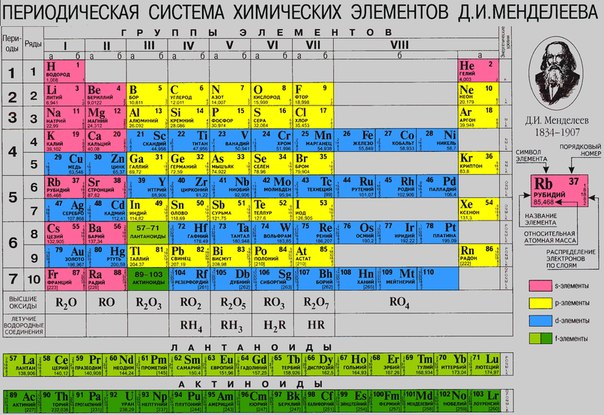 С. Габриелян Химия 8 кл., 2013г., рабочая тетрадь к учебнику О.С. Габриелян Химия 8 кл.,2017.
С. Габриелян Химия 8 кл., 2013г., рабочая тетрадь к учебнику О.С. Габриелян Химия 8 кл.,2017.
видиофильм: tps://www.youtube.com/watch?v=1M7iKKVnPJE Гениальность таблицы Менделеева [TED-ED], презентация,
мультипроектор, мультимедийная доска, листы с заданием
Технологическая карта хода урока
Вводная беседа:-Чей портрет изображен на слайде?
-Чем знаменит этот человек?
Задание: прочитайте эпиграф к уроку
“Будущее не грозит периодическому закону разрушением, а только надстройки и развитие обещает”. (Д.И. Менделеев)
— Какова тема нашего урока?
— Какова главная задача урока?
фронтально
отвечают на вопросы
— запись темы в тетрадь
— письменно в тетрадях
устанавливают причинно — следственные связи(МР)
высказывают собственное суждение (ЛР)
самостоятельно формулируют тему урока, определяют главную задачу (МР)
III.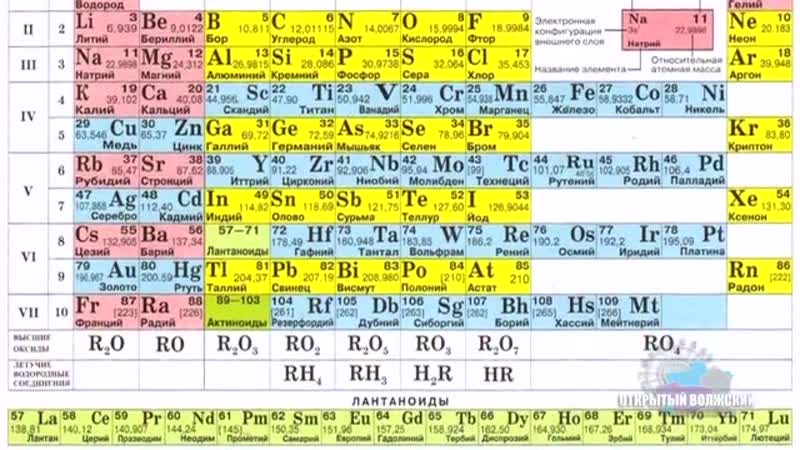 Актуализации новых знаний (15мин.)
Актуализации новых знаний (15мин.)
Интересные факты о Д.И. Менделееве
Видеофильм о гениальности таблицы Д.И. Мендилеева
Обсуждение
Вывод: На основе периодического закона можно предсказать свойства элементов и открывать новые.
Периодическая таблица. Беседа:
— Как сформулировал закон Д.И. Менделеев?
— Как выглядит закон в графическом изображении?
— Каков принцип построения системы элементов?
3.1.Знакомство со строением таблицы.
— формы таблицы Д.И. Менделеева
— строение таблицы: периоды и изменения;
группы и изменения.
устная фронтальная работа
фронтальная
работа и индивидуальная.
индивидуальный лист
устная фронтальная работа
по периодической системе
высказывают собственное мнение о личности ученого.
обсуждение сюжета, высказывают собственное мнение, дают оценку периодическому закону, самостоятельно делают вывод(МР, ЛР)
высказывание суждений (ЛР),
сопоставляют свои ответы с эталоном (МР)
применяют знания на практике: находят по таблице элементы, расположенные в разных периодах и группах (ПР)
IV. ПРИМЕНЕНИЕ НОВЫХ ЗНАНИЙ (5-7 мин.)
3.Самостоятельная работа по вариантам.
индивидуальная работа по таблице с использованием схемы
планируют свою познавательную деятельность (МР)
V. ПОДВЕДЕНИЕ ИТОГОВ УРОКА (3 мин.)
Ситуация рефлексии.
-Удалось ли нам выполнить задачу урока?
— Что у нас хорошо получилось?
— Над чем еще предстоит поработать?
Ситуация самооценки – содержательная самооценка.
-Чему научились на уроке?
— Оцените результат своей работы на уроке?
коллективная дискуссия
индивидуальная
высказывают собственное мнение, обосновывают свою позицию (ЛР)
Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов
И. Менделеева. Знаки химических элементов
Часть 1
1. По горизонтали таблица Д.И. Менделеева делится на периоды, которые подразделяются на
а) малые, это периоды — 1, 2, 3
б) большие, это периоды — 4, 5, 6, 7
2. По вертикали таблица Д.И. Менделеева делится на группы, каждая из которых подразделяется на:
а) главную, или А группу
б) побочную, или В группу
3. Допишите
IA группа — это группа щелочных металлов
IIA группа — это группа щелчноземельных металлов
VIIA группа — это группа галогенов
VIIIA группа — это группа благородных или инертных газов
4. Аналогии языка химии с русским языком.
Русский язык Химический язык Буквы Химические знаки (символы) Слова Названия веществ Предложения Уравнения химических реакций
5. Дополните таблицу «Названия и знаки элементов».
Дополните таблицу «Названия и знаки элементов».
6. Примеры названий химических элементов (в скобках укажите химический знак) в соответствии с этимологическими источниками.
1) Свойства простых веществ
Водород (H), Кислород (O), Фтор (F)
2) Астрономия
Селен (Se), Теллур (Te), Уран (U)
3) География
Германий (Ge), Галлий (Ga), Полоний (Po)
4) Древнегреческие мифы
Тантар (Ta), Прометий (Pm), Лютеций (Lu)
5) Великие ученые
Кюрий (Cm), Менделевий (Md), Резерфордий (Rt)
Часть 2
1. Установите соответствие между положением химического элемента в Периодической системе Д.И. Менделеева и химическим знаком.
Ответ: А-5, Б-1, В-2, Г-4
2. Выберите символы или названия химических элементов одного большого периода.
3. Впишите в соответствующие столбцы названия следующих химических элементов: Cl, He, Br, Ne, Li, I, K, Ba, Ca, Na, Xe, Sr.
Щелочные металлы Щелочноземельный металлы Галогены Благородные газы Литий Барий Хлор Гелий Калий Кальций Бром Неон Натрий Стронций Йод Ксенон
4. Заполните пропуски в логической схеме.
Химический элемент (H, O) — химическая реакция (H2O) — химическое получение (2H2O = 2H2 + O2)
5. Сделайте обощение:
Химические элементы — углерод, кремний, олово, свинец — относятся к IVA группе.
6. В левую колонку таблицы запишите, по какому признаку химические элементы разделены на две группы.
Металлы Цинк, медь, натрий, золото, серебро, железо Неметаллы Хлор, фтор, водород, кремний, углерод, азот
7. Установите соответствие между произношением и химическим знаком (символом).
Ответ: А-4, Б-6, В-2, Г-7, Д-5, Е-1
8. Вычеркните лишнее:
кюрий, менделевий, бром, эйнштейний
9. Общий этимологический источник названий химических элементов:
U, Te, Se — это планетарий
10. В честь различных государств или частей света названы элементы:
Германий, галлий, франций, дубний
Периодический закон Д. И. Менделеева
И. Менделеева
Материалы портала onx.distant.ru
Периодический закон и периодическая система Д. И. Менделеева
Примеры решения задач
Задачи для самостоятельного решения
1. Периодический закон Д.И. Менделеева
Периодический закон – величайшее достижение химической науки, основа всей современной химии. С его открытием химия перестала быть описательной наукой, в ней стало возможным научное предвидение.
Периодический закон открыт Д. И. Менделеевым в 1869 г. Ученый сформулировал этот закон так: «Свойства простых тел, также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
Более детальное изучение строения вещества показало, что периодичность свойств элементов обусловлена не атомной массой, а электронным строением атомов.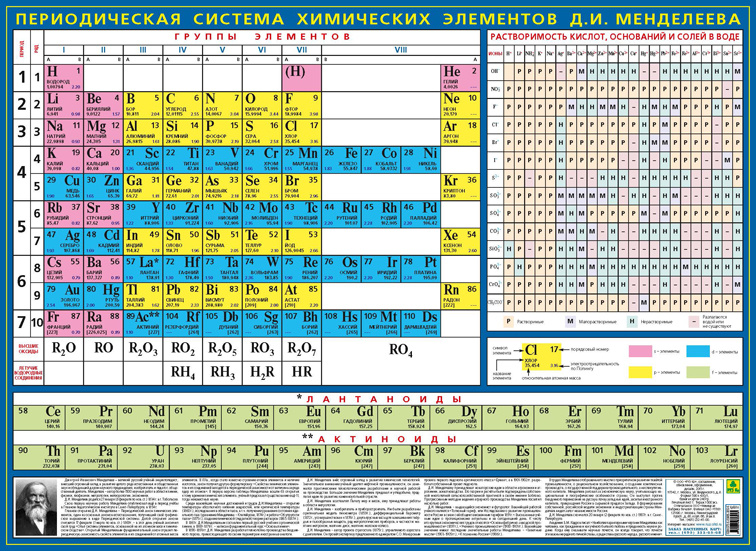
Заряд ядра является характеристикой, определяющей электронное строение атомов, а следовательно, и свойства элементов. Поэтому в современной формулировке Периодический закон звучит так: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от порядкового номера (от величины заряда ядра их атомов).
Выражением Периодического закона является периодическая система элементов.
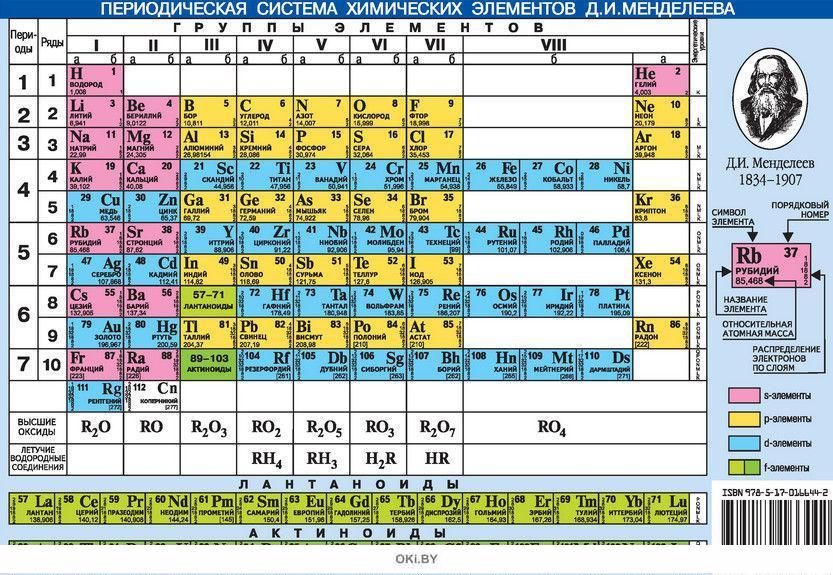
2. Периодическая система Д. И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра. Периоды 1, 2, 3, 4, 5, 6 содержат соответственно 2, 8, 8, 18, 18, 32 элемента. Седьмой период не завершен. Периоды 1, 2 и 3 называют малыми, остальные — большими.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородным газом (Ne, Ar, Kr, Xe, Rn), которому предшествует типичный неметалл. В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства, поскольку с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне.
В первом периоде, кроме гелия, имеется только один элемент — водород. Его условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Сходство водорода со щелочными металлами проявляется в том, что водород, как и щелочные металлы является восстановителем и, отдавая один электрон, образует однозарядный катион. Больше общего у водорода с галогенами: водород, как и галогены неметалл, его молекула двухатомна, он может проявлять окислительные свойства, образуя с активными металлами солеподобные гидриды, например, NaH, CaH2.
В четвертом периоде вслед за Са расположены 10 переходных элементов (декада Sc — Zn), за которыми находятся остальные 6 основных элементов периода (Ga — Кг). Аналогично построен пятый период. Понятие переходный элемент обычно используется для обозначения любого элемента с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположена вставная декада d–элементов (La — Hg), причем после первого переходного элемента La следуют 14 f–элементов — лантаноидов ( Се — Lu). После Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
Таким образом, каждый элемент в периодической системе занимает строго определенное положение, которое отмечается порядковым, или атомным, номером.
В периодической системе по вертикали расположены восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные, или подгруппы А и побочные, или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Сходство элементов внутри каждой подгруппы — наиболее заметная и важная закономерность в периодической системе. В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические. При этом происходит увеличение устойчивости соединений элементов в низшей для данной подгруппы степени окисления. В побочных подгруппах – наоборот – сверху вниз металлические свойства ослабевают и увеличивается устойчивость соединений с высшей степенью окисления.
3. Периодическая система и электронные конфигурации атомов
Поскольку при химических реакциях ядра реагирующих атомов не изменяются, то химические свойства атомов зависят от строения их электронных оболочек.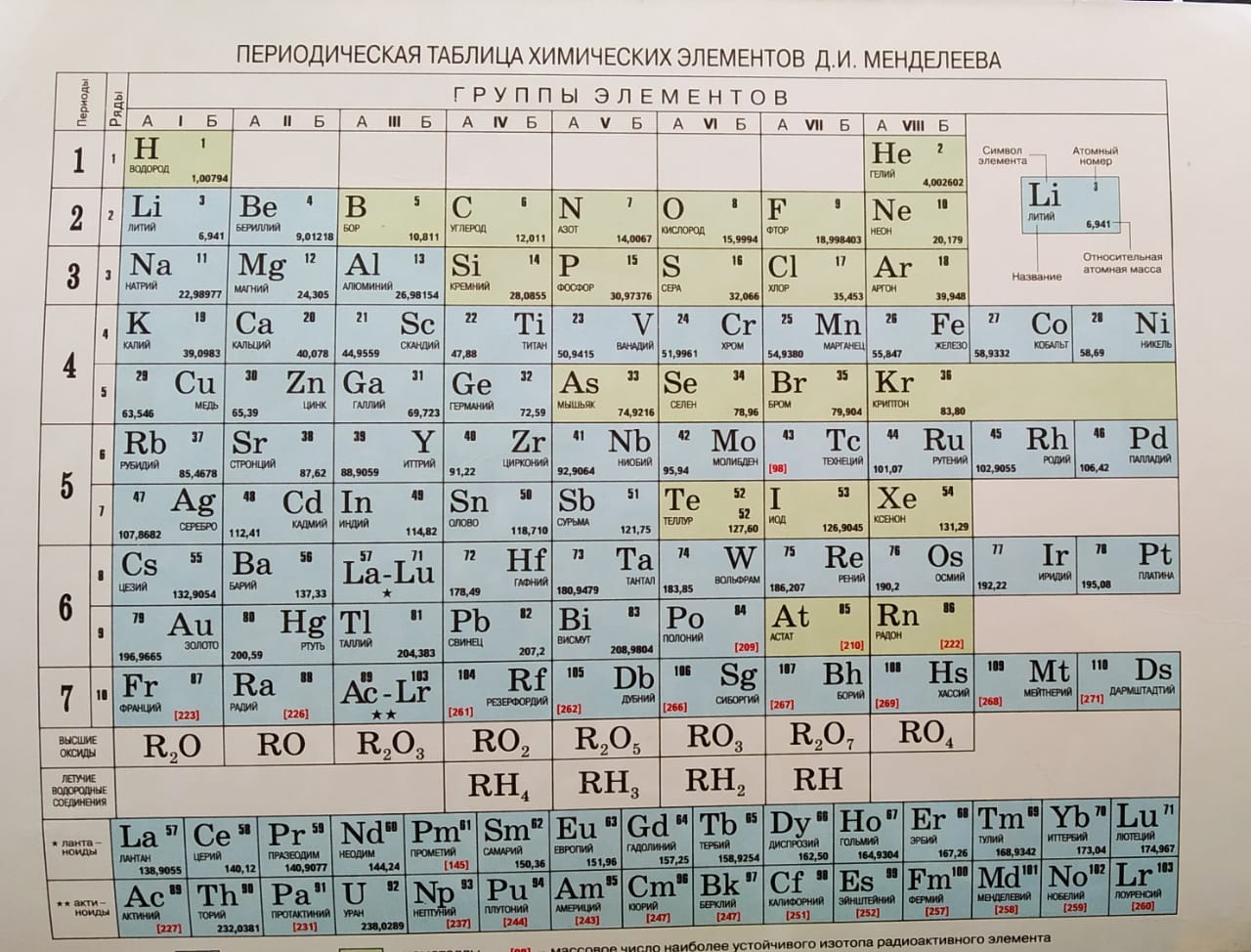
Заполнение электронных слоев и электронных оболочек атомов происходит в соответствии с принципом Паули и правилом Хунда.
Принцип Паули (запрет Паули)
Два электрона в атоме не могут иметь четыре одинаковых квантовых числа (на каждой атомной орбитали может находиться не более двух электронов).
Принцип Паули определяет максимальное число электронов, обладающих данным главным квантовым числом n (т.е. находящихся на данном электронном слое): Nn = 2n2. На первом электронном слое (энергетическом уровне) может быть не больше 2 электронов, на втором – 8, на третьем – 18 и т. д.
В атоме водорода, например, имеется один электрон, который находится на первом энергетическом уровне в 1s – состоянии. Спин этого электрона может быть направлен произвольно (ms = +1/2 или ms = –1/2). Следует подчеркнуть еще раз, что первый энергетический уровень состоит из одного подуровня – 1s, второй энергетический уровень – из двух подуровней – 2s и 2р, третий – из трех подуровней – 3s, 3p, 3d и т.д. Подуровень, в свою очередь, содержит орбитали, число которых определяется побочным квантовым числом l и равно (2l + 1). Каждая орбиталь условно обозначается клеткой, находящийся на ней электрон – стрелкой, направление которой указывает на ориентацию спина этого электрона. Значит, состояние электрона в атоме водорода можно представить как 1s1 или изобразить в виде квантовой ячейки, рис. 1:
Следует подчеркнуть еще раз, что первый энергетический уровень состоит из одного подуровня – 1s, второй энергетический уровень – из двух подуровней – 2s и 2р, третий – из трех подуровней – 3s, 3p, 3d и т.д. Подуровень, в свою очередь, содержит орбитали, число которых определяется побочным квантовым числом l и равно (2l + 1). Каждая орбиталь условно обозначается клеткой, находящийся на ней электрон – стрелкой, направление которой указывает на ориентацию спина этого электрона. Значит, состояние электрона в атоме водорода можно представить как 1s1 или изобразить в виде квантовой ячейки, рис. 1:
1s
Рис. 1. Условное обозначение электрона в атоме водорода на 1s орбитали
Для обоих электронов атома гелия n = 1, l = 0, ml = 0, ms = +1/2 и –1/2. Следовательно, электронная формула гелия 1s2. Электронная оболочка гелия завершена и очень устойчива. Гелий — благородный газ.
Электронная оболочка гелия завершена и очень устойчива. Гелий — благородный газ.
Согласно принципу Паули, на одной орбитали не может быть двух электронов с параллельными спинами. Третий электрон в атоме лития занимает 2s-орбиталь. Электронная конфигурация Li: 1s22s1, а у бериллия 1s22s2. Поскольку 2s-орбиталь заполнена, то пятый электрон у атома бора занимает 2р-орбиталь. При n = 2 побочное (орбитальное) квантовое число l принимает значения 0 и 1. При l = 0 (2s-состояние) ml = 0, а при l = 1 (2p – состояние) ml может быть равным +1; 0; –1. Состоянию 2р соответствуют три энергетические ячейки, рис. 2.
1s 2s 2p
Рис. 2. Расположение электронов атома бора на орбиталях
Для атома азота (электронная конфигурация 1s22s22p3 два электрона на первом уровне, пять — на втором) возможны два следующих варианта электронного строения, рис.![]() 3:
3:
1s 2s 2p 1s 2s 2p
а б
Рис. 3. Возможные варианты расположения электронов атома азота на орбиталях
В первой схеме, рис. 3а, суммарный спин равен 1/2 (+1/2 –1/2 +1/2), во второй (рис. 3б) суммарный спин равен 3/2 (+1/2 +1/2 +1/2).
Расположение спинов определяется правилом Хунда, которое гласит: заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным.
Таким образом, из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают различные орбитали. Орбитали подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами.
Начиная с натрия, заполняется третий энергетический уровень с n = 3.
В атоме каждый электрон занимает свободную орбиталь с наиболее низкой энергией, отвечающей его наибольшей связи с ядром. В 1961 г. В.М. Клечковский сформулировал общее положение, согласно которому энергия электронных орбиталей возрастает в порядке увеличения суммы главного и побочного квантовых чисел (n + l), причем в случае равенства этих сумм, меньшей энергией обладает орбиталь с меньшим значением главного квантового числа n .
Последовательность энергетических уровней в порядке возрастания энергии примерно следующая:
1s < 2s < 2p < 3s < 3р < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f < 6p
Можно представить энергетический ряд орбиталей в виде схемы:
Рассмотрим распределение электронов на орбиталях атомов элементов четвертого периода. Строение атома калия:
Строение атома калия:
+19K 1s22s22p63s23p64s1 1s 2s 2p3s 3p4s
Для записи дальнейших электронных формул в статье будем использовать сокращенную форму:
+19K [Ar]4s1 [Ar] 4s
У кальция 4s-подуровень заполнен:
+20Ca [Ar]4s2 [Ar] 4s
После калия (электронная конфигурация 1s22s22p63s23p64s1) и кальция (электронная конфигурация 1s22s22p63s23p64s2) происходит заполнение электронами внутренней 3d-оболочки (переходные элементы Sc — Zn). Следует отметить существование двух аномалий: у атомов Сr и Сu на 4 s -оболочке находятся не два электрона, а один, т. е. происходит так называемый «провал» внешнего 4s-электрона на предшествующую 3d-оболочку. Электронное строение атома хрома можно представить следующим образом (рис. 4).
е. происходит так называемый «провал» внешнего 4s-электрона на предшествующую 3d-оболочку. Электронное строение атома хрома можно представить следующим образом (рис. 4).
+24Cr [Ar]3d54s1 [Ar] 4s 3d
Рис. 4. Распределение электронов по орбиталям для атома хрома
Физическая причина «нарушения» порядка заполнения связана с различной проникающей способностью электронных орбиталей к ядру, особой устойчивостью электронных конфигураций d5 и d10, f7 и f14, отвечающих заполнению электронных орбиталей одним или двумя электронами, а также экранирующим действием внутренних электронных слоев заряда ядра.
Электронные конфигурации атомов Mn, Fe, Co, Ni, Cu и Zn отражены следующими формулами:
25Mn 1s22s22p63s23p63d54s2
26Fe 1s22s22p63s23p63d64s2
27Co 1s22s22p63s23p63d74s2
28Ni 1s22s22p63s23p63d84s2
29Cu 1s22s22p63s23p63d104s1
30Zn 1s22s22p63s23p63d104s2
После цинка, начиная с 31 элемента — галлия вплоть до 36 элемента — криптона продолжается заполнение четвертого слоя (4р – оболочки). Электронные конфигурации этих элементов имеют следующий вид:
Электронные конфигурации этих элементов имеют следующий вид:
31Ga 1s22s22p63s23p63d104s24p1
32Ge 1s22s22p63s23p63d104s24p2
33As 1s22s22p63s23p63d104s24p3
34Se 1s22s22p63s23p63d104s24p4
35Br 1s22s22p63s23p63d104s24p5,
36Kr 1s22s22p63s23p63d104s24p6
Следует отметить, что если не нарушается запрет Паули, в возбужденных состояниях электроны могут располагаться на других орбиталях атомов.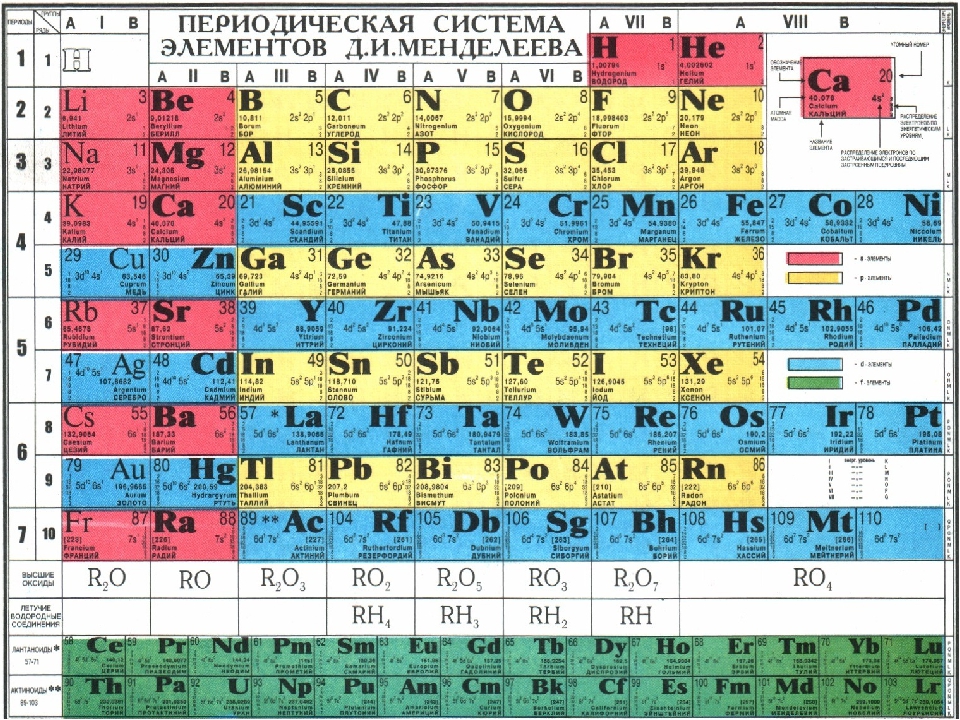
4. Типы химических элементов
Все элементы периодической системы подразделяются на четыре типа:
1. У атомов s–элементов заполняются s–оболочки внешнего слоя (n). К s–элементам относятся водород, гелий и первые два элемента каждого периода.
2. У атомов р–элементов электронами заполняются р–оболочки внешнего уровня (np). К р -элементам относятся последние 6 элементов каждого периода (кроме первого).
3. У d–элементов заполняется электронами d–оболочка второго снаружи уровня (n–1) d . Это элементы вставных декад больших периодов, расположенных между s– и p– элементами.
4. У f–элементов заполняется электронами f–подуровень третьего снаружи уровня (n–2) f . К семейству f–элементов относятся лантаноиды и актиноиды.
Из рассмотрения электронной структуры невозбужденных атомов в зависимости от порядкового номера элемента следует:
-
Число энергетических уровней (электронных слоев) атома любого элемента равно номеру периода, в котором находится элемент.
 Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах.
Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах. -
Номер периода совпадает с главным квантовым числом внешних электронов атома.
-
s– и p–элементы образуют главные подгруппы, d–элементы – побочные подгруппы, f–элементы образуют семейства лантаноидов и актиноидов. Таким образом, подгруппа включает элементы, атомы которых обычно имеют сходное строение не только внешнего, но и предвнешнего слоя (за исключением элементов, в которых имеет место «провал» электрона).
-
Номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом состоит физический смысл номера группы. У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних оболочек. Это является основным различием в свойствах элементов главных и побочных подгрупп.

Элементы с валентными d– или f–электронами называются переходными.
Номер группы, как правило, равен высшей положительной степени окисления элементов, проявляемой ими в соединениях. Исключением является фтор – его степень окисления равна –1; из элементов VIII группы только для Os, Ru и Xe известна степень окисления +8.
5. Периодичность свойств атомов элементов
Такие характеристики атомов, как их радиус, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронным строением атома.
Различают радиусы атомов металлов и ковалентные радиусы атомов неметаллов. Радиусы атомов металлов вычисляются на основе межатомных расстояний, которые хорошо известны для большинства металлов на основе экспериментальных данных. При этом радиус атома металла равен половине расстояния между центрами двух соседних атомов. Аналогичным образом вычисляются ковалентные радиусы неметаллов в молекулах и кристаллах простых веществ. Чем больше атомный радиус, тем легче отрываются от ядра внешние электроны (и наоборот). В отличие от атомных радиусов, радиусы ионов – условные величины.
Аналогичным образом вычисляются ковалентные радиусы неметаллов в молекулах и кристаллах простых веществ. Чем больше атомный радиус, тем легче отрываются от ядра внешние электроны (и наоборот). В отличие от атомных радиусов, радиусы ионов – условные величины.
Слева направо в периодах величина атомных радиусов металлов уменьшается, а атомных радиусов неметаллов изменяется сложным образом, так как она зависит от характера химической связи. Во втором периоде, например, радиусы атомов сначала уменьшаются, а затем возрастают, особенно резко при переходе к атому благородного газа.
В главных подгруппах радиусы атомов увеличиваются сверху вниз, так как возрастает число электронных слоев.
Радиус катиона меньше радиуса соответствующего ему атома, причем с увеличением положительного заряда катиона его радиус уменьшается. Наоборот, радиус аниона всегда больше радиуса соответствующего ему атома. Изоэлектронными называют частицы (атомы и ионы), имеющие одинаковое число электронов. В ряду изоэлектронных ионов радиус снижается с уменьшением отрицательного и возрастанием положительного радиуса иона. Такое уменьшение имеет место, например в ряду: O2–, F–, Na+, Mg2+, Al3+.
В ряду изоэлектронных ионов радиус снижается с уменьшением отрицательного и возрастанием положительного радиуса иона. Такое уменьшение имеет место, например в ряду: O2–, F–, Na+, Mg2+, Al3+.
Энергия ионизации– энергия, необходимая для отрыва электрона от атома, находящегося в основном состоянии. Она обычно выражается в электронвольтах (1 эВ = 96,485 кДж/моль). В периоде слева направо энергия ионизации возрастает с увеличением заряда ядра. В главных подгруппах сверху вниз она уменьшается, т. к. увеличивается расстояние электрона до ядра и возрастает экранирующее действие внутренних электронных слоев.
В таблице 1 приведены значения энергий ионизации (энергий отрыва первого, второго и т.д. электронов) для некоторых атомов.
Во втором периоде при переходе от Li к Ne энергия отрыва первого электрона возрастает (см. таблицу 1). Однако, как видно из таблицы, энергия ионизации возрастает неравномерно: у следующих за бериллием и азотом соответственно бора и кислорода наблюдается ее некоторое уменьшение, что обусловлено особенностями электронного строения атомов.
таблицу 1). Однако, как видно из таблицы, энергия ионизации возрастает неравномерно: у следующих за бериллием и азотом соответственно бора и кислорода наблюдается ее некоторое уменьшение, что обусловлено особенностями электронного строения атомов.
Внешняя s–оболочка бериллия полностью заполнена, поэтому у следующего за ним бора электрон поступает на р-орбиталь. Этот р-электрон менее прочно связан с ядром, чем s–электрон, поэтому отрыв р–электронов требует меньшей затраты энергии.
Таблица 1.
Энергии ионизации I атомов некоторых элементов
|
Атом |
I , эВ |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
Н Не Li Be В С N О F Ne Na Mg Al Si P S Cl Ar К Ca |
13,595 24,581 5,390 9,320 8,296 11,256 14,53 13,614 17,418 21,559 5,138 7,644 5,984 8,149 10,484 10,357 13,01 15,755 4,339 6,111 |
54,403 75,619 18,206 25,149 24,376 29,593 35,146 34,98 41,07 47,29 15,031 18,823 16,34 19,72 23,4 23,80 27,62 31,81 11,868 |
122,419 153,850 37,920 47,871 47,426 54,934 62,646 63,5 71,65 80,12 28,44 33,46 30,156 35,0 39,90 40,90 46,0 51,21 |
217,657 259,298 64,48 77,450 77,394 87,23 97,16 98,88 109,29 119,96 45,13 51,354 47,29 53,5 59,79 60,90 67,0 |
340,127 392,00 97,863 113,873 114,214 126,4 138,60 141,23 153,77 166,73 65,007 72,5 67,80 75,0 82,6 84,39 |
На каждой р-орбитали атома азота имеется по одному электрону. У атома кислорода электрон поступает на р-орбиталь, которая уже занята одним электроном. Два электрона, находящиеся на одной и той же орбитали, сильно отталкиваются, поэтому оторвать электрон от атома кислорода легче, чем от атома азота.
У атома кислорода электрон поступает на р-орбиталь, которая уже занята одним электроном. Два электрона, находящиеся на одной и той же орбитали, сильно отталкиваются, поэтому оторвать электрон от атома кислорода легче, чем от атома азота.
Наименьшее значение энергии ионизации имеют щелочные металлы, поэтому они обладают ярко выраженными металлическими свойствами, наибольшая величина энергии ионизации у инертных газов.
Сродство к электрону– энергия, выделяющаяся при присоединении электрона к нейтральному атому. Сродство к электрону, как и энергию ионизации, обычно выражают в электронвольтах. Наибольшее сродство к электрону – у галогенов, наименьшее – у щелочных металлов. В таблице 2 приведены значения сродства к электрону для атомов некоторых элементов.
Таблица 2.
Сродство к электрону атомов некоторых элементов
|
Атом |
Е, эВ |
Атом |
Е, эВ |
Атом |
Е, эВ |
Атом |
Е, эВ |
|
Н Не Li Be В |
0,754 0 0,620 0 0,28 |
С N О F Ne |
1,268 -0,07 1,46 3,398 0 |
Na Mg Al Si P |
0,546 0 0,46 1,385 0,074 |
S Cl Br I Se |
2,077 3,615 3,364 3,061 2,020 |
Электроотрицательность – способность атома в молекуле или ионе притягивать к себе валентные электроны других атомов.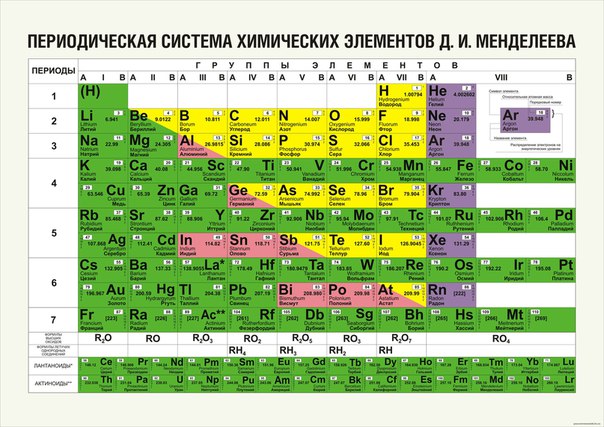 Электроотрицательность (ЭО) как количественная мера – приближенная величина. Предложено около 20 шкал электроотрицательностей, наибольшее признание из которых получила шкала, разработанная Л. Полингом. На рис. 5 приведены значения ЭО по Полингу.
Электроотрицательность (ЭО) как количественная мера – приближенная величина. Предложено около 20 шкал электроотрицательностей, наибольшее признание из которых получила шкала, разработанная Л. Полингом. На рис. 5 приведены значения ЭО по Полингу.
Рис. 5. Электроотрицательность элементов (по Полингу)
Наиболее электроотрицательным из всех элементов по шкале Полинга является фтор. Его ЭО принята равной 4. Наименее электроотрицательный – цезий. Водород занимает промежуточное положение, поскольку при взаимодействии с одними элементами он отдает электрон, а при взаимодействии с другими – приобретает.
6. Кислотно-основные свойства соединений; схема Косселя
Для объяснения характера изменения кислотно-основных свойств соединений элементов Коссель (Германия) предложил использовать простую схему, основанную на предположении о том, что в молекулах существует чисто ионная связь и между ионами имеет место кулоновское взаимодействие. Схема Косселя описывает кислотно-основные свойства соединений, содержащих связи Э-Н и Э-О-Н, в зависимости от заряда ядра и радиуса образующего их элемента.
Схема Косселя описывает кислотно-основные свойства соединений, содержащих связи Э-Н и Э-О-Н, в зависимости от заряда ядра и радиуса образующего их элемента.
Схема Косселя для двух гидроксидов металлов, например, LiOH и KOH показана на рис. 7.
Рис. 7. Схема Косселя для LiOH и KOH
Как видно из представленной схемы, радиус иона Li+ меньше радиуса иона К+ и ОН— –группа связана прочнее с катионом лития, чем с катионом калия. В результате КОН будет легче диссоциировать в растворе и основные свойства гидроксида калия будут выражены сильнее.
Аналогичным образом можно проанализировать схему Косселя для двух оснований CuOH и Cu(OH)2. Поскольку радиус иона Cu2+ меньше, а заряд – больше, чем у иона Cu+, ОН— -группу будет прочнее удерживать ион Cu2+. В результате основание Cu(OH)2 будет более слабым, чем CuOH.
Таким образом, сила оснований возрастает при увеличении радиуса катиона и уменьшении его положительного заряда .
В главных подгруппах сверху вниз сила оснований увеличивается, поскольку в этом направлении возрастают радиусы ионов элементов. В периодах слева направо происходит уменьшение радиусов ионов элементов и увеличение их положительного заряда, поэтому в этом направлении сила оснований уменьшается.
Схема Косселя для двух бескислородных кислот, например, HCl и HI показана на рис. 8
Рис. 8. Схема Косселя для HCl и HI
Поскольку радиус хлорид-иона меньше, чем иодид-иона, ион Н+ прочнее связан с анионом в молекуле хлороводородной кислоты, которая будет слабее, чем иодоводородная кислота. Таким образом, сила бескислородных кислот возрастает с увеличением радиуса отрицательного иона .
Сила кислородсодержащих кислот изменяется противоположным образом. Она увеличивается с уменьшением радиуса иона и увеличением его положительного заряда. Рассмотрим схему Косселя для двух кислот HClO и HClO4.
Она увеличивается с уменьшением радиуса иона и увеличением его положительного заряда. Рассмотрим схему Косселя для двух кислот HClO и HClO4.
| Кислота | Заряд хлора | Сила кислоты |
| HClO | +1 | Слабая кислота |
| HClO4 | +7 | Сильная кислота |
Ион Сl7+ прочно связан с ионом кислорода, поэтому протон легче будет отщепляться в молекуле НСlО4. В то же время связь иона Сl+ с ионом О2- менее прочная, и в молекуле НСlО протон будет сильнее удерживаться анионом О2-. В результате HClO4 будет более сильной кислотой, чем HClO.
Достоинством схемы Косселя является то, что она с использованием простой модели позволяет объяснить характер изменения кислотно-основных свойств соединений в ряду сходных веществ. Вместе с тем эта схема является чисто качественной. Она позволяет лишь сравнивать свойства соединений и не дает возможность определить кислотно-основные свойства произвольно выбранного одного соединения. Недостатком этой модели является то, что в ее основу положены только электростатические представления, в то время как в природе не существует чистой (стопроцентной) ионной связи.
Вместе с тем эта схема является чисто качественной. Она позволяет лишь сравнивать свойства соединений и не дает возможность определить кислотно-основные свойства произвольно выбранного одного соединения. Недостатком этой модели является то, что в ее основу положены только электростатические представления, в то время как в природе не существует чистой (стопроцентной) ионной связи.
7. Окислительно-восстановительные свойства элементов и их соединений
Изменение окислительно-восстановительных свойств простых веществ легко установить, рассматривая характер изменения электроотрицательности соответствующих элементов. В главных подгруппах сверху вниз электроотрицательность уменьшается, что приводит к уменьшению окислительных и увеличению в этом направлении восстановительных свойств. В периодах слева направо электроотрицательность возрастает. В результате в этом направлении восстановительные свойства простых веществ уменьшаются, а окислительные – возрастают. Таким образом, сильные восстановители располагаются в левом нижнем углу периодической системы элементов (калий, рубидий, цезий, барий), в то время как сильные окислители находятся в правом верхнем ее углу (кислород, фтор, хлор).
Таким образом, сильные восстановители располагаются в левом нижнем углу периодической системы элементов (калий, рубидий, цезий, барий), в то время как сильные окислители находятся в правом верхнем ее углу (кислород, фтор, хлор).
Окислительно-восстановительные свойства соединений элементов зависят от их природы, величины степени окисления элементов, положения элементов в периодической системе и ряда других факторов.
В главных подгруппах сверху вниз окислительные свойства кислородсодержащих кислот, в которых атомы центрального элемента имеют одинаковую степень окисления, уменьшаются. Сильными окислителями являются азотная и концентрированная серная кислоты. Окислительные свойства проявляются тем сильнее, чем больше положительная степень окисления элемента в соединении. Сильные окислительные свойства проявляют перманганат калия и дихромат калия.
В главных подгруппах восстановительные свойства простых анионов увеличиваются сверху вниз. Сильными восстановителями являются HI, H2S, иодиды и сульфиды.
Сильными восстановителями являются HI, H2S, иодиды и сульфиды.
Примеры решения задач
Пример 1. Составьте электронные формулы атомов в основном состоянии для следующих элементов: фосфор(15), кальций(20) и титан(22). В скобках указан порядковый номер элемента.
Решение. Фосфор находится в главной подгруппе пятой группы и в третьем периоде. Общее число электронов у этого атома равно 15, и они расположены на трех электронных слоях. Первые два электронных слоя атома фосфора заполнены полностью (электронная конфигурация атома Ne: 1s22s22p6 ), число электронов на третьем слое у фосфора равно номеру группы. Из этих электронов два располагаются на 3s-орбитали, а 3 – на 3р. Таким образом, электронная формула атома фосфора имеет вид:
15Р 1s22s22p63s23p3
Для составления электронной формулы атома кальция к электронной конфигурации атома Ar (1s22s22p63s23p6) необходимо добавить два электрона, которые располагаются на 4s–орбитали. В результате получаем следующую электронную формулу:
В результате получаем следующую электронную формулу:
20Ca 1s22s22p63s23p64s2
Элемент титан расположен в побочной подгруппе 4 группы элементов и в четвертом периоде. Он относится к переходным элементам четвертого периода, у которых происходит заполнение 3d–оболочки, на которой находятся 2 электрона. Общее число электронов у атома титана равно 22. Для составления электронной формулы титана к электронной формуле кальция необходимо добавить два d–электрона ( 3d2 ):
22Ti 1s22s22p63s23p63d24s2
Пример 2. Определите тип (s, p, d, f) следующих элементов: марганец (25), стронций(38), церий(58) и свинец(82). В скобках указан порядковый номер элемента.
Решение. К s-элементам относятся первые два элемента — водород и гелий, а также элементы, находящиеся в главных подгруппах 1-й и 2-й групп элементов (подгруппа лития и подгруппа бериллия). Среди представленных элементов в эту категорию попадает стронций(38) . В главных подгруппах третьей-восьмой групп находятся р-элементы. В нашем случае это свинец(82) . Вставные декады элементов, образующие побочные подгруппы, относятся к типу d-элементов. Среди рассматриваемых элементов к этому типу относится марганец(25) . Наконец, находящиеся в шестом и седьмом периодах вставки из 14 элементов, следующие за лантаном(57) и актинием(89), относятся к f–элементам. Таким образом, f-элементом является церий(58) . Полученные данные представляем в виде таблицы.
К s-элементам относятся первые два элемента — водород и гелий, а также элементы, находящиеся в главных подгруппах 1-й и 2-й групп элементов (подгруппа лития и подгруппа бериллия). Среди представленных элементов в эту категорию попадает стронций(38) . В главных подгруппах третьей-восьмой групп находятся р-элементы. В нашем случае это свинец(82) . Вставные декады элементов, образующие побочные подгруппы, относятся к типу d-элементов. Среди рассматриваемых элементов к этому типу относится марганец(25) . Наконец, находящиеся в шестом и седьмом периодах вставки из 14 элементов, следующие за лантаном(57) и актинием(89), относятся к f–элементам. Таким образом, f-элементом является церий(58) . Полученные данные представляем в виде таблицы.
Элемент | Тип элемента |
Стронций (38) | s |
Свинец (82) | p |
Марганец (25) | d |
Церий (58) | f |
Пример 3.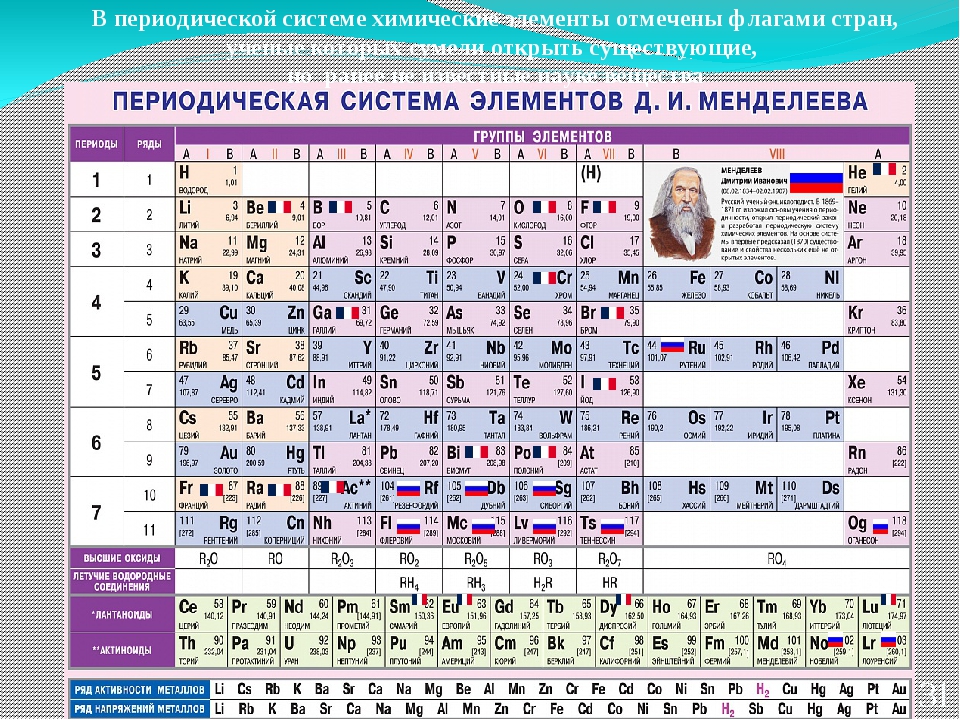 Расположите элементы в порядке увеличения их радиусов: Mg (12), Al (13), K (19), Ca (20). В скобках указан порядковый номер элемента.
Расположите элементы в порядке увеличения их радиусов: Mg (12), Al (13), K (19), Ca (20). В скобках указан порядковый номер элемента.
Решение. Для элементов главных подгрупп радиусы атомов увеличиваются сверху вниз. В периодах же слева направо происходит уменьшение радиусов атомов. Таким образом, наименьший радиус будет иметь атом алюминия, а наибольший – атом калия. Радиус атома кальция меньше атома калия, но больше атома магния. В результате получаем следующий ряд, в котором элементы расположены в порядке увеличения радиуса: Al (13), Mg (12), Ca (20), K (19).
Пример 4. Используя схему Косселя определите, какое основание сильнее CsOH или Ba(OH)2.
Решение. Согласно схеме Косселя у более сильного основания радиус катиона должен быть больше, а заряд – меньше. В этом случае гидроксильная группа слабее удерживается катионом и легче происходит разрыв связи Э–ОН. В рассматриваемом случае радиус иона Cs+ больше, а заряд меньше чем у иона Ba2+ . Таким образом CsOH сильнее, чем Ba(OH)2 .
В рассматриваемом случае радиус иона Cs+ больше, а заряд меньше чем у иона Ba2+ . Таким образом CsOH сильнее, чем Ba(OH)2 .
Пример 5. Используя схему Косселя определите, какая кислота является более сильной H2S или H2Se.
Решение. Сила бескислородных кислот увеличивается с ростом радиуса отрицательного иона, поскольку более крупному иону труднее удержать ион водорода. Поскольку радиус иона Se2– больше, чем иона S2– , H2Se сильнее, чем H2S.
Задачи для самостоятельного решения
| 1. | Составьте электронные формулы следующих элементов: магний (12), хлор (17) и железо (26). В скобках указан порядковый номер элемента. 12Mg: 1s22s22p63s2, | ||||||||||
| 2. | Определите тип (s, p, d, f) следующих элементов: галлий (31), технеций (43), европий (63) и радий (88). В скобках указан порядковый номер элемента.
| ||||||||||
| 3. | Расположите атомы элементов в порядке увеличения их радиусов: B (5), N (7), Si (14), P (15). В скобках указан порядковый номер элемента.
Радиусы атомов увеличиваются в ряду: N (7), B (5), P (15), Si (14). | ||||||||||
| 4. | Используя схему Косселя определите, какое основание сильнее Fe(OH)2 или Fe(OH)3.
Fe(OH)2 более сильное основание, чем Fe(OH)3. | ||||||||||
| 5. | Используя схему Косселя определите, какая кислота является более сильной H2SO3 или H2SeO3.
|
Периодический закон, подготовка к ЕГЭ по химии
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением
периодического закона.
Периодическая система Д.И. Менделеева является наглядным отражением
периодического закона.
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете
предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома,
соответственно, и больше его радиус.
Чем больше период, тем больше электронных орбиталей вокруг атома,
соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1,
индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже :)
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен,
вы уже можете составить конфигурацию его внешнего уровня.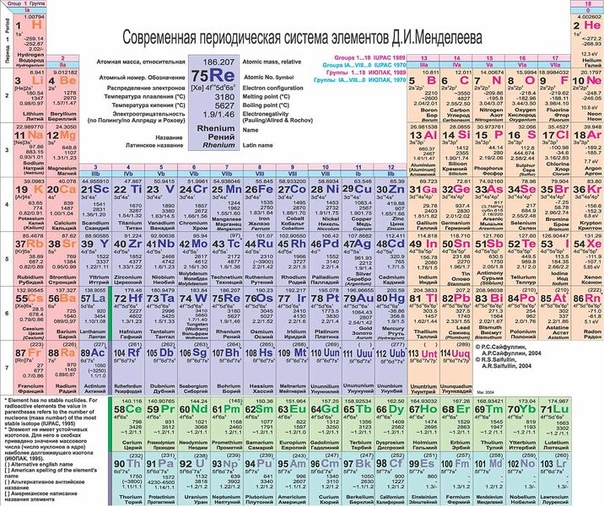 Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»).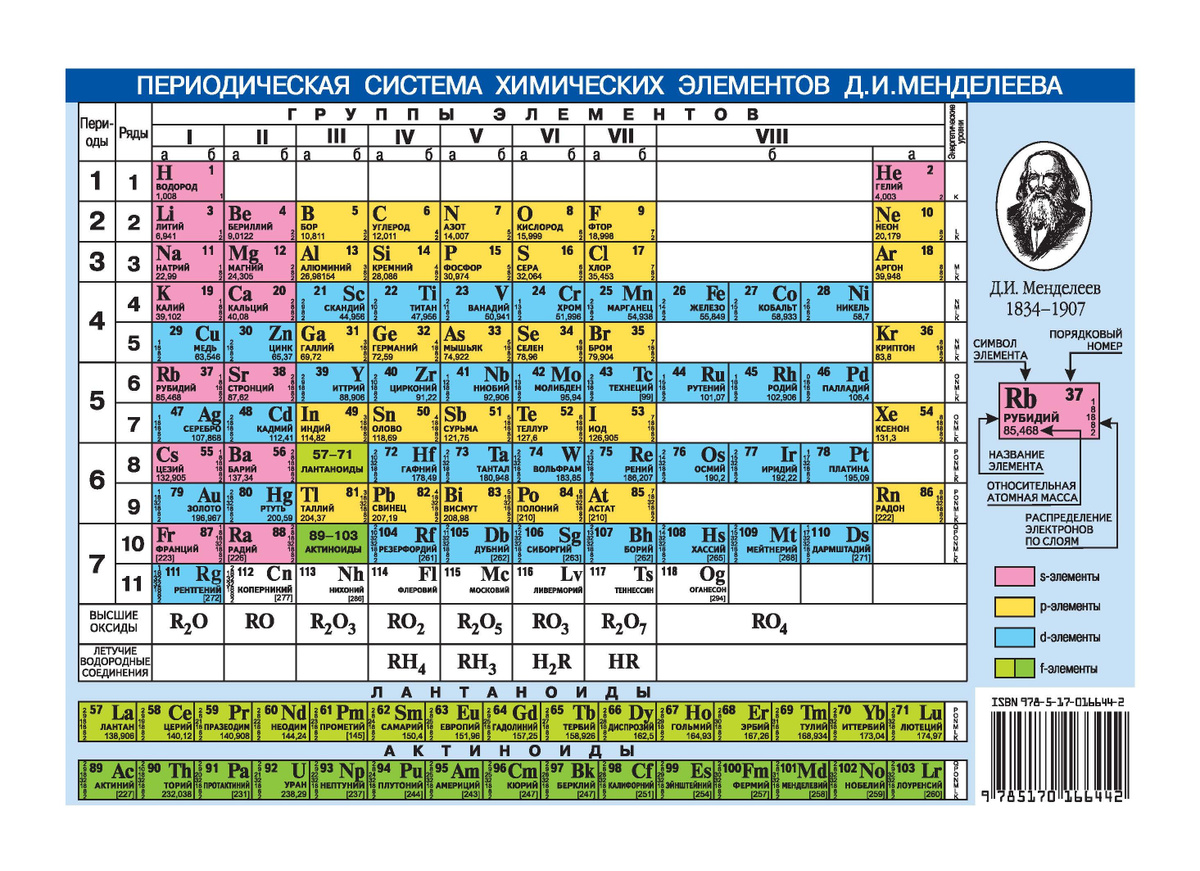 В группе с увеличением
заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).
В группе с увеличением
заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.
Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные — ослабевают.
В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между
молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а
HI — самая сильная.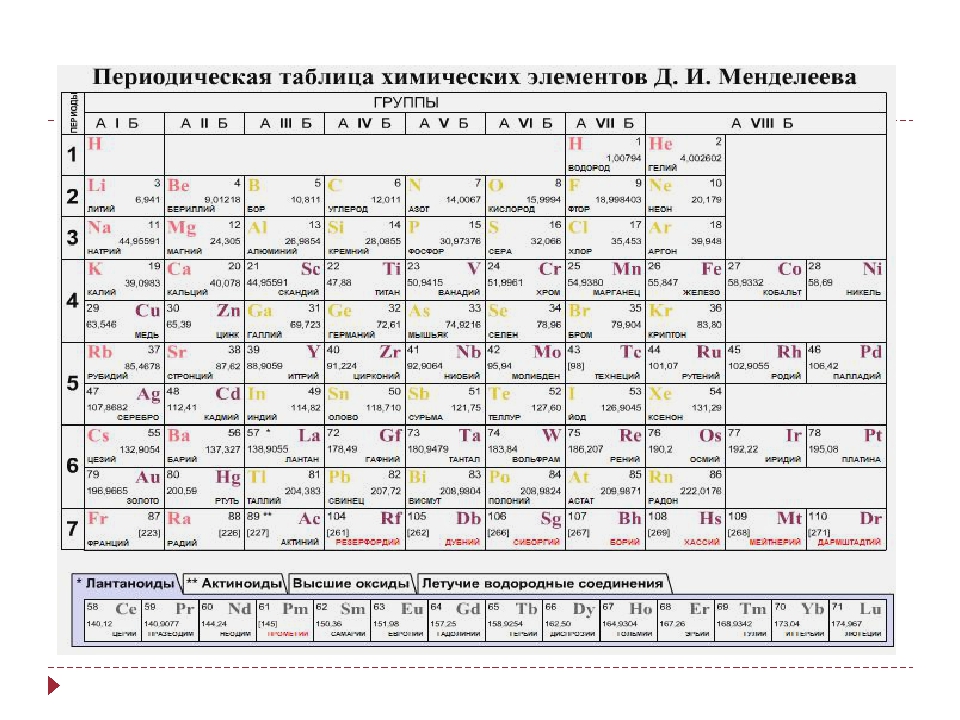
Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить ;-)
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.
Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации —
количеству энергии, которое необходимо для отщепления электрона от атома.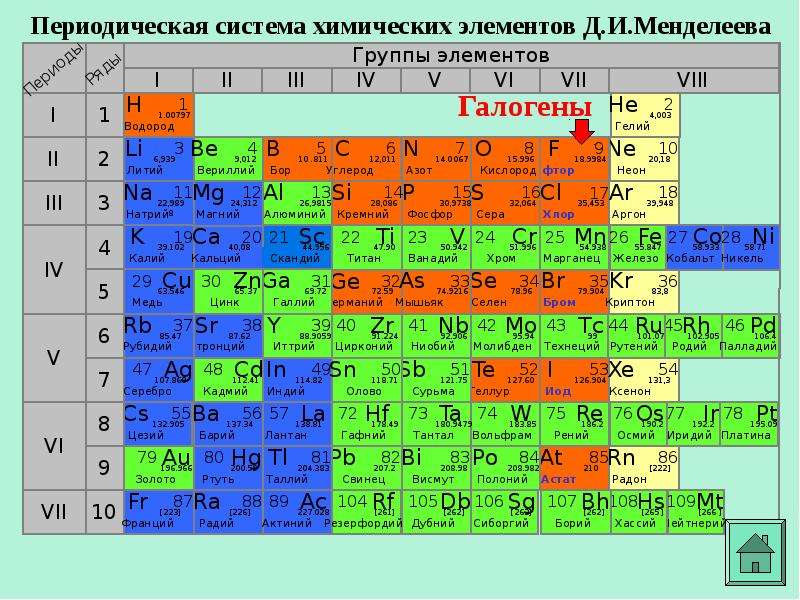 И то, и другое возрастают с увеличением электроотрицательности.
И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем
высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3,
Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить
ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
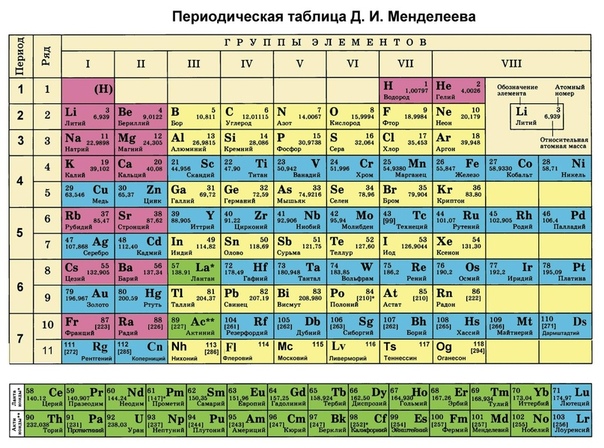
Периодическая таблица химических элементов, также называемая периодической таблицей Менделеева, представляет собой табличное отображение известных химических элементов.
|
Chem4Kids.com: Элементы и Периодическая таблица: Периодическая таблица
Периодическая таблица организована как большая сетка. Каждый элемент размещается в определенном месте из-за его атомарной структуры. Как и в любой другой сетке, в периодической таблице есть строки (слева направо) и столбцы (вверх и вниз).
 Каждая строка и столбец имеют определенные характеристики. Например, магний (Mg) и кальций (Mg) находятся во втором столбце и имеют определенные сходства, в то время как калий (K) и кальций (Ca) из четвертой строки имеют разные характеристики.Магний и натрий (Na) также имеют общие качества, потому что находятся в один период (схожие электронные конфигурации). Несмотря на то, что они пропускают некоторые квадраты между ними, все строки читаются слева направо. Когда вы смотрите на таблицу Менделеева, каждая строка называется периодом (Получите? Как таблица PERIODic.). Все элементы периода имеют одинаковое количество атомных орбиталей. Например, каждый элемент в верхнем ряду (первый период) имеет одну орбиталь для своих электронов. Все элементы во втором ряду (второй период) имеют две орбитали для своих электронов.По мере движения вниз по таблице каждая строка добавляет орбиталь. В настоящее время существует максимум семь электронных орбиталей. Теперь вы знаете, что месячные идут слева направо.
Каждая строка и столбец имеют определенные характеристики. Например, магний (Mg) и кальций (Mg) находятся во втором столбце и имеют определенные сходства, в то время как калий (K) и кальций (Ca) из четвертой строки имеют разные характеристики.Магний и натрий (Na) также имеют общие качества, потому что находятся в один период (схожие электронные конфигурации). Несмотря на то, что они пропускают некоторые квадраты между ними, все строки читаются слева направо. Когда вы смотрите на таблицу Менделеева, каждая строка называется периодом (Получите? Как таблица PERIODic.). Все элементы периода имеют одинаковое количество атомных орбиталей. Например, каждый элемент в верхнем ряду (первый период) имеет одну орбиталь для своих электронов. Все элементы во втором ряду (второй период) имеют две орбитали для своих электронов.По мере движения вниз по таблице каждая строка добавляет орбиталь. В настоящее время существует максимум семь электронных орбиталей. Теперь вы знаете, что месячные идут слева направо. Периодическая таблица Менделеева также имеет специальное название для своих вертикальных столбцов. Каждый столбец называется группой . Элементы в каждой группе имеют одинаковое количество электронов на внешней орбитали . Эти внешние электроны также называются валентными электронами . Это электроны, участвующие в химических связях с другими элементами.
Периодическая таблица Менделеева также имеет специальное название для своих вертикальных столбцов. Каждый столбец называется группой . Элементы в каждой группе имеют одинаковое количество электронов на внешней орбитали . Эти внешние электроны также называются валентными электронами . Это электроны, участвующие в химических связях с другими элементами.Каждый элемент в первом столбце (первая группа) имеет один электрон на внешней оболочке. Каждый элемент во втором столбце (вторая группа) имеет два электрона во внешней оболочке. Продолжая считать столбцы, вы будете знать, сколько электронов находится во внешней оболочке. Когда вы смотрите на элементы перехода, есть исключения из порядка, но вы понимаете общую идею. Переходные элементы добавляют электроны на предпоследнюю орбиталь.
Например, азот (N) имеет атомный номер семь.Атомный номер говорит о том, что в нейтральном атоме азота семь электронов. Сколько электронов находится на его внешней орбитали? Азот находится в пятнадцатом столбце, обозначенном «Группа VA». «V» — это римская цифра для пяти, обозначающая количество электронов на внешней орбитали. Вся эта информация говорит вам, что на первой орбитали есть два электрона, а на второй — пять (2-5).
«V» — это римская цифра для пяти, обозначающая количество электронов на внешней орбитали. Вся эта информация говорит вам, что на первой орбитали есть два электрона, а на второй — пять (2-5).
Фосфор (P) также находится в группе VA, что означает, что он также имеет пять электронов на своей внешней орбитали.Однако, поскольку атомный номер фосфора равен пятнадцати, электронная конфигурация составляет 2-8-5.
Водород (H) и гелий (He) — особые элементы. Водород в нейтральной форме не имеет нейтрона. Есть только один электрон и один протон. Вы, вероятно, не найдете атомарных водородов, плавающих сами по себе. Атомарный водород хочет объединиться с другими элементами, чтобы заполнить свою внешнюю оболочку. Ваша химическая работа, скорее всего, будет использовать молекулярный водород (H 2 ) или ионы водорода (H + , протоны). Гелий (He) отличается от всех других элементов. Он очень стабилен, поскольку на его внешней орбитали (валентной оболочке) всего два электрона. Несмотря на то, что у него всего два электрона, он все еще сгруппирован с благородными газами, у которых есть восемь электронов на их внешних орбиталях. Благородные газы и гелий «счастливы», потому что их валентная оболочка заполнена.
Несмотря на то, что у него всего два электрона, он все еще сгруппирован с благородными газами, у которых есть восемь электронов на их внешних орбиталях. Благородные газы и гелий «счастливы», потому что их валентная оболочка заполнена.
ChemCam Rock Laser для MSL (видео Лос-Аламоса, Нидерланды)
Периодическая таблица элементов Рона Куртуса
SfC Home> Физические науки> Химия>
Рон Куртус (16 апреля 2007 г.)
Периодическая таблица — это комбинация химических элементов , которая является мощным инструментом для изучения этих элементов и того, как они сочетаются.
Элементы расположены в ряды в соответствии с их атомными номерами и в столбцы в соответствии с их валентными электронами или числом электронов во внешней оболочке. Элементы в данном столбце имеют схожие химические характеристики.
Подробная таблица Менделеева обычно дает информацию о названии, символе, атомном номере, атомном весе, конфигурации оболочки и другом материале.
Вопросы, которые могут у вас возникнуть:
- Как расположены элементы?
- Что обозначают строки и столбцы?
- Как пользоваться таблицей?
Этот урок ответит на эти вопросы.
Расположение элементов
Элементы в периодической таблице расположены в ряды в соответствии с атомными номерами и в столбцы в соответствии с конфигурацией внешней орбиты или оболочки.
Неполная таблица Менделеева
В таблице ниже показаны только первые 18 элементов, поэтому вы можете понять, как они расположены в таблице Менделеева. Поскольку элементов более 100, таблица более сложная.
Элементы перечислены в соответствии с их сокращениями. H, = водород, He, = гелий и т. Д.
Внешний | +1 | +2 | +3 | +4 | -3 | -2 | -1 | Полный корпус |
Корпуса | ||||||||
1 | 1 H | 2 He | ||||||
2 | 3 Ли | 4 Be | 5 Б | 6 К | 7 N | 8 О | 9 Факс | 10 Ne |
3 | 11 Na | 12 мг | 13 Al | 14 Si | 15 пол. | 16 ю | Класс 17 | 18 Ар |
Первые три строки Периодической таблицы
Строки и столбцы
Изучая строки и столбцы периодической таблицы, вы можете увидеть, насколько она может быть полезной.
рядов
Если пройти по строкам слева направо, элементы пронумерованы 1 — H , 2 — He , 3 — Li , 4 — Be , 5 — B и т. Д. Атомный номер — это также количество протонов в ядре элемента.
В первой строке перечислены только H и He , поскольку они имеют только одну электронную оболочку или орбиту. Во второй строке перечислены элементы с электронами в двух оболочках. Литий ( Li ) имеет один электрон в оболочке 2, а Неон ( Ne ) имеет полную оболочку из 8 электронов.Элементы в третьем ряду не только имеют два электрона в первой оболочке и восемь во второй оболочке, но также имеют электроны в третьей оболочке. Кремний ( Si ) имеет четыре электрона на своей внешней орбите или оболочке.
Кремний ( Si ) имеет четыре электрона на своей внешней орбите или оболочке.
Колонны
Если вы спуститесь по столбцу, у каждого элемента будет одинаковое количество электронов на внешней орбите или оболочке. Например, H , Li и Na каждый имеет по одному электрону на внешней оболочке. С другой стороны, O , S и те элементы, которые находятся ниже, каждый имеет по 6 электронов во внешней оболочке или 2 до заполнения внешней оболочки 8 электронами.Количество электронов во внешней оболочке определяет химические свойства элемента.
В каждой оболочке разрешено максимальное количество электронов. Только 2 могут быть в первой оболочке, 8 — во второй, 18 — в третьей, 32 — в четвертой и так далее.
(Подробное описание орбит или оболочек см. В разделе «Атом» в разделе «Физика».)
После середины пути в столбцах указано, сколько меньше заполненных находится на внешней орбите или в оболочке.Максимальное количество электронов на второй орбите — 8. Таким образом, Кислород ( O ) имеет на 2 электрона меньше, чем максимум 8 на его внешней орбите.
Таким образом, Кислород ( O ) имеет на 2 электрона меньше, чем максимум 8 на его внешней орбите.
Интерактивная таблица Менделеева
Полная периодическая таблица элементов показана ниже. Эта версия таблицы является интерактивной, что позволяет вам получить больше информации о различных элементах. Информация об использовании приведена под таблицей.
( Примечание : Чтобы найти имя элемента для данного символа, см. Урок по Chemical Elements .)
Чтобы таблица работала, ваш браузер должен поддерживать JavaScript. Не похоже, что JavaScript активирован.Использование стола
Если щелкнуть любое подчеркнутое сокращение для элемента, подробная информация отображается в нижней таблице.
- Имя дает полное имя элемента
- Число — атомный номер (также количество протонов в ядре)
- Вес — средний атомный вес или масса, включая изотопы
- Оболочки — это электронные оболочки или орбиты в порядке (т.
 е.е. 2, 8, 8, 3)
е.е. 2, 8, 8, 3) - Орбиталь указывает на заполнение орбиты электронами (это сложно, и на самом деле не рассматривается и не используется в нашем материале)
- Плавление — температура плавления материала в градусах Цельсия
- Кипение — температура кипения материала в градусах Цельсия
Итак, вы можете получить довольно много информации из этой таблицы.
Состояние при комнатной температуре
В таблице также нанесен цветовой код для каждого элемента в зависимости от того, является ли он твердым, жидким или газообразным при комнатной температуре.
Искусственные элементы обычно производятся в таких небольших количествах и настолько недолговечны, что трудно сказать, в какой форме они существуют. Судя по их расположению в таблице, они, вероятно, являются твердыми.
Сводка
Вы можете использовать эту Периодическую таблицу, чтобы получить значительную информацию об элементах и их взаимосвязи друг с другом, а также о возможных химических комбинациях.
У вас есть большой потенциал
Ресурсы и ссылки
Полномочия Рона Куртуса
Сайтов
Химические элементы.com — Сайт с подробной информацией о таблице Менделеева
Химические ресурсы
Книги
(Примечание: Школа чемпионов может получать комиссионные от покупок книг)
Книги по химии с самым высоким рейтингом
Вопросы и комментарии
У вас есть вопросы, комментарии или мнения по этой теме? Если это так, отправьте свой отзыв по электронной почте. Я постараюсь вернуться к вам как можно скорее.
Поделиться страницей
Нажмите кнопку, чтобы добавить эту страницу в закладки или поделиться ею через Twitter, Facebook, электронную почту или другие службы:
Студенты и исследователи
Веб-адрес этой страницы:
www.school-for-champions.com/chemistry/
периодическая_таблица.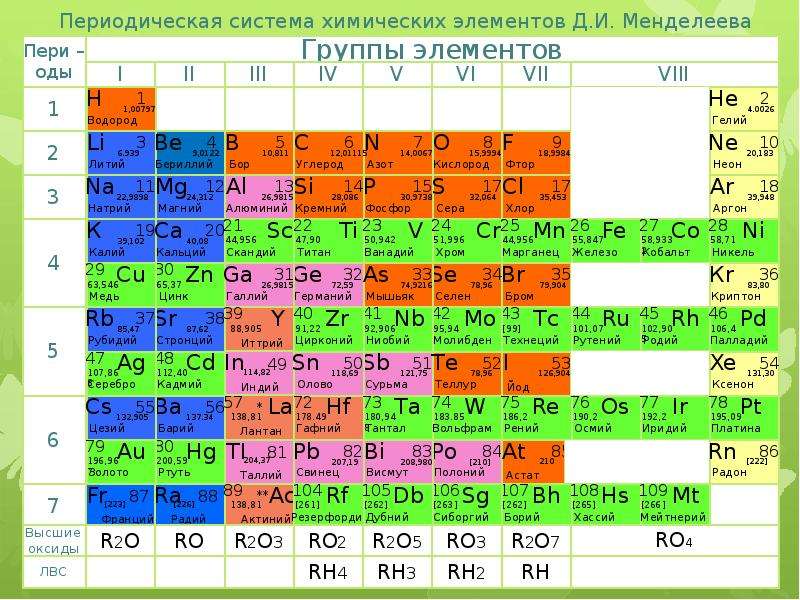 htm
htm
Пожалуйста, включите его в качестве ссылки на свой веб-сайт или в качестве ссылки в своем отчете, документе или диссертации.
Авторские права © Ограничения
Где ты сейчас?
Школа чемпионов
Химия
Периодическая таблица элементов
Металлоид Неметаллы Прочие неметаллы галогены Благородный газ | Металлы Щелочные металлы Щелочноземельные металлы Переходные металлы Металлы после перехода лантаноид Актинид | ЧАС ГазHg ЖидкостьC Твердый |
БЕСПЛАТНАЯ периодическая таблица химических элементов (таблица Менделеева) в пробной версии. Полная версия добавляет точки плавления и кипения, плотность, электроотрицательность, … сродство и многое другое (Mobi Study Guides)
Полная версия добавляет точки плавления и кипения, плотность, электроотрицательность, … сродство и многое другое (Mobi Study Guides)
Free Periodic Table в DEMO-версии. Точки плавления и кипения, плотность, электроотрицательность, сродство к электрону и многое другое в полной версии. Перейдите из оглавления или найдите слова или фразы.
Характеристики
Отформатировано для маленького экрана
Атомные числа, символы и веса
Химические символы и многое другое …
Простая навигация.
Найдите слова или phr.
Бесплатная периодическая таблица в ДЕМО-версии. Точки плавления и кипения, плотность, электроотрицательность, сродство к электрону и многое другое в полной версии. Перейдите из оглавления или найдите слова или фразы.
Характеристики
Отформатировано для маленького экрана
Атомные числа, символы и веса
Химические символы и многое другое …
Простая навигация.
Поиск слов или фраз
Переход по содержанию или чтение страницы за страницей
Доступ к справочнику в любое время и в любом месте — дома, в поезде, в метро.
Используйте свободное время для подготовки к экзамену.
Всегда имейте под рукой руководство для быстрой справки.
Содержание
Периодическая таблица: стандартные | Большой
Список элементов, отсортированных по: Атомному номеру (включая атомную массу) | Имя | Символ | Точка кипения | Точка плавления | Плотность | Атомный радиус | Электроотрицательность | Сродство к электрону | Потенциал ионизации | Стандартное изменение энтальпии испарения | Стандартное изменение энтальпии плавления | Удельная теплоемкость
О таблице Менделеева: Расположение | Периодичность химических свойств | Электронная конфигурация | Именование элементов | Химические символы | История
Химическая серия: Щелочной металл | Щелочноземельный металл | Лантаноиды | Актиниды | Переходные металлы | Бедные металлы | Металлоиды | Неметаллы | Галогены | Благородные газы
Приложение: номенклатура ИЮПАК | Метрическая система (СИ) | СИ стиль письма | Степени 10 префиксов | Конвертация единиц США
.

 И. Менделеева. Знаки химических элементов
И. Менделеева. Знаки химических элементов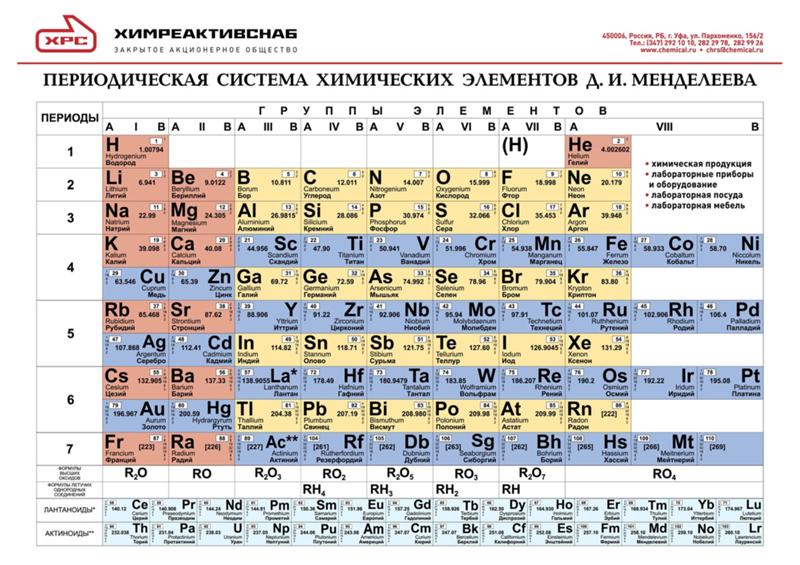
 И. Менделеева
И. Менделеева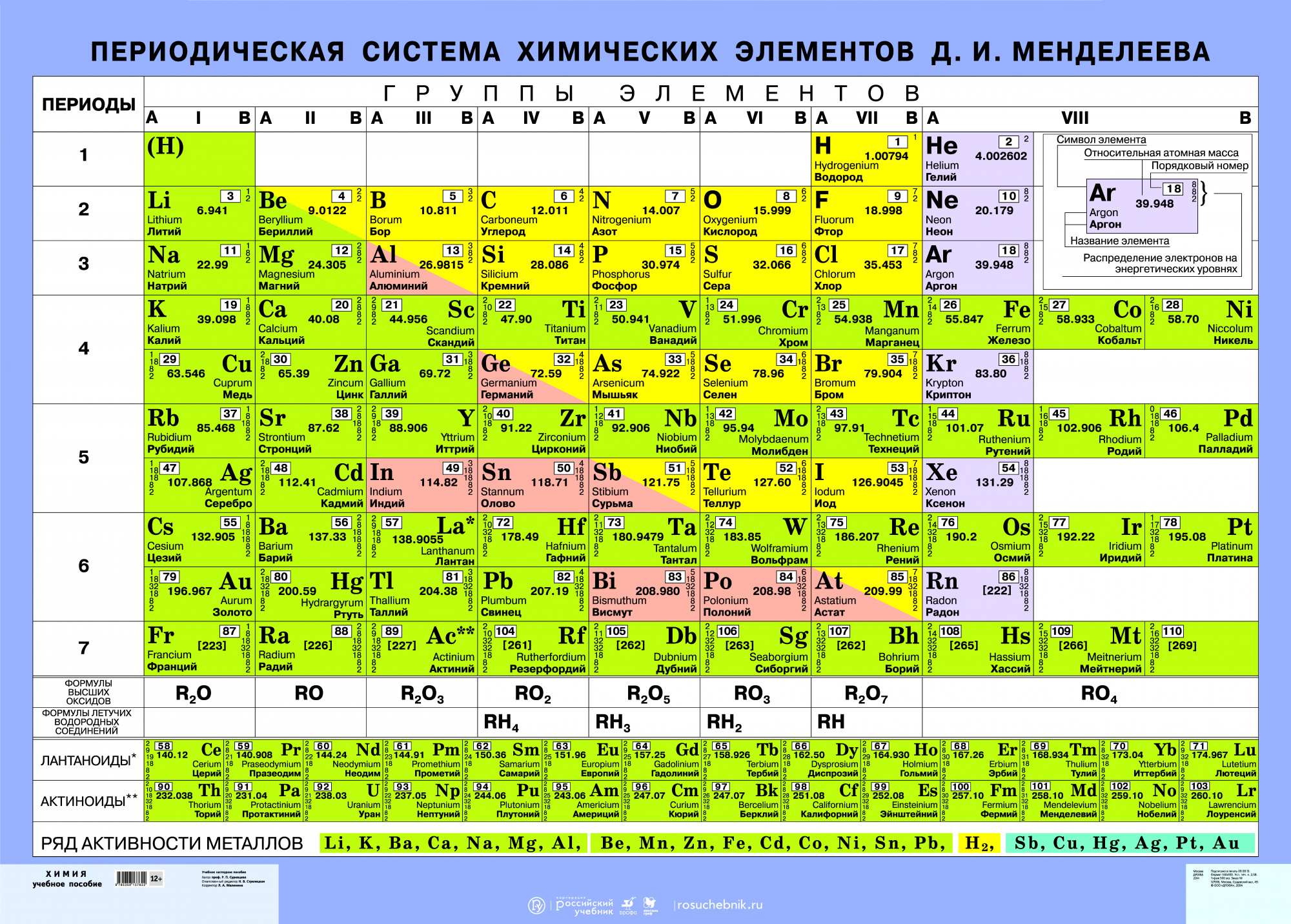 Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах.
Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах.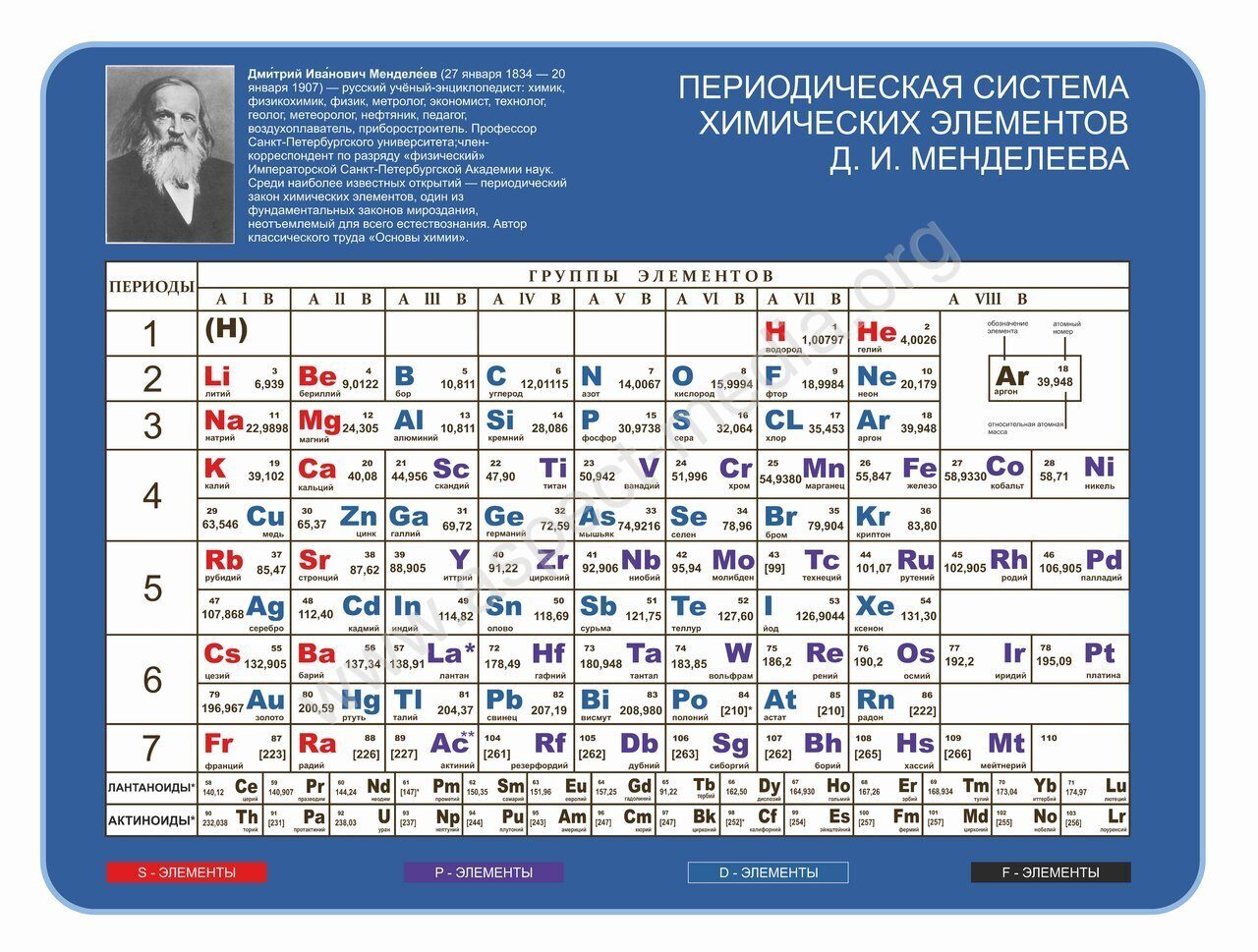
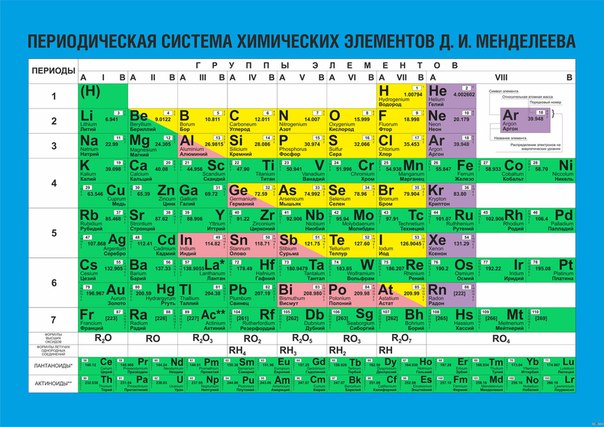
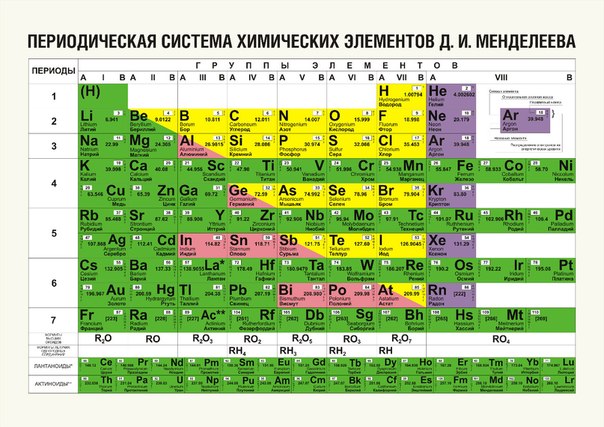
 Элементы, впервые созданные Д. Менделеевым, упорядочены по электронной структуре, поэтому многие химические свойства регулярно меняются по таблице.
Элементы, впервые созданные Д. Менделеевым, упорядочены по электронной структуре, поэтому многие химические свойства регулярно меняются по таблице. 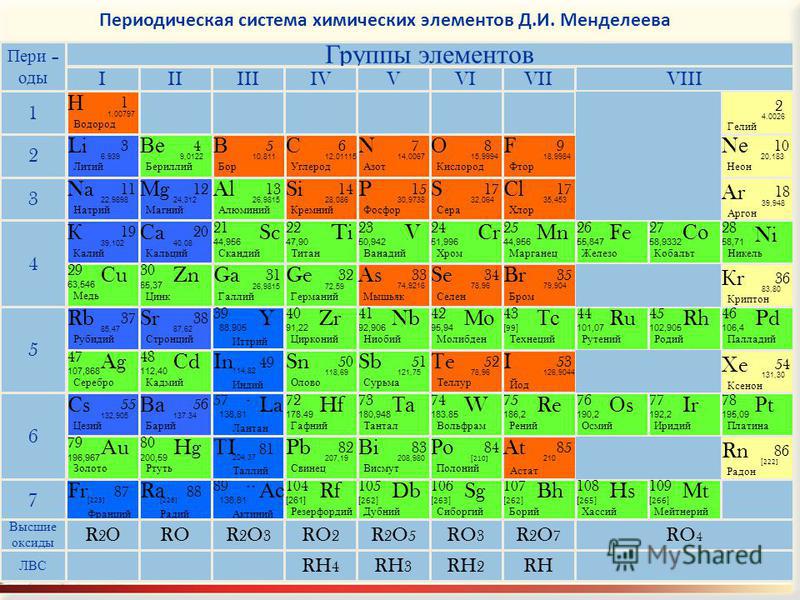 chemicalelements.com
chemicalelements.com 
 е.е. 2, 8, 8, 3)
е.е. 2, 8, 8, 3) Полная версия добавляет точки плавления и кипения, плотность, электроотрицательность, … сродство и многое другое (Mobi Study Guides)
Полная версия добавляет точки плавления и кипения, плотность, электроотрицательность, … сродство и многое другое (Mobi Study Guides)