Практические работы по химии 8 класс
Просмотр содержимого документа
«Практическая работа №2-8 класс»
Практическая работа №2
Анализ почвы и воды
Цель: определить состав почвы, научиться фильтровать и выпаривать жидкость.
Оборудование: две пробирки, воронка, бумажный фильтр, стеклянная палочка, предметное стекло, спиртовка, стеклянный цилиндр с водой, пробка, универсальная индикаторная бумага.
Инструкция по технике безопасности:
Если зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку. Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются. Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого, приподнимите на несколько секунд диск с фитилём для удаления паров. Если случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
Гасить спиртовку можно только одним способом – накрыть пламя фитиля колпачком. Колпачок должен находиться всегда под рукой.
Предметное стекло закрепляется в держателе у одного из его краёв аккуратно. При этом учитывается, что стекло – хрупкий материал и может треснуть, если на него сильно надавить.
В процессе выпаривания воды из почвенной вытяжки вначале прогревается всё предметное стекло, а затем капля жидкости на нём.
Опыт №1. Механический анализ почвы.
В пробирку помещена почва. Прилейте к ней воду, объём которой должен быть в 3 раза больше объёма почвы. Закройте пробирку пробкой и тщательно встряхивайте 1 – 2 минуты. Наблюдайте за осадком частиц почвы и структурой осадков. Опишите и объясните свои наблюдения.
Опыт №2. Получение почвенного раствора и опыты с ним.
Приготовьте бумажный фильтр, вставьте его в чистую пробирку и профильтруйте полученную в первом опыте смесь почвы и воды. Перед фильтрованием смесь не следует встряхивать. Почва останется на фильтре, а собранный в пробирке фильтрат представляет собой почвенную вытяжку (почвенный раствор).
Несколько капель этого раствора с помощью стеклянной палочки поместите на предметное стекло и подержите его над пламенем спиртовки до выпаривания воды. Что наблюдаете? Объясните.
Возьмите универсальную индикаторную бумагу, нанесите на неё стеклянной палочкой почвенный раствор. Сделайте вывод по результатам своих наблюдений.
Заполните таблицу:
№п/п | Что делали | Что наблюдали | Вывод |
Просмотр содержимого документа
«Практическая работа №6 — 8 кл»
«Ионные реакции и условия их протекания»
Цель: выяснить условия протекания химических реакций между растворами электролитов до конца.
Оборудование и реактивы: пробирки, растворы сульфата меди (II), гидроксида натрия, хлорида бария, карбоната натрия, азотной кислоты, серной и соляной кислот, фенолфталеин.
Выполнение работы
Инструктаж по технике безопасности (подпись)
Опыт №1. Условие первое – выпадение осадка.
В одну пробирку налили 1 мл раствора сульфата меди (II) и добавили немного раствора щелочи. Наблюдаем образование ______________
CuSO4 + NaOH = ? + ?
(уравнение написать в молекулярной и ионной формах)
Во вторую пробирку налили раствор хлорида бария и прилили раствор серной кислоты. Наблюдаем образование ______________
BaCl2 + H2SO4 = ? + ?
(уравнение написать в молекулярной и ионной формах)
Опыт №2. Условие второе – выделение газа.
В две пробирки налили по 1 мл раствора карбоната натрия и добавили в одну пробирку несколько капель азотной кислоты, а в другую – несколько капель соляной кислоты. В обеих пробирках наблюдаем выделение ___________________________.
Na2CO3 + HNO3 = ? + ?
Na2CO3 + HCl = ? + ?
(уравнения написать в молекулярной и ионной формах)
Опыт №3. Условие третье – образование воды как побочного продукта.
В две пробирки налили по 1 мл раствора гидроксида натрия и добавили несколько капель фенолфталеина. Раствор приобрел ________________ окраску. В одну пробирку добавили раствор серной кислоты, а в другую – раствор азотной кислоты до исчезновения окраски.
NaOH + H2SO4 = ? + ?
NaOH + HNO3
(уравнения написать в молекулярной и ионной формах)
Работу оформить в виде таблицы
№п/п | Реактивы | Наблюдаемый эффект | Уравнения реакций в молекулярном и ионном виде |
1 | |||
2 | |||
3 |
Вывод: Реакции между растворами электролитов протекают до конца в случае выпадения __________, выделения ___________, образования _____________.
Просмотр содержимого документа
«Практические работы 8 класс оборудование и реактивы»
multiurok.ru
Практические работы по химии. 8-й класс
Разделы: Химия
При изучении химии необходимым условием являются практические работы. Тем более что химия – наука экспериментальная. Но поскольку мы порой ограничены временем урока, то учащимся следует предлагать, особенно на первых порах практически готовые шаблоны оформления практических работ.
Предложенные инструкции к практическим работам 8 класса (по программе Кузнецовой Н.Е., но могут использоваться и при работе по другим программам) содержат цели работ для учащихся, ход (план) работы, образец оформления работы (или рекомендации для отчета), а также тесты по правилам техники безопасности. Систематическое использование тестов позволяет понять учащимся, что гарантия успешной работы как на уроке химии, так и в быту – это знание и соблюдение правил безопасности.
Приложение 1. Практическая работа № 1. 1 “Лабораторное оборудование и приемы работы с ним”.
Приложение 2. Практическая работа № 2. . “Исследование физических и химических свойств веществ”.
Приложение 3. Практическая работа № 3. “Очистка поваренной соли”.
Приложение 4. Практическая работа № 4. “Приготовление раствора с указанной массовой долей вещества”.
Приложение 5. Практическая работа № 5. “Получение кислорода”.
Приложение 6. Практическая работа № 6. “Химические свойства кислот и оснований”.
Приложение 7. Практическая работа № 7. “Решение экспериментальных задач по теме “Основные классы неорганических соединений”.
Приложение 8. Практическая работа № 8. “Получение водорода”.
2.02.2011
Поделиться страницей:urok.1sept.ru
Методика проведения практических работ по химии в 10-11 классах
Содержание работы
Введение………………………………………………………………………2
Ученический эксперимент и его роль в изучении химии…………………3
Методика проведения практических работ по химии в 10 и 11 классе…7
Заключение………………………………………………………………….15
Приложение…………………………………………………………………16
Список литературы…………………………………………………………19
Введение
Химический эксперимент – основа изучения химии. Без его использования невозможно познать предмет. Любое знание без эксперимента – формальное знание. Использование эксперимента при изучении химии позволяет решить разные проблемы. Особенно он необходим при изучении нового материала и при умелом использовании позволяет сформировать познавательную активность и познавательный интерес школьников, без которых невозможно сделать процесс обучения результативным, качественным.
Так же химический эксперимент – практические работы — позволяют применять знаний, умений и навыков учащихся, контролировать эффективность учебного процесса и его качество.
В данной работе представлена методика проведения практических работ в 10 и 11 классах. А именно представлены разработки практических работ, дано описание оборудования и реактивов, задания к практическим работам и описаны некоторые приемы их проведения. В связи с тем, что учащиеся имеют разный уровень знаний, способностей при проведении работ используются разноуровневые задания или система дополнительных заданий, которые учащийся имеет возможность выполнить по желанию.
Ученический эксперимент и его роль в изучении химии
Основной целью школьного образования является создание условий для самореализации учащихся, удовлетворения познавательных потребностей каждого ученика, а также подготовка его к творческому индивидуальному труду. Важную роль в этом призван сыграть ученический эксперимент в процессе изучения школьного курса химии.
Систематическое использование эксперимента на уроках химии помогает бороться с формализмом знаний, развивает умение наблюдать факты и явления и объяснять их сущность в свете изучения теорий и законов.
Выделяется два вида школьного химического эксперимента: демонстрационный, осуществляемый учителем, и ученический, выполняемый школьниками в виде лабораторных опытов, практических работ или решения экспериментальных задач. В основу данной классификации положена деятельность учителя и учащихся.
Ученический эксперимент является одним из важнейших способов обучения детей основам химии. Его принято разделять на лабораторные опыты и практические занятия. Они различаются по дидактической цели. Цель лабораторных опытов – приобретение новых знаний, изучение нового материала. Практические занятия обычно проводятся в конце изучения темы и служат для закрепления и совершенствования, конкретизации знаний, формирования практических умений, совершенствования уже имеющихся знаний, умений и навыков учащихся.
Практические занятия по химии играют ведущую роль в формировании химических умений учащихся. Вначале изучаются некоторые приемы препаративной химии – приобретаются умения работать с нагревательными приборами, инструментами, осваиваются приемы лабораторной техники (нагревание веществ, разделение смесей), изучаются элементарные правила техники безопасности. Затем учащиеся получают простое вещество (на примере кислорода) при разложении сложного и исследуют его свойства. Следующий этап – получение сложного вещества (сульфата меди) и выделение его из раствора, а затем приготовление раствора из сухого вещества. Если все предыдущие работы носили качественный характер, то последняя – количественный. Учащиеся пользуются весами, мерной посудой. И, наконец, экспериментальное решение задач, где от учащихся уже требуется большая самостоятельность. Таким образом, уже в начале изучения химии закладываются основы практических умений, которые в последующих классах получают дальнейшее развитие и совершенствуются.
В школьных программах по химии представлен перечень обязательных работ, которые учащиеся обязаны выполнить лабораторно или практически, а также перечислены умения и навыки, которые необходимо выработать у учащихся в процессе этих работ. Основные требования к выполнению химического эксперимента изложены там же, в учебных программах по химии. Главная их суть – знать правила работы с веществами и простейшим оборудованием, в том числе уметь:
обращаться с пробирками, мерными сосудами, лабораторным штативом, спиртовкой или газовой горелкой;
растворять твердые вещества, проводить нагревание, фильтрование и прочие манипуляции;
обращаться с растворами кислот и щелочей;
проверять водород на чистоту;
готовить растворы заданной процентной и молярной концентрации;
собирать из готовых деталей приборы для получения газов и наполнять ими сосуды методом вытеснения воздуха и воды;
распознавать кислород, водород, углекислый газ, растворы кислот, щелочей, солей.
Умение применять знания при выполнении химического эксперимента можно считать сформированным, если учащийся может правильно (без существенных ошибок) провести опыты, предусмотренные школьной программой, самостоятельно осуществить необходимые наблюдения, достичь поставленной цели и сделать выводы. Умение следует считать сформированным, если учащийся соблюдает технику безопасности в работе с веществами и приборами, не нарушает правила поведения в кабинете и сохраняет порядок на рабочем месте, а при проведении эксперимента не нуждается в помощи со стороны учителя или товарищей.
Практические занятия бывают двух видов: проводимые по инструкции и экспериментальные задачи.
Инструкция – это ориентировочная основа деятельности учащихся. В ней подробно в письменном (печатном) виде изложен каждый этап выполнения опытов, оговариваются даже возможные ошибочные действия учащихся и даются указания, как их избежать. Инструкция содержит информацию и о мерах безопасности при выполнении работы. Чем младше учащиеся, тем подробнее должна быть инструкция.
Однако для выполнения работы только письменной инструкции недостаточно. Необходим грамотный, четкий показ лабораторных приемов и манипуляций в процессе предварительной подготовки к практической работе.
Экспериментальные задачи не содержат инструкции, а только условие. Разрабатывать план решения и осуществить его учащиеся должны самостоятельно.
Подготовка к практическим занятиям, как правило, носит обобщающий характер. При этом используется материал, изученный в разных разделах темы, фактические знания и опыт учащихся, а также формируются практические умения. За урок до проведения практического занятия необходимо ознакомить учащихся с конструкциями приборов, приемами лабораторной техники, проанализировать цели и содержание работы и увязать это с домашним заданием по анализу инструкции. В зависимости от подготовленности класса нужно показать, как соотносить цели опыта и его результат, на какие вопросы нужно дать ответ, чтобы сделать вывод.
На самом практическом занятии в начале урока должна быть проведена краткая беседа о правилах техники безопасности и об узловых моментах работы. На демонстрационном столе размещают в собранном виде все используемые в работе приборы. Очень важно, чтобы работа была выверена во времени, особенно в 8 классах, где учащиеся еще медленно пишут.
В начале урока проводится краткая беседа о домашней подготовке к работе, проверяются знание приемов либо при необходимости напоминается нужное; напоминаются правила техники безопасности, даются ответы на вопросы учащихся. До начала работы можно наметить, за кем из учащихся будет вестись дополнительное наблюдение. Заранее готовится тетрадь, где по графам перечислены умения, используемые при выполнении практической работы, и против фамилий этих учеников ставятся соответствующие отметки.
Оформить работу учащиеся должны тут же на уроке. В отчет о практической работе обязательно ставится оценка, так как нельзя недооценивать его обучающую роль.
Практическая работа, посвященная решению экспериментальных задач, является разновидностью контрольной работы и проводится несколько иначе, чем практическая работа по инструкции. Подготовку учащихся к такой работе можно проводить поэтапно:
Сначала задача решается всем классом или группой теоретически. Для этого необходимо проанализировать условие задачи, сформулировать вопросы, на которые нужно дать ответ для получения окончательного результата, предложить опыты, необходимые для ответа на каждый вопрос.
Учащиеся выполняют эксперимент и оформляют письменный отчет о проделанной работе, объясняют сущность процессов, формулируют выводы.
После этого класс приступает к решению аналогичных задач на рабочих местах.
Экспериментальные задачи целесообразно распределять по вариантам, чтобы добиться большей самостоятельности и активности учащихся в процессе работы. Задание каждого варианта должно быть разработано в трех уровнях сложности, чтобы дать ученику возможность выбора задания по своему усмотрению. Оценка за выполнение задания каждого уровня сложности определяется учителем, как и во всех практических работах.
Методика проведения практических работ по химии в 10 и 11 классе.
В данной работе представлены практические работы базового уровня по УМК Рудзитис Г.Е., Фельдман Ф.Г.
Практические работы в 10 КЛАССЕ
Практическая работа №1.
Решение экспериментальных задач по теме
«Идентификация органических соединений».
Пояснение. Учащимся предлагается выполнить задания одного из уровней.
Оборудование. Пробирки, спиртовка, спички, держалка, штатив для пробирок.
Реактивы.
этанол, глицерин, уксусная кислота, растворы глюкозы, фруктозы, гидроксида натрия, сульфата меди (II), индикаторная бумага
Задание. С помощью качественных реакций определи в какой пробирке какое вещество находится. Составь отчет о проделанной работе.
Твои действия | Твои наблюдения | Твои выводы, объяснения, (уравнения реакций) |
Какие вещества и по каким признакам ты мог определить без эксперимента?
1 уровень.
В пробирках с номерами
1вариант: глюкоза, фруктоза, уксусная кислота
2 вариант: глюкоза, глицерин, этанол
3 вариант: этанол, уксусная кислота, глицерин
2 уровень.
В пробирках с номерами 1-4 находятся растворы уксусной кислоты, глицерин, этанол, глюкоза.
3 уровень.
Выполни задание 2 уровня и без проведения химического эксперимента предложи способ распознавания веществ в пробирках под номерами.
В пробирках с номерами 1-5 находятся растворы уксусной кислоты, фенол, фруктоза, этанол, глюкоза
Практическая работа №2.
Распознавание полимеров.
Пояснение. Для выполнения работы необходимо грамотно подобрать образцы полимеров для их определения. Для выполнения работы необходимо использовать информацию, представленную в учебнике Таблицы 17 и 18.
Оборудование и реактивы.
Спички, зажим для волокон, образцы полимеров.
Задание. По характеру горения определи волокно, оформи письменный отчет о проделанной работе.
Образец | Отношение к нагреванию, характер горения | Название волокна | Химическая формула |
Задание 1.
Выполни задание и заполни таблицу.
Задание 2.
Изучи, как будет вести себя данный полимер при воздействии на него другими веществами. Сделай вывод о правильности распознавания полимера.
Задание 3.
Определи принадлежность данного волокна к определенной группе волокон (натуральные, искусственные, синтетические). Запиши уравнения получения данного полимера.
Практические работы в 11 КЛАССЕ
Практическая работа №1.
Решение экспериментальных задач по теме «Металлы и неметаллы, и их соединения».
Реактивы: пробирка с небольшим кусочком металлического натрия, вода, растворы серной и соляной кислот, гидроксида натрия, хлорида бария, сульфата или хлорида меди (II), фенолфталеин, железо (скрепка), штатив для пробирок.
Оборудование: пробирки, спиртовка, спички, держалка, штатив для пробирок.
Задание.
Осуществите следующие превращения, используя выданное оборудование и реактивы:
CuSO4 → Сu(OH)2 → CuO → CuSO4 → Cu
↓
CuCl2
Na → NaOH → Na2SO4→ Ba SO4↓
Задание по уровням. | 1 уровень | ||
По каким признакам вы делали вывод о протекании химической реакции? Запишите молекулярные уравнения реакций, подпишите названия продуктов реакции. | |||
Составьте полные и сокращенные уравнения реакций. Сделайте вывод о протекании химической реакции. | 2 уровень | ||
Есть ли среди проделанных реакций окислительно-восстановительные реакции? По каким признакам можно судить об этом? Составьте электронный баланс этих реакций, укажите окислитель и восстановитель. | 3 уровень | ||
Твои действия | Твои наблюдения | Твои выводы, объяснения, (уравнения реакций) |
Практическая работа №2.
Получение и распознавание газов.
Примечание. Перед проведением данной работы учащимся дается задание повторить теоретический материал по газообразным веществам кислород, водород, углекислый газ, аммиак и заполнить таблицу. Также необходимо напомнить способы собирания газообразных веществ.
Формула/название | Способ получения | Физические свойства | Способ собирания | Способ распознавания |
Проведение данной практической работы наиболее оптимально организовать, разделив учащихся на группы. Перед проведением работы необходимо выбрать из учащихся класса «Главных химических технологов» — продвинутых учащихся. Их число равно количеству групп. Главным химическим технологам предоставляется возможность выбрать себе команду, приглашая в порядке очередности по одному учащемуся из класса. Каждой группе предоставляется химическое оборудование и реактивы, а так же технологические карты по получению газов. В начале урока традиционно обсуждаются вопросы по технике безопасности. Роль учителя – проверка правильности сборки установок, консультация по возникающим вопросам, контроль соблюдения правил техники безопасности.
Отчет о проделанной работе выполняется с использованием заранее заготовленной таблицы.
Учащимся предоставляется право выбора последовательности получения газов, каждая группа работает в своем темпе.
Реактивы и оборудование.
Название газа | Оборудование | Реактивы |
Кислород | Пробирка Химический стакан (для собирания) Пробка с газоотводной трубкой Спиртовка Спички Штатив Вата Лучинка Химическая ложечка | Перманганат калия |
Водород | Прибор для получения газов Пробирка для собирания газа Спиртовка Спички Штатив | Соляная кислота Гранулы цинка |
Углекислый газ | Пробирка -2 Пробка с газоотводной трубкой Лучинка | Мрамор (мел) Соляная кислота Известковая вода |
Аммиак | Пробирка -2 Вата Пробка с газоотводной трубкой Штатив Химическая ложечка Химический стакан Индикаторная бумага | Хлорид аммония Оксид кальция Вода |
Задание. Получить, собрать и распознать газообразные вещества. Отчет о проделанной работе оформить в виде таблицы.
Формула/ /название | Способ получения | Физические свойства | Способ собирания | Способ распознавания |
Практическая работа №3.
Идентификация неорганических соединений.
Оборудование. Пробирки с растворами веществ, пробирки, штатив для пробирок.
Реактивы. Индикаторная бумага, индикаторы, растворы соляной кислоты, серной кислоты, хлорида бария, гидроксида натрия, сульфата или хлорида цинка, алюминия, железа (III), железа (II), меди (II), аммония.
Задание 1. Используя предложенные реактивы, проведи реакции доказывающие состав веществ:
сульфат или хлорид цинка, алюминия, железа (III), железа (II), меди (II), аммония.
Задание 2. Даны пробирки
с растворами серной кислоты, карбоната натрия, гидроксида натрия
с веществами в твердом виде сульфат аммония, хлорид натрия, сульфат алюминия.
Качественным путем определи в какой пробирке находится какое вещество. Составь отчет о проделанной работе в виде таблицы.
Твои действия | Твои наблюдения | Твои выводы, объяснения, (молекулярные и ионные уравнения реакций) |
З
Заключение.
Образовательные, воспитательные, развивающие цели в педагогическом процессе достигаются разными способами, и одним из них, наиболее эффективным, является активное познание. В области химии это предполагает работу учащихся в процессе ученического эксперимента различных видов на уроке и вне его. Ученический эксперимент играет огромную роль в изучении, понимании данного предмета, придавая ему наглядность, яркость, возбуждая познавательный интерес и обеспечивая активное включение учащихся в учебно-познавательный процесс. Химический эксперимент – это не только источник познания, но и средство воспитания учащихся. Любое познание начинается с ощущения, восприятия конкретных предметов, явлений, процессов и переходит затем к обобщению и абстрагированию. Научное понятие должно обосновываться практически. Используя различные виды химического эксперимента, преподаватель учит конкретизировать теоретические знания, а учащиеся, в свою очередь, «наполняют» усвоенные химические понятия живым конкретным содержанием. Химические эксперимент способствует развитию самостоятельности, повышает интерес к химии, так как в процессе его выполнения учащиеся убеждаются не только в практической значимости такой работы, но и имеют возможность творчески применять свои знания. Велика роль химического эксперимента в развитии мышления и умственной активности учащихся, так как ведущую роль в умственном развитии играет теория в единстве с экспериментом.
Приложение 1.
Инструкции к практической работе №2 в 11 классе.
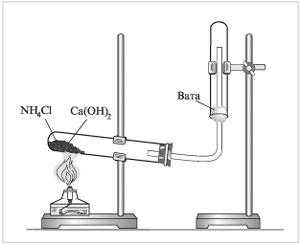
Инструкция. Получение аммиака.
Соберите установку как показано на рисунке: в пробирку поместите оксид кальция и хлорид аммония, плотно закройте её пробкой с газоотводной трубкой, закрепите её в штативе в горизонтальном положении, направив газоотводную трубку вверх. На газоотводную трубку поместите сухую пробирку вверх дном.
Нагревайте смесь веществ в пробирке, и держите влажную индикаторную бумагу около горлышка пробирки, в которую собираете получаемый газ.
Какие признаки реакций наблюдаются в пробирке с исходными веществами? Напишите молекулярное уравнение реакции, в результате которой образуется аммиак.
Почему аммиак собирают в перевёрнутую вверх дном пробирку? Как меняется цвет индикаторной бумаги? Почему влажная индикаторная бумага изменят цвет? Изменит ли цвет сухая индикаторная бумага? Почему? Можно ли собирать аммиак вытеснением воды? Почему?
После окрашивания индикаторной бумаги осторожно снимите пробирку с аммиаком с газоотводной трубки и поместите ее дном вниз в стакан с водой (2-3 мл) с добавлением фенолфталеина. Что вы наблюдаете? Почему вода поднимается вовнутрь пробирки? Как изменяется ее цвет и почему? Ответ поясните уравнением химической реакции.
Инструкция. Получение углекислого газа.
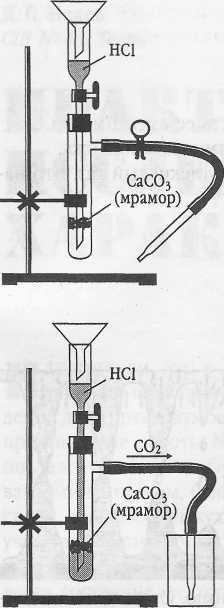
1. Соберите и зарядите прибор для получения газов по плану (рис.1):
а) закрепите в лапке лабораторного штатива прибор для получения газов;
б) выньте из пробирки с отростком пробку с воронкой;
в) поместите в насадку на отростке воронки 2-3 кусочка мрамора величиной не более половины горошины;
г) вставьте вновь пробку с воронкой в пробирку и откройте зажим;
д) прилейте в воронку (осторожно!) соляную кислоту так, чтобы она слегка покрыла мрамор. Что наблюдаете?
2. Откройте зажим и наполните углекислым газом химический стакан (рис.2). Докажите что в стакане находится углекислый газ.
3. Прилейте в пробирку (на 1/5 часть ее вместимости) известковую воду и пропустите через нее углекислый газ (рис. 3). Что наблюдаете?
 Р
Р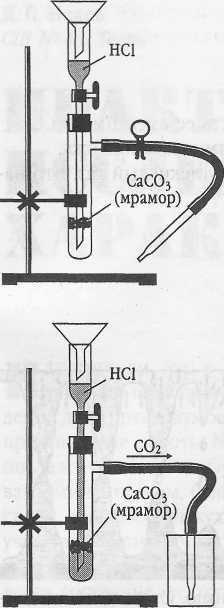
 ис.1 Рис.2 Рис.3
ис.1 Рис.2 Рис.3
Инструкция. Получение кислорода.
Соберите прибор для опыта, как показано на рисунке 1.
Осторожно нагревайте перманганат в пробирке, предварительно обогрев всю пробирку. Виден ли кислород? Есть ли у него цвет, запах? Докажите что стакан наполнен кислородом.
Рис.1 Собирание кислорода вытеснением воздуха.
Рис. 2. Собирание кислорода
вытеснением воды.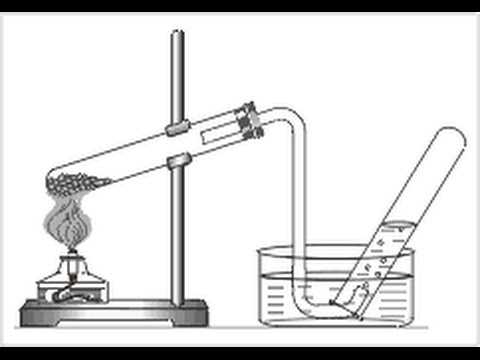
Использованная литература
Личностно ориентированное обучение: теории и технологии. Учебное пособие под редакцией Н.Н.Никитиной. Ульяновск, ИПК ПРО, 1998 г.
Разноуровневое обучение как средство удовлетворения потребностей и возможностей учащихся: сборник статей. Ульяновск, ИПК ПРО, 1998.
Иванова И.Г. Использование модульной и уровневой технологии обучения школьников // Научно-методический журнал «Химия. Методика преподавания в школе», № 7, 2002 , стр. 77-80.
Толкачева Т.К., Политова С.И., Турлакова Е.Ф. Уровневая дифференциация – потребность времени. // Химия в школе, № 8, 2000, стр. 15.
Чернобельская Г.М. Основы методики преподавания химии. Москва, Просвещение, 1987.
Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. и др. Преподавание неорганической химии в 8 классе. Москва, Просвещение, 1988 г.
Полосин В.С., Прокопенко В.Г. Практикум по методике преподавания химии. Учебное пособие для студентов по специальности «химия». Просвещение, 1989.
Чередов И.М. Формы учебной работы в средней школе. Просвещение, 1988.
Зуева М.В. Развитие учащихся при обучении химии. Пособие для учителей. Москва, Просвещение, 1988.
Федеральное государственное бюджетное образовательное
учреждение высшего образования
«Ульяновский государственный педагогический университет
имени И.Н. Ульянова»
Факультет образовательных технологий и непрерывного образования
Кафедра методики естественнонаучного образования
и информационных технологий
Итоговая аттестационная работа
по теме
«Методика проведения практических работ по химии
в 10 и 11 классе»
Выполнил:
слушатель группы Х-1
Куцегуб Нина Фёдоровна
учитель химии
Средней школы №82
Ульяновск, 2018
18
compedu.ru
Инструкционные карты практических работ по химии
ПРАКТИЧЕСКАЯ РАБОТА № 1
Тема: Правила техники безопасности при работе в кабинете химии. Приемы обращения с лабораторным штативом и спиртовкой. Изучение строения пламени.
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: учебник химии для 8 класса, лабораторный штатив, пробирка, химический стаканчик, фарфоровая чашка, спиртовка, спички, держатель для пробирок.
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
№ 1: Правила техники безопасности при работе в кабинете химии | |
Внимательно изучите правила техники безопасности при работе в кабинете химии. | |
№ 2: Приемы обращения с лабораторным штативом | |
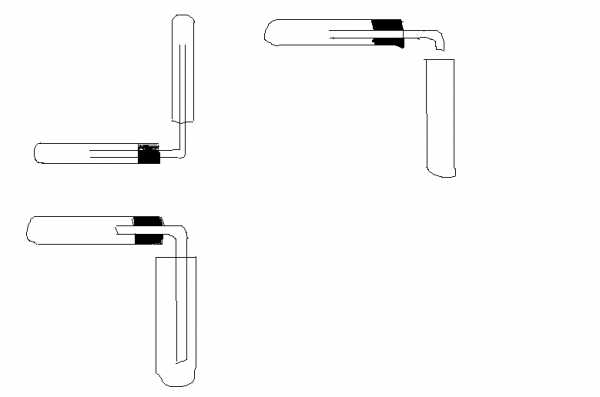
Соберите лабораторный штатив. Для этого сначала закрепите на стержне штатива муфты. Затем закрепите в одной муфте кольцо, а в другой – лапку. На кольцо положите асбестовую сетку, а на неё поставьте химический стакан. В лапке штатива закрепите пробирку. | 1. Зарисуйте схематично лабораторный штатив. 2. Подпишите названия всех его частей. 3. Напишите правила закрепления в лапке штатива пробирки. 4. Для чего служит кольцо штатива. |
№ 3: Приемы обращения со спиртовкой. | |
Внимательно изучите устройство спиртовки и правила обращения с ней. Зажгите спиртовку, предварительно расправив фитиль. Потушите спиртовку, накрыв её колпачком. | 1. Зарисуйте схематично спиртовку. 2. Подпишите названия всех её частей. 3. Напишите основные правила обращения со спиртовкой. |
№ 4: Строение пламени | |
Внимательно рассмотрите пламя спиртовки. Сколько частей пламени вы видите? Проделайте следующий опыт: внесите поочередно спичку в каждую из трех частей пламени. Внимательно следите за скоростью загорания спички. | 1. Зарисуйте схематично строение пламени. 2. Подпишите названия всех трех частей пламени. 2. Сделайте вывод о том, в какой из частей пламени спичка загорается быстрее и почему. |
№ 5: Нагревание пробирки на пламени спиртовки | |
Налейте в пробирку 2-3 мл воды. Закрепите пробирку в держателе для пробирок. Нагрейте пробирку на пламени спиртовки. Для этого сначала пробирку необходимо прогреть со всех сторон, двигая её над пламенем из стороны в сторону. Затем нагревайте только ту часть пробирки, где находится вода. | 1. Кратко опишите ваши действия. 2. Зарисуйте схему опыта. 3. Сделайте вывод о том, в какой из частей пламени надо нагревать пробирку. И почему. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 2
Тема: очистка загрязненной поваренной соли
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: смесь поваренной соли, речного песка и древесных опилок, спиртовка, спички, держатель для пробирок, пробирка, воронка, штатив для пробирок, предметное стекло, химический стакан, стеклянная палочка
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
Опыт 1: Растворение загрязненной поваренной соли | |
В химический стакан со смесью песка, соли и опилок налейте немного воды и перемешайте стеклянной палочкой до полного растворения соли. | 1. Кратко опишите ваши действия. 2. Сделайте вывод о том, что произошло со смесью. |
Опыт 2: Фильтрование раствора загрязненной поваренной соли | |
Сложите фильтр и вставьте его в воронку. Воронку вставьте в пустую пробирку. Осторожно налейте смесь в воронку, но не до краев. Наблюдайте за процессом фильтрования. | 1. Кратко опишите ваши действия. 2. Зарисуйте схему опыта. 2. Сделайте вывод о том, что представляет из себя фильтрат, что осталось на фильтре. |
Опыт 3: Выпаривание раствора поваренной соли | |
Закрепите предметное стекло в держателе для пробирок. Нанесите на него несколько капель очищенного раствора поваренной соли. Зажгите спиртовку и выпарите воду. Сначала прогрейте все стекло, а затем нагревайте только в том месте, где находится раствор. Наблюдайте за процессом выпаривания. | 1. Кратко опишите ваши действия. 2. Зарисуйте схему опыта. 3. Сделайте вывод о том, что осталось на предметном стекле после выпаривания. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 3
Тема: получение, собирание и распознавание кислорода
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, прибор для получения газов, вода, гидроперит, оксид марганца (IV), спички, деревянная лучинка.
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
Опыт 1: получение кислорода | |
В прибор для получения газов поместите таблетку гидроперита и добавьте 1-2 мл воды. Затем добавьте немного оксида марганца (IV). Закройте прибор пробкой с газоотводной трубкой. Конец трубки опустите в пустую пробирку. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции. 3. Составьте уравнение химической реакций: Н2О2 = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить кислород и какую роль в этом опыте сыграл оксид марганца (IV), а также о том как нужно собирать кислород. |
Опыт 2: свойства кислорода | |
В пробирку с собранным кислородом опустите тлеющую лучинку (для этого сначала зажгите лучинку и дайте ей немного прогореть, а затем потушите так, чтобы на конце её образовался уголек). Наблюдайте за происходящим явлением. Будьте осторожны при обращении с огнем. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, что произошло с тлеющей лучинкой в пробирке с кислородом. 3. Составьте уравнение химической реакций: С + О2 = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, почему тлеющая лучинка загорелась. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 4
Тема: получение, собирание и распознавание водорода
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, прибор для получения газов, цинк, соляная кислота, спички.
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
Опыт 1: получение водорода | |
В прибор для получения газов поместите несколько гранул цинка и добавьте 1-2 мл соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Закройте прибор пробкой с газоотводной трубкой. Конец трубки опустите в пустую пробирку. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции. 3. Составьте уравнение химической реакций: Zn + НCL= Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить и собрать водород. |
Опыт 2: свойства водорода | |
Пробирку с собранным водородом закройте пальцем, переверните, зажгите спичку и поднесите к отверстию пробирки, одновременно убрав палец. Наблюдайте за происходящим явлением. Будьте осторожны при обращении с огнем. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, что произошло с газом? 3. Составьте уравнение химической реакций: Н2 + О2 = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как сгорает водород. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 5
Тема: приготовление раствора с заданной массовой долей растворенного вещества.
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: весы учебные с набором гирь, химический стакан, поваренная соль, мерный цилиндр, стеклянная палочка, вода.
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
№ 1: решение задачи | |
Приготовьте 50 мл 2 % раствора поваренной соли. Решите задачу, найдите массу соли и массу воды. | Запишите решение задачи в тетрадь. |
№ 2: взвешивание соли | |
Уравновесьте чашки весов. Для этого подкручивайте винтики сбоку то с одной стороны, то с другой. На одну чашку весов положите гирю, соответствующую найденной массе соли. На другую постепенно насыпайте соль, добиваясь равновесия. Взвешенную соль высыпьте в пустой химический стакан. | 1. Кратко опишите ваши действия (что делали) 2. Зарисуйте схему опыта. 5. Сделайте вывод о том, как нужно правильно взвешивать. |
№ 3: измерение объёма воды | |
В мерный цилиндр налейте полученное при расчетах количество воды. Уровень воды в цилиндре измеряют по нижнему краю мениска. | 1. Кратко опишите ваши действия (что делали) 2. Зарисуйте схему опыта. 5. Сделайте вывод о том, как нужно правильно измерять объём жидкости. |
№ 4: приготовление заданного раствора поваренной соли | |
В химический стакан с солью вылейте воду, перемешайте стеклянной палочкой до полного растворения соли. | 1. Кратко опишите ваши действия (что делали) 2. Зарисуйте схему опыта. 5. Сделайте вывод о том, как правильно приготовить раствор с заданной процентной концентрацией. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 6
Тема: решение экспериментальных задач
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, держатель для пробирок, спиртовка, спички, соляная кислота, гидроксид калия, оксид меди (II)
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
Задача: получите гидроксид меди (II) из оксида меди (II) | |
Опыт 1: получение хлорида меди (II) из оксида меди (II) | |
В пробирку поместите немного порошка оксида меди (II) и добавьте 1-2 мл соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Закрепите пробирку в держателе и осторожно нагрейте на пламени спиртовки. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции? Как изменился цвет раствора? 3. Составьте уравнение химической реакций: CuO + НCL= Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить хлорид меди (II) из оксида меди (II). |
Опыт 2: получение гидроксида меди (II) из хлорида меди (II) | |
В пробирку с полученным в первом опыте хлоридом меди (II) добавьте раствор гидроксида калия. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, что произошло с содержимым пробирки? 3. Составьте уравнение химической реакций: CuCL2 + КОН = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, почему изменился цвет раствора. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 7
Тема: химические свойства соляной кислоты
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, соляная кислота, магний, медь, карбонат кальция, хлорид натрия, нитрат серебра (I)
Ход работы:
Инструкция выполнения опыта | Схема описания опыта | |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | ||
Опыт 1: взаимодействие соляной кислоты с металлами | ||
В две пробирки поместите немного порошка магния и кусочек медной проволоки, осторожно добавьте 1-2 мл соляной кислоты. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции. 3. Составьте уравнения химических реакций: Mg + НCL= Cu+ НCL= Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как соляная кислота взаимодействует с различными металлами. | |
Опыт 2: взаимодействие соляной кислоты с карбонатами | ||
В пробирку поместите несколько кусочков мрамора и добавьте 1-2 мл раствора соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящими реакциями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции. 3. Составьте уравнение химической реакций: СаСО3 + HCL = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Как можно объяснить выделение газа? | |
Опыт 3: распознавание соляной кислоты и ее солей | ||
В одну пробирку налейте немного раствора соляной кислоты в другую раствор хлорида натрия. В обе пробирки добавьте по нескольку капель раствора нитрата серебра (I). Наблюдайте за происходящими реакциями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции. 3. Составьте уравнения химических реакций: AgNO3 + НCL= NaCL+ AgNO3 = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно отличить соляную кислоту от других кислот? | |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | ||
ПРАКТИЧЕСКАЯ РАБОТА № 1
Тема: Решение экспериментальных задач по теме «Электролитическая диссоциация»
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, индикатор лакмус, растворы солей — хлорид калия, карбонат натрия, хлорид алюминия.
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
Опыт 1: распознавание растворов солей | |
В трёх пробирках под номерами даны растворы солей — хлорид калия, карбонат натрия и хлорид алюминия. Добавьте в каждую пробирку по 1-2 капли индикатора лакмуса. Наблюдайте за изменением цвета в каждой пробирке. | 1. Кратко опишите ваши действия (что к чему добавили). 2. Опишите ваши наблюдения. Как изменился цвет в каждой из пробирок. 3. Составьте уравнения реакций гидролиза каждой соли по 1 ступени. Какая среда раствора каждой соли? Каково значение pH каждого раствора соли? 4. Сделайте вывод о том, какой раствор соли находился в какой пробирке. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 2
Тема: Решение экспериментальных задач по теме » Кислород и сера «
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, индикатор лакмус, растворы солей — хлорид калия, карбонат натрия, хлорид алюминия.
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
Опыт 1: распознавание растворов солей | |
В трёх пробирках под номерами даны растворы солей — хлорид калия, карбонат натрия и хлорид алюминия. Добавьте в каждую пробирку по 1-2 капли индикатора лакмуса. Наблюдайте за изменением цвета в каждой пробирке. | 1. Кратко опишите ваши действия (что к чему добавили). 2. Опишите ваши наблюдения. Как изменился цвет в каждой из пробирок. 3. Составьте уравнения реакций гидролиза каждой соли по 1 ступени. Какая среда раствора каждой соли? Каково значение pH каждого раствора соли? 4. Сделайте вывод о том, какой раствор соли находился в какой пробирке. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 3
Тема: «Свойства водного раствора аммиака»
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, индикаторы лакмус и фенолфталеин, сульфат меди(II), соляная кислота.
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
Опыт 1: отношение к индикаторам | |
В пробирку с водным раствором аммиака добавьте 1-2 капли индикатора лакмуса. Наблюдайте за изменением цвета в пробирке. | 1. Кратко опишите ваши действия (что к чему добавили). 2. Опишите ваши наблюдения. Как изменился цвет в пробирке. 3.О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? |
Опыт 2: взаимодействие с кислотами | |
В пробирку с водным раствором аммиака добавьте 1-2 капли индикатора фенолфталеина. Наблюдайте за изменением цвета в пробирке. Затем добавьте 1-2 мл раствора соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящими реакциями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции. 3. Составьте уравнение химической реакций: NH4 ОН + HCL = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, что происходит при действии на водный раствор аммиака кислоты. |
Опыт 3: взаимодействие с солями | |
В пробирку с раствором сульфата меди(II) добавьте водный раствор аммиака. Наблюдайте за изменением цвета в пробирке. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции. 3. Составьте уравнение химической реакций: NH4 ОН +CuSO4 = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, что происходит при действии на растворы солей водного раствора аммиака. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 4
Тема: Определение минеральных удобрений
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, спиртовка, спички, держатель для пробирок, растворы гидроксида натрия и нитрата серебра (I), образцы минеральных удобрений – хлорид аммония, суперфосфат, хлорид калия.
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
Задание : В трех химических стаканчиках под номерами даны образцы минеральных удобрений – хлорид аммония, суперфосфат, хлорид калия. Определите, в каком стаканчике находится каждое из указанных удобрений. | |
Опыт 1: определение цвета и внешнего вида образцов минеральных удобрений | |
Внимательно рассмотрите образцы минеральных удобрений. Пользуясь таблицей учебника (стр.68) | 1. Кратко опишите ваши действия. 2. Пользуясь таблицей учебника (стр.68) опишите внешний вид образцов минеральных удобрений. |
Опыт 2: растворимость в воде образцов минеральных удобрений | |
В пробирки с водой добавьте немного образцов минеральных удобрений. Перемешайте. Наблюдайте за происходящими явлениями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, оцените растворимость в воде образцов минеральных удобрений. 3. Зарисуйте схему опыта. |
Опыт 3: взаимодействие с раствором щелочи при нагревании | |
В пробирки с растворами образцов минеральных удобрений добавьте раствор гидроксида натрия. Закрепите пробирки в держателе и нагрейте на пламени спиртовки. Наблюдайте за происходящими явлениями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции. В какой из пробирок ощущается запах аммиака? 3. Составьте уравнения химической реакции: NH4 CL +NaOH = 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, что происходит с образцами минеральных удобрений при взаимодействии с раствором щелочи при нагревании. |
Опыт 4: взаимодействие с раствором нитрата серебра (I) | |
В пробирку с раствором минерального удобрения добавьте раствор нитрата серебра (I). | 1. Кратко опишите ваши действия. 2. Опишите ваши наблюдения, отметьте цвет осадка. 3. Составьте уравнения химической реакции: AgNO3 + Cа(Н2 РО4)2 = 4. Зарисуйте схему опыта. 5. Сделайте вывод. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 5
Тема: получение оксида углерода (IV) и изучение его свойств
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, прибор для получения газов, соляная кислота, мрамор, известковая вода, индикатор лакмус, вода.
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
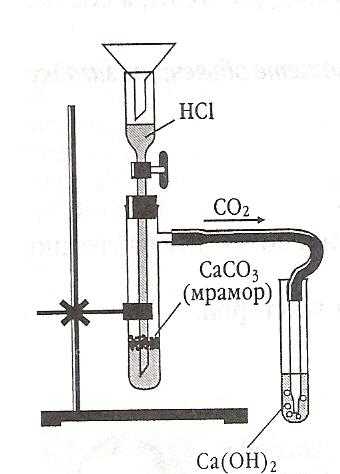
Опыт 1: получение оксида углерода (IV) | |
В прибор для получения газов поместите несколько кусочков мрамора и добавьте 1-2 мл раствора соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Закройте прибор пробкой с газоотводной трубкой. Конец трубки опустите в пробирку с водой. Наблюдайте за происходящими реакциями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции. 3. Составьте уравнение химической реакций: СаСО3 + HCL = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить оксид углерода (IV). |
Опыт 2: взаимодействие оксида углерода (IV) с водой | |
В пробирку с водой, через которую пропускали оксида углерода (IV) добавьте несколько капель раствора лакмуса. Отметьте изменение окраски индикатора. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, как изменился цвет раствора в пробирке. 3. Составьте уравнение химической реакций: СО2 + H2О = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, почему изменился цвет индикатора, какое вещество образовалось при пропускании оксида углерода (IV) через воду. |
Опыт 3: взаимодействие оксида углерода (IV) с известковой водой | |
Конец газоотводной трубки опустите в пробирку с известковой водой и пропускайте через неё оксид углерода (IV). Наблюдайте за происходящими изменениями в пробирке и известковой водой. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирках во время реакции, что получилось после окончания реакции. 3. Составьте уравнения химических реакций: СО2 + Са(ОН)2 = СаСО3 + СО2 + Н2О = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, почему при пропускании оксида углерода (IV) через раствор известковой воды сначала происходит помутнение, а затем раствор становится прозрачным. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 6
Тема: Решение экспериментальных задач по теме «Элементы IА—IIIА-групп ПСХЭ»
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, держатель для пробирок, спиртовка, спички, соляная кислота, гидроксид калия, оксид меди (II)
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
Задача: осуществите цепочку превращений СаО СаCL2 Са(ОН)2 СаSO4 | |
Опыт 1: получение хлорида кальция из оксида кальция | |
В пробирку поместите немного порошка оксида кальция и добавьте 1-2 мл соляной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции? 3. Составьте уравнение химической реакций: CаО + НCL= Расставьте коэффициенты. 4. Зарисуйте схему опыта. |
Опыт 2: получение гидроксида кальция из оксида кальция | |
В пробирку с полученным в первом опыте хлоридом кальция добавьте раствор гидроксида калия. Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, что произошло с содержимым пробирки? 3. Составьте уравнение химической реакций: CаCL2 + КОН = Расставьте коэффициенты. 4. Зарисуйте схему опыта. |
Опыт 3: получение сульфата кальция из гидроксида кальция | |
В пробирку с полученным гидроксидом кальция добавьте 1-2 мл серной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящей реакцией. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, что происходило в пробирке во время реакции? 3. Составьте уравнение химической реакций: Cа(ОН)2 + Н2SO4= Расставьте коэффициенты. 4. Зарисуйте схему опыта. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
ПРАКТИЧЕСКАЯ РАБОТА № 7
Тема: получение гидроксидов железа и изучение их свойств
Цель: (мысленно поставьте вопрос к теме подходящий по смыслу «Что изучить?», или «Чему научиться?» и письменно ответьте на него – получится цель)
Оборудование: штатив для пробирок, пробирки, раствор сульфата железа (II), раствор хлорида железа (III), соляная кислота, гидроксид натрия, перекись водорода.
Ход работы:
Инструкция выполнения опыта | Схема описания опыта |
Выполнение опыта начинайте только с разрешения учителя, точно следуйте инструкциям | |
Опыт 1: получение гидроксида железа (II) | |
Налейте в пробирку 2-3 мл раствора сульфата железа (II) и добавьте немного раствора гидроксида натрия. Наблюдайте за происходящими изменениями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, отметьте цвет получившегося осадка. 3. Составьте уравнение химической реакций: FeSO4 + NaOH = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить гидроксид железа (II) . |
Опыт 2: свойства гидроксида железа (II) | |
Полученный в первом опыте гидроксид железа (II) разделите на две пробирки. В одну пробирку добавьте раствор соляной кислоты, в другую – раствор перекиси водорода. | 1. Кратко опишите ваши действия (что к чему добавили, что делали) 2. Опишите ваши наблюдения, что стало с осадком в первой пробирке, как изменился цвет осадка во второй пробирке. 3. Составьте уравнения химических реакций: Fe(OH)2 + HCL = Fe(OH)2 + H2O2 = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, что происходит с гидроксидом железа (II) при взаимодействии с соляной кислотой и перекисью водорода. |
Опыт 3: получение гидроксида железа (III) | |
Налейте в пробирку 2-3 мл раствора хлорида железа (III) и добавьте немного раствора гидроксида натрия. Наблюдайте за происходящими изменениями. | 1. Кратко опишите ваши действия (что к чему добавили) 2. Опишите ваши наблюдения, отметьте цвет получившегося осадка. 3. Составьте уравнение химической реакций: FeCL3 + NaOH = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, как можно получить гидроксид железа (III). |
Опыт 4: свойства гидроксида железа (III) | |
К полученному в предыдущем опыте гидроксиду железа (III) добавьте немного раствора серной кислоты. Не допускайте попадания кислоты на руки и одежду! Наблюдайте за происходящими изменениями. | 1. Кратко опишите ваши действия. 2. Опишите ваши наблюдения, что произошло с осадком. 3. Составьте уравнение химической реакций: Fe(OH)3 + H2SO4 = Расставьте коэффициенты. 4. Зарисуйте схему опыта. 5. Сделайте вывод о том, что происходит с гидрок-сидом железа (III) при взаимодействии с серной кислотой. |
Вывод: (ответьте на вопрос «Что изучили?», или «Чему научились?» | |
videouroki.net
Практические работы по химии 8-9 классы
Практическая работа №1
Лабораторное оборудование и приемы работы с ним.
Цель: познакомиться с основным лабораторным оборудованием, его назначением и приемам обращения с ними.
С техникой безопасности знаком (а) ___________________________
1 часть
Знакомство со штативом.
По учебнику ознакомьтесь с устройством и назначением штатива. Внимательно посмотрите, как пользуется штативом учитель, демонстрируя его вам. Соберите штатив. Сделайте в тетради рисунок штатива, подписав его основные части: стержень, подставка, зажим, кольцо.
Знакомство со спиртовкой.
Рассмотрите нагревательный прибор, которым вы будете пользоваться при выполнении химических опытов. Прочитайте правила работы со спиртовкой по учебнику. Зарисуйте устройство спиртовки, подпишите её части.
Перечертите кроссворд в тетрадь. Впишите в него названия химического оборудования и посуды. Ключевое слово – название химического элемента
4 | ||||||
| ||||||
| 5 | |||||
2 | 3 |
|
| |||
1 |
|
|
|
| ||
|
|
|
|
| ||
|
|
|
| |||
|
|
|
| |||
|
|
| ||||
|
| |||||
|
| |||||
1. 
2.
3.
4.
5
Тест на знание правил техники безопасности
Вещество на вкус
А) можно пробовать
Б) нельзя пробовать
В) надо спросить у учителя
Знакомясь с запахом вещества надо
А) поднести пробирку к носу
Б) направить воздух рукой от пробирки к носу.
В) нет верного ответа
3. Число склянок, которое можно одновременно открыть при проведении опыта
А) 1 Б) 2 В) много Г) нет верного ответа
4. Спиртовка имеет следующие части:
А) резервуар
Б) фитиль
В) подставка
Г) колпачок
5. Выберите правильные суждения
А) спиртовку можно зажигать от другой спиртовки
Б) нельзя дуть на спиртовку
В) тушить пламя спиртовки можно колпачком
Г) пробирку с веществом сразу греют в нужном месте.
Д) при нагревании отверстие пробирки должно быть направлено в сторону от себя и соседей.
Стеклянную пробирку
А) можно класть на стол
Б) ставят только в штатив
В) можно класть на стол
Г) ставят только в штатив.
Бланк ответа
№ вопроса | 1 | 2 | 3 | 4 | 5 | 6 |
Буква ответа | ||||||
А | ||||||
Б | ||||||
В | ||||||
Г | ||||||
Д |
Практическая работа №2
Исследование физических и химических свойств веществ.
Цель: изучить физические и химические свойства предложенных веществ, используя различные методы.
С техникой безопасности знаком (а) ___________________________
Для выполнения работы используйте табличные данные
1 часть
Рассмотрите выданные вам образцы различных веществ. Исследуйте растворимость твердых веществ. Найдите в справочной таблице данные о плотности, температуре кипения, плавления. Результаты проведенного исследования внесите в таблицу.
Название вещества | Агрегатное состояние | цвет | запах | растворимость | плотность | Температура кипения и плавления |
железо | ||||||
сахар | ||||||
масло подсолнечное |
Исследуйте химические свойства цинка:
— взаимодействие с водой
— взаимодействие с соляной кислотой HCl
— взаимодействие с хлоридом меди CuCl2
Результаты проведенного исследования внесите в таблицу:
свойство | наблюдения | Вывод о протекании реакции | Уравнения реакций |
Вывод: С помощью, каких методов вы изучали вещества во время практической работы?
Тест по правилам техники безопасности
Как определить газ по запаху?
А) наклониться над сосудом и вдохнуть
Б) направить пары газа к себе и сделать осторожный вдох
В) не знаю
Г) нет верного ответа
Растворы из склянки необходимо наливать так, чтобы:
А) при наклоне этикетка оказалась сверху, в ладони
Б) этикетка находится снизу
В) не имеет значения, как взять склянку для реактивов
Г) нет верного ответа
При разливе жидкости на столе необходимо:
А) сообщить учителю или лаборанту
Б) самостоятельно убрать разлитое вещество
В) сделать вид, что ничего не случилось.
Г) нет верного ответа
Почему нельзя собирать на рабочем месте много реактивов?
А) можно перепутать реактивы
Б) создается беспорядок
В) можно запачкать лабораторную тетрадь
Г) все выше перечисленное
Почему нельзя пробирку с раствором нагревать в одном месте:
А) долго не закипит
Б) может произойти выброс жидкости и как следствие ожог руки
В) плохо нагревается
Г) не знаю
Бланк ответа
№ вопроса | 1 | 2 | 3 | 4 | 5 |
Буква ответа | |||||
А | |||||
Б | |||||
В | |||||
Г |
Справочная таблица
Физические свойства некоторых веществ | |||||
Вещество | Температура плавления, ° С | Температура кипения, ° С | Удельная теплоемкость, кДж/кг с | Удельная теплота плавления, Дж/кг | Плотность, г/см3 |
Алюминий | 650 | 2450 | 920 | 397 | 2,7 |
Бронза | 1100 | 2590 | 380 | 210 | 7,8 |
Вода | 0 | 100 | 4200 | 330 | 1 |
Вольфрам | 3380 |
| 150 | 192 | 19,3 |
Железо | 1539 | 3200 | 7,9 | ||
Золото | 1063 | 2700 | 130 | 65,7 | 19,3 |
Иридий | 2450 |
|
| 117 | 22,4 |
Кремний | 1420 |
|
| 164 |
|
Латунь | 500 | 2590 | 380 | 210 | 8,5 |
Медь | 1083 | 2590 | 380 | 210 | 8,93 |
Никель | 1453 | 2800 | 500 | 303 | 8,9 |
Олово | 231,9 | 2430 | 250 | 60 |
|
Платина | 1772 | 3800 | 128 | 111 | 21,4 |
Поваренная соль | 800,8° С | 1465° | 2,165 | ||
Сахар | 185 | 1,6 | |||
Свинец | 327,4 | 1750 | 250 | 25 | 11,3 |
Серебро | 961 |
| 250 | 104,5 | 10,5 |
Сталь | 1539 | 2735 | 460 | 270 | 7,8 |
Титан | 1668 | 3227 | 523 |
| 4,5 |
Углерод | 3650 | 4350 | 840 |
| 2,3 |
Цинк | 419.5 | 906 | 7.1 | ||
Чугун | 1250 | 2735 | 460 | 270 | 7,2 |
Практическая работа №3
«Очистка поваренной соли»
Цель: познакомится со способами разделения смесей, освоить простейшие способы очистки веществ: фильтрование и выпаривание; продолжить формировать умение работать по инструкции и оформлять отчет о химическом эксперименте.
С техникой безопасности знаком (а) ___________________________
1 часть
Получите загрязненную соль. Поместите её в стакан и растворите в 20 мл воды (при растворении перемешивайте стеклянной палочкой).
Разделите получившуюся смесь фильтрованием:
А) приготовьте бумажный фильтр, вложите его в воронку и смочите водой, используя стеклянную палочку
Б) проведите фильтрование. Помните, что жидкости надо наливать столько в воронку, чтобы она не доходила до краев 0,5 см, иначе смесь может протекать между фильтром и стенками воронки, не очищаясь от примесей
В) отфильтрованный раствор сохраните.
Проведите выпаривание:
А) полученный фильтрат вылейте в фарфоровую чашечку
Б) нагрейте чашку в пламени спиртовки, после появления кристаллов соли в чашке, нагревание прекратите
Сравните полученную соль с выданной в начале работы
Оформите отчет о работе
Что делали | Что наблюдали | Объяснения и выводы |
1. Растворение соли | При добавлении воды соль…, а песок … | Одни вещества в воде …, а другие нет. Песок оседает на дно, так как … |
2. Приготовление фильтра | ||
3. Фильтрование (рисунок) | На стенках фильтра остается …, а в колбу отфильтровывается … | Происходит разделение …, так как они отличаются… |
4. Выпаривание (рисунок) | При нагревании в фарфоровой чашке раствора соли вода …, а соль … | Произошло разделение …, так как у них разные |
Вывод:
2 часть
Тест по правилам техники безопасности
Как положено вести себя в школьной химической лаборатории?
А) можно перекусить
Б) можно смешивать реактивы, не пользуясь инструкцией
В) можно бегать и шуметь
Г) следует соблюдать на рабочем месте чистоту и порядок
Чего нельзя делать при работе со спиртовкой?
А) тушить огонь колпачком
Б) зажигать спичками
В) заполнять этиловым спиртом
Г) зажигать от другой спиртовки
Фарфоровую чашечку нагревают в пламени спиртовки, держа:
А) руками
Б) держателем
В) щипцами
Г) нет верного ответа
Полученную очищенную соль:
А) можно попробовать на вкус
Б) нельзя пробовать на вкус
В) нет верного ответа
Что нужно делать, если разлил раствор вещества:
А) сообщить учителю или лаборанту
Б) самостоятельно убрать разлитое вещество
В) сделать вид, что ничего не случилось.
Г) нет верного ответа
Бланк ответа
№ вопроса | 1 | 2 | 3 | 4 | 5 |
Буква ответа | |||||
А | |||||
Б | |||||
В | |||||
Г |
Практическая работа №4
«Приготовление раствора с указанной массовой долей вещества»
Цель:
1) научиться приготавливать растворы с указанной массовой долей () растворенного вещества;
2) продолжить формировать умение пользоваться химической посудой, весами.
С техникой безопасности знаком (а) ___________________________
1 часть
Задача. Для подкормки комнатных растений применяют раствор сульфата калия с массовой долей 2 %. Приготовьте 75 г такого раствора.
1 часть
Рассчитайте массы соли и воды, необходимые для приготовления раствора.
Приготовьте раствор.
Составьте отчет о последовательности ваших действий при приготовлении раствора, проиллюстрируйте их рисунками.
Запишите вывод.
2 часть
Тест по правилам техники безопасности
Твердые вещества берут:
А) рукой
Б) ложечкой
В) как придется
Г) не знаю
Какую посуду надо использовать при работе?
А) чистую
Б) грязную
В) с трещинами
Г) какая есть, ту и использовать
Когда можно приступать к работе в лаборатории?
А) когда хочешь
Б) с разрешения учителя
В) когда будешь готов
Г) нет верного ответа
Объем воды измеряют:
А) на весах
Б) в мерном цилиндре
В) в мерном стакане
Г) нет верного ответа
Полученный раствор необходимо:
А) отдать учителю
Б) вылить в канализацию
В) поставить на соседний стол
Г) нет верного ответа
Бланк ответа
№ вопроса | 1 | 2 | 3 | 4 | 5 |
Буква ответа | |||||
А | |||||
Б | |||||
В | |||||
Г |
Практическая работа №5
«Получение кислорода»
Цель: 1) познакомиться со способом получения кислорода в лаборатории и его химическим свойством — поддерживать горение;
2) научиться собирать газ в сосуд вытеснением воздуха;
3) совершенствовать умение работать с простейшими приборами.
С техникой безопасности знаком (а)________________________________
1 часть
В основание пробирки, в которой находится перманганат калия поместить комочек ваты и закрыть пробирку газоотводной трубкой.
Закрепить пробирку держателем. Опустить конец газоотводной трубки в пустую пробирку.
Нагреть пробирку с перманганатом калия, соблюдая правила нагревания.
Соберите кислород в пробирку способом вытеснения воздуха. Проверьте его наличие с помощью тлеющей лучинки. Прекратите нагревание.
Оформите отчет о работе: а) зарисуйте прибор для сбора кислорода, сделайте соответствующие подписи; б) заполните таблицу, дописав предложения и закончив уравнения реакций.
Что делали | Что наблюдали | Объяснения и выводы |
1. сборка прибора для получения кислорода | Рисунок | Кислород в лаборатории можно получить разложением кислородосодержащих веществ, например: … KMnO4 K2MnO4 + … + … |
2. Нагревание пробирки с перманганатом калия и собирание кислорода методом вытеснения воздуха | В пробирке происходит… | Пробирку для сбора кислорода следует держать … дном, потому что… |
3. Доказательство наличия кислорода в пробирке с помощью тлеющей лучинки | Тлеющая лучинка… | Кислород поддерживает … С + О2 = |
Вывод:
2 часть
Подумайте и ответьте:
Кислород в лаборатории получают при нагревании перманганата калия. Полученный газ можно собрать путем вытеснения воздуха, используя прибор;
Какую посуду надо использовать при работе?
А) чистую
Б) грязную
В) с трещинами
Г) какая есть, ту и использовать
Пробирку нагревают
А) в верхней части пламени
Б) в нижней части пламени
В) не имеет значения
Г) нет верного ответа
Спиртовку тушат
А) задувая огонь
Б) колпачком
В) руками
Г) нет верного ответа
Почему нельзя пользоваться грязной посудой?
А) неприятно брать в руки
Б) можно получить неточный результат
В) нет верного ответа
Бланк ответа
№ вопроса | 1 | 2 | 3 | 4 | 5 |
Буква ответа | |||||
А | |||||
Б | |||||
В | |||||
Г |
Практическая работа №6
«Химические свойства кислот и оснований»
Цель: практически изучить свойства кислот и оснований, продемонстрировать умения фиксировать результаты наблюдений, делать выводы.
С техникой безопасности знаком (а)_____________________
1 часть
Последовательно выполните перечисленные ниже задания и оформите отчет о проведенном химическом эксперименте в виде предложенной таблицы.
Взаимодействие кислоты с металлом.
В пробирку налить 1 мл соляной (хлороводородной кислоты) и добавить гранулу цинка
Изменение окраски индикатора.
В пробирку налить 0,5 мл соляной кислоты, добавить индикатор метилоранжевый
Взаимодействие кислоты с основанием.
В пробирку из предыдущего опыта добавить гидроксид натрия до видимых признаков реакции
Взаимодействие растворимого основания с солью.
В пробирку налить 1 мл гидроксида натрия и добавить несколько капель хлорида железа (III)
Взаимодействие кислоты с основанием
К веществу, полученному в предыдущем опыте добавить соляную кислоту до видимых признаков.
Название опыта | наблюдения | Уравнение реакции | Признак реакции (выпадение осадка, выделение газа, изменение окраски) |
Взаимодействие кислоты с металлом | HCl + Zn = | ||
| — | ||
Взаимодействие кислоты с основанием | HCl + NaOH = | ||
Взаимодействие растворимого основания с солью | NaOH + FeCl3 = | ||
| Fe(OH)3 + HCl |
Вывод: какие свойства веществ изучили, какие признаки реакции наблюдали
2 часть
Тест по правилам техники безопасности
Если налил в пробирку избыток растворов реактивов надо:
А) слить обратно
Б) слить в канализацию
В) поставить в известность учителя или лаборанта
Г) нет верного ответа
Твердые вещества
А) берут руками
Б) берут шпателем
В) берут ложечкой
Г) берут всем выше перечисленным
При попадании на кожу раствора кислоты надо:
А) смыть холодной водой
Б) смыть холодной водой, обработать 2 % раствором соды
В) обработать 2 % раствором уксусной кислоты
Г) нет верного ответа
Кислоту разбавляют:
А) наливая воду в кислоту
Б) наливая кислоту в воду
В) порядок смешивания не имеет значения
Г) не знаю
Признак реакции:
А) изменение объема жидкости
Б) выпадение осадка
В) изменение формы вещества
Г) нет верного ответа
Нагревая пробирку её необходимо держать так, чтобы отверстие было направлено
А) вверх
Б) в сторону от себя
В) вниз
Г) в сторону от себя и от соседей
Бланк ответа
№ вопроса | 1 | 2 | 3 | 4 | 5 | 6 |
Буква ответа | ||||||
А | ||||||
Б | ||||||
В | ||||||
Г |
Практическая работа №7
«Решение экспериментальных задач по теме «Основные классы неорганических соединений»
Цель: повторить свойства оксидов, кислот, оснований и солей и применить эти знания при экспериментальном решении задач; научиться распознавать вещества, помещенные в склянках без этикеток.
С техникой безопасности знаком (а) _________________
1 часть
В двух склянках без этикеток находятся растворы: в одной – соляная кислота, во второй – гидроксид натрия. Как опытным путем доказать, в какой склянке находится каждое из веществ?
Химическим способом отмойте пробирку, загрязненную на практическом занятии гидроксидом железа (III)
Докажите, что выданное вещество – серная кислота.
Из имеющихся на столе реактивов получите несколькими способами сульфат меди (II)
(решите несколько задач по указанию учителя)
Результаты эксперимента оформите в произвольной форме, отметьте наблюдения, запишите уравнения реакций.
2 часть
Тест по правилам техники безопасности
Пробирка для опыта должна быть чистой так как:
А) это эстетично
Б) наличие грязи может сказаться на проведении эксперимента
В) цвет осадка может измениться
Г) не имеет значения
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
Почему избыток вещества (реактива) нельзя сливать (ссыпать) обратно в склянку?
А) можно перепутать вещества
Б) загрязнить вещество
В) запачкать руки
Г) трудно открыть пробки
Проводить опыты, не предусмотренные инструкцией:
А) не разрешается
Б) можно с согласия учителя
В) можно, если знаешь, что получится
Г) нет верного ответа
При попадании на кожу раствора щелочи необходимо:
А) смыть холодной водой
Б) обработать 2 % раствором соды
В) обработать 2 % раствором уксусной кислоты
Г) нет верного ответа
Как оформляются результаты практической работы:
А) на отдельном листочке
Б) в тетради для практических работ
В) в рабочей тетради
Г) нет верного ответа
Пробирку в пробиркодержателе закрепляют
А) на середине пробирки
Б) у отверстия пробирки
В) в нижней части пробирки
Г) не имеет значения
Бланк ответа
№ вопроса | 1 | 2 | 3 | 4 | 5 | 6 |
Буква ответа | ||||||
А | ||||||
Б | ||||||
В | ||||||
Г |
Практическая работа №8
«Получение водорода»
Цель: научиться собирать газ с относительной плотностью меньше плотности воздуха; убедиться опытным путем, что водород является восстановителем
С техникой безопасности знаком (а) _________________
1 часть
В пробирку с газоотводной трубкой опустите 2-3 гранулы цинка и налейте соляной кислоты (чтобы кислота покрывала цинк)
Соберите водород методом вытеснения воздуха.
Проверка водорода на чистоту. Для опыта используем водород, собранный вытеснением воздуха. Поднесите её к пламени спиртовки. Если раздавшийся звук напоминает сухой треск, то значит водород чистый. А если звук резкий, «тявкающий», то водород смешан с воздухом.
В сухую пробирку поместите 0,5 см3 оксида меди (II). Пропустите водород через нагретый оксид меди (II).
Оформите отчет о работе в виде таблицы. Сделайте рисунки с обозначениями к ним. Запишите наблюдения. Составьте уравнения реакций. Сделайте выводы о свойствах водорода.
Вывод к практической работе.
2 часть
Тест по правилам техники безопасности
Перед поджиганием водорода его надо проверить
А) на наличие примесей
Б) на чистоту
В) на наличие водяных паров
Г) нет верного ответа
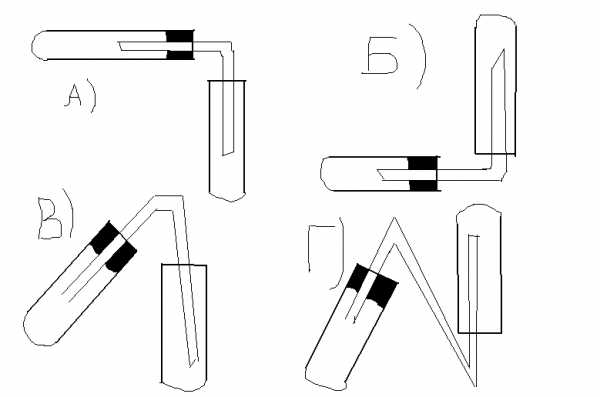
Водород можно собрать, используя следующий прибор:
С целью предотвращения возможного взрыва при демонстрации горения водорода его поджигают:
А) лучинкой
Б) спиртовкой
В) газовой горелкой
Г) пламенем горящего водорода
При попадании на кожу раствора кислоты надо:
А) смыть холодной водой
Б) обработать 2 % раствором соды
В) обработать 2 % раствором уксусной кислоты
Г) нет верного ответа
Приготовленный к работе прибор:
А) можно использовать по назначению
Б) надо продемонстрировать учащимся
В) необходимо показать учителю или лаборанту
Г) нет верного ответа
Бланк ответа
№ вопроса | 1 | 2 | 3 | 4 | 5 |
Буква ответа | |||||
А | |||||
Б | |||||
В | |||||
Г |
kopilkaurokov.ru
Лабораторные и практические работы по химии
Министерство образования и науки Челябинской области
Государственное бюджетное профессиональное образовательное учреждение
Аргаяшский аграрный техникум
Содержание лабораторных работ (практических занятий) по дисциплине
______________________Химия_______________________
_Разделы: Этиленовые углеводороды и диеновые углеводороды_
__________Ацетиленовые углеводороды_______________
Составитель: Вахитова Марьям Ильясовна Преподаватель химии
ГБПОУ «Аргаяшский аграрный техникум»
Лабораторная работа
Ознакомление с образцами полиэтилена и полипропилена
Цель работы: Ознакомление с образцами полиэтилена и полипропилена; определение их свойств.
Материально — техническое оснащение: тигельные щипцы, фарфоровая чашка, стеклянная палочка, спиртовка, спички, спиртовка, образцы полиэтилена, перманганат калия KMnO4, гидроксид натрия NaOH концентрированный.
Задание:
Определить свойства полиэтилена и полипропилена.
Порядок работы:
1) Изделие из полиэтилена нагреть в фарфоровой чашке над пламенем спиртовки. Заметьте, что материал быстро размягчается, а затем плавиться. 2) Стеклянной палочкой измените его форму (вытяните в нить) и дайте изделию остыть.
3)Попытайтесь изменить форму образца при обычной температуре. Приданная ему при этом форма прочно закрепляется.
Контрольные вопросы:
1) Какое свойство полиэтилена лежит в основе наблюдаемых явлений? При каких условиях это свойство проявляется? Какое практическое значение оноимеет?
2) Обратите внимание, горит ли полиэтилен вне пламени? Какого цвета пламя? Образуется ли при этом копоть? Обладают ли продукты сгорания запахом?
Содержание отчета:
Дать ответы на контрольные вопросы;
Оформить работу в тетради в виде таблицы:
Наблюдения
Уравнение реакции, выводы
1
Литература:
Химия, О.С. Габриелян, И.Г. Остроумов, 2013
Органическая химия, 10-11 класс, Цветков Л.А., 2012
Химия, сборник основных формул, Савинкина Е.В., Логинова Г.П.,2013
Лабораторная работа
Распознавание образцов алканов и алкенов
Цель работы:
Получение этилена путём нагревания смеси этилового спирта с концентрированной серной кислотой и изучение его свойства, сравнение свойства алканов и алкенов.
Материально –техническое оснащение: ПК, глобальная сеть Интернет
Задание:
Внимательно просмотреть видео – опыты:
1) «Получение этилена, опыты с ним»
2)«Горение этилена»
3)«Взаимодействие этилена с бромной водой»
4)«Взаимодействие этилена с раствором перманганата калия»
Сравнить свойства алканов и алкенов.
Содержание отчета:
Оформить работу в тетради в виде таблицы:
Название опыта, рисунокНаблюдения
Уравнение реакции, выводы
1
Закончите уравнение реакции:
CH3-CH2-OH t>140°C, H2SO4(конц.)→
Укажите тип реакции, назовите продукты реакции?
2
Закончите уравнение реакции:
CH2=CH2 + [O] + H2O KMnO4→
Назовите продукты и тип реакции?
3
Закончите уравнение реакции:
CH2=CH2 + Br2 →
Назовите продукты и тип реакции?
4
Закончите уравнение реакции:
C2H4 + O2 t →
Назовите тип реакции и продукты?
Контрольные вопросы:
1) Что происходит с раствором марганцовки?
2) Что происходит с бромной водой?
3) Почему этилен горит более светящимся пламенем, чем этан?
4) Каким образом можно распознать алканы и алкены?
Литература:
Химия, О.С. Габриелян, И.Г. Остроумов, 2013
Органическая химия, 10-11 класс, Цветков Л.А., 2012
Химия, сборник основных формул, Савинкина Е.В., Логинова Г.П.,2013
Практическое занятие
Получение этилена дегидратацией этилового спирта
Цель занятия:
Получение в лаборатории этилена реакцией дегидратации спиртов; изучение физических и химических свойств этилена.
Оснащение практического занятия: штатив с пробирками, газоотводная трубка, лабораторный штатив, спиртовка, спички, резиновая пробка, прокалённый песок, этиловый спирт С2Н5ОН, концентрированная серная кислота H2SO4.
Задание:
1. Собрать прибор, как показано на рисунке.
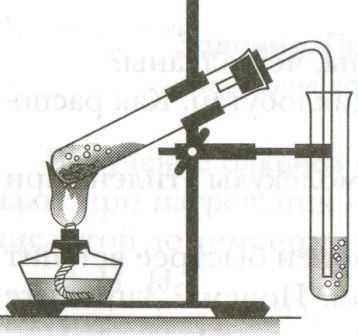
2. В пробирку налить 1 мл этилового спирта С2Н5ОН и осторожно добавьте 6—9 мл концентрированной серной кислоты H2SO4 .
Затем всыпать немного прокаленного песка (песок или мелкие кусочки пемзы вводят для того, чтобы предотвратить толчки жидкости при кипении).
Закрыть пробирку пробкой с газоотводной трубкой, закрепить ее в штативе и осторожно нагреть содержимое пробирки.
5. Смесь этана и этилена объёмом 0,8 л (н.у.) обесцветила 200 г бромной воды с массовой долей 1,6%. Определить объёмную долю каждого газа в смеси.
Содержание отчета:
1)Дать ответы на контрольные вопросы;
2)Оформить работу в тетради в виде таблицы:
Название опыта, рисунокНаблюдения
Уравнение реакции, выводы
1
Контрольные вопросы:
1) Какую роль выполняет концентрированная серная кислота H2SO4 в реакции?
Литература:
Химия, О.С. Габриелян, И.Г. Остроумов., 2013
Органическая химия, 10-11 класс, Цветков Л.А., 2012
Химия, сборник основных формул, Савинкина Е.В., Логинова Г.П.,2013
Практическое занятие
Изготовление моделей молекул алкинов, их изомеров
Цель занятия: составление структурных формул и шаростержневых моделей молекул алкинов по их молекулярным формулам;
Оснащение практического занятия: ПК, глобальная сеть Интернет, шаростержневые модели.
Задание:
Смоделировать шаростержневые молекулы алкинов и их изомеров.
Содержание отчета:
1.Составить структурные формулы для веществ гексин С6Н10 и пентин С5Н8 .
Изобразить их в тетради.
2.Собрать шаростержневые модели молекул этих углеводородов.
Изобразить их в тетради.
3.Составить по одной молекулярной формуле гомолога для каждого из этих веществ. Записать их структурные формулы в тетради.
4.Собрать шаростержневые модели молекул для этих гомологов.
Изобразить их в тетради.
5.Записать структурную формулу одного изомера для каждого из первоначальных веществ.
6.Собрать их шаростержневые модели молекул. Изобразить их в тетради.
7.Сделать вывод о сходстве и различиях веществ гексин С6Н10 и пентин С5Н8 по составу и строению.
Контрольные вопросы:
1)Какие основные положения теории А.М.Бутлерова вы использовали при изготовлении моделей молекул молекул алкинов и их изомеров?
2)Почему для изготовления моделей молекул используются шарики атомов различных размеров и цветов?
3) В чем преимущества и недостатки шаростержневых моделей?
Литература:
Химия, О.С. Габриелян, И.Г. Остроумов, 2013
Органическая химия, 10-11 класс, Цветков Л.А., 2012
Химия, сборник основных формул, Савинкина Е.В., Логинова Г.П.,2013
Практическое занятие
Взаимодействие этилена с бромной водой, раствором перманганата калия
Цель занятия:
Освоение лабораторным способом получение этилена, изучение его свойства, соблюдая правила по технике безопасности; умение подтверждать теоретические знания химическим экспериментом.
Оснащение практического занятия: три пробирки, газоотводная трубка, резиновая пробка с отверстием под газоотводную трубку, металлический штатив, газовая горелка, этанол С2Н5ОН, концентрированная серная кислота Н2SO4 , раствор перманганата калия КMnO4 , раствор бромной воды, кусочки пемзы.
Задание:
В пробирку налить 0,5 мл этанола С2Н5ОН и добавить туда 2 мл концентрированной серной кислоты Н2SO4 (осторожно!).
Положить туда небольшой кусочек пемзы (для равномерного кипения), полученную смесь сильно нагреть.
Выделяющийся этен С2Н4 пропустить по очереди через слабый раствор перманганата калия КMnO4, а затем раствор бромной (или йодной) воды, взятые в количестве по 1 мл.
4)После обесцвечивания растворов конец газоотводной трубки поднимите вверх и подожгите выделяющийся этен С2Н4, не прекращая нагревания прибора. Отметить характер пламени. Прекратить нагревание прибора, дать ему остыть, разобрать и помыть прибор.
Содержание отчета:
1)Дать ответы на контрольные вопросы;
2)Оформить работу в тетради в виде таблицы:
Название опыта, рисунокНаблюдения
Уравнение реакции, выводы
1
Контрольные вопросы:
1.Как получают этен в лаборатории и промышленности?
2.Почему серная кислота, применяющаяся в опыте, должна быть концентрированной?
3.Почему этен легко обесцвечивает раствор перманганата калия и раствор бромной (или йодной) воды?
Литература:
Химия, О.С. Габриелян, И.Г. Остроумов., 2013
Органическая химия, 10-11 класс, Цветков Л.А., 2012
Химия, сборник основных формул, Савинкина Е.В., Логинова Г.П.,2013
infourok.ru
Практическая работа по химии «Решение экспериментальных задач на получение и распознавание органических веществ»
Эпиграф урока «Настоящий химик должен быть и теоретиком , и практиком. М.В.Ломоносов »
Практическая работа №2
«Решение экспериментальных задач на получение и распознавание органических веществ».
Цель работы: повторить основные качественные реакции органических веществ, научиться решать экспериментальные задачи на распознавание органических веществ.
Реактивы и оборудование: раствор KMnO4(розовый), Аммиачный раствор оксида серебра – реактив Толленса[Ag(NH3)2]OH (упрощённо +Ag2O NH3 раствор→), раствор FeCl3(светло-жёлтый), свежеосаждённый гидроксид меди (II) в сильнощелочной среде, лакмус, фенолфталеин, насыщенный раствор соли кальция.
Литература: Г.Е.Рудзитис, Ф.Г.Фельдман, химия 10 класс, стр.149
С правилами по технике безопасности ознакомлен:______________________(подпись)
Ход работы:
Оформить работу в виде отчетной таблицы.
Отчетная таблица
Что делали | Что наблюдали | Уравнения реакций | Выводы |
|
|
|
|
|
|
|
1.Распознавание уксусной кислоты (уксусная кислота –одна из самых древних кислот ,которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты)
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина(глицерин входит в состав мазей, в пищевой промышленности глицерин под кодом Е-422).
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4. Распознавание сахарозы. Сахар-сложное орган.в-во, содержащее много С. Чтобы доказать возьмем немного сахара и добавим к нему серную кислоту. Она забирает воду, получается свободный углерод(черное в-во) С12Н22О11——серн.к-та————12С+11Н2О
5.Распознавание крахмала. Капнем р-ром иода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
6. Определение кислотности р-ров глицерина и мыла с помощью имеющихся индикаторов.
(лакмус, фенолфталеин,метилоранж). Глицерин имеет слабокислую среду, а мыло-щелочную.
Общий вывод(на основе цели)!
videouroki.net
